树豆酮酸A对人肝微粒体中5种常见细胞色素P450酶的体外抑制作用研究
2021-02-21陈瑞周维张丽朱高峰黄静汤磊
陈瑞 周维 张丽 朱高峰 黄静 汤磊


摘 要 目的:研究樹豆酮酸A对人肝微粒体中的5种细胞色素P450(CYP)酶的体外抑制作用。方法:采用Cocktail探针药物法,在人肝微粒体中加入50.0、15.0、5.0、1.5、0.5、0.15、0.05 μmol/L的树豆酮酸A,与混合探针药物[包含非那西丁、右美沙芬、奥美拉唑、睾酮、甲苯磺丁脲(分别为CYP1A2、CYP2D6、CYP2C19、CYP3A4、CYP2C9的探针药物)]共同孵育60 min。在另设空白组和阳性对照组[α-萘黄铜、奎尼丁、(+)-N-3-苄基香酚、酮康唑、磺胺苯吡唑(分别为CYP1A2、CYP2D6、CYP2C19、CYP3A4、CYP2C9的特异性抑制剂)]的基础上,以葛根素为内标,采用超高效液相色谱-质谱联用法(UPLC-MS/MS)分析相应代谢产物(对乙酰氨基酚、右啡烷、5-羟基奥美拉唑、6β-羟基睾酮、羟基甲苯磺丁脲)的含量。以ACQUITY UPLC?BEH C18为色谱柱,以0.01%甲酸水溶液-0.01%甲酸乙腈为流动相(梯度洗脱),柱温为40 ℃,流速为0.4 mL/min,进样量为2 μL;采用电喷雾电离源,以多反应监测模式进行正负离子扫描,数据采集范围为m/z 100~1 200,碰撞气为氩气,雾化气为氮气,锥孔气流量为50 L/h,脱溶剂气流量为800 L/h,正、负离子模式下毛细管电压分别为2.0、1.5 kV,离子源温度分别为120、110 ℃,脱溶剂的温度分别为400、450 ℃。使用Graphpad Prism 5.0软件进行非线性回归分析并计算半数抑制浓度(IC50)。结果:上述各代谢产物检测浓度的线性范围分别为0.26~8.35、0.36~34.56、0.10~3.09、3.67~117.37、0.15~4.88 μmol/L(R2>0.99),定量下限分别为0.26、0.36、0.10、3.67、0.15 μmol/L。阳性对照组特异性抑制剂对人肝微粒体中CYP1A2、CYP2D6、CYP2C19、CYP3A4、CYP2C9酶的IC50均在文献报道的可接受范围内。树豆酮酸A对人肝微粒体中CYP1A2、CYP2D6、CYP3A4酶的IC50值均大于50 μmol/L,对CYP2C9、CYP2C19酶的IC50值分别为4.94、18.00 μmol/L。结论:树豆酮酸A对人肝微粒体中CYP1A2、CYP2D6、CYP3A4酶没有抑制作用,对CYP2C9、CYP2C19酶有一定的抑制作用。
关键词 树豆酮酸A;人肝微粒体;细胞色素P450酶;Cocktail探针药物法;超高效液相色谱-质谱联用法;特异性抑制剂;抑制作用
ABSTRACT OBJECTIVE: To study the inhibitory effects of cajanonic acid A on 5 kinds of cytochrome P450 (CYP) enzyme, in human liver microsomes in vitro. METHODS: By Cocktail probe substrate method, 50.0, 15.0, 5.0, 1.5, 0.5, 0.15, 0.05 μmol/L cajanonic acid A were added into liver microsomes, and incubated with mixed probe substrates [including phenacetin, dextromethorphan, omeprazole, testosterone and toluenesulfonbutylurea (probe substrates of CYP1A2, CYP2D6, CYP2C19, CYP3A4, CYP2C9, respectively)]. On the basis of setting up blank group and positive control group [α-naphthalene brass, quinidine, (+)-N-3-benzyl vanillin, ketoconazole and sulfabendazole (specific inhibitors of CYP1A2, CYP2D6, CYP2C19, CYP3A4, CYP2C9, respectively)], using puerarin as internal standard, UPLC-MS/MS method was adopted to determine the contents of corresponding metabolites (acetaminophen, dextrophane, 5-hydroxy omeprazole, 6β-hydroxytestosterone, hydroxytolbutamide). The determination was performed on ACQUITY UPLC? BEH C18 column, with mobile phase consisted of 0.01% formic acid aqueous solution-0.01% acetonitrile formic acid (gradient elution) at the flow rate of 0.4 mL/min. The column temperature was 40 ℃, and the sample size was 2 μL. An electrospray ionization source was used to conduct positive and negative ion scanning in the multiple reaction monitoring mode. The data acquisition range was m/z 100-1 200, the collision gas was argon, the atomized gas was nitrogen, the gas flow rate of the cone hole was 50 L/h, the desorption gas flow rate was 800 L/h, the capillary voltage under positive and negative mode was 2.0, 1.5 kV, and the ion source temperature was 120 ℃, 110 ℃, respectively. The desolvent temperature were 400 ℃ and 450 ℃, respectively. Non linear regression analysis was performed by using Graphpad Prism 5.0 software and IC50 was calculated. RESULTS: The linear ranges of above metabolifes were 0.26-8.35, 0.36-34.56, 0.10-3.09, 3.67-117.37, 0.15-4.88 μmol/L (R2>0.99). The limits of quantitation were 0.26, 0.36, 0.10, 3.67, 0.15 μmol/L, respectively. The IC50 values of specific inhibitors in positive control group to CYP1A2,CYP2D6, CYP2C19, CYP3A4 and CYP2C9 in human liver microsomes were all within the acceptable range reported in the literature. The IC50 values of cajanonic acid A to CYP1A2, CYP2D6 and CYP3A4 in human liver microsomes were all more than 50 μmol/L, and the IC50 values of CYP2C9 and CYP2C19 were 4.94 and 18.00 μmol/L, respectively. CONCLUSIONS: Cajanonic acid A has no inhibitory effect on CYP1A2,CYP2D6 and CYP3A4, but has a certain inhibitory effect on CYP2C9 and CYP2C19.
KEYWORDS Cajanonic acid A; Human liver microsome; Cytochrome P450 entyme; Cocktail probe substrate method; UPLC-MS/MS; Specific inhibitor; Inhibition effect
中图分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)02-0195-06
DOI 10.6039/j.issn.1001-0408.2021.02.12
樹豆酮酸A(Cajanonic acid A,结构式见图1)是从豆科植物树豆Cajanus cajan(Linn.)Millsp.中提取的一种菧类化合物[1]。已有研究表明,该化合物具有降血糖活性,对2型糖尿病(T2DM)具有良好治疗作用,而且体内、体外研究均证实其对过氧化物酶体增殖物激活受体γ(PPARγ)和蛋白酪氨酸磷酸酶1B(PTP1B)具有抑制作用[2-4],且可能是通过抑制胰岛素抵抗和降低体质量来治疗T2DM[5-6];同时,其还可降低血清总胆固醇、三酰甘油和低密度脂蛋白胆固醇水平[7]。由此可见,树豆酮酸A具有重要的开发价值。
药物代谢的主要场所是肝脏,其中细胞色素P450(CYP)酶为主要的代谢酶,其亚型CYP1A2、CYP2D6、CYP2C19、CYP2C9、CYP3A4参与了体内80%以上的药物代谢[8]。CYP酶是一个多功能的酶系,在体内具有可诱导性和可抑制性[9-10]。该酶与药物的相互作用能够在所有的体内过程(包括吸收、分布、代谢和排泄)中发生,其中以代谢过程最为突出,约占40%[11-12]。可见,研究药物对CYP酶的影响具有重要意义,也是药物临床前研究的重要步骤,可为后期研究提供其抑制效果与诱导效果的相关信息。肝微粒体法是研究体外药物代谢的常用方法,该方法具有操作简单、重复性好等的特点[13]。基于此,本研究采用肝微粒体法,运用Cocktail探针药物法和超高效液相色谱-串联质谱法(UPLC-MS/MS)考察树豆酮酸A对人肝微粒体中5种常见CYP酶的体外影响,旨在为后续该化合物的临床前研究或新药研发提供参考依据。
1 材料
1.1 仪器
本文所用仪器如下:Xevo G2-XS型超高效液相色谱-四极杆串联飞行时间质谱仪(美国Waters公司)、X1型高速离心机(香港基因有限公司)、KH-600E型超声波清洗器(昆山禾创超声仪器有限公司)、优普系列超纯水机(四川优普超纯科技有限公司)、FA805N型十万分之一电子天平(上海菁海仪器有限公司)、DW-86L486型超低温保存箱(海尔集团公司)。
1.2 药品与试剂
树豆酮酸A对照品(批号20181226,纯度>98%)由贵州医科大学药物化学重点实验室制备,葛根素对照品(内标,批号528C021,纯度>98%)、烟酰胺腺嘌呤二核苷酸磷酸二钠(NADP-Na2,批号718B0225,纯度≥98%)、葡萄糖-6-磷酸-二钠(G-6-P-Na2,批号116B039,纯度≥98%)、葡萄糖-6-磷酸脱氢酶(G-6-P- DH,批号20160725,纯度90%)、磷酸盐缓冲液(PBS,浓度0.01 mol/L,pH7.4,批号409L024)均购自北京索莱宝科技有限公司,右美沙芬对照品(批号01155029-75469A,纯度≥98%)购自上海泰坦科技股份有限公司,非那西丁对照品(批号81105,纯度>98%)购自美国Sigma公司,奥美拉唑、甲苯磺丁脲、睾酮、对乙酰氨基酚、(+)-N-3- 苄基香酚、奎尼丁、磺胺苯吡唑、酮康唑和α-萘黄酮等对照品(批号100367-201305、100369-201307、L31J8T40939、SJ0711GA14、L27J9B64115、J09M6B1、A22M10L83645、100294-201203、B20083,纯度≥98%)均购自上海源叶生物科技有限公司,右啡烷对照品(批号FK-J1795,纯度>98%)购自上海樊克生物科技有限公司,羟基甲苯磺丁脲、5-羟基奥美拉唑、6β-羟基睾酮等对照品(批号1-PSB-27-2、1-PSB-27-2、KIT0635,纯度≥98%)均购自加拿大TRC公司;甲酸、甲醇、乙腈均为色谱纯,氯化镁、柠檬酸钠等其余试剂均为分析纯或实验室常用规格,水为蒸馏水。
1.3 其他
男性健康蒙古利亚人种肝微粒体购自武汉普莱特生物医药有限公司,批号为M10001.2017003。
2 方法与结果
2.1 树豆酮酸A和内标溶液的制备
精密称取树豆酮酸A对照品适量,用甲醇溶解并定容,配制成质量浓度为2.8 mmol/L的贮备液;取葛根素对照品适量,同法制得质量浓度为4 μg/mL内标溶液。上述溶液均于4 ℃下保存,备用。临用前,将树豆酮酸A贮备液用甲醇稀释,配制成质量浓度分别为50.0、15.0、5.0、1.5、0.5、0.15、0.05 μmol/L的溶液。
2.2 还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)辅酶溶液的制备
参照文献[14]方法,依次称取NADP-Na2、G-6-P-Na2和氯化镁 200、200、133 mg,用水溶解并定容至10 mL,置于-20 ℃下保存备用,记为A液。依次称取柠檬酸钠和G-6-P-DH 44 mg、1 000 U,用水溶解并定容至25 mL,置于-20 ℃下保存备用,记为B液。使用时,将A液和B液按体积比5 ∶ 1混匀后,加至孵育体系中。
2.3 混合探针药物溶液的制备
参照文献[15]方法,精密称取非那西丁、右美沙芬、奥美拉唑、睾酮、甲苯磺丁脲(分别为CYP1A2、CYP2D6、CYP2C19、CYP3A4、CYP2C9的探针药物)对照品7.557、12.3、4.32、7.21、13.5 mg,用甲醇溶解并定容至10 mL,作为探针药物贮备液。临用前,精密吸取上述探针药物贮备液各1 mL,用氮气流吹干,残渣加入二甲基亚砜(DMSO)20 μL和甲醇80 μL溶解,最后用PBS定容至5 mL,制备成非那西丁、右美沙芬、奥美拉唑、睾酮、甲苯磺丁脲质量浓度分别为1 000、1 500、250、500、1 000 μmol/L的混合探针药物溶液。
2.4 特异性抑制剂溶液的制备
分别精密称取溶液α-萘黄酮、奎尼丁、(+)-N-3-苄基香酚、酮康唑、磺胺苯吡唑(分别为CYP1A2、CYP2D6、CYP2C19、CYP3A4、CYP2C9的特异性抑制剂)对照品适量,用甲醇溶解、稀释,制成质量浓度均为1 mg/mL的单一贮备液。临用时,用甲醇稀释上述单一贮备液,配制成质量浓度分别为0.136、0.162、0.088、0.266、0.157 mg/mL的溶液,備用。
2.5 代谢产物标准溶液的制备
分别精密称取适量对乙酰氨基酚、右啡烷、5-羟基奥美拉唑、6β-羟基睾酮、羟基甲苯磺丁脲(分别为非那西丁、右美沙芬、奥美拉唑、睾酮、甲苯磺丁脲的代谢物)等5种对照品,用甲醇溶解、稀释,制成质量浓度均为1 mg/mL的单一贮备液。临用时,用甲醇将上述单一贮备液稀释至相应质量浓度,备用。
2.6 肝微粒体体外孵育体系的建立
参照文献[16]方法,取人肝微粒体适量,用PBS稀释至0.5 g/L。于冰浴条件下,依次加入人肝微粒体溶液20 μL、PBS 110 μL、相应浓度的树豆酮酸A或特异性抑制剂溶液20 μL、NADPH辅酶溶液(A液25 μL+B液5 μL)30 μL,于37 ℃水浴中孵育3 min;加入混合探针药物溶液20 μL开始反应,反应时间为60 min。每浓度平行3份。试验过程中,确保孵育体系总体积为200 μL(PBS浓度100 mmol/L),其中溶解探针药物的DMSO含量不超过0.1%,甲醇含量不超过1%[17]。
2.7 UPLC-MS/MS法的建立
2.7.1 样品处理 于体外孵育体系中加入冰乙腈(含0.4 mg/mL葛根素)200 μL终止反应,涡旋60 s后,以13 000 r/min(下同)离心10 min,取上清液,用氮气流吹干,残渣用甲醇200 μL复溶,再次离心10 min,取上清液适量,对乙酰氨基酚等代谢产物进行UPLC-MS/MS分析。
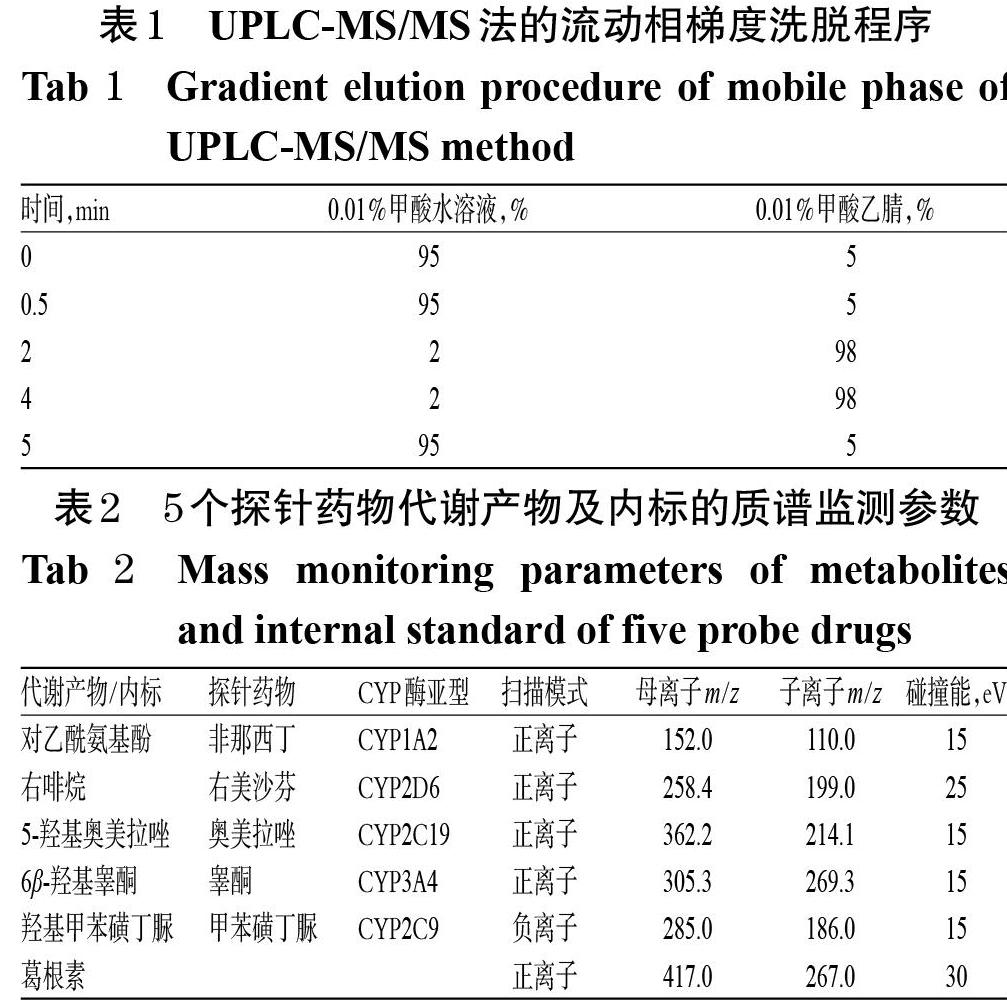
2.7.2 色谱与质谱条件 (1)色谱条件:以Acquity UPLC?BEH C18(100 mm×2.1 mm,1.8 μm)为色谱柱,流动相为0.01%甲酸水溶液-0.01%甲酸乙腈为流动相进行梯度洗脱(洗脱程序见表1),柱温为40 ℃,流速为0.4 mL/min,进样量为2 μL。(2)质谱条件:以电喷雾电离源(ESI)为离子源,扫描模式为多反应监测(MRM)模式,扫描方式为正、负离子,数据采集范围为m/z 100~1 200,毛细管电压为2.0 kV(正离子模式)、1.5 kV(负离子模式),离子源温度为120 ℃(正离子模式)、110 ℃(负离子模式),脱溶剂的温度为400 ℃(正离子模式)、450 ℃(负离子模式),碰撞气为氩气,雾化气为氮气,锥孔气流量为50 L/h,脱溶剂气流量为800 L/h,5个探针药物代谢产物及内标的质谱监测参数见表2。采用甲酸钠(0.5 mmol/L)和亮氨酸脑啡肽(1 ng/mL)分别进行质量轴的校正和质量的实时校正。
2.7.3 专属性考察 取肝微粒体孵育液,除不加探针药物和内标外,其余按“2.6”“2.7.1”项下方法处理后,再按“2.7.2”项下色谱和质谱条件进样测定,记录色谱图;将“2.5”项下的代谢产物标准溶液加入至灭活的肝微粒体孵育液中,按“2.6”“2.7.1”项下方法处理后,同法进样测定,记录色谱图;取“2.6”项下肝微粒体孵育液(5.0 μmol/L的树豆酮酸A),按“2.7.1”项下方法处理后,同法进样测定,记录色谱图。结果,空白肝微粒体对对乙酰氨基酚、右啡烷、5-羟基奥美拉唑、6β-羟基睾酮、羟基甲苯磺丁脲和内标的测定无干扰,专属性良好,详见图2。
2.7.4 线性关系考察 分别吸取对乙酰氨基酚、右啡烷、5-羟基奥美拉唑、6β-羟基睾酮、羟基甲苯磺丁脲单一贮备液适量,用甲醇稀释,配制成对乙酰氨基酚质量浓度分别为0.26、0.52、1.04、2.09、4.18、8.35 μmol/L,右啡烷分别为0.36、1.44、4.32、8.64、17.28、34.56 μmol/L,5-羟基奥美拉唑分别为0.10、0.19、0.38、0.77、1.54、3.09 μmol/L,6β-羟基睾酮分别为3.67、7.34、14.68、29.34、58.68、117.37 μmol/L,羟基甲苯磺丁脲分别为0.15、0.30、0.61、1.22、2.44、4.88 μmol/L的系列溶液,按“2.7.1”项下方法处理后,再按“2.7.2”项下色谱与质谱条件进样测定,记录峰面积。以上述待测成分质量浓度(x,μmol/L)为横坐标、其与内标峰面积之比(y)为纵坐标进行线性回归分析,结果见表3。结果显示,肝微粒体孵育体系中对乙酰氨基酚、右啡烷、5-羟基奥美拉唑、6β-羟基睾酮、羟基甲苯磺丁脲的线性关系良好(R2>0.99),定量下限分别为0.26、0.36、0.10、3.67、0.15 μmol/L。
2.7.5 准确度、精密度、稳定性和基质效应考察 按“2.6”项下方法分别配制定量下限和低、中、高质量浓度(浓度按预试验结果设置)对乙酰氨基酚、右啡烷、5-羟基奥美拉唑、6β-羟基睾酮、羟基甲苯磺丁脲的孵育体系,每个浓度平行5份,按“2.7.1”项下方法处理样品后进样测定,考察准确度和日内精密度;每日测定1次、连续测定3 d,考察日间精密度。样品处理后室温放置12 h后进样测定,考察稳定性。另取空白肝微粒孵育体系200 μL,置于2 mL EP管内,按“2.7.1”项下方法处理样品后,用氮气流吹干,分别加入对乙酰氨基酚、右啡烷、5-羟基奥美拉唑、6β-羟基睾酮、羟基甲苯磺丁脲标准溶液适量,使其质量浓度与上述样品对应,每个浓度平行5份,进样测定,记录峰面积(A1);以甲醇配制相应浓度且不含辅酶溶液的代谢产物标准溶液,按“2.7.1”项下方法处理后进样测定,记录峰面积(A2),计算基质效应,基质效应(%)=A1/A2×100%。结果,肝微粒体孵育体系中对乙酰氨基酚、右啡烷、5-羟基奥美拉唑、6β-羟基睾酮、羟基甲苯磺丁脲的准确度为(87.04±8.62)%~(102.37±4.85)%,日内、日间精密度试验和12 h稳定性试验的RSD均小于10.0%;基质效应为(84.22±3.58)%~(102.42±6.51)%,表明该方法准确、可靠、重现性好,详见表4。
2.8 体外孵育试验
体外孵育试验设置试验组、空白组、阳性对照组,每组平行3次。按“2.6”项下方法制备孵育体系,试验组孵育体系中分别加入质量浓度为50.0、15.0、5.0、1.5、0.5、0.15、0.05 μmol/L的树豆酮酸A溶液,阳性对照组孵育体系中分别加入“2.4”项下的α-萘黄酮、奎尼丁、(+)-N-3-苄基香酚、酮康唑、磺胺苯吡唑溶液,空白组孵育体系中加入等体积的PBS。按“2.7.1”项下方法处理后,按“2.7”项下方法分析各探针药物对应的代谢产物对乙酰氨基酚、右啡烷、5-羟基奥美拉唑、6β-羟基睾酮和羟基甲苯磺丁脲的含量。以空白组代谢产物的含量记为c0,其余各组的代谢产物含量记为cx,计算剩余酶活性,剩余酶活性(%)=(1-cx/c0)×100%。以树豆酮酸A的质量浓度(x,μmol/L)为横坐标、剩余酶活性(y,%)为纵坐标,使用Graphpad Prism 5.0软件进行非线性回归分析并计算半数抑制浓度(IC50)。肝微粒体中CYP1A2、CYP2D6、CYP2C19、CYP3A4、CYP2C9酶的剩余酶活性-树豆酮酸A浓度曲线见图3,树豆酮酸A和特异性抑制剂对人肝微粒体中CYP1A2、CYP2D6、CYP2C19、CYP3A4、CYP2C9的IC50见表5。
由表5结果可知,阳性对照组的特异性抑制剂对肝微粒体中CYP1A2、CYP2D6、CYP2C19、CYP3A4、CYP2C9酶的IC50均在可接受范圍内,表明本试验中的孵育体系可行。树豆酮酸A在50.0~0.05 μmol/L浓度范围内对肝微粒体中CYP1A2、CYP2D6、CYP3A4酶没有抑制作用,其IC50>50 μmol/L;对CYP2C9、CYP2C19酶有一定的抑制作用,其IC50分别为4.94、18.00 μmol/L。
3 讨论
与体内代谢研究比较,体外代谢研究具有成本低廉,操作方法简便、快速,结果重现性好等优点,适用于新药研发候选化合物代谢行为的早期研究及筛选[18]。近年来,随着检测方法灵敏度和特异性的不断提高,Cocktail探针药物法在各个领域研究中的应用越来越广泛。Cocktail探针药物法是指给予不同剂量的探针药物,以测定每种探针药物代谢产物生成率的方法[18-19]。本研究对树豆酮酸A在肝微粒体中的代谢行为进行了初步探讨,采用Cocktail探针药物法评价了该化合物对人肝微粒体中CYP酶亚型1A2、2D6、2C19、3A4、2C9的影响,方法快速、灵敏。
在体外代谢研究中,受试底物的浓度不能过高,过高将无法保证其20%的清除率;受试底物的浓度也不宜过低,过低则底物会在极短时间内被清除完全[20]。通过前期对0.3、1.5、3.0 μmol/L的树豆酮酸A孵育情况进行考察,结果显示,当树豆酮酸A的浓度为1.5 μmol/L时,剩余药物浓度适中,且大部分种属肝微粒体中有20%的药物被清除,所以选择1.5 μmol/L作为树豆酮酸A受试浓度的中间点,上下各取3个浓度水平进行体外孵育试验。
本研究结果显示,树豆酮酸A浓度在0.05~50 μmol/L范围内对人肝微粒体中的CYP2C9、CYP2C19酶有一定的抑制作用,对CYP1A2、CYP2D6、CYP3A4酶没有明显的抑制作用。由此推测,树豆酮酸A相关制剂在临床上使用时有可能与其他经CYP2C9、CPY2C19酶代谢的药物发生竞争性抑制作用。本课题组后期将进一步研究树豆酮酸A对CYP2C9、CYP2C19酶的抑制作用机制。
参考文献
[ 1 ] CAMERON KO,KUNG DW,KALGUTKAR AS,et al.Discovery and preclinical characterization of 6-chloro-5- [4-(l-hydroxycyclobutyl)phenyl]-1H-indole-3-carboxylic acid(PF-06409577),a direct activator of adenosine monophosphate-activated protein kinase(AMPK),for the potential treatment of diabetic nephropathy[J]. J Med Chem,2016,59(17):8068-8081.
[ 2 ] 中华医学会糖尿病学分会.中国2型糖尿病防治指南:2017年版[J].中华糖尿病杂志,2018,10(1):4-67.
[ 3 ] 班玉娟,张丽,陈瑞,等.超滤法结合UPLC-MS/MS法研究树豆酮酸A在不同种属血浆中的血浆蛋白结合率[J].中国药房,2019,30(13):1739-1743.
[ 4 ] 蔡进,张丽,汤磊,等.树豆酮酸A在Caco-2细胞单层模型的转运机制研究[J].中国药学杂志,2018,53(10):793-798.
[ 5 ] YANG RY,WANG L,XIE J,et al. Treatment of type 2 diabetes mellitus via reversing insulin resistance and regulating lipid homeostasis in vitro and in vivo using cajanonic acid A[J]. Int J Mol Med,2018,42(5):2329-2342.
[ 6 ] 王璐.树豆酮酸A调节血糖血脂的作用和机理研究[D].广州:广州中医药大学,2012.
[ 7 ] 冯晓杰.抗肿瘤中药对CYP450酶的影响[C]//第七届中国药学会医院肿瘤药学大会论文集,北京:中国药学会,2018:85-88.
[ 8 ] 向云亚. 6-姜酚在大鼠肝微粒体中的代谢研究[D].广州:广州中医药大学,2013.
[ 9 ] 于敏,张双庆,闻镍,等.细胞色素P450酶系体外药物代谢研究方法进展[J].中国药事,2013,27(1):81-87.
[10] WANG YX,DU Y,LIU XF,et al. A hepatoprotection study of radix bupleuri on acetaminophen-induced liver injury based on CYP450 inhibition[J]. Chin J Nat Med,2019,17(7):517-524.
[11] 董杰.艾瑞昔布对CYP2C9酶的抑制作用及表达的影响[D].石家庄:河北医科大学,2019.
[12] LEE JY,LEE SY,OH SJ et al. Assessment of drug-drug interactions caused by metabolism-dependent cytochrome P450 inhibition[J]. Chem Biol Interact,2012. DOI:10.1016/ j.cbi.2012.05.007.
[13] 郑咪.不同聚合度的PEG对人肝微粒体CYP酶的抑制作用研究[D].长春:吉林大学,2016.
[14] 张丽,朱高峰,黄静,等.采用UPLC-MS/MS法研究树豆酮酸A在不同种属肝微粒体中的代谢差异[J].中国药房,2019,30(18):2497-2502.
[15] 潘洁,陆苑,孙佳,等.艾迪注射液对体外人和大鼠肝微粒体中CYP450酶的抑制作用[J].中成药,2016,38(11):2332-2337.
[16] 潘洁,秦兰,杨淑婷,等.羊耳菊提取物对大鼠和人肝微粒体CYP450酶的体外抑制作用[J].贵州医科大学学报,2019,44(11):1273-1277.
[17] 陈瑞,汤磊,黄静,等.新型胰岛素增敏剂ZG02在大鼠肝微粒体中的代谢稳定性研究[J].中国药房,2018,29(24):3359-3364.
[18] 李思婵. TJ0711盐酸盐对肝脏CYP450酶的抑制作用[D].武汉:华中科技大学,2013.
[19] 黄彧,吴桐,刘春明,等.探针药物法评价厚朴酚、和厚朴酚对大鼠肝微粒体中CYP450酶的抑制作用[J].中国现代应用药学,2019,36(4):392-396.
[20] 陳鹏,汪静,张红盼,等.药物体外肝代谢的研究方法[J].中国药房,2017,28(19):2703-2707.
(收稿日期:2020-07-24 修回日期:2020-12-08)
(编辑:邹丽娟)
