MAH制度下我国药品不良反应损害赔偿保险模型初探
2021-02-21贾夏怡朱岩冰方宇侯鸿军刘佐仁常捷
贾夏怡 朱岩冰 方宇 侯鸿军 刘佐仁 常捷

摘 要 目的:构建药品上市许可持有人(MAH)制度下我国药品不良反应(ADR)损害赔偿保险模型,为减少我国因ADR损害导致的医疗纠纷问题、保障患者权益提供参考。方法:采用推荐法和“滚雪球”法邀请访谈专家进行半结构化访谈获得定性數据,并用主题分析法对访谈结果进行分析;根据主题分析结果从保险类型设置、投保等级划分和强制保险保障对象等3方面设计ADR损害赔偿模型,并使用基于层次分析的模糊综合评价法对模型进行评估;通过问卷调查并结合多因素Logistic回归分析对药品相关机构是否愿意建立ADR损害赔偿体系的影响因素进行分析。结果:共邀请专家40位,其中有34位完成了访谈,回应率为85.0%。目前我国ADR损害赔偿面临的问题主要包括第三方鉴定和ADR损害举证困难,ADR损害导致的医疗纠纷难以得到及时、公平的解决,ADR损害纠纷处理成本高、耗时长以及赔偿模式不确定等。半数以上的受访专家赞同保险这一赔偿模式。所建强制保险与商业保险联合的ADR损害赔偿模型的整体得分为89.50。共发放调查问卷640份,回收有效问卷559份(药品生产企业204家、药品经营企业172家、医疗机构183家),问卷有效率87.3%。多因素Logistic回归分析结果显示,与赞同我国在MAH制度施行后建立ADR损害赔偿体系成正相关的因素包括药品生产企业ADR专员对ADR相关政策的熟悉程度(β=1.697,P<0.05)、药品经营企业经营品种(β=2.987,P<0.05)和医疗机构人员对ADR的认知水平(β=2.800,P<0.05);与赞同我国在MAH制度施行后建立ADR损害赔偿体系成负相关的因素是医疗机构人员工作年限(β=-2.544,P<0.05)。结论:本研究建立的ADR损害赔偿模型具有可行性,对于减轻ADR损害患者的经济负担,及时解决ADR损害引发的患者健康问题,促进我国药品保险发展可能具有一定的参考价值。药品生产企业ADR专员对ADR相关政策的熟悉程度、医疗机构人员对ADR的认知水平、药品经营企业经营的药品品种和医疗机构人员工作年限是MAH制度下构建ADR损害赔偿模型的主要影响因素。
关键词 药品上市许可持有人;药品不良反应;损害赔偿模型;影响因素
ABSTRACT OBJECTIVE: To construct Chinas Insurance Mode for ADR injury compensation model under marketing authorization holder (MAH) system, and to provide reference for reducing the medical disputes caused by ADR damage and protecting the rights and interests of patients. METHODS: Using the methods of recommendation and “snowball”, the interviewers were invited to conduct semi-structured interviews to obtain qualitative data, and the results were analyzed by thematic analysis. According to the results of subject analysis, the ADR injury compensation model was designed from three aspects of insurance type setting, insurance level division and compulsory insurance protection objects, and the Fuzzy comprehensive evaluation method based on AHP was used to evaluate the model; questionnaire and multiple factor Logistic regression analysis was adopted to analyze the influential factors of whether drug related institutions were willing to establish ADR injury compensation system. RESULTS: A total of 40 experts were invited and 34 of them completed the interview, with a response rate of 85.0%. At present, the problems of ADR injury compensation in China mainly included the difficulties of third-party identification and adducing evidence of ADR injury, the difficulty of timely and fair settlement of medical disputes caused by ADR injury, the high cost and long time of handling ADR injury disputes, and the uncertainty of compensation mode. More than half of the experts interviewed agreed with the compensation mode of insurance. The overall score of established model was 89.50. A total of 640 questionnaires were distributed and 559 valid questionnaires were recovered (204 drug manufacturers, 172 drug distributors and 183 medical institutions). The effective rate of the questionnaire was 87.3%. Multiple Logistic regression analysis showed that the factors positively correlated with the approval of establishing ADR injury compensation system after the implementation of MAH system in China included the familiarity of ADR staff in drug manufacturing enterprises with ADR related policies (β=1.697, P<0.05), the types of drugs operated by pharmaceutical companies (β=2.987, P<0.05), the cognitionlevel of medical staff on ADR (β=2.800, P<0.05). The working years of medical staff were negatively correlated with the approval of establishing ADR injury compensation system after the implementation of MAH system (β=-2.544, P<0.05). CONCLUSIONS: ADR injury compensation model designed in this study is feasible. It has reference value for reducing the economic burden of ADR patients, treating patients health problems caused by ADR injury in time, and promoting the development of Chinas drug insurance. Main influential factors for the establishment of ADR injury compensation model under MAH system contain the familiarity of ADR staff in drug manufacturing enterprises with ADR related policies, the types of drugs operated by pharmaceutical companies, the cognitionlevel of medical staff on ADR, the types of drugs operated by pharmaceutical companies, the cognitionlevel of medical staff on ADR.
KEYWORDS Marketing authorization holder; ADR; Injury compensation model; Influential factors
中圖分类号 R95 文献标志码 A 文章编号 1001-0408(2021)02-0151-07
DOI 10.6039/j.issn.1001-0408.2021.02.05
药品不良反应(ADR)是指合格药品在正常用法用量下出现的与用药目的无关的有害反应[1]。根据中国药品不良反应监测网络统计数据显示,近年来我国ADR报告数量持续增加,新的和严重的ADR报告在总报告中的占比自2004年的不足5%上涨至2019年的31.5%,其中严重的ADR报告在总报告中占比也自2004年的不足5%上涨至2019年的10.3%,且因严重的ADR所导致的全身性损害在ADR所有损害中占比超过10%[2]。随着我国医药产业的发展,药品带来的风险越来越受到社会的广泛关注,一些药品潜在风险造成的损害巨大且波及范围广泛(例如2006年的“齐二药”事件[3]),不仅使医药企业和医疗机构承受巨大损失,使患者身体健康受到严重损害甚至导致死亡,而且也会使政府的公信力在这类突发事件的应对过程中深受影响。然而,我国尚未建立ADR的损害赔偿保障机制,缺乏完善的ADR归责和受害者权益保障的法律法规,加之当前我国对ADR的行政干预仅停留在对ADR信息的获取和控制上,尚未深入到对受害者的赔偿层面,患者往往在遭受严重的ADR后得不到及时救治及赔偿,故亟需建立符合我国国情的ADR损害赔偿模式。
药品上市许可持有人(Marketing authorization holder,MAH)是指取得药品注册证书的企业或者药品研制机构等。2019年8月26日颁布的新版《药品管理法》提出,国家对药品实行MAH制度,MAH应当依法对药品的非临床研究、临床试验、生产经营、上市后研究、不良反应监测和处理等承担责任[4]。由于MAH是药品全生命周期的第一责任人,新版《药品管理法》规定,MAH在申请药品注册时必须购买相关保险或提供担保,以保证当药品发生ADR时,药品的质量安全信息和患者的赔偿问题有源可溯,因此MAH制度的全面实施将使我国ADR损害赔偿模式的建立成为可能。
2018年8月开始,本课题组对我国广东、江苏、浙江、北京、上海等5个省市有关MAH实施后的药品保险试点情况进行了实地考察(该5个省市于2015年率先在全国开展MAH试点工作),在ADR损害赔偿方面,笔者发现,当前我国关于MAH在申请注册时所购买的保险种类大部分仅用于保障药物临床试验过程中的相关问题,尚未涉及药品上市后ADR赔偿的情况。此外,新版《药品管理法》仅要求MAH购买保险或提供担保证明,但未对保险的险种、类型、投保等级和保险的保障对象等作出详细要求,并且有关我国药品保险的文献报道也较少。基于此,本研究采用推荐法和“滚雪球”法邀请访谈专家进行半结构化访谈获得定性数据,并用主题分析法对访谈结果进行分析;根据主题分析结果从保险类型设置、投保等级划分和强制保险保障对象等3方面设计ADR损害赔偿模型,并使用基于层次分析的模糊综合评价法对模型进行评估;通过问卷调查并结合多因素Logistic回归分析对药品相关机构是否愿意建立ADR损害赔偿体系的影响因素进行分析。以期为减少我国因ADR损害导致的医疗纠纷问题、保障患者权益提供参考。
1 专家访谈
1.1 专家邀请及访谈方法
本研究采用面对面的半结构化访谈进行定性研究,质性资料分析采用主题分析法[5]。由经过培训的访谈员按照统一的访谈指南进行调研(访谈指南经过6位药学专家的试点测试,以保障访谈问题的质量和语言清晰度)。访谈问题分为3个部分,包括我国ADR损害赔偿的现状、我国ADR损害赔偿面临的问题以及受访专家对于构建ADR损害赔偿模型的建议。本研究通过陕西省药品监督管理局工作人员推荐和“滚雪球”调查法在广东、江苏、浙江、陕西、北京和上海招募访谈专家。专家纳入标准:具有医药学背景且从事医药相关领域或ADR损害赔偿纠纷相关工作;从业时间10年以上;推荐人认为其具有良好的学术水平及行业声誉[6]。
参考文献方法[7]进行访谈前准备。每位专家的访谈持续时间为60~90分钟。正式访谈前由调研人员向受访专家阐明研究目的,并承诺对访谈过程和内容保密,所有访谈均经过参与者同意并进行录音,调查结束后使用NVivo 12.0软件进行信息录入和数据处理。
1.2 受访专家基本资料
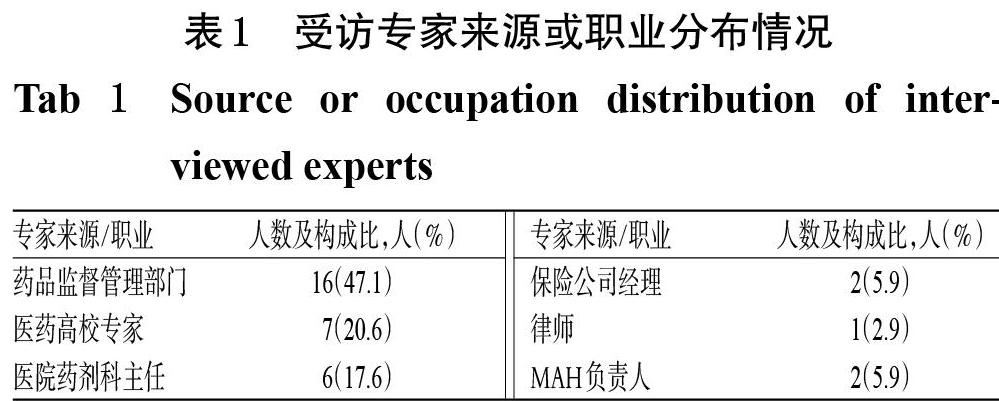
本研究共邀请了40位专家进行访谈,因工作安排,最终有34位完成访谈,回应率为85.0%(34/40)。所有受访者工作年限都在10年以上并具有良好的学术水平和行业声誉,主要研究领域涉及ADR监管、药品政策法规、生产、使用以及保险或法律专业。其中,药品监督管理部门的参与者占47.1%(16/34),其对ADR损害赔偿模式具有更大的决策影响。受访专家来源或职业分布情况见表1。
1.3 专家访谈结果
1.3.1 我国ADR损害赔偿的现状
目前,我国尚无ADR损害赔偿的相关立法,因此在发生ADR纠纷时若无法确定过错方,仅依靠无过错责任将ADR损害的赔偿归责给药品生产企业和医疗机构不仅会增加后者的经济负担,也不够客观公正。在临床实际中,当患者用药致ADR纠纷发生时,一般会由其就诊的医疗机构出面给予一定的经济补偿;而对于严重的ADR,或当患者及其家属提出较高要求无法与就诊的医疗机构就赔偿问题达成一致时,当事人可选择通过司法途径解决,司法判决结果有可能会要求药品生产企业、经营企业和医疗机构同时对事故赔偿金额进行分担。此外,还会有部分医疗机构会借由ADR纠纷事件,要求药品生产企业通过承担医疗机构学术活动等费用来“弥补”其赔偿损失,否则就会影响该企业生产药品在该机构的销售情况。
1.3.2 我国ADR损害赔偿面临的问题
(1)第三方鉴定困难。所有受访专家均表示缺乏ADR损害第三方鉴定机构和鉴定流程是我国ADR损害赔偿面临的首要难题。导致ADR的原因涉及药品质量、治疗方式、疾病种类、患者情况等多种因素,因此ADR的鉴定工作具有较强的技术性和专业性。由于我国还没有确立法定的ADR鉴定机构和鉴定程序,故目前这一鉴定工作多由医疗机构承担。但ADR的认定较为复杂,仅靠医师依据患者的临床症状和相关治疗信息很难认定损害是否由ADR引起,因此当事各方(包括药品监督管理部门、药品生产企业、药品经营企业、医疗机构、处方者、患者等)在将损害是否定性为ADR以及ADR的严重程度等级等方面很难达成一致意见。同时,在漫长的争论过程中,ADR受害者难以得到及时、合理的经济补偿,往往会耽误其治疗,进而引发更多的社会问题。
(2)ADR损害举证困难。一般患者要证明损害的发生与药品之间存在因果关系的难度非常大,尤其是对于某些在长期用药后才发生的ADR,要证明该损害与药品间存在因果关系的困难更大。通常患者需要依赖专业的医务人员进行举证,而医务人员为避免麻烦或害怕承担责任,不愿为患者提供证明甚至阻碍患者收集证据的情况也时有发生。
(3)ADR损害纠纷难以得到及时、公平的解决。在我国当前的政策环境下,ADR纠纷难以通过诉讼渠道来解决。在当事各方因赔偿问题僵持不下、矛盾激化的情况下,很多ADR损害事件容易变为社会纠纷。此外,部分医务人员由于害怕纠纷,担心ADR损害纠纷会转变成医疗责任事故,个人可能要为此承担医疗责任或行政、刑事责任,因而对临床治疗过程中出现的ADR是否应该向相关部门报告顾虑重重,这样使得ADR报告和监测工作难度都很大,很容易造成ADR损害不能在第一时间被发现和控制,进而进一步扩大或加深了ADR损害造成的不良后果。
(4)ADR损害纠纷处理成本高、耗时长。受访的MAH负责人均表示,处理一件ADR纠纷的人力、物力、财力等成本投入均较高,有时还会对生产企业的品牌形象造成无法估量的影响,进而产生更多的包括公关费用或宣传费用在内的品牌维护费用。且当发生ADR纠纷时,事件处理、取证、鉴定和司法诉讼等方面所耗的时间往往也非常长。
(5)赔偿模式不确定。所有受访专家均表示,我国药品保险、基金和担保行业才刚刚起步,因此我国ADR损害赔偿是否应该选择保险、担保或基金模式仍存在争议。保险方面,我国的保险业发展并不成熟,缺少药品相关险种的运作经验。2003年,上海曾开始推行“严重ADR综合保险”,由药品生产企业支付药品销售额0.2%作为保险金,如果在药品使用过程中发生严重的ADR,则由保险公司支付一定额度的赔偿金。该保险推出后曾有两家保险公司参与,但是未见有任何生产企业投保,导致该项目以失败告终[8]。基金方面,有受访专家表示,2016年上海张江高科技园区管委会曾在张江专项(沪张江园区管〔2016〕103号)中拨付5 000万元的风险救济基金,对注册在张江高科技园核心区内的MAH和受托生产企业提供药品ADR风险救济保障,并为企业提供保费补贴。当发生严重的ADR后,可用该基金对事件中的死亡受害人给予每人不超过10万元的救助,其他受害人给予每人不超过5万元的救助。但是该基金至今未投入使用。
1.3.3 受访专家对于构建ADR损害赔偿模型的建议
(1)保险。所有受访者均赞同基于MAH制度构建ADR损害赔偿模式,其中67.6%(23/34)的受访专家认为保险更适合我国的市场环境,推荐强制保险与商业保险联合的模式。保险模式的优势在于保险公司久经市场考验,是国际社会通用的选择,其抗风险能力更强、理赔更加及时、监管体系较为完备,其运行方式也更容易与现有的其他法规相衔接。在处理ADR损害赔偿时,受访的一位律师表示,首先要分清是何种原因造成的,如果属于医疗机构人为过失导致的药害事件,自然应该由医疗机构赔偿;如果属于ADR事件,则应由MAH进行经济补偿,此时可启动保险赔付以缓解生产企业的压力;而对药品生产企业来说,购买药品保险的资金压力一般是小于ADR事件的赔偿压力的。
(2)基金或擔保保障。73.5%(25/34)的受访专家认为,我国基金行业尚未发展成熟,现阶段不建议采用基金方式进行ADR损害的赔偿。另外,52.9%(18/34)的受访专家不赞同采用担保方式,他们认为担保合同较为复杂,现有的药品监督管理部门审评人员恐较少有金融相关背景,不熟悉相关领域知识,故不利于政府部门对其进行监管。
(3)保证金。有部分受访专家表示,大型药品生产企业财力雄厚,可初步尝试实行风险保证金制度,一旦出现赔付力不足的问题,则可强制其购买ADR损害责任险。
2 模型的建立与评估
2.1 ADR损害赔偿模型的构建
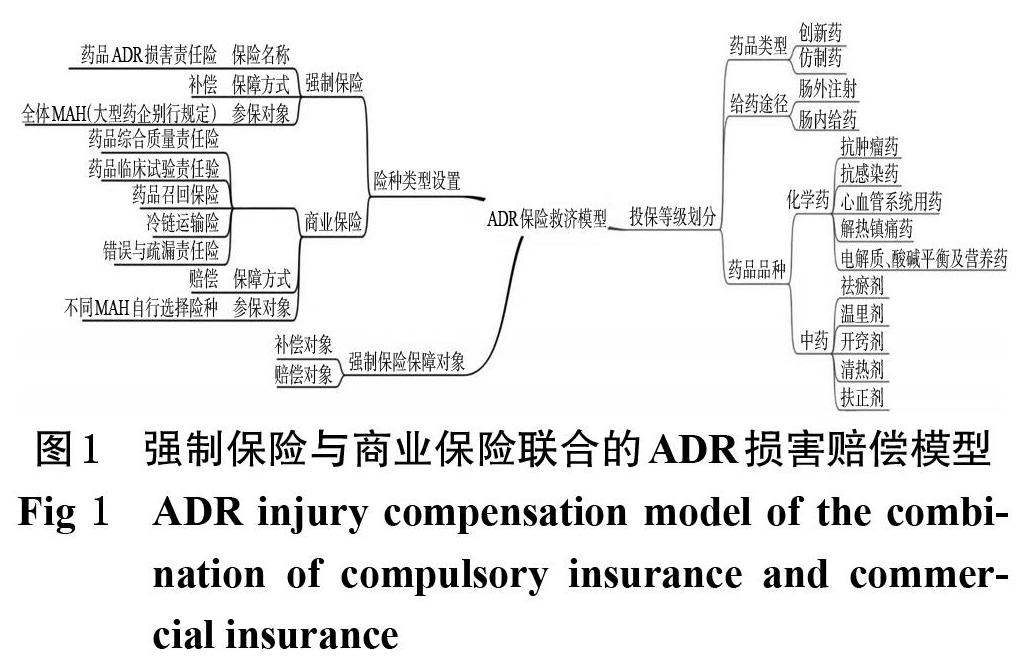
根据上述专家定性访谈结果,本研究得出强制保险与商业保险联合的ADR损害赔偿模型,详见图1。模型主要包含险种类型设置、投保等级划分和强制保险保障对象等3方面。
2.1.1 险种类型设置
按险种类型可分为强制保险与商业保险。本研究将强制保险命名为ADR损害责任险,该保单采用事故发生制,保单的时限为药品有效期,参保对象为全体MAH。商业保险包括药品质量综合责任险、药品临床试验责任险、药品召回保险、冷链运输险及药品供应环节的错误与疏漏责任险等。
2.1.2 投保等级划分
强制保险与商业保险的投保等级按药品属性可考虑按照如下3个步骤进行划分:第1步,区分MAH持有的药品属于创新药还是仿制药。根据受访专家意见,一般情况下,创新药ADR发生的概率更高,所以创新药与仿制药在购买保险时需要区别对待。第2步,考虑MAH持有药品的给药途径属于肠外注射还是肠内给药。根据近5年来国家ADR监测年度报告可知,注射剂ADR发生的概率最高[2],因此药品属肠外注射或是肠内给药在购买保险时也需区别对待。第3步,区分药品种类,按照化学药与中药(含中成药)进行区分。由于我国《疫苗管理法》要求所有疫苗及生物制品的生产单位均需要购买强制保险,因此本研究暂不涉及生物制品。
2.1.3 强制保险保障对象
ADR损害责任险的保障对象分为两类。第一类为补偿对象:当患者发生药品说明书中提及的ADR,但后果严重导致其丧失劳动能力的,保险公司可按照条约对患者进行经济补偿,补偿金额仅限保障患者的基本医疗费用。第二类为赔偿对象:若患者遭受药品说明书中未提及的ADR(轻微伤害不构成索赔基础),保险公司将按照条约对患者进行经济赔偿。赔偿金额一般高于补偿金额。
2.2 模型的评估
根据专家访谈结果建立ADR保险赔偿模型指标体系,使用YAAHP 12.0 软件生成层次分析法调查问卷,在34位访谈参与者中随机抽取5位不同专业方向的专家参照Saaty 1~9标度法对评价体系中各层指标进行两两比较来建立判断矩阵。在各个判断矩阵都通过了一致性检验后(即一致性比率<0.1),利用YAAHP 12.0软件直接计算得出评价体系中各级指标的权重[9];然后通过邮件再次向所有访谈参与者发送模型评价问卷。34位访谈参与者的问卷回收率为100%。在ADR损害赔偿模型中,险种类型设置、投保等级划分、强制保险保障对象这3个一级指标的权重分别为0.577 3、0.260 6、0.162 3。结合各级指标的权重和事先设定的评语集,使用模糊综合评价法计算各评价指标得分及模型整体得分。不同评价等级对应分值标准[10-11]:95分及以上为非常好,85~<95分为比较好,75~<85分为一般,65~<75分为差,<65分为非常差。结果,模糊综合评价法计算出模型的整体得分为89.50,3个一级指标评价结果得分依次为90.02(险种类型设置)、89.36(投保等级划分)、87.17(强制保险保障对象)。按药品类型划分投保等级(二级指标)的评价结果为“非常好”;其他指标评价结果均为“比较好”或“非常好”。
3 影响因素问卷调查
参考ADR损害赔偿和MAH制度的相关文献[12-25],分别针对217家药品生产企业、223家药品经营企业和200家医疗机构等3类研究对象设计3种不同的结构化问卷(均为选择题),调查相关机构人员是否赞同我国在MAH制度施行后建立ADR损害赔偿体系的影响因素。采用Epi InfoTM 7.2.1.0软件制作数字问卷。为提高问卷内容的有效性,首先在34位受访专家中抽取2位药学专家对问卷内容、结构、适用性以及逻辑性进行主观评价;修改后,于正式调查前在30个拟调查的对象中进行预调查。经验证,3种问卷的信效度均良好。正式问卷调查于2019年1-7月开展,由经过培训的3名调查员进行问卷调查,调查员均具有本科以上学历且具有现场研究经验。问卷数据采用Epi InfoTM 7.2.1.0软件进行编辑,并将数据导入SPSS 24.0软件中进行数据清洗和分析。采用χ2检验(必要时可采用Fisher精确检验)检验因变量与自变量的关联性,采用多因素Logistic回归分析研究自变量对因变量的影响。P<0.05为差异有统计学意义。不同研究对象的变量设置情况见表2。
结果,共回收有效问卷559份,问卷有效率为87.3%(559/640),其中药品生产企业204份、药品经营企业172份、医疗机构183份。559份问卷中,与是否赞同我国在MAH制度施行后建立ADR损害赔偿体系成正相关的因素包括药品生产企业ADR专员对ADR相关政策的熟悉程度(β=1.697,P<0.05)、药品经营企业经营品种(β=2.987,P<0.05)和医疗机构人员对ADR的认知水平(β=2.800,P<0.05)。与是否赞同我国在MAH制度施行后建立ADR损害赔偿体系成负相关的因素是医疗机构人员工作年限(β=-2.544,P<0.05)。多因素Logistic回归分析结果见表3(因篇幅所限,表中仅列出有显著影响的回归分析结果)。
4 讨论
本研究结果表明,目前我国ADR损害赔偿面临的问题主要有第三方鉴定和ADR损害举证困难,ADR损害导致的医疗纠纷难以得到及时、公平的解决,ADR损害纠纷处理成本高、耗时长以及赔偿模式不确定等。半数以上的受访专家均赞同保险这一赔偿模式。根据上述专家访谈定性结果,本研究主要从保险类型设置、投保等级划分和强制保险保障对象等3方面对强制保险与商业保险联合的ADR损害赔偿模型进行设计和评估,模型的整体得分为89.50,表明本研究建立的ADR损害赔偿模型具有可行性,对于减轻ADR损害患者的经济负担、及时解决ADR损害引发的患者健康问題、促进我国药品保险发展可能具有一定的参考价值。
在模型设计阶段,ADR损害责任险的设计重点针对中、小型药品生产企业等MAH,而非赔偿能力强的大型企业MAH。大型药品生产企业一般规模较大,一般保险体系即可解决ADR面临的风险问题,可以暂时以交纳保证金的形式应对可能出现的ADR损害赔偿问题;同时可在其增加新药研发投入或者因其他资金问题出现赔付力不足的情况下,要求其强制购买ADR损害责任险。但是,中、小型药品生产企业和药品研发机构的赔偿能力弱,在强制其购买保险的同时,还应采取配套措施以鼓励其主动购买相关保险,如通过政府的部分财政补贴投保费用、适当降低保费费率等。在问卷调研中,本研究还对药品生产企业及药品经营企业就险种设置进行了摸底问卷调查,结果显示受访者对药品综合质量责任险、药品临床试验责任险、药品召回保险、冷链运输险和错误与疏漏责任险的支持率均较高。
本研究结果显示,MAH制度施行后,我国建立ADR损害赔偿模型的影响因素有药品生产企业ADR专员对ADR相关政策的熟悉程度、医疗机构人员对ADR的认知水平、药品经营企业经营品种和医疗机构人员工作年限。ADR专员熟悉MAH制度中涉及ADR相关政策的药品生产企业、对ADR认知清楚的医疗机构人员和经营生化药品的药品经营企业更倾向于“赞同”态度,而仅有3年以下工作经验的医疗机构人员则不倾向于“赞同”态度。
问卷调查结束后,本研究还对药品生产企业ADR专员进行了访谈,发现部分生产企业对ADR的理解存在误区,认为在药品说明书中罗列详细的ADR会使消费者质疑企业的药品质量,从而影响药品的销售状况,没有意识到及时监测、上报ADR,定期修改药品说明书及标签对药品生产企业具有保护作用。另外,有88.0%的受访医疗机构工作人员可以明确区分ADR及医疗事故的区别;同时,医疗机构工作人员普遍认为大多数药品说明书“不良反应”项中的“尚不明确”加大了药品的安全风险,并且ADR损害引发的医疗纠纷主要是由于患者与医护人员之间的药品信息不对等所导致的。患者对ADR缺乏正确认知,不知道ADR是药品本身性质之一。因此,临床药师应及时更新临床用药信息,向患者及公众宣传合理用药知识。
综上所述,本研究根据专家访谈结果建立的ADR损害赔偿模型具有一定的可行性。近年来我国经济实力持续增长,医药卫生行业的改革进入深水区,公共卫生福利与健康保障体系正在逐步完善[26]。构建ADR损害赔偿机制是一项保护患者健康权益、分散企业或医疗机构风险损失的政策。在MAH制度下,建立ADR损害赔偿体系,把单个MAH的风险分散到整个药品行业中,由所有MAH、药品生产企业和整个社会共同承担,将有利于制药行业提高生产效率,实现稳步、长远的发展目标。在MAH制度及国家鼓励创新药品研发的大背景下,政府可以以“先试点后推广”的方式建立我国ADR损害赔偿体系,可初步采用强制保险与商业保险联合的赔偿模型,并针对强制性的ADR损害责任险采取前期补贴推广加后期强制执行的发展模式,在初期推广阶段由政府财政对投保企业的保费进行一定比例的补贴,并采取补贴逐年递减的模式,逐步引导MAH、委托生产企业、药品经营企业及医疗机构等形成投保意愿,扩大覆盖面,最终为保障患者健康权益、为企业减少后顾之忧提供保障 。
参考文献
[ 1 ] 卫生部.药品不良反应报告和监测管理办法[S]. 2011- 01-17.
[ 2 ] 王丹,任经天,董铎,等.药品不良反应监测年度报告十年趋势分析[J].中国药物警戒,2020,17(5):276-283.
[ 3 ] 侯珂露,黄琳,封宇飞.我国药品质量相关的药害事件的回顾性分析[J].中国医院药学杂志,2020,40(6):640- 643.
[ 4 ] 全国人民代表大会.中华人民共和国药品管理法:2019修订[S].2019-08-26.
[ 5 ] HENNINK MM,HUTTER I,BAILEY A. Qualitative research methods[M]. London:Sage Publications,2011:151-154
[ 6 ] V?LEZ M,WILSON MG,ABELSON J,et al. Understanding the role of values in health policy decision-making from the perspective of policy-makers and stakeholders:a multiple-case embedded study in Chile and Colombia[J]. IJHPM,2020,9(5):185-197.
[ 7 ] ARRIOLA-VIGO JA,STOVALL JG,MOON TD,et al. Perceptions of community involvement in the peruvian mental health reform process among clinicians and policy-makers:a qualitative study[J]. IJHPM,2019,8(12):711-722.
[ 8 ] 杜玉艷.药品不良反应损害救济制度研究[D].烟台:烟台大学,2017.
[ 9 ] CHANGWON K,JONG-SEOB W. A fuzzy analytic hierarchy process and cooperative game theory combined multiple mobile robot navigation algorithm[J]. Sensors,2020.DOI:10.3390/s20102827.
[10] GIOVANNI I,ANTONIETTA P,MARIO AR,et al. Heal- th technology assessment(HTA)of optoelectronic biosensors for oncology by analytic hierarchy process(AHP)and Likert scale[J]. BMC,2019. DOI:10.1186/s12874-019- 0775-z.
[11] 黄厚波.基于 AHP-模糊综合评价法的长沙市公交乘客满意度评价研究[D].长沙:中南林业科技大学,2014.
[12] PRABESH G,VISHNUPS. Factors associated with enrolment of households in Nepals national health insurance program[J]. IJHPM,2019,8(11):636-645.
[13] 郭记敏.我国药品不良反应损害救济模式构建的研究[D].郑州:河南中医药大学,2016.
[14] 董阳.上海市MAH制度试点探析[N].中国医药报,2019- 01-29(003).
[15] 白庚亮.江苏省药品上市许可持有人制度试点现状分析[C]//2018年中国药学会药事管理专业委员会年会暨学术研讨会论文集.济南:中国药学会药事管理专业委员会,2018:9.
[16] 陈云,任磊,颜建周,等. MAH制度下日本药品不良反应损害救济基金制度研究[J].中国药事,2017,31(12):1395-1403.
[17] 国务院.基金会管理条例[S]. 2004-03-08.
[18] 刘齐林.药剂科药品不良反应监测管理存在的问题与对策[J].中国卫生产业,2018,15(3):141-142.
[19] 商务部市场秩序司.关于《全国零售药店分类分级管理指导意见(征求意见稿)》公开征求意见的通知[Z]. 2018- 11-23.
[20] 田小权,李先兰.药品经营企业药学技术人员药品不良反应认知度调查分析[J].中国药物警戒,2007(3):151-153.
[21] 国务院办公厅.国务院办公厅关于印发药品上市许可持有人制度试点方案的通知[Z]. 2016-06-06.
[22] 国家食品药品监督管理总局.药品经营许可证管理办法:2017修正[S]. 2017-11-17.
[23] 郁敏杰.论我国药品不良反应损害赔偿制度[D].上海:上海交通大学,2012.
[24] VAN HUNSEL F,H?RMARK L,ROLFESL. Fifteen years of patient reporting:what have we learned and where are we heading to? [J]. Expert Opin Drug Saf,2019,18(6):477-484.
[25] SOMMER H,DWENGER A. Action plan of the federal ministry of health for improvement of medication safety in Germany:an inventory[J]. Bundesgesundheitsbla,2018,61(9):1062-1065.
[26] 健康中国行动推进委员会.健康中国行动:2019-2030年[EB/OL]. (2019-07-09)[2020-08-20]. http://www.gov.cn/xinwen/2019-07/15/content_5409694.html.
(收稿日期:2020-09-29 修回日期:2020-12-24)
(编辑:孙 冰)
