化风丹药母指纹图谱的建立及不同发酵时间样品中7种核苷类成分的含量测定
2021-02-21曹国琼游珊丽徐剑张永萍
曹国琼 游珊丽 徐剑 张永萍
摘 要 目的:建立化風丹药母的指纹图谱,并测定不同发酵时间样品中7种核苷类成分的含量。方法:采用高效液相色谱法(HPLC),色谱柱为Pntulips BP-C18,流动相为甲醇-水(梯度洗脱),流速为0.8 mL/min,检测波长为260 nm,柱温为35 ℃,进样量为10 μL。以黄嘌呤为参照,绘制12批化风丹药母的HPLC指纹图谱;采用《中药色谱指纹图谱相似度评价系统(2012版)》进行相似度评价,确定共有峰;同法测定不同发酵时间(0、1、2、3、4周)样品中尿嘧啶、次黄嘌呤、黄嘌呤、尿苷、肌苷、鸟苷、胸苷的含量。结果:12批化风丹药母共有8个共有峰,相似度为0.712~0.954;指认了7种成分,分别为尿嘧啶、次黄嘌呤、黄嘌呤、尿苷、肌苷、鸟苷、胸苷。不同发酵时间样品中上述7种成分检测质量浓度的线性范围分别为0.87~8.7 μg/mL(r=0.999 6)、1.51~15.1 μg/mL(r=0.999 7)、6.08~60.8 μg/mL(r=0.999 5)、1.52~15.2 μg/mL(r=0.999 6)、1.82~18.2 μg/mL(r=0.999 6)、1.48~14.8 μg/mL(r=0.999 6)、1.63~16.3 μg/mL(r=0.999 3);定量限分别为 0.027 4、0.076 3、0.250 4、0.172 3、0.101 1、0.078 3、0.084 2 μg/mL,检测限分别为0.008 7、0.025 5、0.007 9、0.084 1、0.035 7、0.026 9、0.027 5 μg/mL;精密度、重复性、稳定性(12 h)试验的RSD均小于3%;加样回收率分别为94.16%~100.16%(RSD=2.24%,n=6),93.87%~100.65%(RSD=2.67%,n=6),93.52%~99.66%(RSD=2.30%,n=6),93.67%~98.24%(RSD=1.89%,n=6),96.00%~102.18%(RSD=1.96%,n=6),94.62%~101.54%(RSD=2.82%,n=6),97.72%~104.56%(RSD=2.97%,n=6)。发酵0~4周时,上述7种成分及总核苷的含量分别为0.042~0.232、0.027~0.181、0.039~0.651、0.026~0.225、0.034~0.111、0.009~0.124、0.079~0.099 、0.647~1.292 mg/g;发酵1~4周时的尿嘧啶、次黄嘌呤、黄嘌呤及总核苷的含量均较发酵0周时显著升高,而尿苷、肌苷、鸟苷的含量较发酵0周时显著降低。结论:所建指纹图谱特征性强且操作简便,可用于化风丹药母的质量控制;含量测定方法准确、可靠,可用于同时测定其中7种核苷类有效成分的含量;化风丹药母中的核苷类成分含量受发酵时间的影响。
关键词 化风丹药母;高效液相色谱法;指纹图谱;核苷类成分;含量测定
ABSTRACT OBJECTIVE: To establish fingerprint of Huafengdan yaomu, and to determine the contents of 7 nucleosides in samples of different fermentation time. METHODS: HPLC method was adopted. The determination was performed on Pntulips BP-C18 column with mobile phase consisted of methanol-water (gradient elution) at the flow rate of 0.8 mL/min. The detection wavelength was set at 260 nm, and column temperature was 35 ℃. The sample size was 10 μL. Using xanthine as reference, HPLC fingerprint of 12 batches of Huafengdan yaomu was drawn. The similarity of samples were evaluated with Similarity Evaluation System of TCM Chromatographic Fingerprints (2012 edition). Common peaks were confirmed. The contents of uracil, hypoxanthine, xanthine, uridine, inosine, guanosine and thymidine were determined in samples of different fermentation time (0, 1, 2, 3, 4 weeks) by the same method. RESULTS: There were 8 common peaks in 12 batches of Huafengdan yaomu, with similarities ranging from 0.712 to 0.954; 7 components were identified, namely uracil, hypoxanthine, xanthine, uridine, inosine, guanosine and thymidine. The linear ranges of mass concentrations of above 7 components in samples at different fermentation time were 0.87-8.7 μg/mL (r=0.999 6), 1.51-15.1 μg/mL(r=0.999 7), 6.08-60.8 μg/mL(r=0.999 5), 1.52-15.2 μg/mL(r=0.999 6), 1.82-18.2 μg/mL(r=0.999 6), 1.48-14.8 μg/mL(r=0.999 6), 1.63-16.3 μg/mL(r=0.999 3). The limits of quantification were 0.027 4, 0.076 3, 0.250 4, 0.172 3, 0.101 1, 0.078 3, and 0.084 2 μg/mL, and the detection limits were 0.008 7, 0.025 5, 0.007 9, 0.084 1, 0.035 7, 0.026 9, 0.027 5 μg/mL, respectively. RSDs of precision, repeatability and stability tests (12 h) were all less than 3%. The sample recovery rates were 94.16%-100.16% (RSD=2.24%, n=6), 93.87%-100.65% (RSD=2.67%, n=6), 93.52%-99.66% (RSD=2.30%, n=6), 93.67%-98.24% (RSD=1.89%, n=6), 96.00%-102.18% (RSD=1.96%, n=6), 94.62%-101.54% (RSD=2.82%, n=6), 97.72%-104.56% (RSD=2.97%, n=6). After fermentation for 0-4 weeks, the contents of the above 7 components and total nucleosides were 0.042-0.232, 0.027-0.181, 0.039-0.651, 0.026-0.225, 0.034-0.111, 0.009-0.124, 0.079-0.099, 0.647-1.292 mg/g, respectively. After fermentation for 1-4 weeks, the contents of uracil, hypoxanthine, xanthine and total nucleosides were significantly increased, compared with 0 week of fermentation; the contents of uridine, inosine and guanosine were significantly lower than those in 0 weeks. CONCLUSIONS: The established fingerprint has strong characteristics and simple to operate, which can be used for the quality control of Huafengdan yaomu; the content determination method is accurate and reliable, and can be used to simultaneously determine the contents of 7 active nucleosides; the content of nucleosides in Huafengdan muyao is affected by fermentation time.
KEYWORDS Huafengdan yaomu; HPLC; Fingerprint; Nucleosides; Content determination
中图分类号 R283.1;R917 文献标志码 A 文章编号 1001-0408(2021)02-0158-06
DOI 10.6039/j.issn.1001-0408.2021.02.06
化风丹是贵州省传统名药,具有息风镇痉、豁痰开窍的功效,临床用于治疗风痰闭阻、中风偏瘫、癫痫等症,疗效显著[1-2]。化风丹的制备分为药母制备和成药制备。其中,药母是将川乌、半夏、天南星、白附子、郁金等药材粉碎,再加入六神曲和牛胆汁混匀,于自然条件下发酵,经阴干后即得[3-5]。含有毒性成分的中药是中药重要组成部分,在中药复方制剂中的应用十分广泛,在临床实践中发挥了重要治疗作用[6]。化风丹药母中含有川乌、半夏、天南星等多种含毒性成分的中药,有研究认为,发酵可以减弱药物毒副作用,增强疗效,改变药物的原有性能,有利于成分溶出并产生新的活性成分和治疗作用[7]。而化风丹药母采用发酵法进行炮制,目的就在于减少副作用、增强疗效。
目前,关于化风丹药母质量检测仅有药母中毒性生物碱乌头碱、新乌头碱、次乌头碱、苯甲酰乌头碱、苯甲酰新乌头碱、苯甲酰次乌头碱的报道[8],暂无有关其药母中有效成分含量的研究,且关于化风丹药母质量控制及发酵前后主要化学成分或指标性成分的变化也未见相关文献报道。因此,建立综合评价化风丹药母质量的方法尤为重要。化风丹药母中的天南星、半夏、白附子为天南星科植物,化学成分相似,都含有生物碱、核苷、挥发油、氨基酸、有机酸等成分[9-11]。其中,核苷类如肌苷、尿苷、鸟苷、黄嘌呤、尿嘧啶、次黄嘌呤、胸苷等成分具有广泛的药理活性,如调节免疫、调节脑细胞代谢、镇静中枢神经、抗血小板聚集等[12-15]。有文献报道,半夏、天南星和白附子均含有肌苷、尿苷、鸟苷、黄嘌呤等成分[16],因此核苷类成分可以作为化风丹药母的指标性成分。
指纹图谱及多成分检测能提供丰富的指标成分或药效成分信息,可全面反映药品的质量,近年来已被广泛应用于中药材和中成药的质量控制领域[17-18]。为此,本研究建立了化风丹药母的高效液相色谱(HPLC)指纹图谱,同时采用HPLC法测定不同发酵时间样品中尿嘧啶、次黄嘌呤、黄嘌呤、尿苷、肌苷、鸟苷、胸苷等7种核苷类成分的含量,旨在为化风丹药母的整体质量评价和质量控制提供参考。
1 材料
1.1 仪器
本研究所用的仪器有:LC-20AT型HPLC仪(包括LC-20AT型二元泵、SPD-20A型紫外-可见光检测器,日本Shimadzu公司)、METTLER AE240型萬分之一电子分析天平(瑞士Mettler Toledo公司)、KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司)、SHZ-D(Ⅲ)型循环水真空泵[邦西仪器科技(上海)有限公司]、HSX-250型恒温恒湿培养箱(上海海向仪器设备厂)。
1.2 药品与试剂
尿嘧啶对照品(批号100469-201302,纯度99.6%)、次黄嘌呤对照品(批号140661-201704,纯度100%)、黄嘌呤对照品(批号140662- 201606,纯度100%)、尿苷对照品(批号110887-201802,纯度99.5%)、肌苷对照品(批号140669-201606,纯度98.6%)、鸟苷对照品(批号111977- 201501,纯度93.6%)、胸苷对照品(批号101215-201401,纯度100%)均购自中国食品药品检定研究院;药材样品天南星、半夏、白附子、川乌、郁金(批号分别为20190506、20190412、 20190215、20190116、20190309)和六神曲(批号190207)均购自亳州康美中药城,5种药材经贵州中医药大学中药民族药资源研究院肖承鸿高级实验师鉴定分别为天南星科植物天南星Arisaema erubescens (Wall.) Schott的干燥块茎,天南星科植物半夏Pinellia ternata (Thunb.) Breit.的干燥块茎,天南星科植物独角莲Typhonium giganteum Engl.的干燥块茎,毛茛科植物乌头Aconitum carmichaelii Debx.的干燥母根,姜科植物温郁金Curcuma zvenyujin Y. H. Chenet C. Ling的干燥块根;牛胆汁收集自屠宰场(按前期研究筛选pH值为6.27~7.29);甲醇为色谱纯,其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 化风丹药母的制备
按化风丹药母处方比例(生川乌 ∶ 白附子 ∶ 生半夏 ∶ 生南星 ∶ 郁金 ∶ 六神曲=1 ∶ 1 ∶ 1 ∶ 1 ∶ 0.5 ∶ 0.005,g/g,下同)称取川乌、白附子、半夏、天南星、郁金和六神曲,置于研钵中混匀,加入与上述药材总质量相等的牛胆汁搅拌均匀,置于密闭容器内,于35 ℃、湿度60%的恒温恒湿培养箱中发酵4周,取出,干燥,即得化风丹药母。
2.2 化风丹药母发酵样品的制备
按化风丹药母处方比例称取川乌、白附子、半夏、天南星、郁金和六神曲,共12份,按“2.1”项下方法制备发酵1周样品(编号S1~S12),用于指纹图谱的建立及含量测定的方法学考察(前期预试验发现,无论发酵几周,所得样品均可用于指纹图谱的建立及含量测定的方法学考察,故本研究选择发酵时间最短的样品)。另按化风丹药母处方比例称取川乌、白附子、半夏、天南星、郁金和六神曲,共15份,按“2.1”项下方法分别于发酵0、1、2、3、4周时取出,每周平行取出3份,置于- 80 ℃冰箱中保存,用于不同发酵时间样品的含量测定。
2.3 指纹图谱的建立
2.3.1 色谱条件 以Pntulips BP-C18(250 mm×4.6 mm,5 μm)为色谱柱;以甲醇(A)-水(B)为流动相,梯度洗脱(0~24 min,100%B;24~48 min,100%B→80%B;48~55 min,80%B→100%B);流速为0.8 mL/min,检测波长为260 nm,柱温为35 ℃,进样量为10 μL。
2.3.2 供试品溶液的制备 精密称取“2.2”项下化风丹药母发酵1周样品(编号S3),约3 g,精密称定,置于具塞锥形瓶中,加入水20 mL,精密称定,超声(功率100 W,頻率53 kHz)处理30 min,放冷,再次称定质量,用水补足减失的质量,以20 000 r/min离心10 min,取上清液,经0.45 μm微孔滤膜滤过,取续滤液,即得。
2.3.3 混合对照品溶液的制备 精密称定尿嘧啶、次黄嘌呤、黄嘌呤、尿苷、肌苷、鸟苷、胸苷对照品适量,加水制成上述成分质量浓度分别为0.174、0.151、0.152、0.152、0.182、0.148、0.163 mg/mL的单一对照品贮备液。分别精密吸取上述单一对照品贮备液0.5、1、4、1、1、1、1 mL,置于10 mL量瓶中,用水定容,混匀,制得尿嘧啶、次黄嘌呤、黄嘌呤、尿苷、肌苷、鸟苷、胸苷质量浓度分别为0.008 7、0.015 1、0.060 8、0.015 2、0.018 2、0.014 8、0.016 3 mg/mL的混合对照品溶液。
2.3.4 精密度试验 取“2.3.2”项下供试品溶液(编号S3)适量,按“2.3.1”项下色谱条件连续进样测定6次,以4号峰为参照,记录各共有峰的相对保留时间和相对峰面积。结果,8个共有峰相对峰面积的RSD为1.65%~2.24%(n=6),相对保留时间的RSD为0.42%~1.73%(n=6),表明方法精密度良好。
2.3.5 稳定性试验 取“2.3.2”项下供试品溶液(编号S3)适量,分别于室温下放置0、1、2、4、6、8、12 h时按“2.3.1”项下色谱条件进样测定,以4号峰为参照,记录各共有峰的相对保留时间和相对峰面积。结果,8个共有峰相对峰面积的RSD为1.09%~2.85%(n=7)、相对保留时间的RSD为0.49%~1.67%(n=7),表明供试品溶液于室温下放置12 h内稳定性良好。
2.3.6 重复性试验 取“2.2”项下化风丹药母发酵1周样品(编号S3),约3 g,共6份,按“2.3.2”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,以4号峰为参照,记录各共有峰的相对保留时间和相对峰面积。结果,8个共有峰相对峰面积的RSD为1.37%~2.65%(n=6),相对保留时间的RSD为0.53%~1.64%(n=6),表明方法重复性良好。
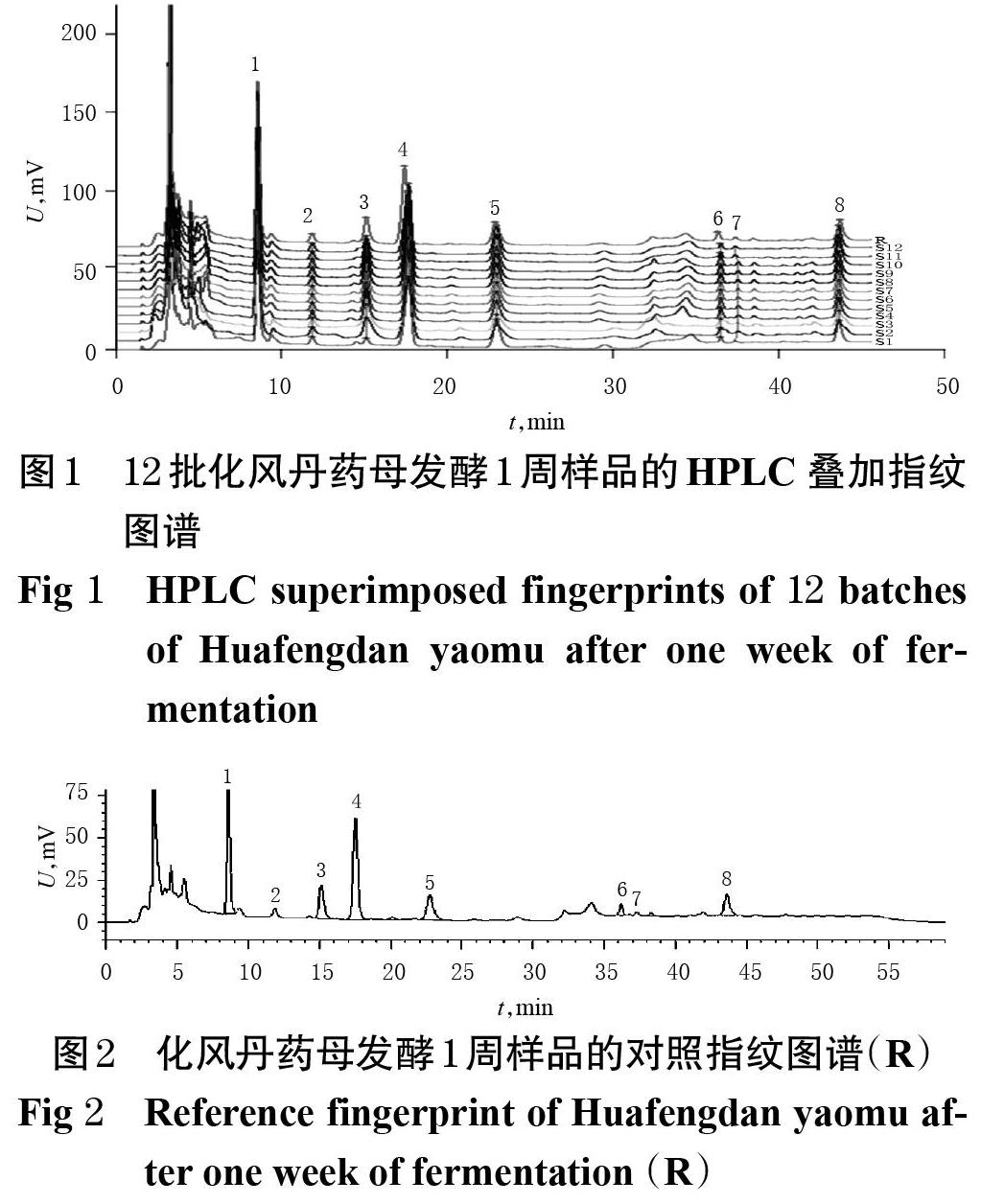
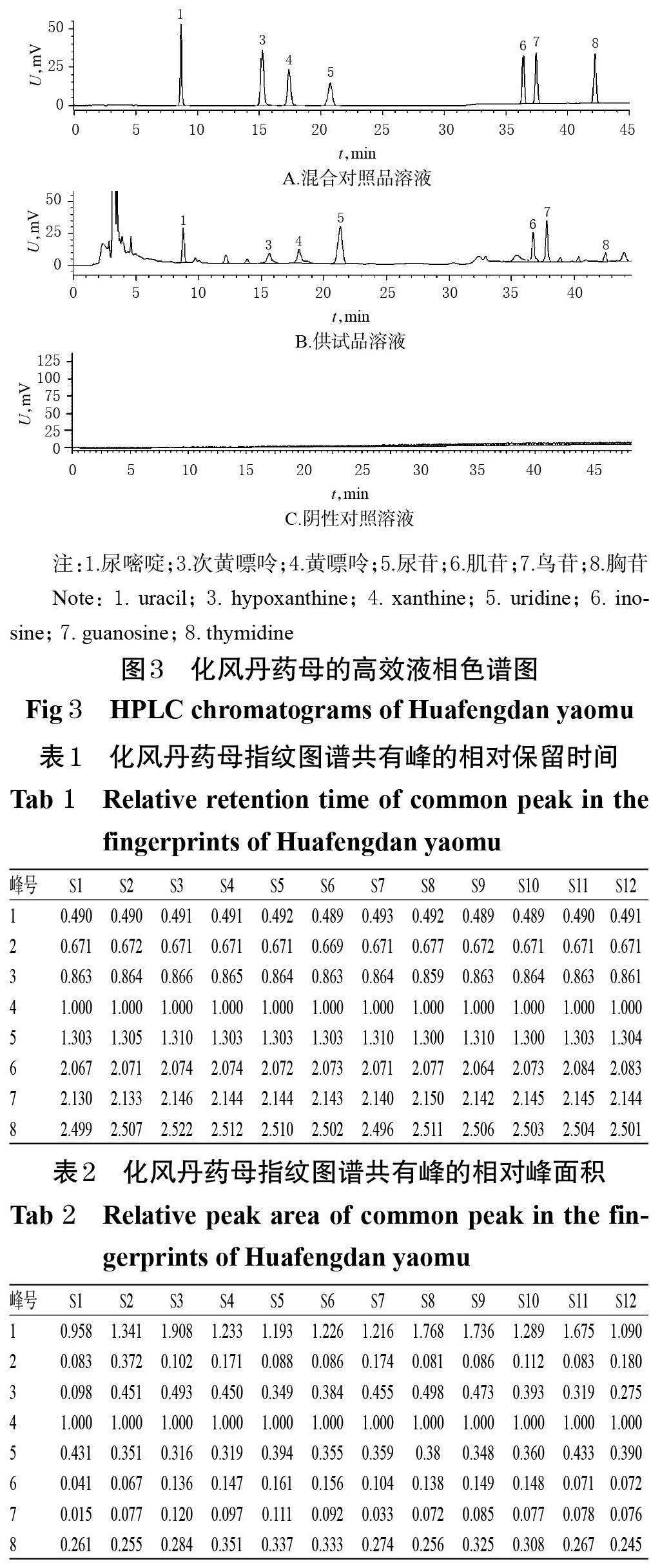
2.3.7 HPLC指纹图谱的建立 取12批“2.2”项下化风丹药母发酵1周样品(编号S1~S12)适量,按“2.3.2”项下方法制备供试品溶液,再按“2.3.1”项下色谱条件进样测定,采用《中药色谱指纹图谱相似度评价系统(2012 版)》,以S1样品(随机选取)色谱图作为参照色谱,对照指纹图谱采用中位数法,设定时间窗为 0~47 min,时间宽度为 0.3 min,经多点校正后自动匹配,采用平均值法生成HPLC 叠加指纹图谱和对照指纹图谱,详见图1、图2。
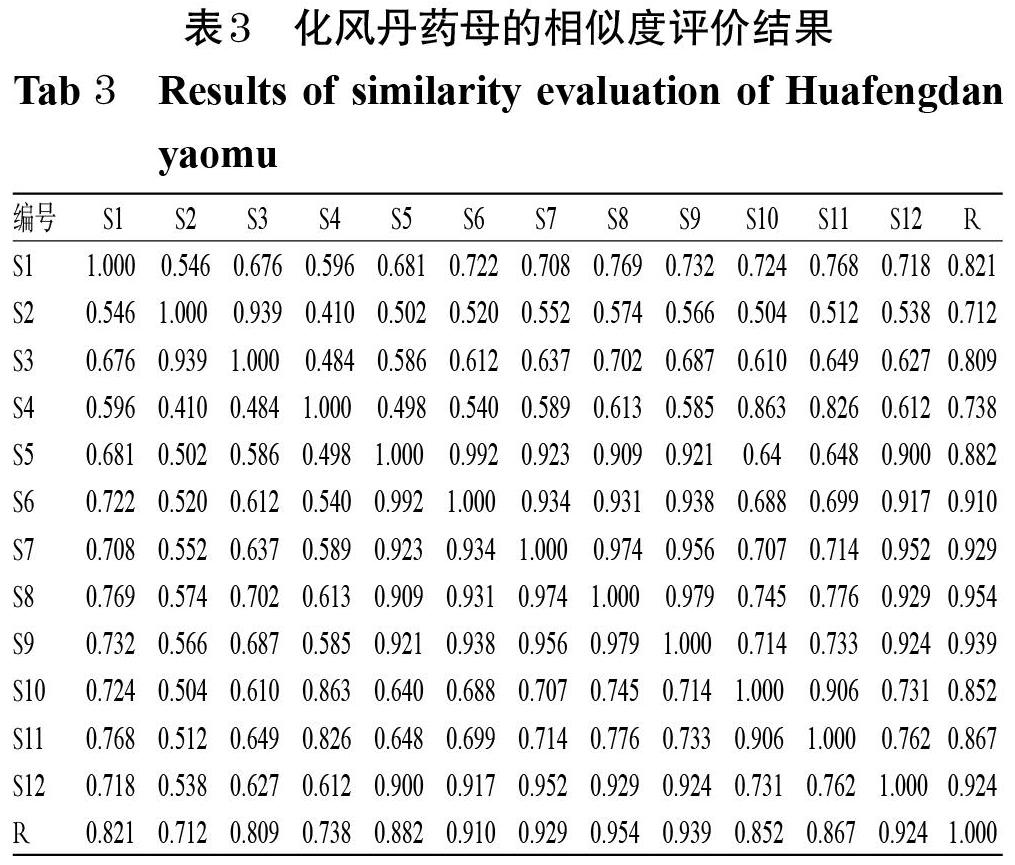
2.3.8 共有峰的指认 12批化风丹药母发酵1周样品共有8个共有峰,通过与混合对照品溶液(图3 A)色谱峰比对,共指认7个色谱峰,分别为尿嘧啶(1号峰)、次黄嘌呤(3号峰)、黄嘌呤(4号峰)、尿苷(5号峰)、肌苷(6号峰)、鸟苷(7号峰)、胸苷(8号峰)。其中,4号峰黄嘌呤色谱峰保留时间适中,与其余色谱峰分离良好,故以其为参照峰(S),计算各共有峰的相对保留时间和相对峰面积,结果见表1、表2。
2.3.9 相似度评价 采用《中药色谱指纹图谱相似度评价系统(2012版)》,以S1为对照,对12批化风丹药母发酵1周样品进行整体相似度评价。结果,12批化风丹药母指纹图谱与对照指纹图谱的相似度为0.712~0.954,详见表3。
2.4 7种核苷类成分的含量测定
2.4.1 色谱条件 同“2.3.1”项下色谱条件。
2.4.2 溶液的制备 供试品溶液制备同“2.3.2”项下,混合对照品溶液制备同“2.3.3”项下方法,以水为阴性对照溶液。
2.4.3 系统适用性试验 取上述混合对照品溶液、供试品溶液、阴性对照溶液各适量,按“2.4.1”项下色谱条件进样测定,记录色谱图。结果,各待测成分色谱峰与相邻色谱峰的分离度均大于1.5,理论板数均不低于10 000,详见图3。
2.4.4 线性关系考察 取“2.4.2”项下混合对照品溶液1、2、4、6、8、10 mL,分别置于10 mL量瓶中,加水定容,混匀,得系列线性工作溶液;精密吸取上述系列线性工作溶液,按“2.4.1”项下色谱条件进样测定,记录色谱图,以待测成分质量浓度(X,μg/mL)为横坐标、峰面积(Y)为纵坐标进行线性回归,结果见表4。
2.4.5 定量限与检测限考察 取“2.4.2”项下混合对照品溶液适量,用水逐级稀释,按“2.4.1”项下色谱条件进样测定,分别以信噪比10 ∶ 1、3 ∶ 1计算定量限、检测限。结果,尿嘧啶、次黄嘌呤、黄嘌呤、尿苷、肌苷、鸟苷、胸苷的定量限分别为0.027 4、0.076 3、0.250 4、0.172 3、0.101 1、0.078 3、0.084 2 μg/mL,检测限分别为0.008 7、0.025 5、0.007 9、0.084 1、0.035 7、0.026 9、0.027 5 μg/mL。
2.4.6 精密度试验 取“2.4.2”项下混合对照品溶液,按“2.4.1”项下色谱条件连续进样测定6次,记录峰面积。结果,尿嘧啶、次黄嘌呤、黄嘌呤、尿苷、肌苷、鸟苷、胸苷峰面积的RSD分别为1.57%、0.92%、2.20%、1.16%、1.15%、1.39%、1.42%(n=6),表明仪器精密度良好。
2.4.7 重复性试验 取化风丹药母发酵1周样品(编号S3),约3 g,共6份,按“2.4.2”项下方法制备供试品溶液,再按“2.4.1”项下色谱条件进样测定,记录峰面积并按外标法计算样品含量。结果,尿嘧啶、次黄嘌呤、黄嘌呤、尿苷、肌苷、鸟苷、胸苷的含量分别为0.169、0.081、0.324、0.161、0.037、0.009、0.098 mg/g,RSD分别为1.25%、1.97%、1.18%、2.03%、2.94%、2.77%、2.02%(n=6),表明方法重复性良好。
2.4.8 稳定性试验 取“2.4.2”项下供试品溶液(编号S3),分别于室温下放置0、1、2、4、6、8、12 h时按“2.4.1”项下色谱条件进样测定,记录峰面积。结果,尿嘧啶、次黄嘌呤、黄嘌呤、尿苷、肌苷、鸟苷、胸苷峰面积的RSD分别为2.00%、2.13%、2.46%、1.58%、2.43%、1.27%、2.78%(n=7),表明供试品溶液于室温放置12 h内稳定性良好。
2.4.9 加样回收率试验 取已知含量的化风丹药母发酵1周样品(编号S3),约1.5 g,共6份,精密称定,分别精密加入各单一对照品溶液(精密称定尿嘧啶、次黄嘌呤、黄嘌呤、尿苷、肌苷、鸟苷、胸苷对照品各12.85、6.20、12.35、12.25、13.75、3.25、7.45 mg,加水制成上述成分质量浓度分别为0.257、0.124、0.494、0.245、0.055、0.013、0.149 mg/mL的单一对照品溶液)1 mL,按“2.4.2”项下方法制备供试品溶液,再按“2.4.1”项下色谱条件进样测定,记录峰面积并计算加样回收率,结果见表5。
2.4.10 样品含量测定 精密称取“2.2”项下不同发酵时间的化风丹药母样品,约3 g,按“2.4.2”项下方法制备供试品溶液,再按“2.4.1”项下色谱条件进样测定,记录峰面积并按外标法计算样品含量,结果见表6。
由表6可知,发酵0周(未发酵)时,化风丹药母中尿嘧啶、次黄嘌呤、黄嘌呤及总核苷的平均含量分别为0.042、0.027、0.039、0.647 mg/g;发酵不同时间(1~4周)后,上述3种成分及总核苷的平均含量均明显高于发酵0周时,平均含量分别为0.160~0.232、0.070~0.181、0.298~0.651、0.845~1.292 mg/g。发酵0周时,化风丹药母中尿苷、肌苷、鸟苷的平均含量分别为0.225、0.111、0.124 mg/g;发酵不同时间(1~4周)后,上述3种成分的平均含量均明显低于发酵0周时,平均含量分别为0.026~0.162、0.034~0.071、0.009~0.032 mg/g。发酵0周时,胸苷的平均含量为0.079 mg/g;发酵不同时间(1~4周)后,其含量稍有增加,为0.084~0.099 mg/g。
3 讨论
中药复方制剂化学成分复杂,选择梯度洗脱能有利于不同极性成分的分离[19]。本研究参考相关文献方法[20],选择甲醇-水为流动相,对不同流动相梯度洗脱程序[(0~6 min,100%B;6~60 min,100%B→80%B)、(0~30 min,100%B;30~60 min,100%B→80%B)、(0~24 min,100%B;24~48 min,100%B→80%B;48~55 min,80%B→100%B)]、柱温(25、30、35 ℃)、流速(8.0、1.0 mL/min)等进行比较。结果发现,采用本研究“2.3.1”项下色谱条件时各色谱峰分离良好,能达到指纹图谱及定量分析的要求。
指纹图谱技术能全面反映中药的内在化学特征,具有整體性和模糊性特点,已成为控制中药质量的最有效手段[21]。本研究首先建立了化风丹药母的HPLC指纹图谱,结果显示共有8个共有峰,并指认了其中7个共有峰,分别为尿嘧啶、次黄嘌呤、黄嘌呤、尿苷、肌苷、鸟苷和胸苷。
中药发酵是指药物在一定的温度和湿度条件下,借助微生物和酶的催化分解作用,使药材发泡,并生成黄白色霉衣,从而改变药材原有药性,以更好地满足临床用药的需要[22]。本研究结果显示,不同发酵时间化风丹药母中核苷类成分含量存在显著差异,其中不同发酵时间(1~4周)样品中尿嘧啶、次黄嘌呤、黄嘌呤及总核苷含量与发酵0周时比较均显著增加,其原因可能为未发酵的化风丹药母中存在其他大分子核苷(酸)类成分等,这些成分在发酵条件下进行降解,产生小分子的核苷类成分,从而导致部分核苷及总核苷成分含量显著增加,提示化风丹药母发酵具有增加有效成分的作用。而尿苷、肌苷、鸟苷的含量与发酵0周时比较均显著降低,其原因可能为发酵过程中微生物对这几种成分进行分解或转化,也可能为发酵时加入的牛胆汁呈弱酸性,核苷呈碱性,发酵过程中发生了化学反应。
综上所述,所建指纹图谱特征性强且操作简便,可用于化风丹药母的质量控制;含量测定方法准确、可靠,可用于同时测定其中7种核苷类有效成分的含量;化风丹药母中的核苷类成分含量受发酵时间的影响。
参考文献
[ 1 ] 向文英,杨武,梅朝叶,等.化风丹血清药物化学的初步研究[J].中国药房,2016,27(28):3911-3914.
[ 2 ] 徐文峰,李怡,金鹏飞,等.化风丹的研究进展[J].中南药学,2017,15(8):1100-1105.
[ 3 ] 曹国琼,张永萍,徐剑,等.高效液相色谱法测定化风丹药母中3种双酯型生物碱含量[J].贵州农业科学,2014,42(11):58-61.
[ 4 ] 曹国琼,张永萍,徐剑,等.神曲与酶对化风丹药母发酵过程中毒性成分的影响[J].中国实验方剂学杂志,2015,21(4):1-4.
[ 5 ] 曹国琼,张永萍,徐剑,等.牛胆汁对化风丹药母发酵减毒的影响[J].中成药,2019,41(4):868-873.
[ 6 ] 严妍,吴娟,焦月华,等.毒性中药复方临床安全性再评价的思考[J].中国新药杂志,2017,26(15):1762-1766.
[ 7 ] 孟彬,孙敬锋,吕爱军.发酵中草药在水产养殖中的应用[J].水产科学,2018,37(3):421-426.
[ 8 ] 马奋刚,张永萍,曹国琼,等. HPLC法测定化风丹药母在发酵过程中6个酯型生物碱的含量[J].药物分析杂志,2020,40(3):413-419.
[ 9 ] 翟兴英,张凌,李冰涛,等.采用UPLC-Q-TOF-MS/MS分析半夏药材中的化学成分[J].中国实验方剂学杂志,2019,25(7):173-183.
[10] 何达海,丁克毅,王晓玲.天南星属植物化学成分研究进展[J].西南民族大学学报(自然科学版),2014,40(6):861-865.
[11] 顾晓玲,金阳,张丽颖,等.白附子正丁醇部位化学成分研究[J].现代中药研究与实践,2017,31(4):30-32.
[12] 王锐.嘧啶核苷的研究进展[J].生物技术通讯,2007,18(3):539-542.
[13] SCHNEIDER B,SARFATI R,DEVILLE-BONNE D, et al. Role of nucleoside diphosphate kinase in the activation of anti-HIV nucleoside analogs[J]. J Bioenerg Biomembr,2000,32(3):317-324.
[14] SUN Q,LI X,GONG S,et al. A novel synthesis of antiviral nucleoside phosphoramidate and thiophosphoramidate prodrugs via nucleoside H-phosphonamidates[J]. Nucleosides Nucleotides Nucleic Acids,2013,32(11):617-638.
[15] LEE J,CHUANG TH,REDECKE V,et al. Molecular basis for the immunostimulatory activity of guanine nucleoside analogs:activation of Toll-like receptor 7[J]. Proc Natl Acad Sci U S A,2003,100(11):6646-6651.
[16] 黄鲛,易进海,刘玉红,等.天南星、半夏、白附子中8种核苷成分的含量测定[J].中国实验方剂学杂志,2013,19(16):59-62.
[17] 尚莹莹,胡辉,刘源才.金樱子配方颗粒提取工艺优化及质量标准、指纹图谱研究[J].中国药房,2018,29(14):1922-1927.
[18] 牛晓静,鲁静,孙广科,等.淫羊藿总黄酮提取物的HPLC指纹图谱建立及其中8种成分的含量测定[J].中国药房,2018,29(24):3376-3380.
[19] 王芳.高效液相色谱在中药研究中的应用进展[J].基层中药杂志,2002,16(3):44-46.
[20] 王朋展,相美容,李燦,等. HPLC法同时测定不同来源半夏及其伪品中9种核苷类成分的含量[J].药物分析杂志,2017,37(2):212-218.
[21] 徐妍,杨华蕊,杨永寿,等.中药指纹图谱研究现状及展望[J].世界最新医学信息文摘,2018,18(76):91-94.
[22] 胥敏,吴纯洁,严丹,等.中药发酵技术传承与创新的探索[J].中国实验方剂学杂志,2015,21(23):230-234.
(收稿日期:2020-07-19 修回日期:2020-10-26)
(编辑:陈 宏)
