安肠汤对TNBS致溃疡性结肠炎模型大鼠TLR4/NF-κB信号通路及粪钙卫蛋白表达的影响
2021-02-21梁运特黄仲海廖志远张琴汤勇孙平良
梁运特 黄仲海 廖志远 张琴 汤勇 孙平良


摘 要 目的:研究安腸汤对2,4,6-三硝基苯磺酸(TNBS)致溃疡性结肠炎(UC)模型大鼠Toll样受体4(TLR4)/核因子κB(NF-κB)信号通路及粪钙卫蛋白(FC)表达的影响。方法:将SD大鼠随机分为空白组、模型组、阳性对照组[双歧杆菌活菌胶囊,5 mL(含双歧杆菌活菌0.35 g)]和安肠汤低、中、高剂量组(1、5、10 mL,每mL约相当于生药总量0.11 g),每组15只。除空白组大鼠注入生理盐水外,其余各组大鼠均采用TNBS结合乙醇复合灌肠法建立UC模型。造模成功2 d后,空白组、模型组大鼠灌胃生理盐水5 mL,各药物组大鼠灌胃相应药物,每日1次,连续给药14 d。末次给药后,采用苏木精-尹红染色法观察大鼠结肠组织的病理改变;采用Western blotting法检测大鼠结肠组织中TLR4、TNF受体关联因子6(TRAF6)、NF-κB蛋白的表达水平;采用实时荧光定量聚合酶链式反应法检测TLR4、TRAF6、TNF-α、NF-κB mRNA的表达水平;采用酶联免疫吸附测定法检测大鼠血清TNF-α、IL-6以及粪便样品中FC的水平。结果:与空白组比较,模型组大鼠的结肠黏膜严重受损,其结肠组织中TLR4、TRAF6、NF-κB蛋白和TLR4、TRAF6、TNF-α、NF-κb mRNA的表达水平以及血清TNF-α、IL-6及粪便样品中FC水平均显著升高(P<0.05);与模型组比较,各药物组大鼠结肠组织病变均有不同程度的改善,且上述指标水平均显著降低(P<0.05)。结论:安肠汤可能通过调节TLR4/NF-κB信号通路及FC水平来减轻UC模型大鼠的炎症反应。
关键词 溃疡性结肠炎;安肠汤;Toll样受体4;TNF受体关联因子6;核因子κB;粪钙卫蛋白
中图分类号 R285.5 文献标志码 A 文章编号 1001-0408(2021)02-0189-06
DOI 10.6039/j.issn.1001-0408.2021.02.11
ABSTRACT OBJECTIVE: To study the effects of Anchang decoction on TLR4/NF-κB signaling pathway and the expression of fecal calprotectin (FC) in TNBS-induced ulcerative colitis (UC) model rats. METHODS: SD rats were randomly divided into blank group, model group, positive control group [Live Bifidobacterium capsules,5 mL (containing Bifidobacterium 0.35 g)], Anchang decoction low-dose, medium-dose and high-dose groups (1,5,10 mL, each milliliter is approximately equivalent to 0.11 g of total crude drug), with 15 rats in each group. Other groups were given TNBS combined with ethanol enema to establish UC model rat, except blank group was given normal saline. Two days after successful modeling, blank group and model group were given normal saline 5 mL, administration groups were given relevant medicine intragastrically, once a day, for consecutive 14 d. After last medication, HE staining was used to observe the pathological change of colon tissue in rats. Western blotting assay was used to detect the protein expression of TLR4, TRAF6 and NF-κB in colon tissues of rats; Real-time fluorescent quantitative PCR was used to detect mRNA expression of TLR4, TRAF6, TNF-α and NF-κB; ELISA assay was adopted to detect serum level of TNF-α, IL-6 and FC in stool samples. RESULTS: Compared with blank group, the colonic mucosa of model group was severely damaged, and the protein expression of TLR4, TRAF6 and NF-κB, mRNA expression of TLR4, TRAF6, TNF-α and NF-κb as well as serum levels of TNF-α, IL-6 and FC level in stool samples were increased significantly (P<0.05). Compared with model group, the pathological changes of colon tissue in rats were improved in different administration groups to different extents, and above indexes were all decreased significantly (P<0.05). CONCLUSIONS: Anchang decoction may relieve the inflammation of UC model rats by regulating the TLR4/NF-κB signaling pathway and the expression of FC.
KEYWORDS Ulcerative colitis; Anchang decoction; TLR4; TRAF6; NF-κB; Fecal calprotectin
溃疡性结肠炎(Ulcerative colitis,UC)以反复腹泻、排脓血便、身体消瘦、发热等炎症症状为主要临床表现,其病情反复、难以治愈,逐渐成为近年来研究的热点[1]。Toll样受体4(TLR4)/核因子κB(NF-κB)信号通路被认为是促进炎症因子释放的重要途径,当该通路被激活时,促炎因子[如肿瘤坏死因子α(TNF-α)和白细胞介素1(IL-1)等]得以表达,并参与机体炎症反应、免疫应答等过程[2-3]。李姿慧等[4]研究证实,参苓白术散能够抑制UC模型大鼠NF-κB相关蛋白的表达,下调血清TNF-α、IL-6及IL-1β的表达水平,从而对大鼠的结肠黏膜起到保护作用,说明NF-κB信号通路与UC的炎症反应密切相关。
安肠汤是广西中医药大学肖振球教授治疗UC的经验方。肖教授认为,UC属中医“痢疾”范畴,该病易反复发作,迁延日久,致脾肾阳虚为主,湿毒瘀邪停滞胃肠为标,强调正虚邪恋为根本,因此创立安肠汤扶正祛邪[5]。本课题组前期研究发现,安肠汤能显著改善UC模型大鼠的疾病状态,减弱其巨噬细胞吞噬能力,改善大鼠肠道微生态,降低血清内毒素;同时还发现,粪钙卫蛋白(FC)在UC模型大鼠急性炎症期表达量上升,可用于评价肠道的炎症反应情况[6]。那么其作用的机制是否与TLR4/NF-κB信号通路相关,目前尚无相关报道。为此,本研究以UC模型大鼠为研究对象,拟通过探究安肠汤干预对模型大鼠结肠组织中TLR4、TNF受体关联因子6(TRAF6)、TNF-α、NF-κB mRNA以及相关蛋白表达水平的影响,阐明该方通过调控TLR4/NF-κB信号通路及FC水平以达到防治UC的药效作用机制,为其临床应用提供依据。
1 材料
1.1 仪器
本文所用的仪器有:T18型组织匀浆机(德国IKA公司)、TU-100C型恒温金属浴锅(上海一恒科学仪器有限公司)、单道移液器和5418R型低温离心机(德国Eppendorf公司)、一次性使用真空采血管(江西精致科技有限公司)、配套蛋白转印模块(湿转)及PowerPac Basic型电泳仪(美国Bio-Rad公司)、TD4型普通离心机(上海卢湘仪离心机仪器有限公司)、DW-86L728J型医用低温保存箱(青岛海尔特种电器有限公司)、FC-1100型超微量核酸检测仪(青岛爱普科生物工程有限公司)、G8830-64001型实时荧光定量聚合酶链式反应(PCR)仪(美国Agilent公司)、50I型生物显微镜(日本Nikon公司)、Tanon-5200型凝胶成像仪(上海天能科技有限公司)、HED-SY96S型酶标仪(山东霍尔德电子科技有限公司)。
1.2 药品与试剂
安肠汤方药的组成为补骨脂25 g、黄芪20 g、党参15 g、白头翁15 g、茯苓15 g、槟榔15 g、熟附子15 g、地榆15 g、赤芍15 g、鸡内金10 g、薏苡仁10 g、干姜10 g、白术10 g、木香10 g、延胡索10 g、甘草10 g,用2 000 mL水煎,分2次口服,每日1剂。安肠汤原药材依据 2015 年版《中国药典》(一部)[7]进行炮制,并由广西中医药大学附属第一医院药剂科加工制备(原药材全部购自广东康美药业股份有限公司,经广西中医药大学附属第一医院药学部陈超副主任药师鉴定为真品)。双歧杆菌活菌胶囊[阳性对照药,国药准字S10960040,批号C13201000927,规格0.35 g(含0.5亿活菌)]购自丽珠集团丽珠制药厂。本实验用药处方及用量全部經过广西中医药大学附属第一医院药学部审核。
水合氯醛溶液(批号2013101801)、甲醛(批号20130817)均购自成都市科龙化工试剂厂;Takara反转录试剂(批号AI80462A)购自宝日医生物技术(北京)有限公司;Triquick Reagent总RNA提取试剂(批号20200212)、高效RIPA组织/细胞裂解液(批号69067530)、蛋白酶抑制剂混合液(100×PIC)(批号P6730)、脱脂奶粉(批号EZ5619C137)、三羟甲基氨基甲烷盐酸盐缓冲液(TBST,批号70015639)、BCA蛋白浓度测定试剂盒(批号PC0020)均购自北京索莱宝科技有限公司;5%2,4,6-三硝基苯磺酸溶液(TNBS,批号2508-19-2)购自南宁市托普邦生物科技有限公司;Trans Script?-Uni一步gDNA拆卸和cDNA合成超混合液(批号N20909)购自北京全式金生物科技有限公司;兔甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体(批号AB-P-R001)购自南宁市托普邦生物科技有限公司;大鼠免疫球蛋白G(IgG)二抗(批号SLBP0889V)、完全弗式佐剂(批号20170301)均购自上海希格玛高技术有限公司;超敏型化学发光(ECL)试剂(批号BL523A)购自合肥兰杰柯科技有限公司;0.9%氯化钠注射液(批号H20033974,规格500 mL;作生理盐水用)购自贵州科伦药业有限公司;小鼠抗大鼠TLR4一抗(批号J1016)购自美国Santa Cruz公司;兔抗大鼠NF-κB p65一抗(批号8242S)购自美国CST公司;兔抗小鼠TRAF6 一抗(批号ab40675)购自美国Abcam公司;大鼠IL-6酶联免疫吸附测定(ELISA)分析试剂盒(批号JYM0651Ra)、大鼠FC ELISA分析试剂盒(批号JYM1159Ra)均购自武汉基因美生物科技有限公司;大鼠TNF-α ELISA分析试剂盒(批号E-EL-R2856c)购自武汉伊莱瑞特生物科技股份有限公司,辣根过氧化酶标记的兔二抗(批号7074、7076)购自美国Cell Signaling Technology公司;其余试剂均为实验室常用规格。
1.3 动物
健康SPF级SD成年大鼠90只,2月龄,雄雌各半,体质量(250±20)g,购自长沙天勤生物技术有限公司,动物生产许可证号的SCXK(湘)2014-0011。动物由广西中医药大学医学分子实验室进行专人饲养,饲养条件为安静、通风、清洁、昼夜室温20~23 ℃、相对湿度50%~60%。本实验方案经广西中医药大学第一附属医院动物实验伦理委员会批准,批准号为2013(KF)-E- 003。
2 方法
2.1 分组、造模与给药
大鼠适应性喂养1周后,将其随机分为空白组、模型组、阳性对照组和安肠汤低、中、高剂量组,每组15只。参照文献方法(TNBS结合乙醇复合灌肠法)[8]建立UC大鼠模型:所有大鼠禁食不禁水24 h后,均腹腔注射10%水合氯醛溶液(0.003 mL/g)进行麻醉,顺着大鼠肛门-直肠生理弯曲插入软管约7 cm,注入TNBS/乙醇(TNBS+等体积50%乙醇,100 mg/kg,以TNBS计)造模,再将大鼠倒立保持2 min以保证药液充分吸收。造模成功标准[8]:(1)大鼠反复大便溏泄甚至带有脓血;(2)大鼠食欲及体质量均下降;(3)大鼠精神萎靡、毛色枯槁、畏寒弓背,群体聚堆;具备两项及以上者认定为造模成功。空白组大鼠除注入生理盐水外,其余操作同前。大鼠麻醉清醒后,可自由进饮进食。
造模成功2 d后,空白组和模型组大鼠灌胃生理盐水5 mL,阳性对照组大鼠灌胃双歧杆菌活菌胶囊悬液5 mL(以0.9%氯化钠注射液为溶剂,含双歧杆菌活菌0.35 g),安肠汤组大鼠按比例灌胃低、中、高剂量安肠汤溶液1、5、10 mL,每mL约相当于生药总量0.11 g(各药物组用药剂量均参照前期试验[1]并按人与动物体质量系数换算而得),每日1次,连续给药14 d。
2.2 标本采集与处理
末次给药后,所有大鼠均禁食不禁水24 h,腹腔注射10%水合氯醛溶液进行麻醉后,立即剖腹取腹主动脉血约8 mL,静置30 min,以3 000 r/min离心15 min分离上层血清,置于-20 ℃冰箱内保存,待测。统一在距大鼠肛门约7 cm处取结肠组织后并置于4%多聚甲醛溶液中密封,置于4 ℃下避光保存,待测。取肠道内粪便样品适量,置于-20 ℃冰箱中保持,待测。
2.3 指标检测
2.3.1 大鼠结肠组织病理情况观察 取“2.2”项下经4%多聚甲醛溶液固定后的大鼠结肠组织适量,依次进行石蜡包埋、切片(厚度10 μm)、脱蜡、苏木精染液染色、冲洗、分化液分化、伊红染液染色、脱水透明封片等处理,在显微镜下观测组织形态学改变并拍照。
2.3.2 各组大鼠结肠组织中TLR4、TRAF6、NF-κB蛋白表达水平检测 采用Western blotting法。取“2.2”项下各组大鼠结肠组织40 mg,放入2 mL离心管,按照RIPA裂解液说明书方法提取相关蛋白,匀浆至无沉淀,以12 000 r/min离心5 min,取上清液采用BCA法测定蛋白含量并定量至2 μg/μL。蛋白于100 ℃变性10 min,取变性后的蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转至聚偏二氟乙烯(PVDF)膜上,用8%脱脂奶粉室温封闭3 h。加入相应一抗[TLR4(稀释度为1 ∶ 2 000)、TRAF6(稀释度为1 ∶ 2 000)、NF-κB(稀释度为1 ∶ 2 000)、GAPDH(稀释度为1 ∶ 2 000)],37 ℃孵育12 h;以TBST洗膜15 min×3次,加入IgG二抗(稀释度为1 ∶ 4 000),37 ℃ 孵育1 h,以TBST洗膜15 min×3次。以ECL顯色后,于凝胶成像仪中进行曝光成像后,采用Image J 1.51软件对蛋白条带灰度值进行分析,以目的蛋白条带灰度值与内参GAPDH蛋白条带灰度值的比值表示目的蛋白的表达水平。
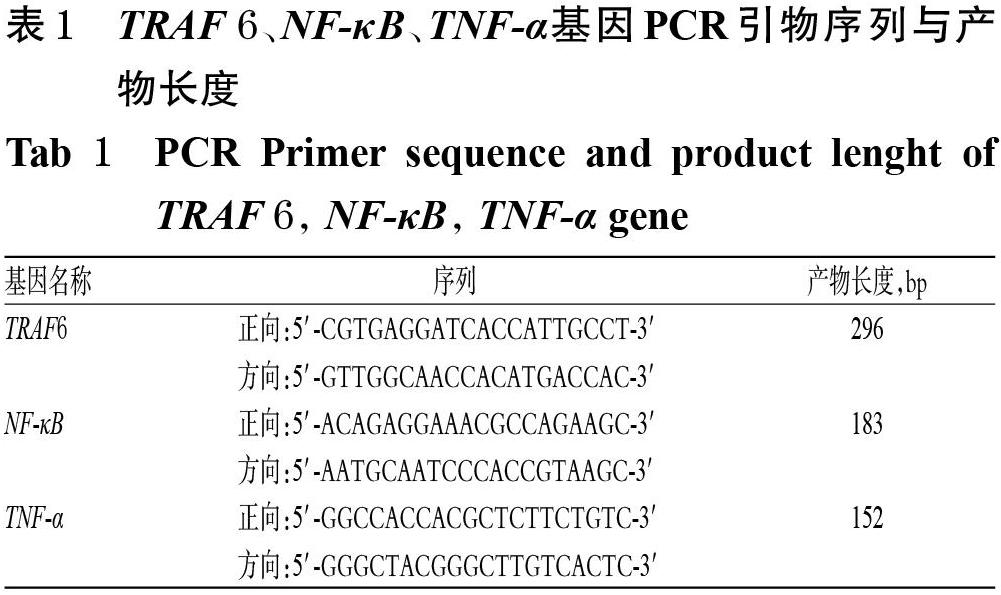
2.3.3 各组大鼠结肠组织中TLR4、TRAF6、TNF-α、NF-κB mRNA水平检测 采用实时荧光定量PCR(RT-PCR)法。取“2.2”项下各组大鼠结肠组织适量,剪碎后放入2 mL离心管,加入 Triquick Reagent总RNA提取试剂1 mL,匀浆至无沉淀,静置5 min后加入氯仿0.2 mL,振荡15 s;于4 ℃下以4 500 r/min离心15 min后,取上清液0.5 mL加至另一1.5 mL离心管中;加入异丙醇0.5 mL,置于室温下静置10 min;重复上述步骤3次,弃上清液。沉淀于65 ℃金属浴锅中烘干,加入焦碳酸二乙酯(DEPC)水0.03 mL溶解,经超微量核酸检测仪测定RNA浓度并按反转录试剂盒说明书进行操作,将所得cDNA置于-80 ℃冰箱内保存,待用。RT-PCR反应体系为MonAmpTM SYBR? Green qPCR Mix 10 μL,cDNA 1 μL,正向引物(10 μmol/L)0.4 μL,反向引物(10 μmol/L)0.4 μL,H2O 8.2 μL;反应条件为95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,共40个循环。以GAPDH作为内参,采用2-ΔΔCt法计算各目标基因mRNA的表达水平(式中Ct表示荧光信号强度达到设定阈值时经历的循环次数)。引物序列详见表1。
2.3.4 各组大鼠血清中相关炎症因子以及粪便样品中FC水平检测 采用ELISA法。取“2.2”项下血清/粪便样品适量,参照ELISA试剂盒说明书进行操作,检测各组大鼠血清中TNF-α、IL-6以及粪便样品中FC的水平。
2.4 统计学方法
采用SPSS 18.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,两组间比较采用SNK-q检验。P<0.05为差异有统计学意义。
3 结果
3.1 各组大鼠结肠组织的病理改变
与空白组比较,模型组大鼠结肠组织黏膜表面严重缺损,可见深达肌层的溃疡坏死。经药物治疗后,安肠汤低剂量组大鼠结肠组织黏膜表面较模型组稍有改善,但仍可见炎症细胞浸润;而安肠汤中、高剂量组以及阳性对照组大鼠结肠组织恢复明显,其黏膜表面可见新生腺体且排列较整齐。详见图1。
3.2 各组大鼠结肠组织中TLR4、TRAF6、NF-κB蛋白表达水平
与空白组比较,模型组大鼠结肠组织中TLR4、TRAF6、NF-κB蛋白的表达水平均显著升高(P<0.05);与模型组比较,各药物组大鼠结肠组织中上述指标的表达水平均显著降低(P<0.05),详见表2、图2。
3.3 各组大鼠结肠组织中TLR4、TRAF6、TNF-α、NF-κB mRNA表达水平
与空白组比较,模型组大鼠结肠组织中TLR4、TRAF6、TNF-α、NF-κB mRNA表达水平均显著升高(P<0. 05);与模型组比较,各药物组大鼠结肠组织中上述指标的表达水平均显著降低(P<0. 05),详见表3。
3.4 各组大鼠血清中TNF-α、IL-6及粪便样品中FC的水平
与空白组比较,模型组大鼠血清中TNF-α、IL-6及粪便样品中FC水平均显著升高(P<0. 05);与模型组比较,各药物组大鼠血清/粪便中上述指标水平均显著降低(P<0.05),详见表4。
4 讨论
目前,UC的病因和发病机制仍未明确,但近年的研究热点聚焦在免疫炎症反应的相关通路上,如NF-κB信號通路、TLR信号通路等分泌的炎症因子,被证实与UC的炎症程度密切相关[9-11]。NF-κB是一种蛋白质复合物,在静息状态下因NF-κB/Rel蛋白二聚体与抑制蛋白IκB结合而处于失活状态[12];而TLR4属于Ⅰ型跨膜糖蛋白受体,在细胞表面能够识别病原相关分子,在活化信号转导中起到桥梁作用[13-14]。当TLR4/NF-κB信号通路被异己抗原激活后,其细胞表面受体会发生构象改变,激活激酶1和代谢性炎症的IκK复合物使其磷酸化,并由泛素连接酶引导,从而可被泛素化和被溶酶体识别并降解,于是NF-κB从NF-κB抑制因子α(IκBα)重组蛋白复合物中脱离出来,暴露出核定位域,且迅速发生核转位,通过与EB病毒靶基因反应元件结合,启动了相关炎症因子(如TNF-α、脂多糖、IL-1、过氧化氢等)的表达[15];而产生的炎症因子又进一步激活NF-κB,从而形成恶性循环,使病情不断恶化。牛亚蒙等[16]在研究内毒素性肝损伤时发现,解毒化瘀通腑方可抑制TLR4/NF-κB信号通路的激活,减少炎症因子的释放,减轻内毒素引起的肝损害。段紫钰等[17]基于TLR4/髓样分化因子(MyD88)/NF-κB通路的研究发现,双草油对大鼠放射性皮炎能起到一定的保护作用。董小鹏等[18]研究表明,血必净注射液能降低TLR4、NF-κB、TNF-α蛋白的表达水平,从而抑制肺组织炎症反应。由此可见,TLR4/NF-κB信号通路通过调控炎症因子的表达在疾病发生、发展中起着重要的作用。
TNF受体相关因子TRAFs家族成员包括TRAF1~7,其是一类能直接或间接与多种TNF和IL-1/TLRs结合的接头蛋白,介导多种下游信号通路的信号传导,从而影响细胞的生长、增殖、分化和死亡[19-20];此外,TRAF2~7的N-末端存在一个环指结构域,可作为E3泛素连接酶将泛素转移到目的蛋白上[21]。Deng等[22]研究表明,TRAF6可与E3以及泛素连接酶Ubc13/Uev1A结合形成多聚泛素链,使IκB发生磷酸化,从而激活NF-κB信号通路。陈华群等[23]研究发现,在NF-κB信号通路激活过程中,TRAF6发生降解,且该降解是由蛋白酶复合体介导的,提示TRAF6可能是通过自身的泛素化及蛋白酶降解来调节NF-κB信号通路的。吴晓丹[24]研究认为,高糖条件下能激活高迁移率族蛋白B1(HMGB1)/TLR4/TRAF6/NF-κB信号通路,引起细胞自噬从而造成心肌细胞的损伤。Ahmedy等[25]研究认为,蜂毒肽可通过TLR4/TRAF6介导的NF-κB和应激激活的p38丝裂原活化蛋白激酶(p38 MAPK)途径来减轻乙酸诱发的小鼠UC。Yang等[26]研究发现,木犀草素可通过TLR4/TRAF6/ NF-κB信号通路而减轻脑出血引起的神经炎症。
1980年,Dale等[27]首次从中性粒细胞中分离出FC,是一种新型的炎症标志物。林丽琳等[28]研究发现,在急性炎症患者体内FC表达水平增高,且比其他炎症标志物[如C-反应蛋白(CRP)]更加稳定。邢晔陈等[29]通过检测克罗恩患者和健康体检者的粪便样本,发现克罗恩病患者的致病菌和FC的检出率与丰度都显著升高。
本研究病理研究发现,模型组大鼠结肠组织黏膜表面严重缺损,可见深达肌层的溃疡坏死。经药物治疗后,安肠汤低剂量组黏膜表面较模型组稍有改善,但仍可见炎症细胞浸润;而安肠汤中、高剂量组以及阳性对照组大鼠恢复明显,黏膜表面可见新生腺体且排列较整齐。本研究还发现,与空白组比较,模型组大鼠结肠组织中TLR4、TRAF6、NF-κB蛋白表达水平,TLR4、TRAF6、TNF-α、NF-κB mRNA水平以及血清中TNF-α、IL-6和粪便样品中FC水平均显著升高;而经药物处理后,各药物组大鼠上述指标均较模型组显著降低(P<0.05),尤以安肠汤中、高剂量组及阳性对照组的结果变化明显。这提示经安肠汤和双歧杆菌活菌胶囊治疗后,UC模型大鼠的炎症反应得到改善。同时,本研究中以双歧杆菌活菌胶囊作为阳性对照,以排除使用安肠汤干预后可能出现的假阴性情况,结果表明,两药都能抑制TLR4/NF-κB信号通路及FC的表达。
综上所述,安肠汤可缓解UC模型大鼠的炎症发炎,促进肠道组织黏膜的修复,其作用机制可能与抑制TLR4/NF-κB信号通路及FC的表达有关;但因实验条件有限,笔者尚未深入探讨安肠汤与TLR4/NF-κB信号通路的具体药效机制,有待后续研究加以完善。
参考文献
[ 1 ] 孙平良.基于代谢组学的溃疡性结肠炎大鼠肠道微生态变化及安肠汤干预机制研究[D].南宁:广西医科大学,2017.
[ 2 ] 李建功,孙文熙,刘家玥,等.基于TLR4/MyD88/NF-κB信号通路研究黄连素对小鼠巨噬细胞极化的干预作用[J].中国药房,2020,31(15):1804-1809.
[ 3 ] 唐冰雪,张源文,吴雅晨,等.淫羊藿苷对脑缺血再灌注大鼠的神经保护及小胶质细胞TLR4/NF-κB通路的影响[J].中国实验方剂学杂志,2020,26(22):47-52.
[ 4 ] 李姿慧,蔡荣林,孙娟,等.参苓白术散对脾虚湿困型溃疡性结肠炎大鼠结肠组织NF-κB p65、IκBα、IκKβ蛋白及mRNA表达的影响[J].中国实验方剂学杂志,2020,26(19):108-113.
[ 5 ] 肖振球,何译生,吕小平,等.自拟安肠汤治疗溃疡性结肠炎50例[J].广西中医药,1993,16(3):3-6.
[ 6 ] 刘佳丽,杨坤,徐爱玲,等. miRNA-146a在溃疡性结肠炎大鼠结肠组织与血浆中浓度表达意义[J]. 中华中医药学刊,2020,38(1):115-118、276.
[ 7 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:211-291.
[ 8 ] 李茹柳,迟莉,郭文峰,等.造模因素对TNBS致大鼠溃疡性结肠炎模型的影响[J].中药药理与临床,2007,23(6):81-83.
[ 9 ] 李斌.乌梅丸及其拆方对溃疡性结肠炎大鼠TLR9/MyD88/NF-κBp65及IL-6/JAK/STAT3信号通路的影响[D].沈阳:辽宁中医药大学,2016.
[10] 蒋宛瑾,谢聪,喻嵘,等.白虎加人参汤对转基因2型糖尿病MKR小鼠肠道TLR4/NF-κB信号通路及肠道屏障功能的影响[J].中草药,2020,51(11):3005-3012.
[11] 閆曙光,惠毅,李倩,等.黄连-干姜提取物对溃疡性结肠炎小鼠结肠上皮TLR4/NF-κB信号通路的影响[J].中国实验方剂学杂志,2020,26(4):70-75.
[12] MITCHELL JP,CARMODY RJ. NF-κB and the transcriptional control of inflammation[J]. Int Rev Cell Mol Biol,2018. DOI:10.1016/bs.ircmb.2017.07.007.
[13] MARONGIU L,GORNATI L,ARTUSO I,et al. Below the surface:the inner lives of TLR4 and TLR9[J]. J Leukoc Biol,2019,106(1):147-160.
[14] 常晓彤,辇晓峰,王振辉. Toll样受体信号转导途径研究进展[J].生理科学进展,2011,42(5):340-346.
[15] MULERO MC,HUXFORD T,GHOSH G. NF-κB,IκB,and IκK:integral components of immune system signaling[J]. Adv Exp Med Biol,2019. DOI:10.1007/978-981-13- 9367-9_10.
[16] 牛亚蒙,刘江凯,刘香丽,等.基于TLR4/NF-κB通路的解毒化瘀通腑方干预内毒素性肝损伤的作用机制[J].时珍国医国药,2020,31(5):1029-1033.
[17] 段紫钰,李建国,袁星海,等. TLR4/MyD88/NF-κB通路中双草油对大鼠放射性皮炎模型的保护机制[J].中国皮肤性病学杂志,2020,34(8):861-866.
[18] 董小鹏,王丽娟,赵春霖,等.血必净注射液对急性胰腺炎大鼠肺损伤及肺组织TLR4、NF-κB、TNF-α表达的影响[J].中成药,2020,42(11):3025-3030.
[19] 李影,陈镜宇,张玲玲,等.肿瘤坏死因子受体相关因子参与炎症免疫调节的研究进展[J].中国药理学通报,2015,31(9):1206-1211.
[20] 吴刚.TLR4信号通路介导的炎症反应在高原肺水肿发生中的作用及机制研究[D].重庆:陆军军医大学,2019.
[21] 孙婷,陈泉,肖继,等. NF-κB亚基泛素化研究进展[J].生理科学进展,2018,49(3):217-221.
[22] DENG L,WANG C,SPENCER E,et al. Activation of the IkappaB kinasecomplex by TRAF6 requires a dimeric ubiquitin-conjugating enzymecomplex and a unique polyubiquitin chain[J]. Cell,2000,103(2):351-361.
[23] 陈华群,张锡然,ORTH K. TRAF6在NF-κB信号通路中的修饰与降解[J].南京医科大学学报(自然科学版),2004,24(1):59-62.
[24] 吴晓丹. HMGB1/TLR4/TRAF6/NF-κB介导自噬在高糖预培养hiPSCs-CM缺氧复氧损伤中的作用机制研究[D].南宁:广西医科大学,2019.
[25] AHMEDY OA,IBRAHIM SM,SALEM HH,et al. Antiulcerogenic effect of melittin via mitigating TLR4/TRAF6 mediated NF-κB and p38 MAPK pathways in acetic acid-induced ulcerative colitis in mice[J]. Chem Biol Interact,2020. DOI:10.1016/j.cbi.2020.109276.
[26] YANG Y,TAN X,XU J,et al. Luteolin alleviates neuroinflammation via downregulating the TLR4/TRAF6/NF-κB pathway after intracerebral hemorrhage[J]. Biomed Pharmacother,2020. DOI:10.1016/j.biopha.2020.110044.
[27] DALE I,FAGERHOL MK,NAESGAARD I. Purification and partial charac-terization of a highly immunogenic human leukocyte protein,the L1 antigen[J]. Eur J Biochem,1983,134(1):1-6.
[28] 林丽琳,王承党.粪钙卫蛋白在炎症性肠病中的应用价值[J].胃肠病学,2019,24(4):247-250.
[29] 邢晔陈,胡彤,徐丽娟,等.克罗恩病患者粪便具核梭杆菌与钙卫蛋白相关性研究[J].胃肠病学,2020,25(6):326-331.
(收稿日期:2020-07-06 修回日期:2020-12-17)
(编辑:罗 瑞)
