羟基喜树碱纳米粒在大鼠体内的药动学、组织分布及靶向性研究
2021-02-21林柳任窦晨郑永仁马云淑孙赟程欣
林柳任 窦晨 郑永仁 马云淑 孙赟 程欣
摘 要 目的:研究羥基喜树碱纳米粒在大鼠体内的药动学及组织分布特征,并探讨其靶向性。方法:将雄性SD大鼠随机分为两组,每组6只,分别单剂量尾静脉注射羟基喜树碱纳米粒和市售羟喜树碱注射液(4 mg/kg,以羟基喜树碱计),在给药后5、30、60、120、240、360、480、600、720 min时于眼底静脉丛取血500 μL,采用高效液相色谱法测定不同时间点血浆中羟基喜树碱的含量,以DAS 3.0等软件计算药动学参数。另取雄性SD大鼠随机分为两组,每组24只,分别单剂量尾静脉注射羟基喜树碱纳米粒和市售羟喜树碱注射液(0.6 mg/kg,以羟基喜树碱计),在给药后30、60、120、240 min时于腹主动脉取血并摘取心、肝、脾、肺、肾、脑,采用高效液相色谱法测定不同时间点血浆及组织中羟基喜树碱的含量,考察其分布特征及靶向性。结果:羟基喜树碱纳米粒和市售羟喜树碱注射液在大鼠体内均符合二室模型,羟基喜树碱纳米粒的AUC0-720 min和AUC0-∞分别为市售羟喜树碱注射液的1.89和1.87倍,MRT0-720 min和MRT0-∞为2.74和3.00倍,t1/2β为2.75倍,组间比较差异均有统计学意义(P<0.05);给药后30 min时,羟基喜树碱纳米粒和注射液在肺中浓度最高;随着时间的推移,药物逐渐向肝部位积累,在60 min时肝药浓度达到最高。羟基喜树碱纳米粒在肝的相对摄取率最大(6.28);以肝为靶向器官,其在心、脾、肺、肾、脑和血浆中的靶向效率均大于羟喜树碱注射液;给药后30~120 min,羟基喜树碱纳米粒在心、肺(除给药后30 min外)、肾、脑、血浆中的选择性指数均显著高于羟喜树碱注射液(P<0.05或P<0.01)。结论:羟基喜树碱纳米粒延长了药物的半衰期、提高了其血药浓度、延长了其体内作用时间,且肝靶向性显著。
关键词 羟基喜树碱;纳米粒;药动学;组织分布;靶向性;大鼠
ABSTRACT OBJECTIVE:To study the pharmacokinetics and tissue distribution characteristics of Hydroxycamptothecin (HCPT) nanoparticles in rats, and to investigate their targeting. METHODS: Male SD rats were randomly divided into 2 groups, with 6 rats in each group. They were given HCPT nanoparticles and HCPT injection (4 mg/kg based on HCPT) via tail vein respectively. 500 μL fundus venous plexus blood were sampled at 5, 30, 60, 120, 240, 360, 480, 600 and 720 min after administration. The plasma concentration of HCPT in rats were measured by HPLC at different time points. The pharmacokinetic parameters were calculated by DAS 3.0 software. Male SD rats were randomly divided into two groups, with 24 rats in each group. They were given HCPT nanoparticles and HCPT injection (0.6 mg/kg based on HCPT) via tail vein, respectively. Blood was immediately taken from the abdominal aorta, and heart, liver, spleen, lung, kidney and brain were removed at 30, 60,120, 240 min after administration. The plasma and tissue concentration of HCPT in rats were measured by HPLC. The distribution of HCPT in each tissue and targeting were investigated. RESULTS: HCPT nanoparticles and its injection conformed to a two-compartment model in rats. Compared with HCPT injection, AUC0-720 min and AUC0-∞ increased by 1.89 and 1.87 times respectively, MRT0-720 min and MRT0-∞ increased by 2.74 and 3.00 times respectively, t1/2β increased by 2.75 times, with statistical significance (P<0.05). At 30 min after administration, HCPT nanoparticles and HCPT injection had the highest concentration in lung; with the passage of time, the drug gradually accumulated in the liver and reached the highest concentration at 60 min. The relative liver uptake rate of HCPT nanoparticles was the highest (6.28). Taking liver ad target organ, and the targeting efficiencies of it in heart, spleen, lung, kindey, brain and plasma were higher than those of HCPT injection. The selectivity index of HCPT nanoparticles in heart, lung (except for 30 min after administration), kidney, brain and plasma were significantly higher than those of HCPT injection at 30-120 min after administration. CONCLUSIONS: HCPT nanoparticles extend the half-life of the drug, increase its plasma concentration, and prolong its action time in vivo, with significant liver targeting.
KEYWORDS Hydroxycamptothecin; Nanoparticles; Pharmacokinetics; Organization distribution; Targeting; Rat
中图分类号 R917 文献标志码 A 文章编号 1001-0408(2021)02-0164-07
DOI 10.6039/j.issn.1001-0408.2021.02.07
羟基喜树碱(Hydroxycamptothecin)是一种具有高效抗癌作用的活性生物碱,临床上常用以辅助治疗各类原发性肝癌、胃癌、食道癌等恶性肿瘤[1-3]。羟基喜树碱在碱性环境中易开环生成溶于水的羧酸衍生物,故临床上多以此衍生物的钠盐作为注射液使用[4]。但因羟基喜树碱开环衍生物的生物利用度低、半衰期短,在体内吸收慢且毒副作用大,其临床应用上受到了很大的限制[5]。近年来,纳米粒的应用越来越广泛,其作为药物载体,具有制备工艺简单、保护药物不被降解、促进药物吸收、优化并改善药物在体内的分布特征等优点[6]。基于此,本课题组前期成功制备了羟基喜树碱纳米粒。为进一步探讨其体内的缓释作用及靶向性,本研究以市售羟喜树碱注射液为参照,比较了羟基喜树碱纳米粒在大鼠体内的药动学及组织分布特征,旨在为该制剂的临床应用提供参考。
1 材料
1.1 仪器
实验所用仪器有:Waters e2695型高效液相色谱(HPLC)仪(包括2998型二极管阵列检测器、717型自动进样器、1525型元梯度输液泵,美国Waters公司)、190 Plus PALS型纳米激光粒度仪(美国Brookhaven Instruments公司)、TGL-16G型台式离心机(上海安亭科学仪器厂)、FS-300N型超声波处理器(上海生析超声仪器有限公司)、DF-101S型集热式恒温加热磁力搅拌器(巩义市予化仪器有限责任公司)、XK96-A型快速混匀机(江苏新康医疗器械有限公司)、XHF-1型高速分散器(宁波新芝生物科技有限公司)、CP124C-OHAUS型电子天平(奥豪斯仪器常州有限公司)、HSC-12A型氮吹仪(天津市恒奥科技发展有限公司)。
1.2 药品与试剂
实验所用药品和试剂有:羟基喜树碱对照品(彭州茂源生物科技公司,批号170401,纯度≥99%)、喜树碱对照品(内标,成都得思特生物技术有限公司,批号DST180310-028,纯度≥98%)、羟喜树碱注射液(哈尔滨三联药业股份有限公司,批号19010510,规格10 mL ∶ 10 mg)、聚乳酸-羟基乙酸-聚乙二醇-叶酸(PLGA-PEG-FA,分子量18.5 kDa,重庆浦诺维生物科技有限公司)、聚乳酸-羟基乙酸共聚物(PLGA,分子量13 kDa,濟南岱罡生物科技有限公司)、全氟戊烷(PFP,美国Strem Chemicals公司)、细胞膜荧光探针DiR碘化物(美国Biotium公司)、聚乙烯醇(PVA,分子量89~98 kDa,水解度99%,美国Sigma公司)、二甲基亚砜(DMSO,广州赛国生物技有限公司,纯度≥99%)、肝素钠注射液(常州千红生化制药股份有限公司,批号151903017A,规格2 mL ∶ 5 000 U)等;甲醇、乙腈均为色谱纯,其余试剂均为分析纯或实验室常用规格,水为纯净水。
1.3 动物
SPF级SD大鼠,雄性,体质量(250±20)g,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号为SCXK(湘)2019-0004。所有大鼠均常规饲养于云南中医药大学实验动物中心。
2 方法与结果
2.1 羟基喜树碱纳米粒的制备
精密称取羟基喜树碱对照品约63 mg,溶于DMSO 1.5 mL中,超声(功率480 W,频率40 kHz)处理30 min,即得质量浓度为42 mg/mL的羟基喜树碱混悬液;在该混悬液中加入PLGA 25 mg、5 mg/mL DiR碘化物溶液(溶剂为乙酸乙酯)0.1 mL,作为油相1(O1)。吸取PFP 300 μL,加入至O1相中,于避光冰浴下超声(功率105 W,频率25 kHz,下同)乳化366 s,得到乳化后的油相1′(O1′)。另称取PLGA-PEG-FA 75 mg,溶于乙酸乙酯0.5 mL中作为油相2(O2)。将O2相加入到O1′相中,于避光冰浴下超声乳化10 s,得到O1′/O2初乳;将上述初乳加入到5 mg/mL PVA水溶液[水相(W)]中,于避光冰浴下超声乳化180 s,得到O1′/O2/W预复乳;搅拌下,加入水75 mL进行稀释,室温下于通风橱内避光搅拌过夜;最后将上述乳液于4 ℃下以10 000 r/min离心15 min,弃去上清液,收集沉淀以水5 mL进行分散,即得羟基喜树碱纳米粒。检测该纳米粒平均粒径为(743.65±4.31)nm,平均Zeta电位为(16.24±0.45)mV;载药量为31.8%(重复测定3次)。
2.2 羟基喜树碱分析方法的建立
采用HPLC法进行检测。
2.2.1 色谱条件 以Zorbax Eclipse Plus C18(250 mm×4.6 mm,5 μm)为色谱柱;以0.1%三乙胺水溶液(用磷酸调pH至3.0)-乙腈(73 ∶ 27,V/V)为流动相;流速为0.6 mL/min;柱温为30 ℃;检测波长为384 nm;进样量为10 μL。
2.2.2 系列标准溶液的配制 精密称取羟基喜树碱对照品适量,用甲醇溶解制成质量浓度为1 000 mg/L的贮备液,再用甲醇进一步稀释制成质量浓度分别为36、24、18、12、6、3、1.5、0.3、0.15、0.075 mg/L的系列标准溶液,于4 ℃下密封保存,备用。
2.2.3 内标溶液的配制 精密称取喜树碱对照品1.0 mg,置于10 mL量瓶中,用甲醇溶解并稀释至刻度,制成质量浓度为100 mg/L的内标溶液,于4 ℃下密封保存,备用。
2.2.4 血浆和组织匀浆的制备 于大鼠眼眶取血,采集的血样置于含有肝素钠的离心管中,以6 000 r/min离心10 min,分离血浆,于-20 ℃下保存,备用。摘取大鼠心、肝、脾、肺、肾、脑,用生理盐水洗净,滤纸吸干水分,称定质量后加生理盐水研磨,制成组织匀浆,于4 ℃下保存,备用。
2.2.5 样品预处理 精密吸取大鼠血浆或组织匀浆样品200 μL,置于2 mL离心管中,加入内标溶液20 μL,涡旋混匀3 min,再加入乙腈1.2 mL,静置5 min后,以6 000 r/min离心10 min,吸取上清液1.0 mL,以氮气流吹干,残渣用甲醇100 μL涡旋3 min复溶,经0.22 μm微孔滤膜滤过,取续滤液,待测。
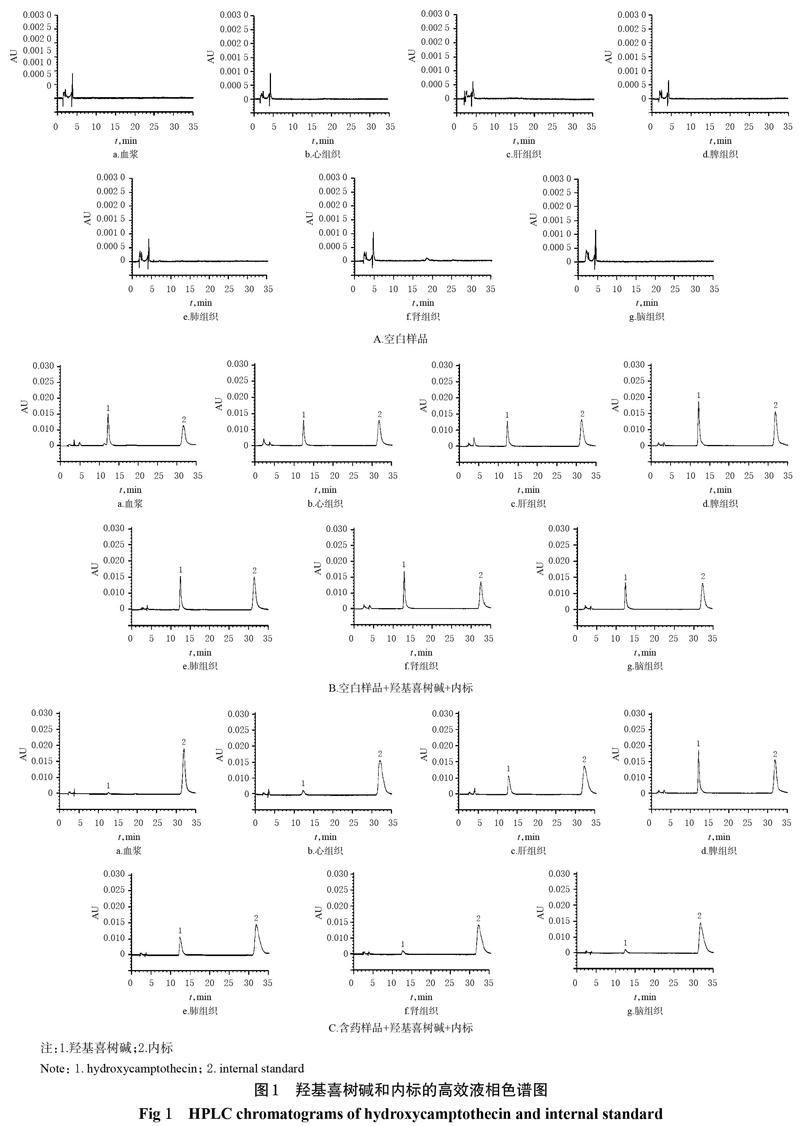
2.2.6 专属性考察 取大鼠空白血浆和空白心、肝、脾、肺、肾、脑组织匀浆样品,空白血浆和各组织匀浆+羟基喜树碱(6 mg/L)样品,大鼠尾静脉注射给药30 min后的含药血浆和含药组织匀浆样品,按“2.2.5”项下方法处理(各空白生物样品不加内标)后,再按“2.2.1”项下色谱条件进样测定,记录色谱图。结果,羟基喜树碱与内标色谱峰的峰形对称且分离度好,保留时间分别为12.6、31.4 min,且无内源性杂质干扰,表明方法专属性好,详见图1。
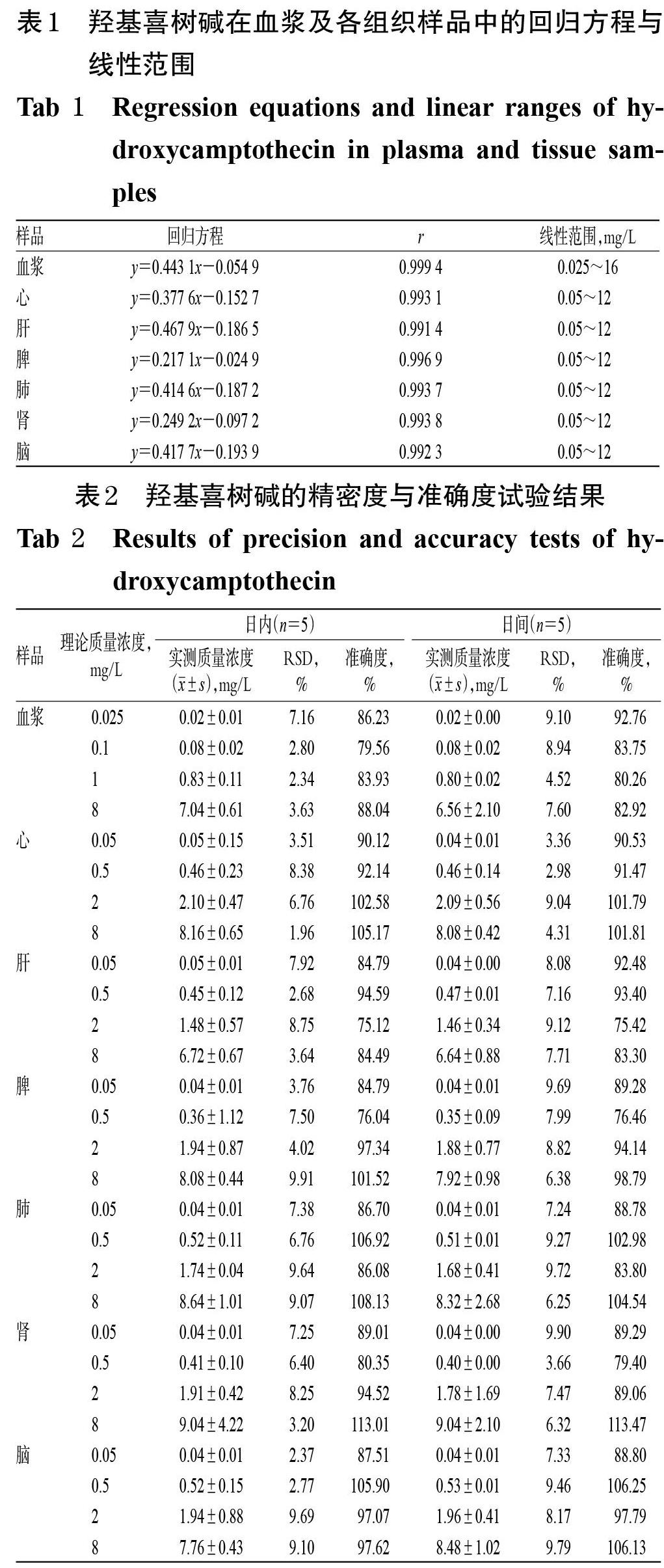
2.2.7 线性关系考察 精密吸取大鼠空白血浆和空白心、肝、脾、肺、肾、脑组织匀浆各200 μL,加入“2.2.2”项下羟基喜树碱系列标准溶液适量,分别制成质量浓度分别均为0.025、0.05、0.1、0.5、1、2、4、6、8、12、16 mg/L的系列血浆样品和0.05、0.1、0.5、1、2、4、6、8、12 mg/L的系列组织样品,按“2.2.5”项下方法处理后,再按“2.2.1”项下色谱条件进样测定,记录峰面积。以待测成分质量浓度(x,mg/L)为横坐标、待测成分与内标峰面积比值(y)为纵坐标进行线性回归。结果,血浆样品中羟基喜树碱检测质量浓度的线性范围为0.025~16 mg/L(r>0.999),定量下限为0.025 mg/L;各组织样品中该成分检测质量浓度的线性范围均为0.05~12 mg/L(r>0.99),定量下限均为0.5 mg/L,详见表1。
2.2.8 精密度与准确度试验 精密吸取空白血浆和空白心、肝、脾、肺、肾、脑组织匀浆各200 μL,按“2.2.7”项下方法制成定量下限(0.025 mg/L)以及低、中、高质量浓度(0.1、1、8 mg/L,浓度按预试验结果设置,下同)的血浆样品和定量下限(0.05 mg/L)以及低、中、高质量浓度(0.5、2、8 mg/L,浓度按预试验结果设置,下同)的组织样品,按“2.2.5”项下方法处理后,再按“2.2.1”项下色谱条件进样测定,記录峰面积。其中,同日内连续测定5次考察日内精密度;每日测定1次、连续测定5 d考察日间精密度;以实测质量浓度与理论质量浓度的百分比考察准确度,结果见表2。结果,血浆样品和各组织样品中羟基喜树碱的日内、日间RSD均小于10%,准确度均大于75%,符合方法学要求[7]。
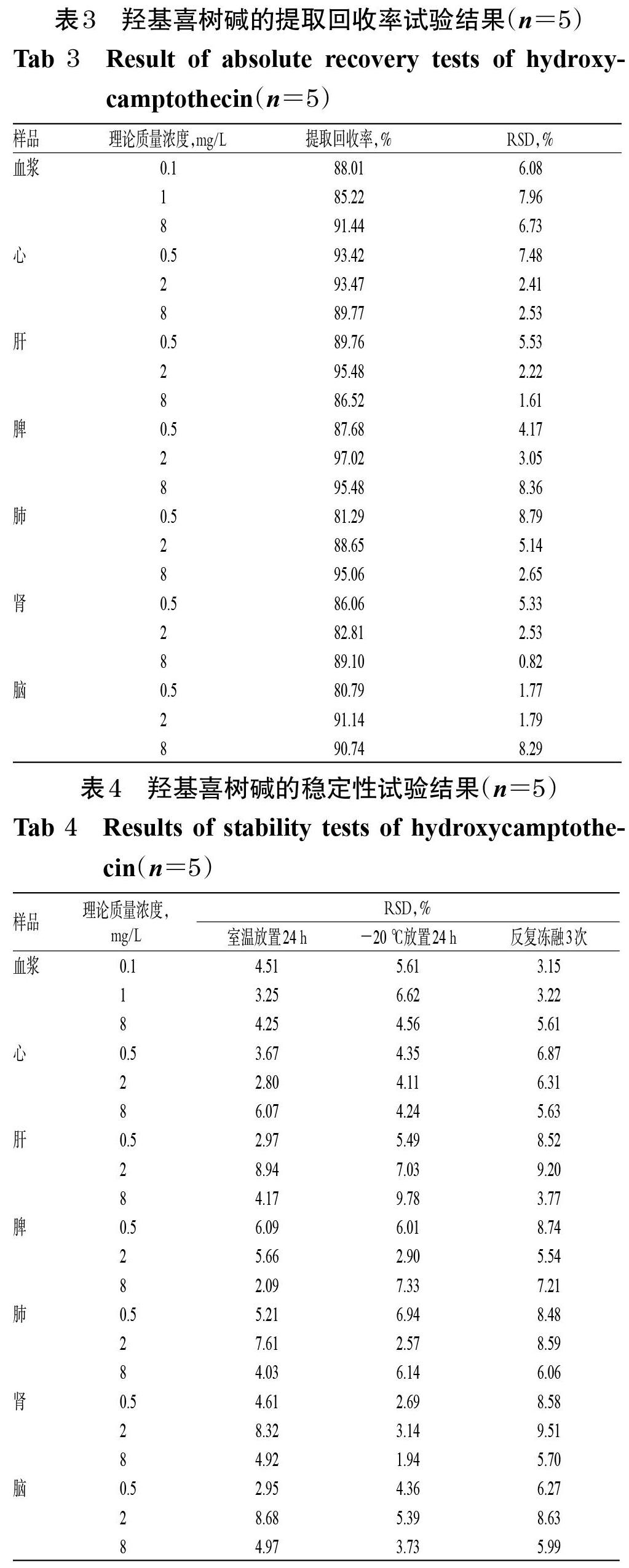
2.2.9 提取回收率 精密吸取空白血浆和空白心、肝、脾、肺、肾、脑组织匀浆各200 μL,按“2.2.8”项下方法制成低、中、高质量浓度的血浆样品和组织样品各5份,按“2.2.5”项下方法处理后,再按“2.2.1”项下色谱条件进样测定,记录羟基喜树碱与内标的峰面积之比(A1);另取空白血浆和空白心、肝、脾、肺、肾、脑组织匀浆各200 μL,按“2.2.5”项下方法处理后,加入羟基喜树碱标准溶液使其质量浓度与上述相同,进样测定,记录峰面积之比(A2),以A1/A2×100%计算提取回收率,结果见表3。结果,血浆样品和各组织样品的提取回收率均大于80%(RSD<10%,n=5)。
2.2.10 稳定性试验 按“2.2.8”项下方法制备低、中、高质量浓度的血浆样品和组织样品,分别于室温放置24 h、-20 ℃放置24 h、反复冻融(-20℃~室温)3次后,按“2.2.5”项下方法处理,再按“2.2.1”项下色谱条件进样测定,记录峰面积。每样品重复测定5次,结果见表4。结果,血浆样品和各组织样品在上述条件下放置,稳定性良好(RSD<10%,n=5),符合方法学要求[7]。
2.3 药动学实验
取大鼠12只,适应性饲养1周后,禁食不禁水12 h,随机分为受试组(给予自制羟基喜树碱纳米粒)和参照组(给予市售羟喜树碱注射液),每组6只。各组大鼠均单次尾静脉注射相应药物4 mg/kg(以羟基喜树碱计,剂量设置参考文献[8]),分别在给药后5、30、60、120、240、360、480、600、720 min时于眼底静脉丛取血500 μL,分离血浆,按“2.2.5”项下方法处理后,再按“2.2.1”项下色谱条件进样测定,记录峰面积并代入回归方程计算各个时间点大鼠体内羟基喜树碱的血药浓度。使用DAS 3.0软件和Graphpad Prism 7软件计算羟基喜树碱的药动学参数并作图,采用SPSS 19.0软件进行统计分析。数据以x±s表示,组间比较采用t检验。P<0.05表示差异有统计学意义。结果,自制羟基喜树碱纳米粒和市售羟喜树碱注射液在大鼠体内均符合二室模型,其药-时曲线及药动学参数见图2、表5。与羟喜树碱注射液比较,羟基喜树碱纳米粒的AUC0-720 min、AUC0-∞均显著升高,MRT0-720 min、MRT0-∞、t1/2β均显著延长(P<0.05),其中纳米粒AUC0-720 min和AUC0-∞分别为注射液的1.89和1.87倍,MRT0-720 min和MRT0-∞分别为注射液的2.74和3.00倍,t1/2β为注射液的2.75倍;同时,给药360 min后,羟喜树碱注射液在血浆中难以被检出,而羟基喜树碱纳米粒在给药720 min后仍能被检出,表明纳米粒可延长羟基喜树碱的半衰期并延长其在体内的作用时间。
2.4 组织分布实验与靶向性评价
2.4.1 组织分布实验 另取大鼠48只,适应性饲养1周后,禁食不禁水12 h,随机分为受试组(给予自制羟基喜树碱纳米粒)和参照组(给予市售羟喜树碱注射液),每组24只。各组大鼠均单次尾静脉注射相应药物0.6 mg/kg(以羟基喜树碱计,剂量设置参照文献[9]和前期预实验结果),分别在给药后30、60、120、240 min时于腹主动脉取血0.5 mL,分离血浆;然后迅速摘取其心、肝、脾、肺、肾、脑组织制成组织匀浆;按“2.2.5”项下方法进行处理后,再按“2.2.1”项下色谱条件进样测定,记录峰面积并代入回归方程计算各个时间点羟基喜树碱的质量浓度,结果见表6。结果,给药后30 min时,羟基喜树碱纳米粒及其注射液在肺中浓度最高;随着时间的推移,药物逐渐向肝部位积累,在60 min时肝药浓度达到最高,此时羟基喜树碱纳米粒的肝药浓度是其注射液的6.02倍。此外,羟基喜树碱纳米粒肝药浓度的下降速率低于羥喜树碱注射液,提示羟基喜树碱纳米粒在肝脏中有一定的蓄积。
2.4.2 靶向性评价 纳米给药系统属于靶向给药系统,主要评价指标有相对摄取率(Re)、靶向效率(Te)、选择性指数(Si),其中Re和Te反映整个代谢过程的靶向性,Si反映各时间点的靶向性,其数值越大即靶向性越强[10-12]。Re=AUCt/AUCc(AUC为AUC0-720 min,t为靶向制剂,c为非靶向制剂),Te=AUCT/AUCNT(T为靶器官,NT为非靶器官,下同),Si=cT/cNT。结果,羟基喜树碱纳米粒在肝的Re值最大,为6.28(>1),表明羟基喜树碱纳米粒对肝具有较强的靶向性,因此推测肝为靶器官。此外,羟基喜树碱纳米粒在血浆中的Re值为1.40(>1),进一步反映自制纳米粒具有一定的长循环作用[13]。后续以肝作为靶器官计算Te值和Si值,结果见表7、表8。对比各组织的Te值发现,羟基喜树碱纳米粒均高于羟喜树碱注射液,尤其在心、肾、脑和血浆中Te值均大于6,表明相比于羟喜树碱注射液,纳米粒能提高药物在各组织内的蓄积量[12]。对比两药在各时间点的Si值发现,除在肺组织(30 min)外,羟基喜树碱纳米粒的Si值均大于1,表明各时间点药物在肝中的浓度普遍高于其他组织,肝靶向性显著;且随着时间的延长,肝靶向性明显强于羟喜树碱注射液。经配对t检验分析发现,在给药后30~240 min时间段内,羟基喜树碱纳米粒在心、肺(除给药后30 min外)、肾、脑、血浆中的Si值均显著高于羟喜树碱注射液(P<0.05或P<0.01)。
3 讨论
PLGA-PEG类嵌段共聚物具有良好的生物相容性和机械性能[14],其作为纳米粒外壳,能明显提高难溶性药物羟基喜树碱亲水性,发挥缓释作用并提高药物生物利用度,因此其相应制剂具有长循环及被动靶向能力[15]。虽然PLGA-PEG外壳能依靠高渗透长滞留(EPR)效应将药物被动靶向到肿瘤部位,但无法进一步提高肿瘤部位的药物累积量[16]。为了进一步提高对肿瘤组织的靶向效率,本研究在PLGA-PEG表面连接了小分子靶向基团叶酸,借助后者能与肿瘤组织或细胞表面的叶酸受体特异性结合的性质,实现肿瘤组织靶向性。
药动学实验表明,羟基喜树碱纳米粒通过尾静脉注射进入大鼠体内后,其AUC、MRT、t1/2β均显著高于或长于羟喜树碱注射液,说明纳米粒在血浆中作用时间更长、消除更慢、体内长循环效果更好。组织分布实验结果表明,无论羟基喜树碱纳米粒还是羟喜树碱注射液,药物在肝和肺中的浓度均普遍高于其他组织,表现出羟基喜树碱趋向肝、肺蓄积的特性,这可能与羟基喜树碱主要经过肝代谢且肺部巨噬细胞较多,容易摄取药物等有关,与文献报道基本一致[17-18]。由于纳米载药系统改变了药物在体内的分布特征,导致纳米粒在体内的分布与羟基喜树碱注射液相比有较大的差异。且随着时间延长,羟基喜树碱纳米粒的肝药浓度高于注射液,但羟基喜树碱纳米粒是否会产生潜在的毒性,还需进一步实验的证实。此外,通过Te、Re、Si等3个靶向指标可以看出羟基喜树碱纳米粒的肝靶向性显著,且优于羟喜树碱注射液。
综上所述,羟基喜树碱纳米粒延长了药物的半衰期、提高了其血药浓度、延长了其体内作用时间,且肝靶向性显著。
参考文献
[ 1 ] 侯建成,刘洋,魏雪苗,等.羟基喜树碱临床抗肿瘤作用研究进展[J].吉林医药学院学报,2017,38(4):282-285.
[ 2 ] 康军英,李复红,韩蓓.参一胶囊联合羟基喜树碱和顺铂治疗晚期非小细胞肺癌的临床研究[J].现代药物与临床,2020,35(1):133-137.
[ 3 ] 杨小飞,张鹏飞.华蟾素胶囊联合羟基喜树碱对中晚期食管癌疼痛患者的疗效分析[J].现代医学,2019,47(11):1333-1336.
[ 4 ] 马萍,金武龙,马丽萍.羟基喜树碱纳米靶向给药系统的研究进展[J].转化医学杂志,2015,4(3):185-189.
[ 5 ] 李木生,王婴,蒋梦玥,等.星点设计-效应面法优化羟基喜树碱长循环纳米粒的制备工艺[J].中药新药与临床药理,2018,29(1):85-90.
[ 6 ] 李辉,王丹丹,杨菡,等.载药白蛋白纳米粒的研究进展[J].中国药物警戒,2020,17(9):636-642.
[ 7 ] 国家药典委员会.中华人民共和国药典:四部[S]. 2015年版.北京:中国医药科技出版社,2015:363-368.
[ 8 ] 刘卫晶.羟基喜树碱纳米晶体的药动学及其肿瘤靶向性评价[D].郑州:郑州大学,2010.
[ 9 ] 蒋梦玥,王彦苏,杜妍旖,等.羟基喜树碱长循环纳米粒的药动学与组织分布研究[J].广东药科大学学报,2018,34(3):265-270.
[10] 邢玉桂.吴茱萸碱脂质体在大鼠体内的药动学及小鼠体内的组织分布研究[J].中国药房,2016,27(16):2236- 2239.
[11] 徐红,高萌,褚秋辰,等.脂蟾毒配基PLGA-TPGS纳米粒在小鼠体内肝的靶向性[J].中国医院药学杂志,2017,37(7):590-595、612.
[12] 张钰欣.甘草次酸衍生物修饰脂质体的制备及肝靶向性评价[D].唐山:华北理工大学,2020.
[13] 于莲,杜妍,平洋,等.叶酸修饰的水飞蓟宾固体脂质纳米粒体内药动学及靶向性研究[J].中草药,2014,45(8):1110-1114.
[14] 杨芝明.温度敏感性PLGA-PEG-PLGA水凝胶包载化疗药物用于骨肉瘤原位治疗的研究[D].长春:吉林大学,2018.
[15] 宋振国,吴小瑜,程沁园,等.功能化阿霉素脂质体制备与肿瘤靶向性评价[J].中国药业,2019,28(4):12-15.
[16] 许璨,刘厂辉,彭旷.川芎嗪PEG-PLGA纳米胶束的体外评价及在急性心肌缺血模型大鼠体内的组织分布[J].实用医学杂志,2019,35(6):868-873.
[17] 孙佰贺.叶酸靶向羟基喜树碱人血清白蛋白纳米粒的制备及抗肿瘤活性[D].哈尔滨:东北林业大学,2013.
[18] 曾俊芬,黄岭,鲁建武,等.肺靶向羟基喜树碱脂质体的制备及其在小鼠体内的组织分布研究[J].中国医院药学杂志,2016,36(16):1374-1379.
(收稿日期:2020-09-27 修回日期:2020-12-11)
(编辑:邹丽娟)
