腐殖酸对土霉素和土壤酶活性交互响应研究
2021-02-21仝玉琴
权 刚,仝玉琴,高 莹,张 洁,杨 迪
(咸阳职业技术学院,陕西 咸阳 712000)
土壤酶在土壤微生态活动中扮演重要角色,是土壤重要的有机组成成分之一,广泛参与土壤中各类生物化学作用,具有生物催化能力,如动植物和微生物等残骸的分解,土壤自身存在的腐殖酸的合成与生理作用等。土壤酶的生物活性反应了土壤生物化学过程的相对强度,如土壤过氧化氢酶、脲酶和磷酸酶全程参与土壤各类元素的生物化学反应及循环,属于土壤新陈代谢过程中的催化剂。土壤酶的活性对土壤外源物的影响较为敏感,尤其是污染物,一定程度对土壤酶的生物活性具有破坏性,反之,土壤酶的活性也能够反应土壤受到的污染情况。腐殖酸在农业上应用广泛,它可以刺激农作物的生理代谢,改善农作产品籽实质量,改良土壤结构,优化化肥各种个性,增强植物自身抗逆性。
课题组拟模拟土霉素污染土壤环境,设计不同浓度梯度,通过测定8个周期内土壤中过氧化氢酶、脲酶、磷酸酶的生物活性,分析研究土霉素对土壤污染情况下,土壤酶的生物活性受到的影响情况,探明抗生素土霉素对土壤中微观层面的生物效应,并尝试使用腐殖酸对土壤生态环境进行修复,探索对处理农林业生产及生态环境问题的方案。
1 材料与方法
1.1 试验材料
腐殖酸,由凯瑞斯农业科技有限公司提供。
土霉素,购于美国默克公司,分子量496.9。
供试土壤,采自咸阳职业技术学院生物技术实习基地,0~20 cm表层土壤。
1.2 实验方法
对采样土壤作自然风干处理,风干过2 mm筛后常态保存,供室内培养实验。试验前,调节供试土样含水量,按最大田间持水量40%为标准,装塑封袋内,放置生化培养箱中,作暗箱培养一周,培养温度25℃。
测定前,在土壤样品中加入土霉素溶液,模拟抗生素污染土壤,配置土霉素浓度梯度为:0.02、0.035、0.065、0.113、0.201 mol OTC L-1,土霉素实际含量为10、17.8、32.6、56.2、100 mg OTC kg-1,并设置空白对照。
将试验土样称取250 g加入烧杯中(500 mL),用蒸馏水调节试验土样含水量为最大持水量的50%,放置恒温培养箱中作暗箱培养,培养温度25℃。为了更大程度模拟自然环境,培养期间,可用差减法补充水分,并适当通气,保持土壤湿度与土壤活性。取培养时长第1天土样进行测定,测定土壤中过氧化氢酶、磷酸酶和脲酶活性,后期按照每隔一周的时长,连续测定8周。
1.3 项目测定
1.3.1 过氧化氢酶 采用滴定法测定。将待测土样过1 mm筛,用150 mL三角瓶称取5 g,加入蒸馏水40 mL,0.3%过氧化氢5 mL。同时设置空白试验,在150 mL三角瓶中注入等量蒸馏水和相同0.3%过氧化氢5 mL,但不加土样。置于往返式摇床上,振荡30 min,频率120次·min-1。振荡结束后,加入3N硫酸5 mL,待反应结束后,用致密滤纸过滤。取上层滤液25 mL进行滴定,用0.1N高锰酸钾(0.02 mol·L-1当量)滴定至微红色。
土壤过氧化氢酶的生物活性,用单位土重消耗的0.1 N高锰酸钾毫升数与对照组试验测定量的差表示。
1.3.2 脲酶 采用奈氏比色法测定。用250 mL带塞三角瓶称取5 g培养土样,滴入甲苯(抑菌作用)1 mL, 静置15 min使其充分反应, 再加入10%尿素溶液10 mL,pH6.7的柠檬酸盐20 mL,作为缓冲液,用手摇匀后,在恒温箱中培养,培养温度设定37℃,培养时长24 h。培养结束后,取上层滤液并过滤,将滤液3 mL置于50 mL容量瓶中, 加入苯酚钠溶液4 mL,0.9%次氯酸钠溶液3 mL, 充分摇匀,待显色20 min后, 用蒸馏水定容至50 mL。在分光光度计上578 nm波长比色测定。
土壤脲酶的生物活性,以培养24 h后每克土壤样品中所含的NH3-N的毫克数来表示。
1.3.3 磷酸酶(碱性) 采用磷酸苯二钠比色法测定。用称50 mL三角瓶称取待测土样5 g,加入甲苯5滴,再加0.5%磷酸苯二纳试剂20 mL,充分振荡后进行恒温培养,温度设定37℃,培养时长2 h。培养结束后,取上层液进行过滤,吸取滤液5 mL置于50 mL容量瓶中,加入pH9.8氯化铵-氢氧化铵0.25 mL,作缓冲液用,加入2%的4-氨基安替比林液0.5 mL,8%铁氰化钾0.5 mL,用手充分摇动后,用蒸馏水定容至50 mL。在分光光度计上于510 nm处比色测定。
磷酸酶的生物活性,以培养2 h后,每百克土壤样品中所含P2O5的毫克数来表示。
2 结果与分析
2.1 尿酶活性影响分析
土壤中的脲酶主要参与土壤氨氮的转化及形成过程,土壤营养物质的吸收转化过程,它的生物活性的高低反应了土壤的肥力水平,反之,也能够反应土壤受到污染的程度。从表1可以看出,供试土样第1天的测定结果显示,土壤脲酶的生物活性受到明显的抑制作用,土霉素浓度的越大,抑制作用越明显。分别为:3.6%、5.2%、7.8%、7.7%、9.0%。供试土样第7天的测定结果显示,第1周开始土壤脲酶的生物活性受到土霉素的影响最大,抑制程度最高。分别达到:4.2%、10.0%、26.5%、23.7%、23.4%。供试土样第14天的测定结果显示,第2周开始土壤脲酶的生物活性受土霉素的影响有所减小,抑制的情况开始下降。抑制率分别为:8.5%、10.1%、0.6%、3.5%、4.3%。供试土样第21天的测定结果显示,第3周后土壤脲酶受土霉素影响相比略有下降,整天表现仍为抑制作用。抑制率分别为:3.7%、2.7%、9.9%、1.9%、1.6%。供试土样第28天的测定结果显示,从第4周以后土霉素对土壤脲酶的生物活性不在抑制,表现为刺激作用,第28天的刺激效果分别为:3.0%、0.1%、0.4%、5.0%、4.9%。供试土样第56天的测定结果显示,土霉素对土壤脲酶的生物活性的抑制作用已不再存在,各浓度都显示刺激作用,刺激效果分别为:0.6%、4.9%、6.5%、4.0%、2.9%。由此可见,土霉素对土壤脲酶的生物活性的影响大致以第4周起程正太分布,前期主要表现为抑制脲酶生物活性,后期主要表现为刺激脲酶的生物活性。

表1 脲酶活性与土霉素浓度及培养时长试验结果
2.2 磷酸酶活性影响分析
土壤磷酸酶对于磷在生态环境中的循环起着非常重要的作用,在研究污染物对土壤酶的影响中是研究频率极高的一种酶。由表2可知,供试土样第1天的测定结果显示,土壤中磷酸酶的生物活性受到土霉素的刺激作用,尤其是最高浓度的土霉素对磷酸酶活性的刺激作用最强,达到了40.9%。供试土样第7天的测定结果显示,低浓度10 mg·kg-1、17.8 mg·kg-1两个梯度的土霉素使土壤磷酸酶的生物活性受到抑制,而高浓度的土霉素则刺激磷酸酶的生物活性,浓度越高,刺激作用越强烈。供试土样第14天的测定结果显示,低浓度10 mg·kg-1、17.8 mg·kg-1、31.6 mg·kg-1处理的土霉素对土壤磷酸酶的生物活性产生抑制作用,而高浓度56.2和100 mg·kg-1的土霉素对土壤磷酸酶的生物活性产生刺激作用,但不论是抑制作用还是刺激作用对磷酸酶活性的影响都不显著。到第21天所有处理下的磷酸酶活性均高于对照,其刺激情况与第3天情况相似。第28天的情况与14天相似。到56天所有土霉素处理磷酸酶活性均低于对照。土霉素对土壤磷酸酶活性的影响作用相对比较明显,抑制或刺激程度相对较高,前4周表现为刺激土壤磷酸酶的生物活性,以后则表现为强烈的抑制作用。

表2 磷酸酶活性与土霉素浓度及培养时长试验结果
2.3 过氧化氢酶活性影响分析
土壤过氧化氢酶是土壤植物微生物等进行呼吸作用,有机物生物化学氧化反应的关键参与者,它的存在,避免各生物反应过程中产生的过氧化氢对土壤及生物的危害作用,它的活性既表明土壤生物学特性,也能指示土壤污染状况。从表3可知,供试土样第1天、第7天的测定结果显示,土霉素对土壤过氧化氢酶的生物活性有明显的抑制作用,培养第1天和第7天抑制作用最强烈,且随着土霉素浓度的增加土壤过氧化氢酶的生物活性降低越明显。第1天的抑制率为:4.0%、5.3%、5.4%、6.5%、8.6%。第7天的抑制率为:2.6%、4.4%、5.9%、5.9%、7.0%。供试土样第14天的测定结果显示,第2周土壤过氧化氢酶的生物活性基本恢复到了空白对照水平。供试土样第21天的测定结果显示,从第3周起至培养结束,土壤过氧化氢酶的生物活性整体上都受到了抑制作用,但抑制作用不强烈,最高为3.3%。由此可见,各浓度梯度土霉素对土壤过氧化氢酶的生物活性影响较为明显,整体表现为抑制作用,但抑制程度不强烈。
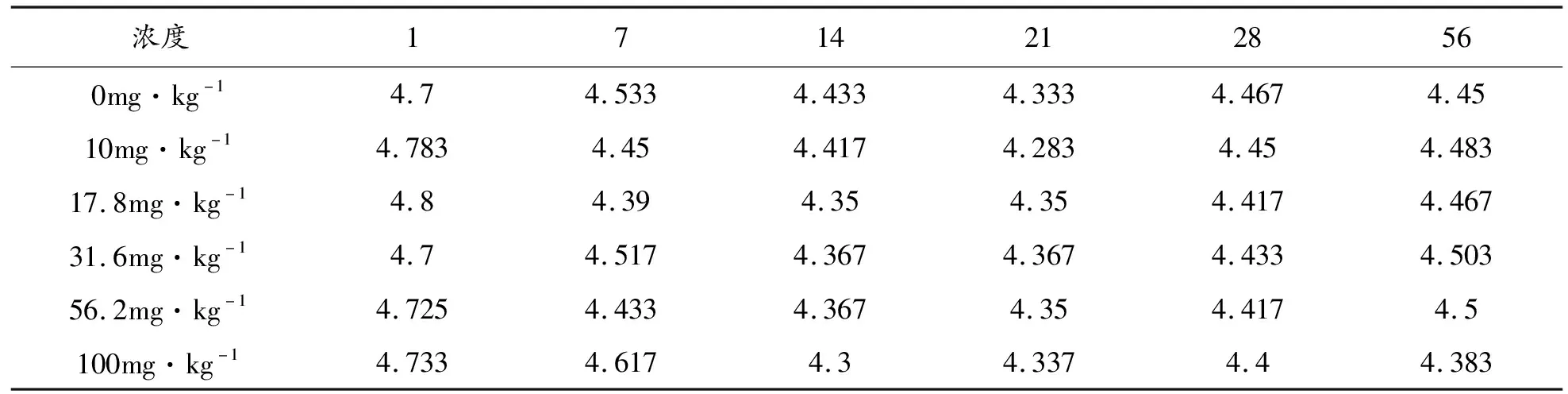
表3 过氧化氢酶活性与土霉素浓度及培养时长试验结果
3 讨论与结论
通过试验表明,腐殖酸对土霉素污染的土壤酶活性具有一定的刺激作用。在实验室控制条件下,通过模拟自然环境,测定了6个浓度梯度(含对照)土霉素对8周期内,土壤氧化氢酶、脲酶、磷酸酶活性的刺激与抑制情况。试验表明,土霉素对脲酶活性的影响程正态分布,具体表现为前期抑制,后期刺激。初步原因分析与土壤中微生物的生长,土霉素碳、氮源形式使得脲酶活性后期被激活恢复有关;对土壤磷酸酶表现较为复杂且持续时间较长,仅在第1天、第21天各浓度均表现为刺激作用,其余均表现为抑制作用;对土壤过氧化氢酶活性抑制作用较为明显,并随时间推移,抑制作用减弱。
研究表明,腐殖酸含有多种活性官能团,可以强化作物体内过氧化氢酶的活性,刺激植物生理代谢,具有催芽、增根等功能,能够刺激根系细胞组织分裂增长,促使植物根量增加,为植物生长提供充足的养分。腐殖酸与土壤中的微量元素能够形成促进植物子实生长的络合物以及螯合物,加强植物根系对糖分、淀粉、蛋白质及各种维生素的合成运转,加速各种初级产物在子实中转化积累。腐殖酸能够增强土壤团粒结构的形成,促进土壤中好氧细菌的活性,加快对有机质等营养物质的分解转化,提高植物对营养的吸收。腐殖酸中的羟基、酚基等官能团,能与有机化肥更好的作用,可以抑制土壤脲酶的活性,促进根系对磷元素的吸收利用,有利于根系和叶面吸收微量元素。腐殖酸有固液两相,表面活性交大,可增强植物抗旱、保水性,进而通过改变细胞膜渗透性等作用,提高植物吸收养分,减少病虫害。
关于腐殖酸在改良土壤环境及对修复抗生素污染土壤环境等方面的作用,我们认为具有很高的价值,在深入探索其影响机制及改良效果等方面亦将是课题组未来研究的主要方向,相关试验将在后期课题中继续开展。
