西安市大田土壤中抗药性烟曲霉发生率调查
2021-02-21许宁侠
崔 宁,王 培,许宁侠
(西安外事学院,陕西 西安 710077)
烟曲霉(Aspergillusfumigatus)是一种普遍分布在全球各地额腐生真菌,可作为分解者参与自然环境中的养分循环[1]。烟曲霉是曲霉属中重要的条件致病菌之一,对于免疫防御系统出现功能性障碍的病人,烟曲霉可沉积在肺泡等部位,从而引起过敏性、慢性或急性侵袭性曲霉病,仅侵袭性曲霉病患者的死亡率就高达40%~90%[2]。
自上世纪90年代以来,三唑类药物是预防和治疗人和动物曲霉病的主要药物如伏立康唑、伊曲康唑和泊沙康唑等,它们的使用使患者的生存率得到了显著的提升[3]。1997年,Denning等[4]首次报道了烟曲霉对三唑类药物产生了抗药性,他们从加利福尼亚一位长期接受伊曲康唑治疗的患者痰液中分离到了抗伊曲康唑烟曲霉菌株,自此有关烟曲霉抗药性被频繁报道。欧洲、美国、印度、中东、非洲和中国等地均已检测出抗性烟曲霉,烟曲霉对三唑类医药的抗药性现已成为全球的公共卫生问题[5]。
除了在接受或未接受过临床治疗的患者样品中分离出抗性烟曲霉,世界各地的环境样品中也频繁分离出抗性烟曲霉。近些年来,有研究报道指出病人体内的烟曲霉抗性菌可能来源于环境中三唑类农药的使用,而不是服用三唑类药物后在体内诱导产生。医用三唑类与农用三唑类化合物化学结构相似且作用机制相同,均为甾醇抑制剂,可作用于 14α-脱甲基酶,通过阻止麦角甾醇的生物合成达到杀菌的作用。因此本研究采集西安市周边大田土壤样品,分析土壤样品中抗药性烟曲霉的发生率及其相关机制,为曲霉病的预防与治疗提供相关的实际环境监测数据。
1 材料与方法
1.1 仪器
伯能CT90A全自动蒸汽灭菌器;知楚ZQZY-88CV全温震荡培养箱;Gilson移液枪PL系列(1 μL、10 μL、100 μL、1 mL);美菱DW-HL678超低温冰箱-86°C;WEALTEC GES核酸水平电泳槽;WEALTEC公司KETACX化学发光凝胶成像系统;美国伯腾Epoch超微量核酸蛋白定量仪;Beckman Microfuge20R微型冷冻离心机;Esco单人水平流超净工作台。
1.2 试剂
泊沙康唑(POC)(>99.9%),购自美国 Sigma-Aldrich 公司;伏立康唑(VRC)(>99.9%),购自德国 Dr.Ehrenstorfer GmbH 公司;伊曲康唑(ITZ)(>98.0%),购自德国 Dr.Ehrenstorfer GmbH 公司;氯霉素标准品(>98.0%)和柱式基因组DNA抽提试剂盒均购自于生工生物工程(上海)股份有限公司;马铃薯葡萄糖琼脂培养基,购自上海博微生物科技有限公司;RPMI-1640 培养基,购自美国 Sigma-Aldrich 有限公司;沙氏固体培养基,购自青岛高科技工业园海博生物技术有限公司。
1.3 土壤样品采集
2020年9月在西安市周边大田采集0~5 cm的表层土壤样品,用无菌塑料袋密封冰袋冷藏保存运回实验室,于4°C保存。
1.4 烟曲霉的分离和鉴定
取约3 g土壤样品于30 mL无菌生理盐水中,置于摇床震荡培养2 h,摇床条件设置为37℃、150 rpm。2 h取出后在无菌条件下吸取40 μL土壤悬浊液,涂布在含有100 mg·L-1氯霉素的马铃薯葡萄糖琼脂培养基平板上,将其放置于37℃培养箱中培养5 d。
挑取疑似烟曲霉分离物参照它们的颜色、形态等宏观特征,孢子分化等微观特点,以及是否能在48℃条件下生长等耐热性综合判定,并采用柱式基因组DNA抽提试剂盒提取疑似烟曲霉DNA,随后以基因组DNA为模板扩增菌株ITS基因片段,引物选择真菌ITS通用引物ITS1和ITS4。扩增序列委托通用生物系统(安徽)有限公司进行纯化与测序。测序得到的序列与NCBI数据库序列比对,实现对菌株的鉴定。
1.5 烟曲霉药物敏感性测定
采用美国国家临床实验室标准协会(CLSI,2008)推荐的M38-A2方案—微量肉汤稀释法测定ITZ、VRC和POS对烟曲霉的最低抑菌浓度(Minimum inhibitory concentration, MIC)。MIC值是培养48 h后真菌生长完全受到抑制的最低浓度。烟曲霉对伊曲康唑、泊沙康唑和伏立康唑的敏感性判断标准详见表1。
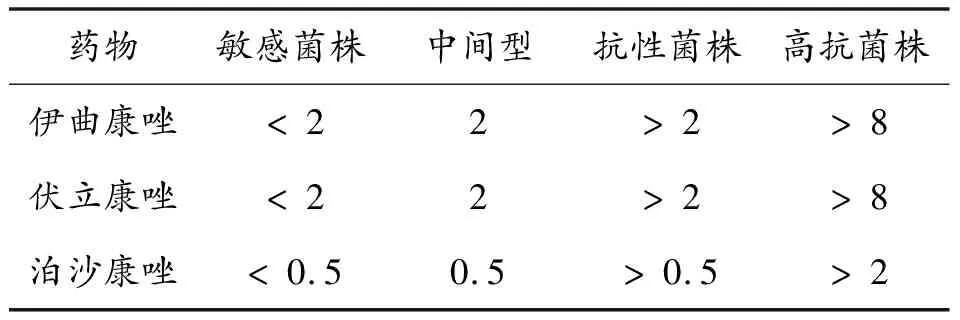
表1 烟曲霉对药物的敏感性水平 (MIC: mg·L-1)
1.6 烟曲霉cyp51A基因扩增及分析
按照1.4的方法进行烟曲霉DNA的提取。采用Ren等(2017)[6]提到的引物A7(TCATATGTTGCTCAGCGG)和P450-A2(CTGTCTCACTTGGATGTG)扩增cyp51A基因及其启动子序列。通过与GenBank序列号为AF338659的野生型烟曲霉cyp51A基因序列比较,确定菌株cyp51A基因是否存在氨基酸位点替换。
2 结果与分析
2.1 土壤中烟曲霉的分离率
本项目共收集西安市周边大田土壤样品36份,其中15份土壤样品中共分离出34株烟曲霉菌株,21份土壤样品中未分离出烟曲霉菌株,土壤样品中烟曲霉菌株的分离率为41.7%(表2),这与现有烟曲霉调查报道的数据一致。Cao等(2020)[7]对2014、2016和2018年三年杭州市部分医院绿化带周围采集到的59、68和64份土壤样品进行烟曲霉的分离和敏感性测定,结果表明这三年样品中分别分离到43、105和134株烟曲霉,分离率分别为45.8%、64.7%和62.5%。Ren等(2017)[6]采集了144份温室大棚土壤样品,其中58份样品可筛分离出烟曲霉菌株,分离率为40.3%。本实验中,土壤样品中烟曲霉的分离率为41.7%,结果表明烟曲霉广泛存在于西安农田土壤中。

表2 土壤样品在烟曲霉的分离率
2.2 土壤样品中烟曲霉抗药性
2020年9月西安市周边大田土壤样品中所分离出的烟曲霉抗性菌株对三种医用三唑类药物的MIC值详见表3。由表可知,本次分离出的34株烟曲霉菌株中共有2株(R-5和R-17)表现出三唑类药物的抗药性,抗性菌株占烟曲霉菌株总数的5.9%。其中菌株R-5具有对伏立康唑和伊曲康唑的交叉抗性,MIC值分别为8 mg·L-1和4 mg·L-1,但未表现出泊沙康唑的抗药性;菌株R-17具有伊曲康唑的高抗性,MIC值>16 mg·L-1,同时也对伏立康唑表现出抗药性,MIC值为4 mg·L-1,对泊沙康唑未表现出明显的抗药性。相较于泊沙康唑,环境中的烟曲霉更容易产生对伊曲康唑和伏立康唑的抗药性。Wang 等(2018)[8]在台湾2 760份空气和土壤样品中分离出451株烟曲霉,其中34株菌株至少对一种三唑类药物表现出抗药性,抗性菌株的分离率为7.54%。Cao等(2020)[7]在2014、2016和2018年杭州部分医院土壤样品中分离出的抗药性烟曲霉数分别为2、10和14株,对应的抗性菌株分离率分别为4.65%、9.52%和10.4%,抗性菌株分离率逐年上升。实验从土壤中分离出的抗性菌株占烟曲霉菌株总数的5.9%,表明西安周边大田土壤样品中存在抗药性烟曲霉,而这些抗性菌株对于临床治疗曲霉病将会带来更大的挑战。
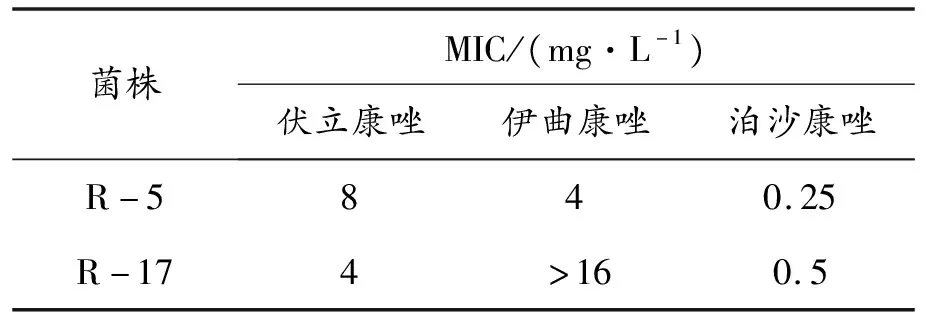
表3 抗性烟曲霉对三唑类药物的敏感性
2.3 抗性菌株cyp51A基因分析
在目前烟曲霉已报道的或可能存在的抗性机制中,cyp51A突变导致的三唑类药物抗性是最常见也是最主要的机制。为了阐明这些菌株的抗性机制,通过cyp51A基因的扩增、测序和比对,结果表明R-5抗性菌株无基因突变,菌株中可能存在其他抗性机制。Cui 等(2019)[9]用戊唑醇诱导用潮霉素基因标记的敏感烟曲霉菌株,其中HI-30和HI-36菌株分别诱导出了ITZ(MIC>16 mg·L-1)和VRC(MIC>16 mg·L-1)高抗药性,但cyp51A未检测出突变,荧光定量PCR结果显示两株菌株外排泵基因过量表达,抗性机制可能与此有关。
R-17菌株cyp51A基因存在TR34/L98H/S297T/F495I 型突变。cyp51A基因中唑类结合位点氨基酸的多态性会直接影响药物与酶的结合亲和力,进而使菌株获得抗药性。Mellado等(2004)[10]首次证明了烟曲霉cyp51A基因的突变与其抗药性相关,接着cyp51A基因各种抗性相关突变也被不断报道。Jensen 等人(2016)[11]从丹麦临床上分离出 1 098 株烟曲霉,其中 64 株具有抗药性且cyp51A基因带有 P216L、M220K、G54W 等突变;van der Linden 等人(2015)[12]在荷兰分离纯化出的 60 株菌株中有 47 株具有唑类抗性,并发现了 M220I、M220K/E317G、P381R/D481E、L77V/L399I/D481E、M220I/L319V、G54R、M220R、G54E、G54W、Q249H、L329V 等突变的存在;除上述已证实的与烟曲霉耐药性相关的热点cyp51A基因突变外,不断有新的突变类型被报道。其中,TR34/L98H被认为是最常见也是最主要的抗性突变之一[13]。
3 结论
目前不少研究指出农用和医用三唑类药物均可导致烟曲霉产生交叉抗药性。部分临床研究表明抗药性烟曲霉来源于土壤等自然环境,因此烟曲霉在环境中获得唑类抗性已成为一个值得重视的公众卫生问题。本研究调查了西安36份土壤样品,从中筛选到了2株抗药性烟曲霉,抗性烟曲霉的发生率为5.9%。其中R-17菌株cyp51A基因具有TR34/L98H/S297T/F495I 型突变。本项目的数据为曲霉病的防治提供相关理论依据。
