局部复发直肠癌的外科治疗进展
2021-02-19黄骁项建斌
黄骁 项建斌
直肠癌是常见的消化道的恶性肿瘤之一。据统计,2015年我国结直肠癌的发病率为28.20/10万,在恶性肿瘤中排名第三,死亡率则高达13.61/10万[1],术后复发和转移是其致死的主要原因,但尚缺乏有效的治疗手段。随着骨盆内的解剖学和医疗技术的发展,临床工作者们不断提出新颖的治疗方式,期待寻找到最佳治疗方案,但目前仍未有明确有效的治疗规范,这严重影响了患者的生活质量及生存期。本文综述了局部复发直肠癌(locally recurrent rectal cancer,LRRC)的预测因素、复发分类系统及手术治疗的新尝试。
一、局部复发的定义
LRRC是指通过根治性手术治疗直肠癌后,术野出现与原发性肿瘤有较高生物相似性的病灶,包括伴/不伴远处转移。局部复发部位包括吻合口及周围组织、骶前区、盆腔侧壁等,远处转移多出现在肝脏以及肺部。
随着全直肠系膜切除术(total mesorectal excision,TME)和围手术期放、化疗等治疗措施的开展,LRRC的发生率多已下降至10%以下[2-4]。但通过症状发现的LRRC多已发展至疾病晚期,临床处理棘手,患者预后较差,所以通过术后随访,早期发现复发是十分重要的,有复发危险因素的患者应加强定期随访。
二、LRRC的新预测因素
目前直肠癌局部复发的预测因素可分为肿瘤特征和治疗两方面。
多种肿瘤相关的特征与直肠癌的局部复发有关,临床上常使用的预测指标包括:原发性肿瘤的高T/N分期、黏液性直肠癌、下段直肠癌、肿瘤出芽、淋巴结转移、周围神经受侵犯、壁外静脉侵犯、术前血清CEA水平>6.0 ng/mL、放疗后肿瘤大小>10 mm等;为更准确预测LRRC的发生,Khan等[5]回顾以往文献中局部复发的独立预测因素后,综合T分期、N分期、黏液组织学、肿瘤距肛门的距离、环周切缘<2 mm、远端切缘阳性、淋巴血管受累、缺乏新辅助放疗等八个特征及其在各研究中的合并比值比(odds,ratio,OR),按照OR权重大小建立了目前第一套局部复发预测的评分系统,希望通过该系统识别高复发风险的患者,针对性的加强随访计划,该研究纳入文献质量较好,且多数研究是在亚洲国家进行,这使该评分系统更具代表性,但该系统仍需要在大量直肠癌患者中进行验证。一些研究者还致力于建立基于基因水平的复发预测模型,结直肠癌分型联盟[6]综合了已有6个基因分类系统提出包含4种亚型的CRC分类系统:CMS1(免疫微卫星不稳定型)、CMS2(染色体不稳定,WNT和MYC信号激活)、CMS3(以代谢失调为特征)、CMS4(转化生长因子-β活化,基质破坏和血管生成),其中CMS4型有着更差的总生存期和无复发生存期(OS:CMS4vs.CMS1,HR:1.55;CMS4vs.CMS2HR:1.94;CMS4vs.CMS3,HR:1.72。RFS:CMS4vs.CMS1,HR:1.77;CMS4vs.CMS2,HR:1.70;CMS4vs.CMS3,HR:1.74),CMS2型在肿瘤复发后有着更高的生存率,CMS1型复发后生存率较差(CMS4vs.CMS1,HR:0.60;CMS3vs.CMS1,HR:0.6;CMS2vs.CMS1,HR:0.35)。Lu等[7]通过微阵列荟萃分析确定了479个Ⅱ期结直肠癌复发相关基因,并根据其中26个基因建立了随机生存森林模型计算的风险评分系统,在其研究中根据该系统划分的高危组的复发风险明显高于低危组(HR:1.824,P=0.025)。Kamal等[8]发现肿瘤内浸润的自然杀伤(NK)细胞、巨噬细胞(M1和M2)、CD4+记忆激活T细胞等细胞均与肿瘤复发具有相关性,其中CD4+记忆激活细胞在四个数据集的联合分析中预测能力最强(HR:0.93,FDR=0.0001)。
治疗方案的选择与实施同样影响着直肠癌局部复发概率。手术联合新辅助治疗与辅助治疗被视为中下段进展期直肠癌治疗的金标准方案,缺乏新辅助治疗/辅助治疗是直肠癌局部复发的高危因素;新辅助治疗与手术治疗的间隔时间存有争议,九周以上的间隔时间被认为可以提高直肠癌患者术后的病理完全缓解(pCR)率及无病生存期(DFS),降低远处复发率,但对局部复发率无影响[9];而对于新辅助治疗后出现临床完全缓解(cCR)或pCR的患者而言,观察和等待(W&W)策略是否会增加患者局部复发的风险仍未形成共识,Pinto等[2]回顾了16例W&W策略和60例手术治疗患者的长期预后,发现两组在出现局部复发、远处复发、死亡三方面差异无统计学意义,这与以往的相关研究结果一致,但目前仍然缺少随机临床试验的证据证明该策略的有效性及安全性。某些直肠癌手术方式也被认为会增加局部复发的风险,经括约肌间切除术(intersphincteric resection,ISR)常作为低位直肠癌的保留括约肌的手术方式,但在日本的一项回顾性研究中发现,ISR的局部复发率明显高于低位前切除术组(11.5%vs.4.1%)、腹会阴联合切除术组(11.5%vs.7.5%),T3和T4期患者的局部复发率尤其高,因此应严格筛选行ISR的患者[3]。始于2010年的经肛直肠系膜切除术(transanal total mesorectal excision,TaTME)因自下向上进入直肠系膜平面的手术方式,改善了远端直肠的可视化,降低了CRM(+)的比例[10],迅速成为低位直肠肿瘤的热门手术方案。我国TaTME注册合作中心的一项大样本观察性研究报道了TaTME较优的短期结果:术后发生率为18.4%,完整TME率为81.9%,CRM阳性率为2.8%[11],相似的短期结果也在国际TaTME注册合作中心的报道中得到证实[12]。但目前对于TaTME的长期预后仍存在争议,Wasmuth等[13]报道了挪威7家医院的157例TaTME手术患者,其中3家医院在进行5例TaTME后放弃该术式,研究结果显示局部复发率为7.6%,累计2.4年的局部复发率为11.6%,且在早期随访中出现了与传统复发模式不符的盆腔多灶性复发,Wasmuth认为多灶性的复发模式可能与直肠内气体压力和长时间的手术操作了增加肿瘤细胞渗漏到盆腔的概率有关;此外,鉴于局部复发的病例平均分布于各个中心,特殊的复发模式也出现在较晚行TaTME的患者中,Wasmuth认为问题可能出现在技术本身,学习曲线并无显著的影响。基于异常的复发情况,挪威已决定禁止TaTME的应用;英国和爱尔兰结直肠病学协会也于2020年7月停止了TaTME的推广,建议只有具有合格的技术和设备的大容量中心才能继续提供TaTME[14]。但详细分析报道152例TaTME手术的研究中指出,数量最多的医院在4年内仅进行了57例手术,剩余95例分布于其余3家医院,而第一次TaTME国际培训研讨会建议为了达到TaTME手术的最佳质量,每年至少要在同一中心进行14例手术[15],挪威的医生可能并未克服学习曲线,13%的R1切除率也佐证了该观点。最近来自荷兰[16]、加拿大[4]的两项多中心研究报道的局部复发率(荷兰:6.6%;加拿大:3.6%)显著低于上述研究,且在加拿大的研究中13.6%的复发患者出现在前10例TaTME手术中,荷兰的研究中第1~10例TaTME手术3年的预计局部复发率高达14%,随着手术经验的增加,局部复发率可下降至6%以下,因此笔者认为TaTME术式的学习曲线对局部复发的影响是可能存在的;在关于TaTME安全性的更高级证据发表之前,一个明确的结构化培训是必不可少的,所有新加入术者均应接受严谨规范的培训,在取得培训合格证书后最初的几例TaTME手术应邀请有丰富TaTME经验的术者监督指导,帮助其安全度过陡峭的学习曲线期;且术者在TaTME术式的初期尝试阶段,应避免选择手术难度大的病例进行技术的锻炼,防止出现不良的手术结局。手术完成的情况同样影响着直肠癌局部复发的概率,环周切缘(CRM)阳性、远端切缘<10 mm、术中肿瘤穿孔、术后发生吻合口漏是增加局部复发风险的关键因素;以往的观念中,TME的质量在很大程度上会决定肿瘤的长期结果,但在一项大样本的Ⅲ期随机临床试验中发现术中行肠系膜内切除与行完整肠系膜切除在局部复发(HR:1.47,P=0.3)和远处转移(HR:1.34,P=0.08)方面差异无统计学意义[17]。
三、局部复发直肠癌的复发模式
R0(切缘阴性)切除仍是LRRC最重要的预后预测因素,目前国际上有多种LRRC分类方法用于预测LRRC的可切除性和预后,包括梅奥诊所从固定部位和固定点数两方面所提出F分类系统[18]、Yamada等[19]为了预测生存率所提出的分类系统等。临床上常用的分类包括Leeds[20]与MSKCC[21](纪念斯隆凯特林癌症中心)局部复发直肠癌分类,前者根据复发病灶在盆腔内的累及范围分类,后者分类的依据是复发病灶在盆腔内的位置和受累的结构,Leeds分类中的中央型包含了前向复发和中央复发(如表1)。目前没有任何分类方式是被证明优于其他分类方法的,所有的分类方法都是为了更加准确评估患者病情及预测手术的R0切除率,避免无意义的手术及防止因高估病情让患者失去手术治疗的机会。但每种分类都有其不足之处,例如梅奥诊所的分类依据仅从固定点数出发,并没有考虑到具体解剖结构的影响;Yamada、Leeds的分类模型仅是起源于小样本的回顾性研究;MSKCC的分类系统是于1998年提出,而那时新辅助放化疗和TME仍然没有在临床上普及,其分类系统有待完善。为了获得更好的预测R0切除及指导临床治疗的选择,2020年米兰癌症中心(NCIM)提出一种新的分类系统[22],其与Yamada分类系统相似,但充分考虑到盆腔具体解剖结构及不同程度骶骨侵犯的影响(如表2),进而提高了判断R0切除的可行性。Sorrentino等[23]利用其中心152位LRRC患者的R0/R+切除情况对梅奥诊所、MSKCC、Leeds、NCIM、Yamada等7种LRRC分类方式的优劣性进行了判断,结果提示R0切除仅与所有分类中的中央型复发有关,R+切除则与MSKCC分类中前向型(OR:2.66,P=0.007)、NCIM中的S2b(OR:3.50,P=0.04)、S3(OR:2.70,P=0.01)及其他分类中的骨盆侧壁复发有关;NCIM分类方式中4个分型(S1a,S1b,S2b,S3)与切缘状态显著相关,是对R0/R1切除最具预测性的分类。但该研究的不足是LRRC手术患者的筛选按照其中心所提出的NCIM分类方式进行的,这可能部分解释了NCIM分类系统对R0切除更好的预测效果。
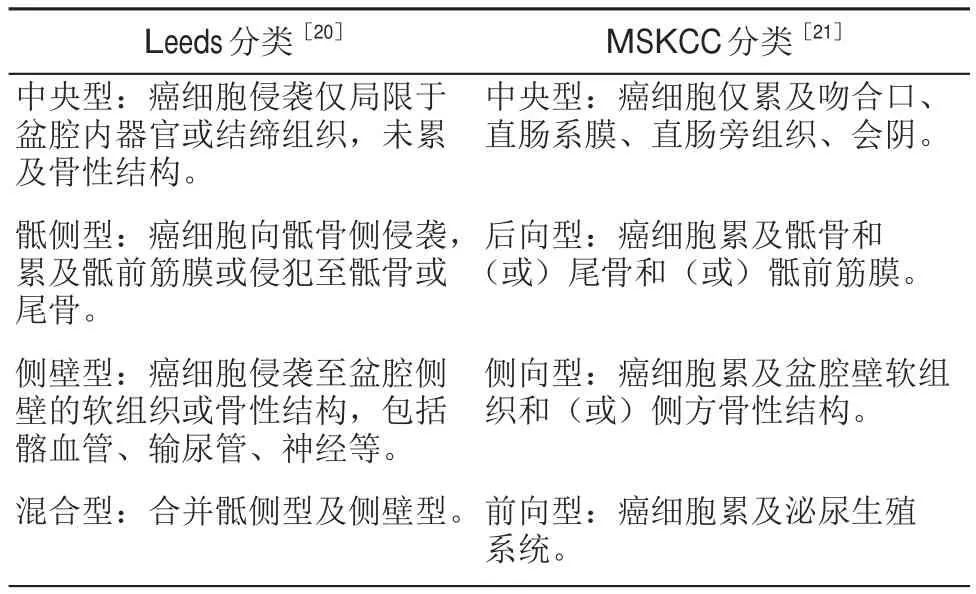
表1 Leeds与MSKCC局部复发直肠癌分类
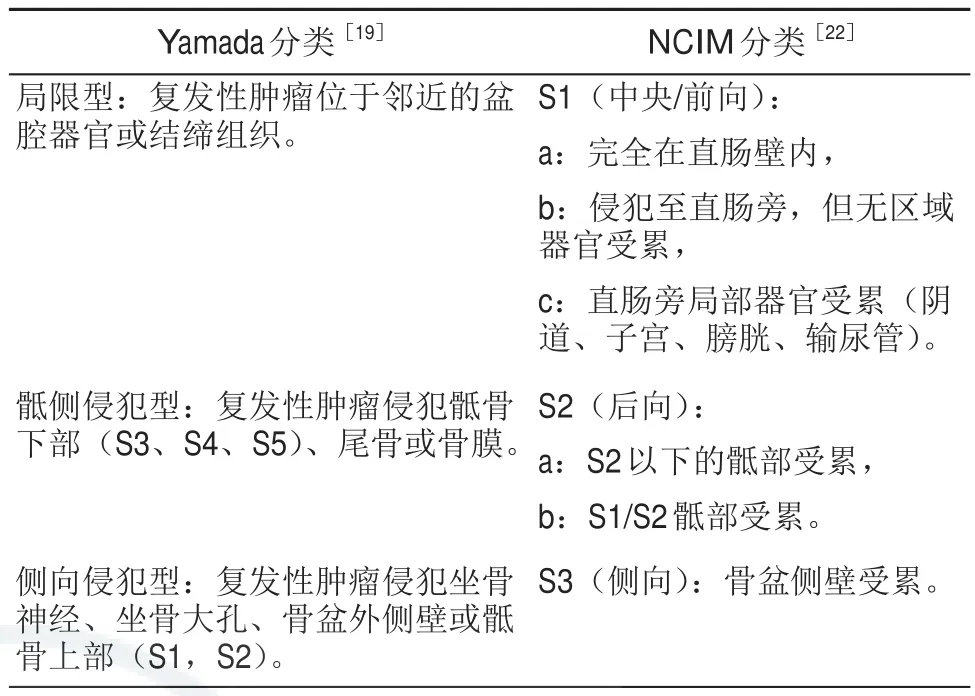
表2 Yamada与NCIM局部复发直肠癌分类
手术方式的进步与联合治疗的应用不仅降低了局部复发的概率,也使LRRC的分布比例发生了改变。在TME时代之前,最常见的是中央型LRRC;侧向型与后向型LRRC在联合治疗推广后出现的概率逐步升高[24];在接受TaTME治疗的患者中,则观察到了与传统手术不同的早期多灶性的盆腔侧壁复发。
四、局部复发直肠癌手术治疗的新尝试
目前,手术治疗仍是可实现R0切除的LRRC首选治疗手段。Cyr等[25]对52例LRRC手术患者进行了超长期的随访,中位随访时间为16.5年,发现手术后患者5年、10年和15年的疾病特异性生存率(DSS)分别为41%、33%、31%,若患者实现R0切除,其5年、10年和15年的DSS可达到58%、47%、44%,所以若患者没有绝对的手术禁忌证,都应该考虑手术治疗。目前主要的手术方式可分为根治性手术、扩大根治性手术和姑息性手术。根治性手术主要包括Miles手术、Dixon手术、ELAPE手术及Hartmann手术,适用于无脏器、盆壁浸润的局部孤立LRRC;对于累及泌尿生殖道的LRRC,若仅累及膀胱穹窿和阴道后壁等局部区域,在保证阴性切缘的情况下可在根治性手术的基础上联合切除部分器官;但若侵犯到膀胱三角、前列腺等,则需要考虑全盆腔切除术(total pelvic exenteration,TPE),但无需联合神经、血管或骨切除,R0切除率较高,术后并发症较少。对于向后侵犯至耻骨的LRRC,除传统的雷济厄斯腔(cave of Retzius)的手术入路外,有研究提出由会阴入路进行尿道切除联合不同程度耻骨切除的手术方式,其简化了背静脉复合体的处理且让术者可以在前下方获得更佳的手术切缘,该研究中R0切除率可达76%,5年OS为53%,30天内死亡率为0%,但由于手术的复杂性,有31%的患者因术后并发症进行了二次手术[26]。若LRRC累及骶骨,对于累及S2/3关节面以下骶骨的患者,应选择复发肿瘤与骶骨的根治性切除,而高位骶骨切除术由于常出现膀胱和肠道的神经功能障碍、盆腔脓肿、下肢活动功能受限以及脊柱稳定性等高危并发症而被列为相对手术禁忌证。但Milne等[27]研究发现高位骶骨切除术在R0切除率上与低位骶骨切除术差异无统计学意义(76%vs.71%,P=0.584),二者在严重或轻微术后并发症、神经系统并发症同样没有显著性差异;Dozois等[28]报道了梅奥诊所进行的9例经腹和骶旁联合入路的高骶骨切除术,所有患者都实现了R0切除且术后30天内死亡率为0%,5年OS达30%,3例患者分别在40个月、76个月和101个月后仍无疾病进展,虽术后并发症发生率较高,但主要与切口有关。尽管高骶骨切除术在一些大容量中心已被证实是安全可行的,但骶部神经根切除导致的神经功能缺失仍令人头疼,一些团队正在尝试新的高位骶骨切除术术式,Brown等[29]团队完成了一例局限性的高位骶骨切除术,其先进行后路入路阶段,后完成腹部入路阶段,仅切除受累骶神经节段,保留远端及对侧神经根,术后病理检查显示肿瘤完全切除,患者术后左侧S1-S2神经根完全麻痹,但右下肢运动功能正常,术后23天时可独立活动。对于累及骨盆侧壁的LRRC,由于手术常涉及输尿管、髂血管、坐骨神经等结构,常需进行外侧腔室全切除术,较难实现R0切除。但一些研究已经表明对涉及主要血管、神经结构的复发直肠癌行扩大切除或整体切除是安全可行且是利于患者的生存预后。Abdelsattar等[30]报道了梅奥中心12例涉及主动脉-髂轴的复发结直肠癌的手术方案,术者为了达到R0切除,进行受累血管的联合切除并对8位患者行血管重建;其中的11位患者接受了术中放疗,1位因广泛阴性切缘而免于放射治疗,他们发现30天内死亡率为0%,58%的患者实现了R0切除,4年总生存率和无病生存率达55%和45%;Peacock团队[31]连续对11例髂血管受累患者进行了血管切除与重建,其中8例是复发直肠癌,其30天内死亡率为0%,R0切除率达81.8%,仅1例患者出现严重术后并发症,中位生存时间为21个月;Brown团队[32]对33例坐骨神经或股神经受累的复发直肠患者进行了受累神经的联合切除,其R0切除率可达68%,5年生存率为41%,但神经切除术后康复时间显著延长,患者12个月时的物理生活质量才恢复至基线水平。
腹腔镜技术因其创伤小、术野清晰、放大等优势,目前已常规用于结直肠癌手术,一些团队正开展将其应用于LRRC手术中。Uemura等[33]在腹腔镜下使用Gigli线锯进行LRRC术中骶骨切除,术后病理显示达到R0切除,该方法减少了术中出血量且避免了骶尾部区域的额外切口。Hasegawa等[34]和Matsui等[35]分别尝试将腹腔镜与经会阴内窥镜联合应用于LRRC的联合脏器切除和骶骨切除术中,均实现了阴性切缘,该方法从腹部和会阴两入路操作,为术者提供良好的手术视野,降低术中出血和周围脏器损伤的可能,且有助于实现R0切除,但要求术者熟知盆腔解剖,可能具有陡峭的学习曲线,目前不做常规推荐。
五、小结和展望
直肠癌根治术后局部复发目前仍是结直肠外科所需面对的一大难题,随着外科技术的进步,手术治疗的适用范围不断被拓宽;新辅助放化疗、术中放射治疗、辅助化疗的联合应用提升了手术患者的R0切除率与术后生存期;低氧盆腔灌注化疗、I125粒子植入、热疗、射频消融、免疫治疗等常用于辅助治疗或姑息性治疗。因此,在治疗LRRC时,应当经过结直肠外科、泌尿外科、放疗科、化疗科、肿瘤内科等多学科的讨论评估,结合患者的具体情况,针对性地给出个性化方案,争取达到最佳的治疗结果。
