NOSES在低位直肠癌保肛手术中的临床观察
2021-02-19郭新宇刘茂希江波
郭新宇 刘茂希 江波
直肠癌是常见的消化道恶性肿瘤之一,低位直肠癌(距肛缘7 cm或距齿状线5 cm以下)约占全部直肠癌的60.0%~75.0%。随着经济和科技进步,经自然腔道取标本手术(natural orifice specimen extraction surgery,NOSES)做为微创外科重要组成部分凭借较少的创伤、疼痛、住院时间,腹壁美容等优点[1]为低位保肛提供了更多的选择。但NOSES一直面临无菌无瘤原则的争议[2],如吻合器抵钉座经肛门进入近端肠管、标本通过肛门取出是否存在肿瘤播散及血行转移等,且目前缺乏NOSES不同术式在低位直肠癌保肛安全性、肛门功能等方面的临床观察。为此本研究选择无淋巴结、癌结节及远处转移的早期低位直肠癌病例并接受外翻法(NOSES-Ⅰ式A法)和拖出法(NOSES-Ⅰ式E法)根治的资料展开探讨。
资料与方法
一、一般资料
回顾性分析山西省肿瘤医院结直肠肛门外科2017年1月至2019年4月收治的109例接受直肠癌根治手术且未行预防性造瘘患者的病例,包含一般资料、围手术期资料、病理结果、随访数据等。按术式进行分组:A组57例行腹腔镜下腹部辅助切口移除标本手术(Dixon);B组25例行经自然腔道取标本手术(NOSES-Ⅰ式A法),C组27例行经自然腔道取本手术(NOSESⅠ式E法,改良Bacon)。纳入标准:(1)术前经直肠指诊、肠镜、病理学等方式诊断为低位直肠癌,并符合手术适应证;(2)术后病理Tis-T3,N0,M0;(3)未行预防性造瘘。排除标准:(1)除外术前肛门内外括约肌功能异常,骨盆过于狭窄;(2)BMI≥30 kg/m2,肠系膜过于肥厚;(3)合并有其他系统的恶性疾病;严重的脑血管疾病,心肺、肝肾功能严重障碍,凝血功能障碍;(4)临床资料不全;(5)病理证明双源癌或存在癌结节;(6)不能正常配合治疗程序。
二、观察指标
(1)一般资料:性别、年龄、BMI、肿瘤距肛缘距离、T分期;(2)手术情况:手术时间、术中出血量、手术费用;(3)围术期情况:术后开始进食流食的时间、术后排气时间、术后留置导尿时间、术后引流管拔除时间、术后住院时间、术后镇痛药物使用时间;(4)术后病理学检查情况:术后病理标本的长度、淋巴结获取数目、肿瘤下缘距远切缘距离、环周切缘阳性例数、肿物长径、肿物宽径及厚度;(5)12个月及24个月肛门Vaizey量表评估肛门功能、2年无病生存期、局部复发率及远处转移率;(6)术后并发症情况。本研究获得山西省肿瘤医院医学伦理委员会批准(批准文号:202108),豁免知情同意。
三、手术方法
手术主要包括腹腔镜探查、内侧入路游离乙状结肠及直肠、高位结扎肠系膜下血管及清扫淋巴结、移除标本、重建肠管。五孔法建立气腹(14 mmHg)(1mmHg=0.133 kPa),于骶骨岬前方向上作切口切开腹膜,解剖肠系膜下动脉根部后,在距离根部1 cm处夹闭离断,并按同样方式处理肠系膜下静脉,自内向外游离结肠系膜,锐性分离盆壁筋膜与直肠固有筋膜间隙,直肠后方至尾骨尖平面,再游离两侧。三组手术在完成上述操作后进行标本取出及肠管重建。见图1。

图1 直肠癌根治腹部主要手术步骤。1A:游离乙状结肠粘连;1B:内侧入路骶前第一刀;1C:结扎肠系膜血管;1D:游离直肠
1.A组:距离肿瘤下端2 cm使用切割闭合器闭合肠管,于脐下5 cm行一长约5 cm的纵行切口,置入切口扩张器,卵圆钳取出近端直肠,距离癌肿上界7 cm横断肠管,置入吻合器抵钉座,于打结槽打结扎紧,送回盆腔。逐层关闭切口。腹腔镜下1 500 mL生理盐水冲洗腹腔,查无出血摆顺乙状结肠行直肠-乙状结肠端端吻合。见图2。
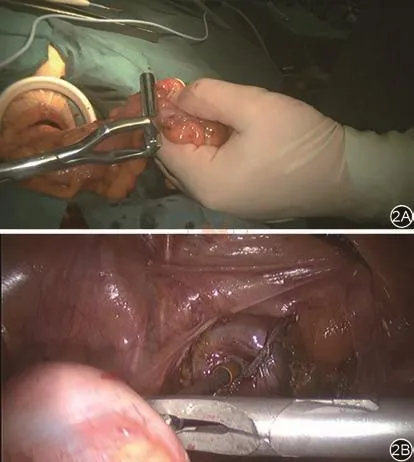
图2 Dixon经腹移除标本及吻合主要操作步骤。2A:经腹移除标本;2B:肠管吻合
2.B组:扩肛后碘伏水消毒肠管,经肛门置入无菌保护套,保护套上缘高于肿瘤上缘5 cm;将抵钉座在保护套内置入直肠肠腔,直至乙状结肠预切除线处;用直线切割闭合器切断乙状结肠,并将抵钉座留在乙状结肠近端肠腔;卵圆钳经肛门置入切缘远端抓持直肠残端将标本轻柔翻出体外;直视下使用切割闭合器将直肠远端切断,并将直肠残端还纳回盆腔;将抵钉座连接杆从乙状结肠切缘处中取出;经肛门置入圆形吻合器,吻合乙状结肠-直肠残端。见图3。

图3 NOSESⅠ式-A法移除标本及吻合主要操作步骤。3A:将远端肠管外翻于体外移除;3B:肠管吻合
3.C组:采用缝线将肛门外展,在肿瘤下方1 cm处荷包缝合肛门,在白线上方剥除肛管黏膜或齿状线附近打开肠壁向上游离,保留肛门内括约肌,自肛门将游离肠段向下拖出。肿瘤上方7~10 cm处切断肠管,肛门处外留3~5 cm肠管,周围缝线固定3~4针,冲洗盆腔,留置引流管。见图4。

图4 NOSESⅠ式-E法移除标本及二次肛门成形主要操作步骤。4A:充分暴露肛门;4B:移除标本后拖出肠管固定;4C:二次成型后外观
四、统计学方法
数据应用SPSS 22.0行统计学处理,符合近似正态分布的计量资料用均数±标准差(±s)描述,三组比较采用单因素方差分析检验,若P<0.05则利用Scheffe检验进一步进行组间两两比较;不符合正太分布的资料则采用四分位数描述,Kruskal-Wailis H检验。计数资料采用频数和百分比描述,采用卡方检验进行检验。采用Kaplan-Meier方法分析不同手术方式和肿瘤分期对术后无疾病生存期的影响。P<0.05时表示差异具有统计学意义。
结 果
一、一般资料
三组手术患者一般资料中BMI在B组最低(F=9.62,P<0.05),A组与C组差异无统计学意义;C组肿瘤下缘距肛缘距离最近(F=18.77,P<0.05),A组高于B组但差异无统计学意义,见表1。
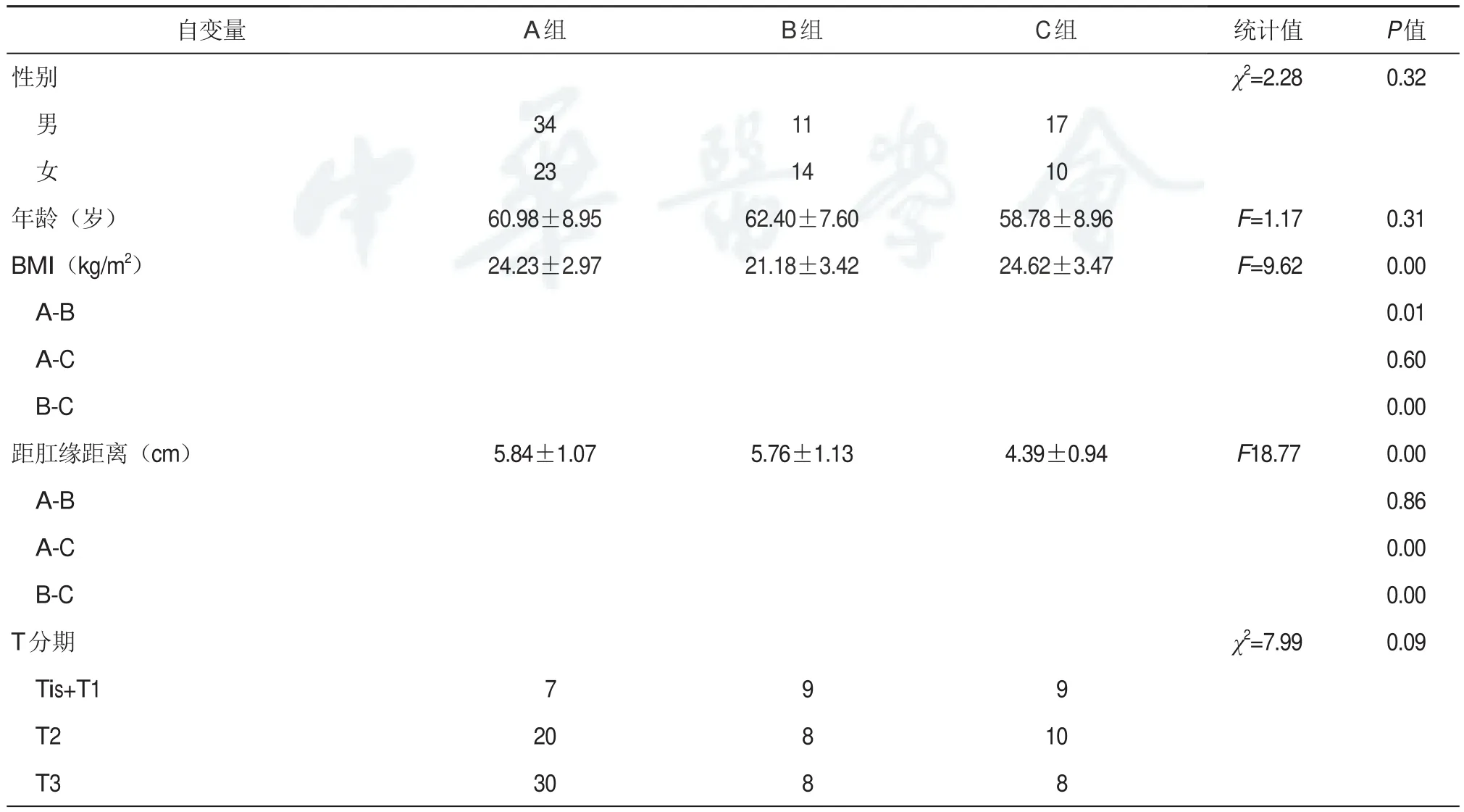
表1 一般资料
二、围手术期指标及病理情况
围手术结果:B组与C组在开始进食时间方面与A组差异无统计学意义(F=8.07,χ2=5.34;P>0.05),但C组优于B组;导尿时间与拔除引流管时间C组明显优于其他两组(χ2=7.59,F=7.48;P<0.05),A组与B组差异无统计学意义(P>0.05)。住院费用方面C组有4例Bacon术后未办理出院行二次肛门成形手术,排除该4例后住院费用为3组中最少(F=9.51,P<0.05);余围手术期指标3组间差异均无统计学意义(P>0.05)。3组病理情况:标本长度(F=4.13,P>0.05)、淋巴结个数(F=0.21,P>0.05)、肿瘤距下切缘距离(F=2.23,P>0.05)、肿物长径(χ2=3.51,P>0.05)、肿物宽径(χ2=5.09,P>0.05)及肿物厚度(χ2=3.06,P>0.05)差异均无统计学意义,见表2。

表2 围手术期及病理情况
三、随访情况
肛门功能评估以门诊复查、电话回访等方式随访,随访频率为一年;随访终点事件为失访、复发及死亡。A组1例术后1年造口还纳,1例1年后吻合口穿孔造瘘;C组1例肛门狭窄永久造瘘。术后12个月3组肛门功能Vaizey量表评分A组及B组优于C组(χ2=12.04,P<0.05);术后24个月3组肛门功能评分差异无统计学意义(χ2=5.04,P>0.05),见表3。

表3 回访情况
四、肿瘤学预后结果
本研究随访过程中无局部复发病例,6例发生远处转移。所有研究对象总体2年无病生存率为94.5%,A组、B组和C组无病生存率为94.7%,96.0%和88.9%(χ2=1.36,P>0.05),见图5;Tis+T1、T2和T3组无病生存率分别为95.8%、94.7%和91.5%(χ2=0.64,P>0.05),见图6。所有患者2年远处转移率为5.5%,A组、B组和C组远处转移率分别为4.6%,4.0%和11.1%(χ2=2.19,P>0.05),见图7;Tis+T1、T2和T3组远处转移率分别为 4.2%,5.3% 和 6.5%(χ2=0.17,P>0.05),见图8。
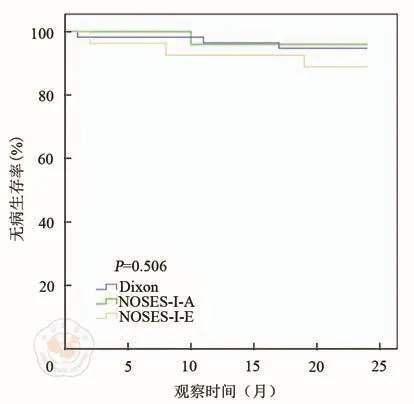
图5 不同术式无病生存期比较

图6 不同肿瘤分期无病生存期比较

图7 不同术式远处转移率比较

图8 不同肿瘤分期远处转移率比较
五、术后并发症情况
本研究中吻合口漏发生率B组较A组高(24.0%vs.19.3%);吻合口漏确诊后高龄或一般情况差者行二次造瘘手术。A组1例高龄患者因吻合口漏合并腹腔感染死亡,余所有患者健在。C组发生外置结肠坏死及结肠脱垂各1例,术后1年余A组发生切口疝及吻合口破裂各1例,三组间并发症发生率差异无统计学意义(χ2=0.48,P>0.05),见表4。

表4 术后并发症情况(例)
讨 论
NOSES理念的兴起在低位直肠癌根治中极大提高了保肛率与此同时满足了美容需求[3],减少了腹壁并发症的发生[4],但充分的评估新技术的安全性和患者潜在获益情况是对其最好的检验。本研究中患者的一般资料方面BMI和肿瘤距肛缘距离在3组中差异有统计学意义(P<0.05),间接表明BMI和肿瘤距肛缘距离与手术方式有关,B组(A法)与C组(E法)入组患者符合专家共识。围手术期方面B组与C组在住院费用、开始进流食时间与A组差异无统计学意义(P>0.05),但C组优于B组(P<0.05),这表明E法具有无吻合口漏风险可早期进食的优势;导尿时间与拔除引流管时间C组优于其他两组(P<0.05),可能与E法无吻合口、进食早有关。Park等[5]和Rahbari等[6]报道国外吻合口漏发生率3%~23%,国内报道吻合口发生率约3.8%~15%[7],本研究B组吻合口漏发生率(24%)较A组19.29%高,与关旭等[2]报道的NOSESⅠ式A法吻合口漏发生率高一致,这可能是由于入组患者均为低位直肠癌[8]且未采取预防性造瘘、样本数量较小、手术难度大以及研究对象涵盖术者在NOSES学习曲线早中期阶段病例等原因有关。有学者指出行Bacon术后患者括约肌功能不佳,控便能力难以达满意效果,据刘李等[9]、罗学来等[10]研究,Bacon术后约6个月后患者肛门功能逐渐改善,12个月后与Dixon组无明显区别,这与本研究12个月肛门功能评分有所出入,可能与E法组患者肿瘤距肛缘距离较近(P<0.05),切除肛门内括约肌较多有关。A组与B组患者肿瘤距肛缘距离较远,故术后肛门功能恢复较快,至术后24个月三组间肛门功能评分差异无统计学意义(P>0.05)。根据本研究三组病例0例局部复发,三组患者2年远处转移率和无病生存期差异无统计学意义(P<0.05),结合入组患者病理学已排除淋巴结、癌结节阳性和脉管、神经侵犯,本研究暂不考虑取标本过程中存在挤压引起肿瘤细胞引发血行转移,但由于本研究患者数量较少,这一结果仍需大样本研究。
众所周知,低位直肠保肛手以及远端直肠肠管的切除离断具有很大难度,尤其是骨盆狭小的男性患者。NOSES-Ⅰ式A法通过远端直肠标本外翻至体外,术者在直视下完成直肠远端肠管的切除离断,其在低位保肛手术中可克服Dixon术中肿瘤下缘位置判定困难的优势十分明显。与Dixon手术相比,这种操作方式更加直观,但肿瘤位置、肠系膜肥厚程度要求更加严格。NOSES-Ⅰ式E法本身优势在于肿瘤距肛缘小于5 cm、无吻合口漏风险、无法实现双吻合器吻合等情况下实现极限保肛。其与肿瘤位置较高可行双吻合器吻合的术式相比肛门功能恢复可能无突出优势,但作为低位直肠癌保肛的备选术式[11]与传统的腹会阴联合切除术(abdominoperi⁃neal resection,APR)相比,避免了腹部永久造瘘,极大改善了患者生活质量。需要注意的是Bacon术后吻合口的良性狭窄[12],扩肛训练应在瘢痕牢固后及早开展,减轻瘢痕挛缩。近年有学者提出Bacon手术肛门一次成型[13],这虽然避免二次手术,但肠管回缩是Bacon手术始终绕不开的并发症,这关乎手术成败[14]。Bacon的吻合方式是独立于手工吻合及吻合器吻合的炎性粘连,术后过早外置结肠坏死脱落或者肛门一次成型有可能粘连回缩进而引起腹腔感染,必要时需二次手术。三组间并发症率无统计学差异加之A法与E法围手术期安全性及良好肿瘤学预后表明在低位保肛应用中NOSES不劣于腹腔镜Dixon手术。
综上,在低位直肠癌根治保肛手术高度发展的今天,外科医师应该清醒认识到由于客观条件局限,如骨盆大小、肿瘤位置、患者身体状况等,每种手术各有优缺点,并无完美术式,只有更适合的术式。虽然NOSES有“微创中的微创”的美誉,完整保留了腹壁功能的同时极大提高了就医体验,但其在低位保肛中操作相对复杂[15],应足够重视系统化操作和学习曲线的积累。在术式选择方面低位直肠癌保肛术式繁多,具体选用何种术式才能使患者受益最大化,术者应严格依据适应证和自身经验决定,切勿依赖个人喜好,避免术中及术后不必要的麻烦。笔者关于NOSES术后吻合口漏预防的经验:较早充分肛门准备、术中吻合口血运线观察(必要时缝合加固)及术后排便次数管理对降低吻合口漏风险至关重要。
