列线图预测同时性转移结直肠癌患者的生存并构建风险分级系统
2021-02-19刘恩瑞关旭郭雅琪魏然马晓龙姜争刘正陈瑛罡王锡山
刘恩瑞 关旭 郭雅琪 魏然 马晓龙 姜争 刘正 陈瑛罡 王锡山
结直肠癌(colorectal cancer,CRC)是最常见的恶性肿瘤之一,在所有恶性肿瘤中发病率(10.2%)排名第三,死亡率(9.2%)排名第二[1-2]。在东欧、拉丁美洲和亚洲国家,结直肠癌的发病率和死亡率逐年上升[3]。结直肠癌早期无明显症状和体征,超过五分之一的患者确诊时已发生远处转移[4]。在结直肠癌中,同时性转移比异时转移的生存率更低[5]。CRC最常见的转移器官是肝和肺,骨转移罕见,只有1%的CRC发生脑转移[6-7]。虽然转移性结直肠癌(metastatic colorectal cancer,mCRC)预后最差,但不同转移器官的生存结果存在巨大差异。肝和肺转移的1年生存率超过80%,而骨和脑转移的1年生存率分别为30%和11%[8-10]。因此,准确筛查不同的风险对于医生预测mCRC预后至关重要。
目前,美国癌症联合委员会(American Joint Committee on Cancer,AJCC)分期系统是预测mCRC患者生存结局的主要方法[11]。然而,T分期(tumor)、N分期(node)、M分期(metastases)是区分不同预后的唯一依据,该方案在预测准确性方面远不能令人满意[12]。
列线图是一种可视化的图形工具,用于预测终点发生的概率,并量化生存风险。根据回归系数的不同,列线图可以纳入显著性因素,提高预测精度。迄今为止,列线图已成功地用于预测结直肠癌的预后,但很少用于mCRC。
因此,我们的目标是建立一种新的列线图模型来预测同时性mCRC的肿瘤特异性生存期(cancerspecific survival,CSS),并将其划分为不同的风险级别,以准确评估预后。
对象与方法
一、研究对象
本研究通过SEER*Stat软件(8.3.6版)从美国国家癌症研究所的SEER项目中获取所有数据。数据的收集和报告使用数据项目和代码由北美中央癌症登记协会记录[13]。纳入标准:(1)患者在2010~2015年诊断为结直肠癌;(2)患者确诊为同时性转移;(3)组织学确诊。排除标准:(1)未发现远处转移的患者;(2)资料缺失不详者:种族、原发肿瘤部位、T分期、N分期、CEA状态、手术状态、生存时间。
收集以下变量:种族、性别、诊断年龄、原发部位、分级、T分期、N分期、CEA状态、远处转移状态(肝、肺、骨、脑)、手术(原发肿瘤切除)、化疗、CSS和生存时间。CSS是通过1年、2年和3年生存率评估的,CSS定义为从诊断日期到死亡或因CRC导致的研究截止日期的时间。分期依据第八版AJCC TNM分期系统。
二、统计学方法
所有符合条件的病例被随机分为训练组和验证组(比例为7∶3)。Pearson卡方检验用于检验所有队列、训练队列和验证队列之间的人口统计学差异。采用多变量Cox比例风险模型探索CSS的独立危险因素,并利用训练队列建立预测列线图模型。采用一致性指数(C-index)、校准曲线和决策曲线分析(decision curve analysis,DCA)进行内、外验证。
利用X-tile软件,根据列线图总分确定最佳临界值建立风险分级系统,将所有患者分为低、中、高危组。构建了CSS的Kaplan-Meier曲线,并用对数秩检验进行比较。采用SPSS 21.0统计软件进行统计分析(IBM SPSS Statistics for Windows.Armonk,NY:IBM Corp.),GraphPad Prism 6(GraphPad Software),X‐tile软件(Yale University),and R统计软件3.6.2(www.r-project.org/)。以P<0.05被认为差异有统计学意义。
结 果
一、人口基线信息
根据纳入标准,本研究共纳入符合纳入条件的15 838例患者,其中11 088例(70.0%)患者随机分配到训练队列,4 750例(30.0%)患者随机分配到验证队列。本研究人群的人口统计学特征见表1。
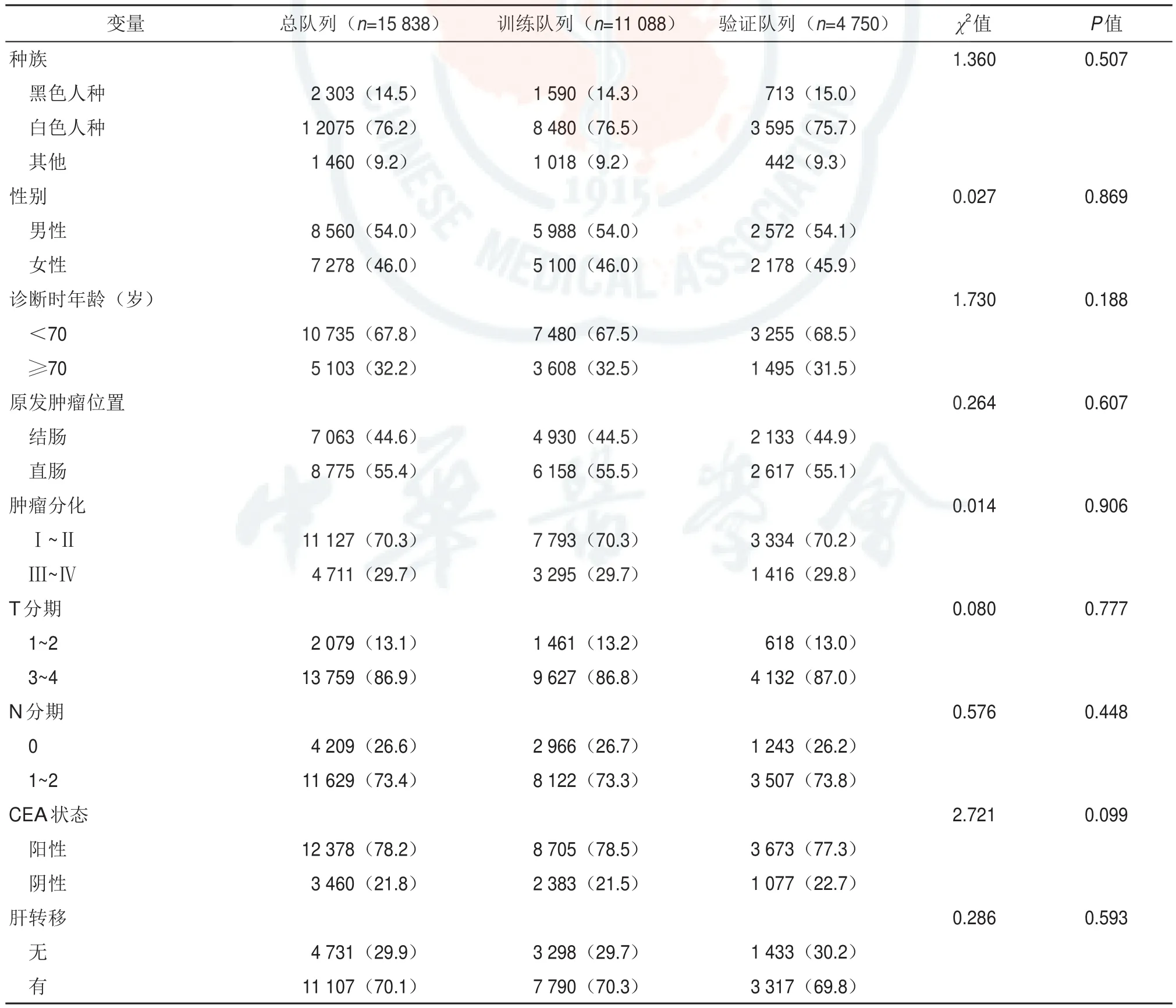
表1 人口统计学特征[例(%)]
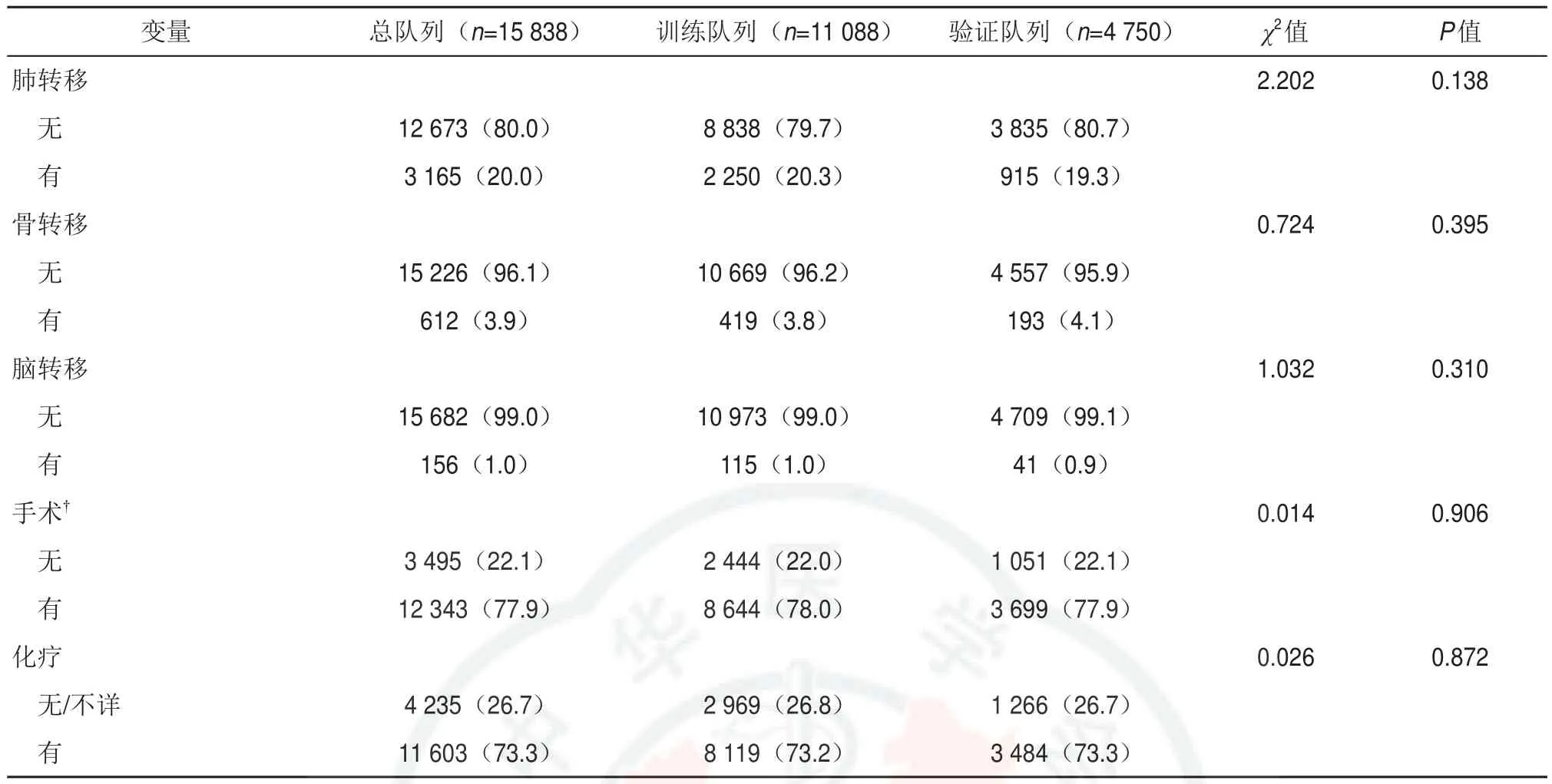
续表
本研究中男性8 560例(54.0%),女性7 278例(46.0%),其中白人居多(76.2%),T3~4期13759例(86.9%),N1~2期11 629例(73.4%),CEA阳性(78.2%)。远处转移在肝、肺、骨、脑的发生率分别为 11 107(70.1%)、3 165(20.0%)、612(3.9%)、156(1.0%)。12 343例(77.9%)患者接受手术,11 603例(73.3%)患者接受化疗。训练队列与验证队列之间各变量间差异无统计学意义(P>0.05)。
二、预测因素确定
采用Cox比例风险模型识别CSS的独立风险因素。多因素分析显示,训练队列中的独立危险因素为种族、诊断年龄、原发部位、肿瘤分级、N分期、CEA状态、肝转移、肺转移、骨转移、脑转移、手术和化疗(表2)。
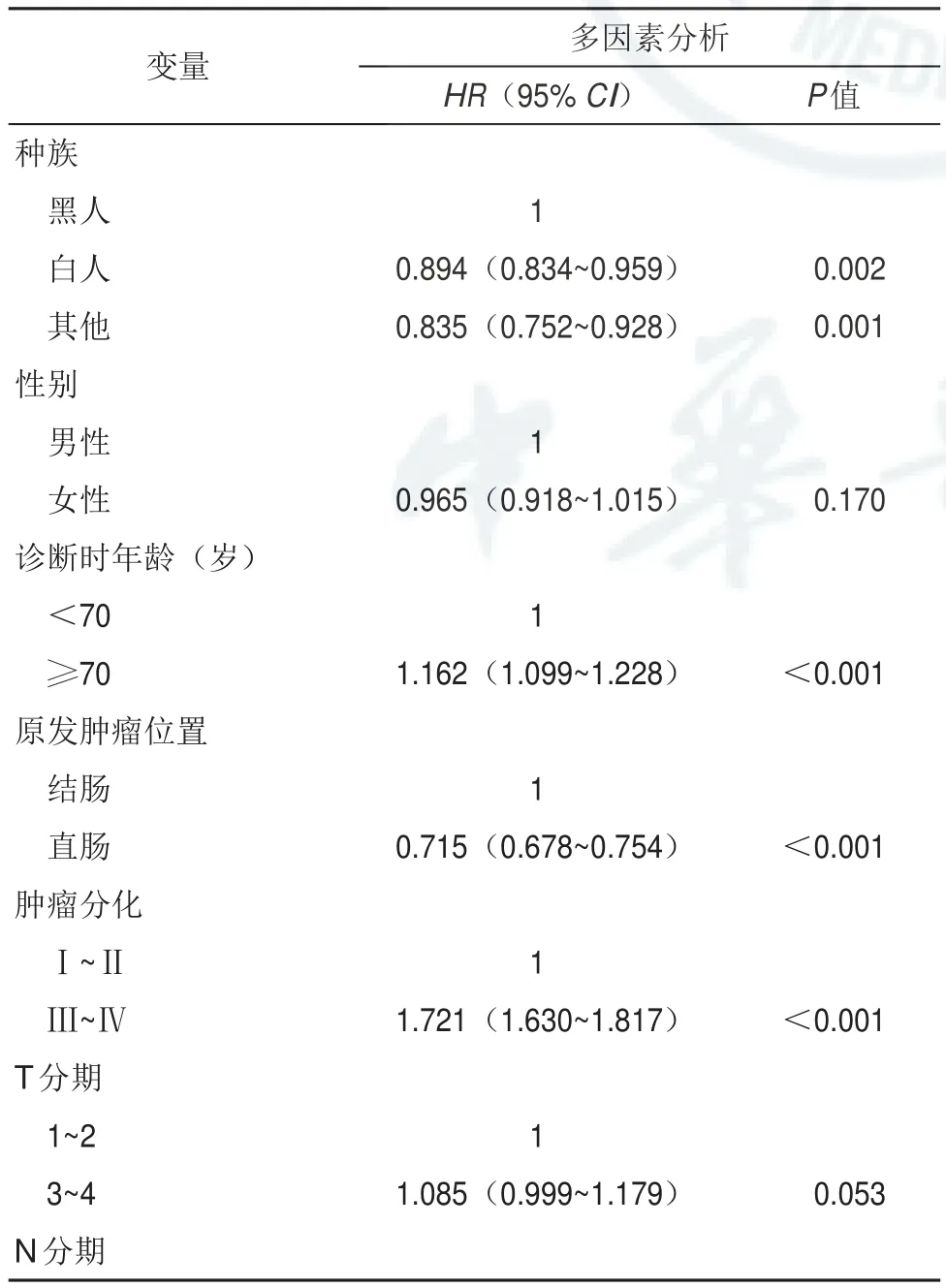
表2 基于训练队列的COX多因素分析

续表
三、列线图的建立与验证
基于CSS的显著风险因素,建立CSS的预测列线图模型(图1),训练队列的回归系数和估计值如表3所示。通过内部和外部验证来评估这个列线图。该列线图的C指数为0.718(95%CI:0.712~0.725),验证队列的C指数为0.722(95%CI:0.711~0.732),表明良好的鉴别能力,且优于TNM分期(C-index:训练集,0.533,95%CI,0.525~0.540; 验 证 集 , 0.524, 95%CI,0.513~0.535)。CSS的校准图显示了训练和验证队列的预测值与实际值之间良好的一致性,bootstrap抽样1 000次(图2)。DCA曲线显示了不同时间点的大部分阈值概率之间的巨大净收益,表明预测CSS具有良好的潜在临床效度(图3)。
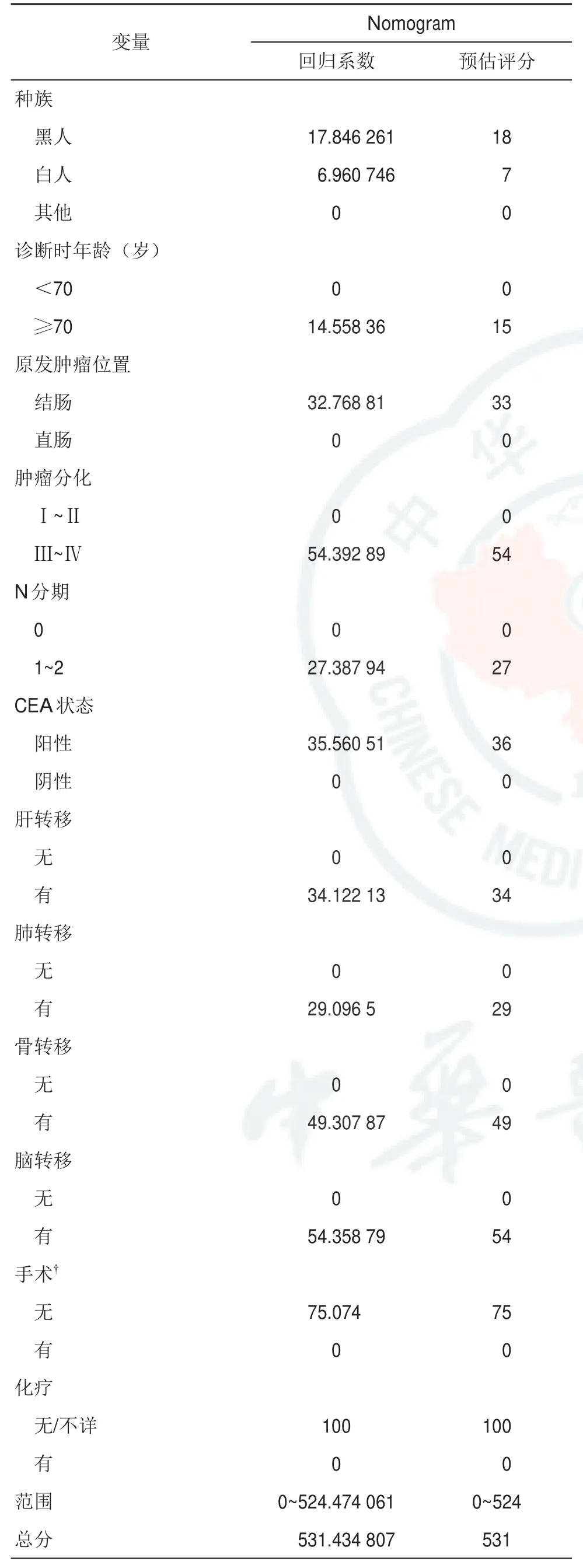
表3 基于训练队列构建Nomogram预测模型的回归系数和预估评分
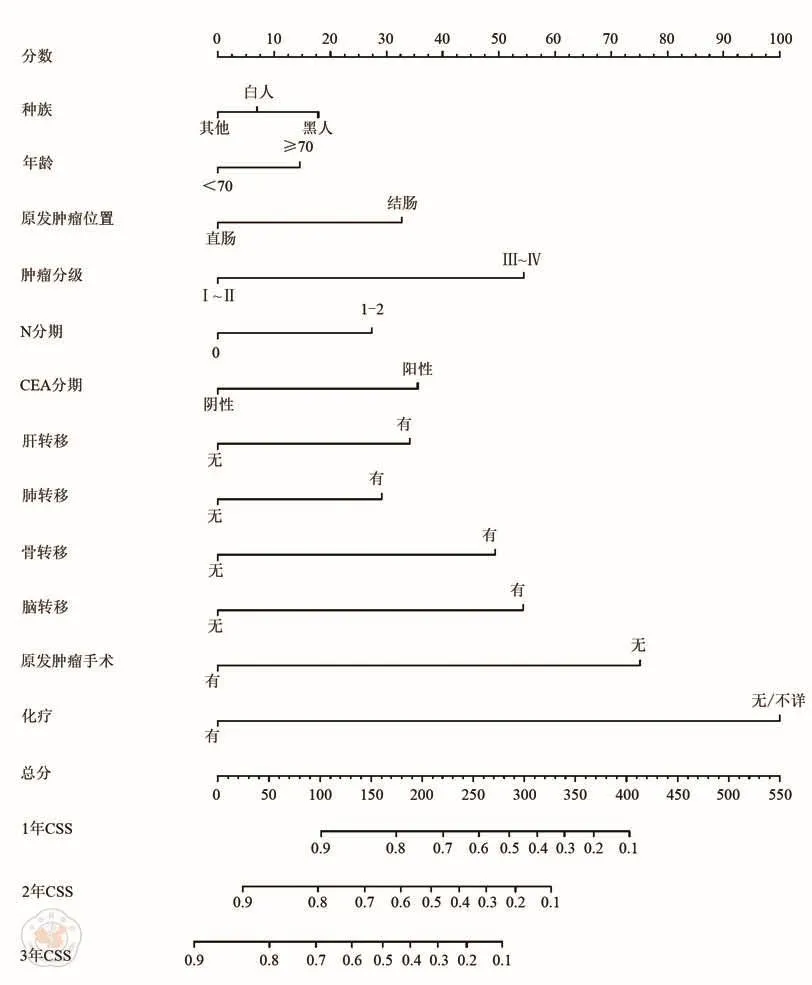
图1 列线图预测转移性结直肠癌患者的肿瘤特异性生存(CSS)
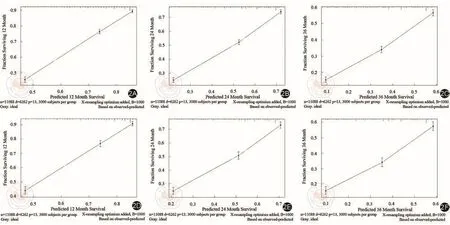
图2 基于mCRC患者CSS的校准曲线。2A~2C:基于训练队列1年,2年和3年CSS的校准曲线;2D~2F:基于验证队列1年,2年和3年CSS的校准曲线
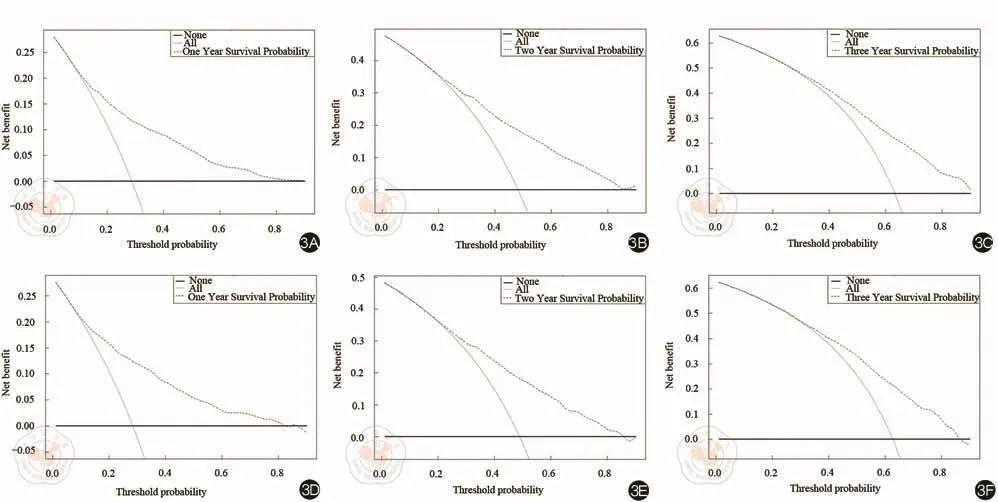
图3 列线图模型预测mCRC患者CSS的临床决策曲线。3A~3C:基于训练队列1年,2年和3年CSS的临床决策曲线;3D~3F:基于验证队列1年,2年和3年CSS的临床决策曲线
四、风险分级系统建立
此外,利用X-Tile软件确定最优截断值并建立风险分级系统(图4)。将所有患者分为低风险(5 852/11 088,52.78%,分数:0~164)、中风险(3 487/11 088,31.45%,分数:165~247)和高风险(1 749/11 088,15.77%,分数:248~524)。理论上,总分数的范围为0~524。Kaplan-Meier曲线表明,该风险分级系统对不同组的CSS具有良好的分层和区分能力(表4和图5)。
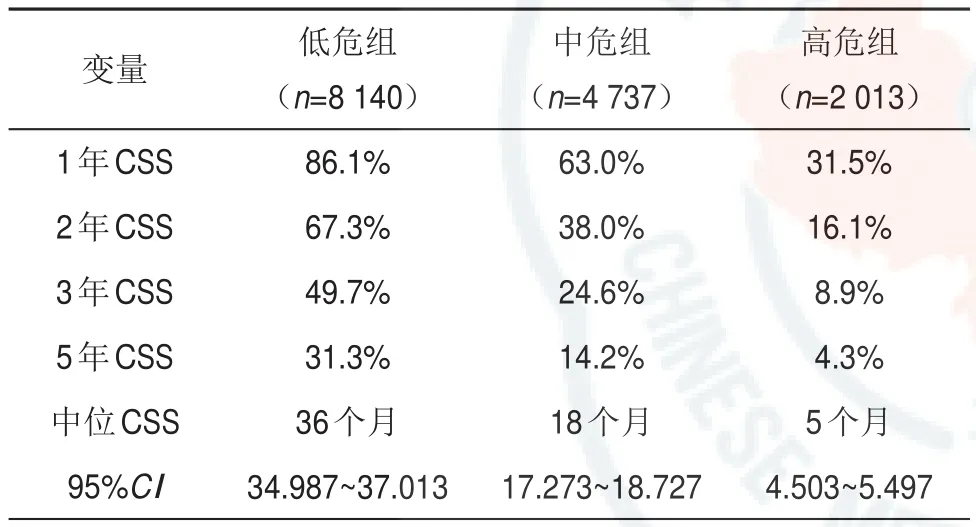
表4 基于总队列分析不同风险等级患者的肿瘤特异性生存率

图4 利用X-tile软件计算最优截断值并建立风险分级系统。4A~4B:预测总分数的最优截断值,低危组(评分:0~164),中危组(评分:165~247),高危组(评分:248~480);4C:根据训练队列的CSS绘制不同风险等级的Kaplan-Meier曲线
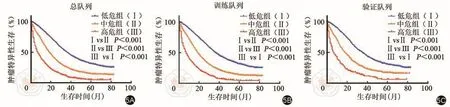
图5 根据总队列的CSS绘制不同风险等级的Kaplan-Meier曲线。5A:总队列;5B:训练队列;5C:验证队列
讨 论
mCRC的预后明显差于非mCRC。不同病例的mCRC死亡率差异很大,提示在AJCC分期系统的基础上对准确的风险级别进行重新分类的重要性和必要性。然而,现有的预测模型由于纳入因素的限制,缺乏个体化和综合评价,且大部分研究样本量小,也限制了其普遍适用性。本研究开发了一种新的基于大人群队列的同时性mCRC的CSS预测列线图。
我们确定的CSS预测因素与之前的研究一致,包括种族、诊断年龄、原发部位、分级、N期、CEA状态、肝转移、肺转移、骨转移、脑转移、手术和化疗。对于mCRC患者,手术和化疗对改善预后都很重要,这是美国国家综合癌症网络(NCCN)指南和欧洲医学肿瘤学会(ESMO)指南推荐的[14-15]。而Modest则指出一线全身治疗的有效率可达38%~65%,疾病控制率可达81%~90%。与早期研究相比,该列线图首次将化疗状态作为预测CSS的风险预测指标。而未接受化疗的mCRC患者评分最高为100分,高于未接受手术的mCRC患者,说明化疗状态对CSS的回归系数大于手术状态。另外,SEER数据库中没有单独记录未接受化疗和未知化疗的患者,在本研究中作为混杂危险因素,可能会降低未接受化疗的实际回归系数。从以往的研究来看,化疗与mCRC患者的生存获益呈正相关[16-18],我们的研究进一步强调了同时性mCRC化疗的独特优势。
除了化疗,我们的研究发现原发性肿瘤切除对预后也很重要。一些研究在mCRC中支持这一观点,特别是对于有肝或肺转移的患者[19-21]。NCCN指南建议mCRC患者应接受多学科团队(MDT)评估,如果可能,转移性疾病和原发肿瘤应切除[22]。所以对于无法切除转移的mCRC患者,原发肿瘤切除仍有争议。Ishihara等[23]指出,原发肿瘤切除可以显著延长无法切除转移的mCRC患者的总生存期(OS)(中位OS:13.8个月vs.6.3个月,P=0.0001)。Tong等[24]也支持这一观点,即原发肿瘤切除可使不可切除转移的mCRC患者获得更好的生存(2年CSS:50.2%vs.28.1%,P<0.001)。总之,原发性肿瘤切除对患者的生存有积极的影响。
如上所述,肝和肺是CRC最常见的转移部位,骨和脑转移非常罕见。此外,不同转移器官的预后意义不一致。发生脑转移往往意味着最糟糕的生存,Vatandoust等[25]报道,CRC患者脑转移的中位生存期为3~6个月,骨转移为5~7个月,肝转移为22.8个月,肺转移为36.2~49个月。Ge等[11]也证实了这一观点,在CRC的四个转移器官中,脑转移的影响系数最大。我们的研究表明,CSS的回归系数从高到低依次为:脑转移、骨转移、肝转移和肺转移。由于血脑屏障(BBB)和血脑脊液屏障(CSF)的存在,脑转移往往是CRC的最终转移器官,而其他颅外转移区域已经发生,如肝和肺。血脑屏障和脑脊液屏障也阻碍了化疗疗效,这可能是预后不良的另一个原因[26]。
在多元回归分析的基础上,我们开发了一个新的列线图来整合多个预测变量,有助于准确预测同时性mCRC的生存。Zhang等[27]已经构建了用于预测CRC患者生存的列线图。Ge等[11]也开发了预测mCRC的OS列线图模型,具有很强的一致性。与现有的预测模型相比,我们的列线图整合了更多的预测变量,如化疗和手术,为CSS提供了全面的预测。此外,我们通过X‐tile软件建立了一个具有最优截断值的风险分级系统,该系统更加精确和可靠。该方法有助于评估mCRC患者的风险水平,从而实现个体化治疗和准确预后。此外,我们提供了每个重要预后因素的估计点,以提高临床应用。
我们的研究也有一些局限性。首先,本研究是对现有选择性偏倚的回顾性分析。并且SEER数据库没有描述详细的化疗方案和靶向治疗,这阻碍了进一步亚组分析的进行。然后,用SEER数据验证了该列线图预测的有效性,缺乏真实数据的验证。
综上所述,我们开发了一个新的列线图模型来预测同时性mCRC患者的CSS。模型的验证表明,该模型具有较好的鉴别性和一致性。风险分级系统可以对mCRC患者的风险水平进行分级,准确评估预后,指导治疗。
