我国东南沿海地区三带喙库蚊对拟除虫菊酯类杀虫剂抗药性调查分析*
2021-02-18吴治明褚宏亮
吴治明 阴 琪 田 野 褚宏亮**
(1.江苏省疾病预防控制中心,南京 210009;2.南京医科大学,南京 211166)
三带喙库蚊Culextritaeniorhynchus是我国流行性乙型脑炎(Japanese B encephalitis,乙脑)的主要传播媒介,其孳生地多为稻田,广泛接触农业用杀虫剂,由于杀虫剂的连续大量使用,导致了三带喙库蚊抗药性的发生和发展。目前,我国很多地区三带喙库蚊幼虫已经对多种杀虫剂产生了不同程度的抗性(周明浩等,2006;刘洪霞等,2008;王军浩等,2010;孙养信等,2011;杨维芳等,2011;吴治明等,2013;蔡蓉等,2015;杨迎宇等,2016)。其中江苏、广东、海南、陕西、安徽、湖南等6个省份12个自然种群三带喙库蚊幼虫对拟除虫菊酯类杀虫剂的抗性倍数在1.70~103.93之间,对残杀威的抗药性倍数在51.32~108.83之间,对敌敌畏抗性倍数在291.85~530.89之间;山东省济南市历城区三带喙库蚊幼虫对双硫磷的相对抗性倍数则高达7977.8倍。
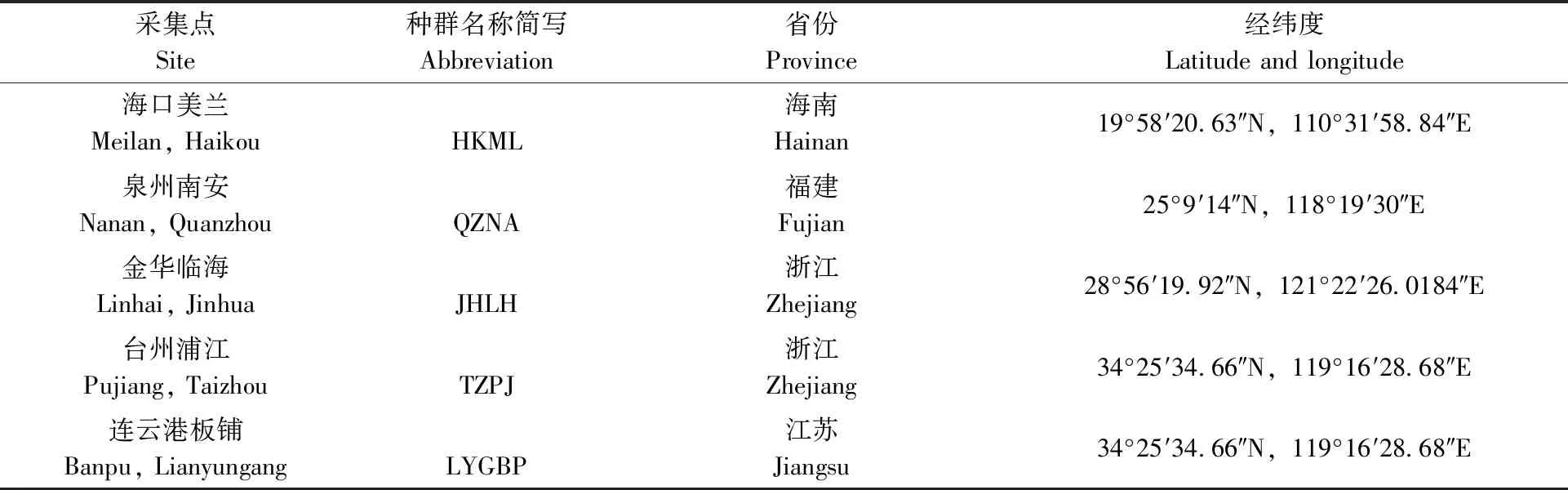
表1 5个三带喙库蚊种群采集点信息Tab.1 Origins of five populations of Cx. tritaeniorhynchus
蚊虫抗药性监测是了解其抗药性发生发展的重要手段,监测结果为杀虫剂的合理使用和蚊虫的科学防制提供数据支撑。在我国蚊虫抗药性的常规监测中,生物学测定方法被广泛推荐使用,具有结果直观、方法容易掌握等优点,但也存在诸如检测结果重复性较差、影响检测结果的因素较多、所需实验蚊虫数量多、试验蚊虫饲养困难和生测过程工作强度大等缺点。因此,测试评价更加便捷实用的方法对于蚊虫抗药性常规监测极为必要。此外,随着对蚊虫抗药性分子机制的深入研究,已证实可以通过检测蚊虫抗药性靶标基因频率的方法来反映其对相关杀虫剂的抗性水平(Wuetal., 2016),且该方法具有监测结果准确、操作简单、蚊虫数量需求少等优点。
本研究采集了我国东南沿海4个省份的5个自然种群三带喙库蚊成蚊,采用美国CDC生测瓶法(CDC,2010)测定其对2种拟除虫菊酯类杀虫剂的敏感性,并采用分子生物学方法检测其与击倒抗性(Knockdown resistance,kdr)相关的钠离子通道等位基因频率。以期了解我国东南沿海三带喙库蚊抗药性水平,从而为三带喙库蚊的科学防制提供依据。
1 材料与方法
1.1 蚊虫采集
2019年4—9月,在我国东南沿海的海南、福建、浙江和江苏等4省共采集了5个三带喙库蚊野外种群,采集点信息见表1。
采集方法为栖息蚊捕捉法和牛帐诱法。其中QZNA、JHLH、TZPJ和LYGBP种群采用栖息蚊捕捉法采集,即在三带喙库蚊活动的高峰时段(一般在日落前1 h至日落后1 h),选择在猪或奶牛的厩舍内,手电筒照明,使用电动吸蚊器在动物厩舍内捕获栖息的蚊虫。HKML种群采用牛帐诱法采集,即在三带喙库蚊活动的高峰时段,选择在离动物厩舍10~20 m的区域悬挂蚊帐,并将水牛用牛绳固定在帐内活动,蚊帐悬挂要求为上下四角撑开并固定,使蚊帐下缘距地面25 cm 高,采集者手持电动吸蚊器和手电筒捕捉蚊帐内蚊虫。为减少对蚊虫的损伤,每次捕获蚊虫数量达50只,便将捕获的蚊虫转移至便携式蚊笼中,将捕获到的蚊虫带回实验室正常饲养。
1.2 实验试剂及仪器
杀虫剂:溴氰菊酯,有效成分含量为98%;高效氯氰菊酯,有效成分含量为92%。两种杀虫剂均由中国疾病预防控制中心提供。实验试剂:丙酮,分析纯;DNA提取试剂盒(DNeasy Blood & Tissue Kit,Cat.No.69506),QIAGEN,德国;PCR扩增试剂盒(DNA PCR Kit,Cat.No.R011),TaKaRa,大连。蚊虫采集和抗性生测的主要器材:蚊帐(规格:帐顶和帐底均为250 cm×250 cm,顶角至下沿的垂直高度200 cm,帐底开口距地面垂直距离25 cm)、电动吸蚊器、玻璃吸蚊管、250 mL惠顿瓶(Wheaton bottles)。
1.3 成蚊对杀虫剂的敏感性测定
参照美国CDC生测瓶法(诊断剂量),测定不同种群三带喙库蚊对溴氰菊酯和高效氯氰菊酯的敏感性,诊断剂量参考WHO推荐的药膜接触法中致倦库蚊成蚊的诊断剂量,两种杀虫剂的诊断剂量均为0.05%,接触时间均为1 h。
1.3.1测试瓶药膜制备 选择250 mL惠顿瓶(Wheaton bottles),温肥皂水清洗后,再用清水冲洗干净,并充分晾干。根据杀虫剂使用的诊断剂量,用丙酮配制相应浓度的药液,每个测试瓶中加入1 mL药液,先盖紧瓶盖后晃动瓶中药液,使其均匀布满瓶子内壁,然后取下瓶盖,继续旋转瓶身直到看不到明显药液,瓶子完全干燥,在瓶身和瓶盖上标记药膜浓度和配制时间,对照瓶中则只加1 mL丙酮。
1.3.2测试蚊虫生理状态及数量要求 通过牛帐诱法或在牲畜厩舍中采集得到的三带喙库蚊可能处于不同的生理状态,包括饱血和非饱血蚊。因此,需将蚊虫饲养1~2 d,待血液消化后再进行生测。
1.3.3生测过程 使用吸蚊管吸取10~25只雌性三带喙库蚊放入测试瓶中,立即盖上瓶盖并开始计时,在诊断时间范围内,每间隔一定时间,观察记录1次蚊虫的击倒数。然后将蚊虫转移至清洁蚊笼中正常饲养,24 h后观察记录死亡情况。每个浓度杀虫剂测试重复4次,同时设置对照实验,如对照瓶中蚊虫24 h死亡率≥3%时,重做实验。
1.4 自然种群kdr等位基因频率检测
1.4.1三带喙库蚊核酸提取,按试剂盒说明书进行操作。
1.4.2kdr基因扩增 利用特异引物扩增各种群三带喙库蚊钠通道ⅡS4-ⅡS6 区段DNA 片段,该区段中的 L1014F突变位点是三带喙库蚊对拟除虫菊酯类杀虫剂抗性的分子标记。上游引物 Tri5:5′-C T T C A C C G A C T T C A T G C A C TC-3′,下 游引物Tri6:5′-G A T T T T G G A C A A A A G C A A G GC-3′。
1.4.3PCR 反应及测序 反应总体积 50 μL,包括 Premix Taq(loading dye mix) 25 μL,模板 DNA 4.0 μL,上游引物(10 μmol/L)2.0 μL, 下游引物(10 μmol/L)2.0 μL,去离子水 17 μL。 反应条件为 94 ℃,5 min;94 ℃,30 s,60 ℃,30 s,72 ℃,1 min,35 个循环;72 ℃,7 min;4 ℃保存。PCR 反应结束后,1.2%琼脂糖凝胶电泳检测结果,电泳的条件为120 V,30 mA, 电泳的时间为25 min。阳性结果直接送上海生工公司测序。
1.4.4kdr个体基因型的判读kdr个体基因型可以根据测序结果峰图进行判读。当基因型为敏感纯合子(SS)或抗性纯合子(RR)时,突变位点峰图为单峰;当基因型为抗性杂合子(SR)时,突变位点峰图为双峰。再结合碱基序列即可确定kdr个体基因型。
1.5 统计分析
三带喙库蚊对杀虫剂的KT50值采用DPS (v15.10版)软件计算,kdr等位基因频率与KT50值之间的相关性采用SPSS 16.0软件进行分析。
2 结果
2.1 成蚊对杀虫剂的敏感性
采用美国CDC生测瓶法测定了5个种群三带喙库蚊成蚊对溴氰菊酯和高效氯氰菊酯的敏感性。结果显示:5个三带喙库蚊种群对0.05%溴氰菊酯的KT50值在2.17~16.96 min之间;接触1 h后的击倒率除JHLH种群为98.39%以外,其余种群均为100%;24 h死亡率均为100%。对0.05%高效氯氰菊酯的 KT50值在3.90~16.23 min之间;接触1 h后的击倒率和24 h死亡率均为100%(表2,表3)。
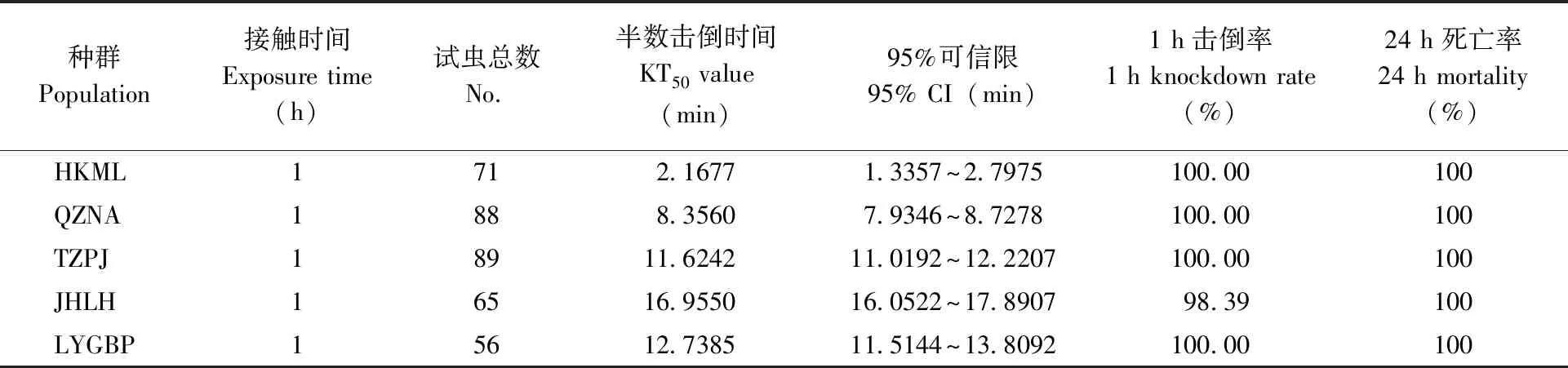
表2 不同种群三带喙库蚊成蚊对0.05﹪溴氰菊酯的敏感性Tab.2 Sensitivity of the adult Cx.tritaeniorhynchus to permethrin (0.05﹪)
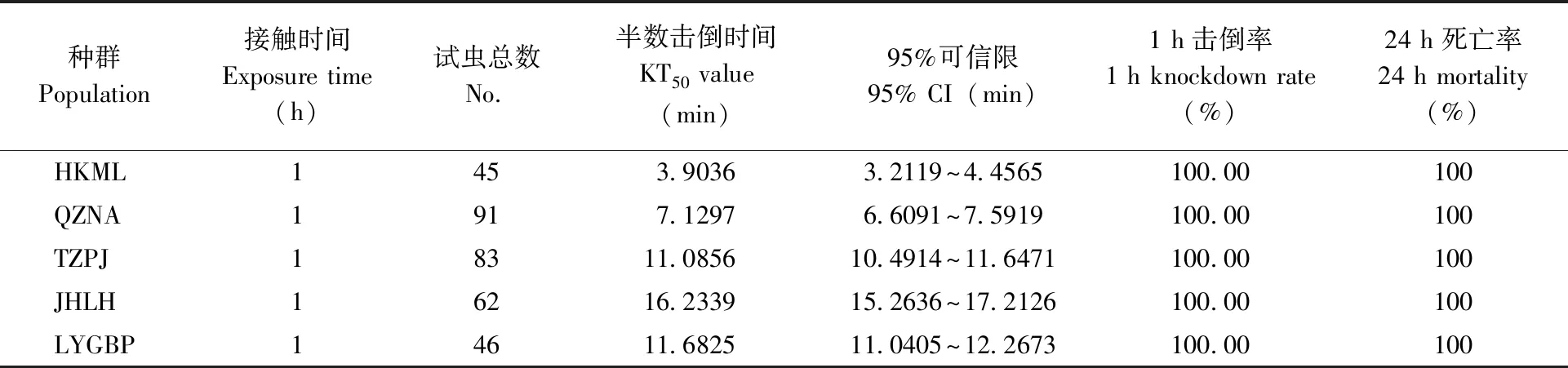
表3 不同种群三带喙库蚊成蚊对0.05﹪高效氯氰菊酯的敏感性Tab.3 Sensitivity of the adult Cx.tritaeniorhynchus to betacypermethrin (0.05﹪)
2.2 kdr等位基因频率检测结果
kdr等位基因频率及个体基因型频率的检测结果见表4。各种群三带喙库蚊kdr等位基因频率在0~38.89%之间,QZNA种群未检测到突变个体,HKML种群只检测到1个RS个体。从基因型占比来看,抗性纯合子(RR)在各种群中均较少,仅在LYGBP和JHLH种群中检测到,两个种群中RR个体在检测样本中所占比例分别仅为7.55%和11.11%;敏感纯合子(SS)在各种群中所占比例较高,在55.56%~100%之间,其中QZNA种群所有检测个体基因型均为SS型;杂合子(RS)在各种群中所占比例则为0~33.96%。
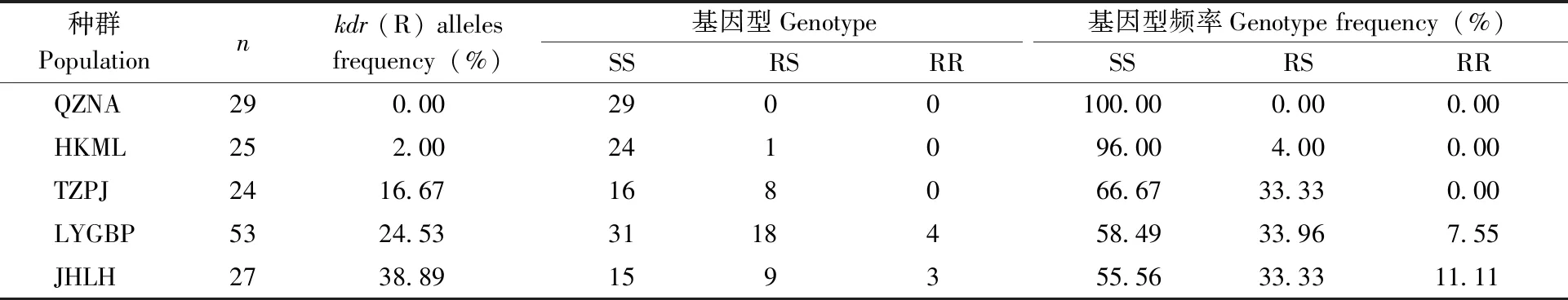
表4 5个野外种群三带喙库蚊 kdr 等位基因频率Tab.4 Knockdown resistance (kdr) allele frequencies in five Cx.tritaeniorhynchus population
2.3 kdr等位基因频率与KT50值之间的相关性分析
将不同种群三带喙库蚊成蚊kdr等位基因频率与其对两种拟除虫菊酯类杀虫剂的KT50值作相关性分析。结果显示三带喙库蚊成蚊kdr等位基因频率与其对溴氰菊酯和高效氯氰菊酯的KT50值之间相关性显著,且均为正相关关系,即三带喙库蚊成蚊kdr等位基因频率越高,其对溴氰菊酯和高效氯氰菊酯的KT50值均越大。其中,kdr等位基因频率与其对溴氰菊酯KT50值的相关系数为0.892,回归方程为:y=5.378+30.451x,(P=0.042) (图1);kdr基因频率与其对高效氯氰菊酯KT50值的相关系数为0.903,回归方程为:y=5.480+27.573x(P=0.013)(图2)。
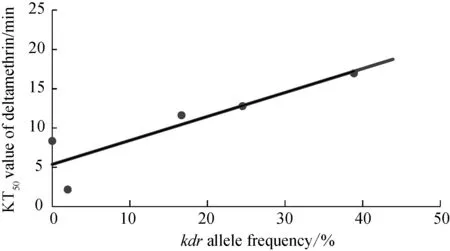
图1 三带喙库蚊 kdr 等位基因频率与其对溴氰菊酯半数击倒时间(KT50)之间的回归曲线(P=0.042)Fig.1 Liner regression between kdr alleles frequency of Cx. tritaeniorhynchus strains and the KT50 value of deltamethrin (P= 0.042)
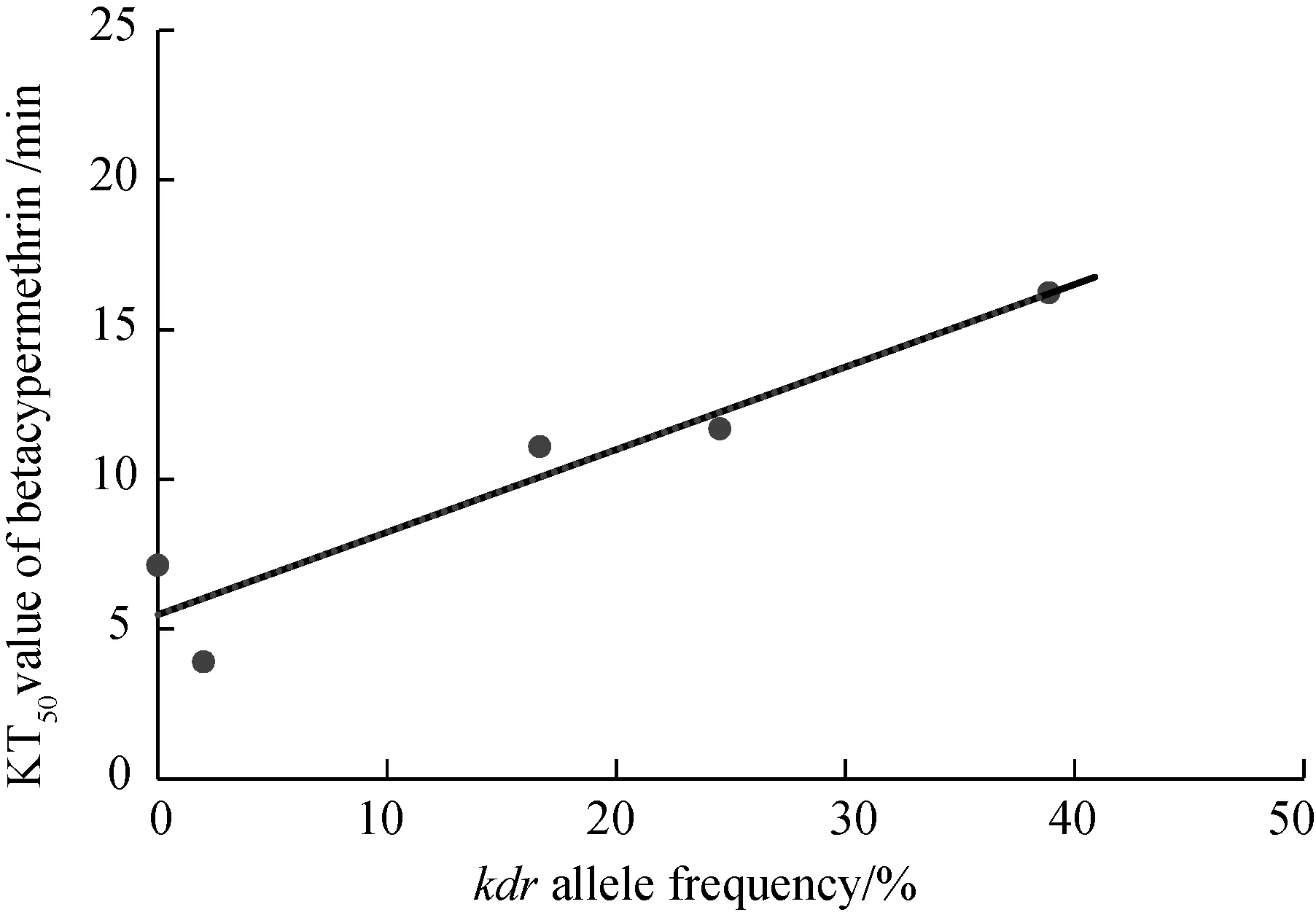
图2 三带喙库蚊 kdr 等位基因频率与其对高效氯氰菊酯半数击倒时间(KT50)之间的回归曲线(P =0.013)Fig.2 Liner regression between kdr alleles frequency of Cx. tritaeniorhynchus strains and the KT50 value of betacypermethrin (P = 0.013)
3 讨论
目前,在我国开展的三带喙库蚊抗药性水平的调查研究中,调查对象主要为幼虫,为数不多的针对成蚊的调查研究结果显示,各地三带喙库蚊成蚊对不同种类杀虫剂也产生了不同程度的抗药性。例如山东省历城区三带喙库蚊成蚊对0.05%溴氰菊酯(1 h)和0.05%高效氯氰菊酯(1 h)的24 h死亡率分别为85.0%和74.6%(陈云等,2012);辽宁省东港市三带喙库蚊成蚊对0.05%溴氰菊酯(1 h)、0.25%氯菊酯(3 h)、1%杀螟硫磷(1 h)的24 h死亡率分别为15.9%、27.7%和8.2%(靳建超等,2012)。云南省昭阳、芒市、江城、孟连和元江等地的三带喙库蚊成蚊对0.05%溴氰菊酯(1 h)和4.00%DDT(1 h)的24 h死亡率分别在3.31%~59.22%和4.61%~86.76%之间(姜进勇等,2015);江苏省南京市、湖南省怀化市、广东省清远市、安徽省濉溪市三带喙库蚊成蚊对0.025%溴氰菊酯(1 h)的24 h死亡率在5.17%~75.25%之间(吴治明,2013)。
本次调查生测结果显示海口美兰(HKML)等5个种群三带喙库蚊成蚊对0.05%溴氰菊酯和0.05%高效氯氰菊酯的24 h死亡率均为100%。如果按照国家标准(GB/T 26347—2010)(中华人民共和国卫生部等,2011)的判别标准,即24 h死亡率在98%~100%为敏感种群、在80%~97%表明其为可能抗性种群,<80%为抗性种群的,5个种群三带喙库蚊均可以判定为对溴氰菊酯和高效氯氰菊酯敏感。但是从kdr等位基因频率来看,除泉州南安种群(kdr等位基因频率为0)可能对两种杀虫剂敏感外,其余5个种群(kdr等位基因频率在2.00%~38.89%之间)对溴氰菊酯和高效氯氰菊酯是具有一定抗性的。
蚊虫抗性生物测定结果受到测定方法、试虫状态和测试环境等诸多因素的影响。本研究采用美国CDC生测瓶法进行蚊虫抗性生物测定,其诊断剂量是参考WHO推荐的药膜接触法中致倦库蚊成蚊的诊断剂量。两种方法最大的区别在于药剂附着的表面不同,WHO推荐的药膜接触法中的药剂浸润于滤纸中,滤纸相当于吸收表面,而美国CDC生测瓶法中的药剂附着于玻璃瓶内壁,玻璃内壁相当于不吸收面,因此,在诊断剂量相同的情况下,美国CDC生测瓶法中蚊虫在单位面积接触到的有效药量可能要比WHO推荐的接触法中要高很多,蚊虫死亡率就会偏高,诊断剂量抗性诊断作用失效,最终导致生物测定的结果与抗性基因检测结果出现了不相匹配的情况。但是,从半数击倒时间(KT50值)的角度进行分析发现,不同种群三带喙库蚊成蚊kdr等位基因频率与其对两种拟除虫菊酯类杀虫剂的KT50值均呈正相关关系,即三带喙库蚊成蚊kdr等位基因频率越高,其对溴氰菊酯和高效氯氰菊酯的KT50值均越大。因此,我们认为在使用美国CDC生测瓶法对三带喙库蚊成蚊进行抗性检测时,0.05%溴氰菊酯(1 h)、0.05%高效氯氰菊酯(1 h)的诊断剂量偏高;此外,在死亡率判定失效的时候,可以通过比较KT50值的大小来比较不同种群之间抗性水平的差异。
参考以往关于三带喙库蚊幼虫对拟除虫菊酯类杀虫剂抗性水平与kdr等位基因频率之间关系的研究结果,在生物测定抗性倍数为1.70~54.70之间时,其对应的kdr等位基因频率在1.32~29.55之间(姜进勇,2015;Wuetal.,2016)。对本次研究中生物测定和抗性分子检测结果进行综合分析,推测出泉州南安(QZNA)种群三带喙库蚊对溴氰菊酯和高效氯氰菊酯还处于相对敏感阶段,海口美兰(HKML)种群已经产生了部分抗性,台州浦江(TZPJ)、连云港板铺(LYGBP)和金华临海(JHLH)种群的抗性程度相对较高。
由于三带喙库蚊极难饲养,其敏感品系成蚊对杀虫剂的敏感基线或诊断剂量未见报道,以往的研究通常参考淡色库蚊或致倦库蚊成蚊的诊断剂量来对三带喙库蚊进行测试。由于诊断剂量会对检测结果产生直接影响,因此,在使用不同的检测方法时应先通过预试验来确定一个相对合适的诊断剂量。在抗性检测的方法中,生物测定法、生化法和分子生物学方法各具优势,互相补充,测试评价简单、实用、经济的测试方法极为必要。本研究中两种抗性检测方法均有值得推荐之处,其中分子生物学方法具有简便、准确的优点,它不仅可以了解蚊虫抗药性水平及其动态变化过程,还能预测蚊虫的抗药性发展过程。美国CDC生测瓶法则具有操作简单、所需蚊虫数量相对较少、经济实用等优点(Galardoetal.,2015)。
本研究虽涉及到的杀虫剂种类较少,还需要开展三带喙库蚊成蚊对其他种类杀虫剂的抗性监测研究,但研究结果同样可以为上述地区的三带喙库蚊成蚊防制和农药使用策略提供科学依据。在抗性水平较高地区,当有流行性乙型脑炎疫情或三带喙库蚊密度高时,应尽量减少溴氰菊酯和高效氯氰菊酯等拟除虫菊酯类杀虫剂的大量使用,可以选择与其他杀虫机制的杀虫剂轮换使用。
