微塑料和芘对菲律宾蛤仔的毒性效应研究
2021-02-16柳佳佳朱效鹏滕佳赵建民李成华单恩翠张晨王清
柳佳佳,朱效鹏,滕佳,赵建民,李成华,单恩翠,张晨,王清
(1.宁波大学,浙江 宁波 315211;2.中国科学院烟台海岸带研究所 海岸带生物资源高效利用研究与发展中心,山东 烟台 264003;3.中国科学院烟台海岸带研究所 牟平海岸带环境综合试验站,山东 烟台 264117;4.中国科学院大学,北京 100049)
塑料制品由于轻便、耐用和价廉等特点被广泛应用于农业、工业及日常生活中。2019 年,全球塑料产量达到3.7 亿吨(Plastics Europe,2020)。每年塑料产量的50%用于制作一次性塑料产品,预计会产生大量的塑料垃圾(Plastics Europe,2020)。据估计,每年约有480 万~1 270 万吨塑料垃圾进入海洋(Jambeck et al,2015)。目前世界大部分海域的水体、沉积物以及海洋生物体内均已检测到微塑料(冉文 等,2018;Farrell et al,2013;Cincinelli et al,2017;Smith et al,2018;He et al,2021;Russell et al,2021)。越来越多的研究证实了微塑料对海洋动物的多种毒性效应,包括能量储备减少、摄食能力受抑制、炎症反应和代谢紊乱等(Van Cauwenberghe et al,2012;Von Moos et al,2012;Lu et al,2016;Watts et al,2016;Cole et al,2019)。富集在生物体内的微塑料能够沿食物链进行传递,危害生态系统,甚至对人类健康产生负面影响(Farrell et al,2013)。微塑料还会从环境中吸附重金属和有机污染物,从而成为有毒有害化学物质的载体(Browne et al,2013)。因此,微塑料已成为海洋环境中广泛存在的一类污染物,引起了世界各国特别是沿海国家的高度重视。
多环芳烃类化合物(PAHs)因其具有生物蓄积性、高毒性、长期残留性、半挥发性和可长距离运输性在国际上备受关注。PAHs 主要来源包括森林火灾、石油泄漏以及矿物燃料等的不完全燃烧(Sun et al,2012)。近年来,研究人员在海水、河流、沉积物和海洋生物体中均已检测到PAHs 的存在(Zhi et al,2015;Nemr et al,2016;Jafarabadi et al,2017;Wang et al,2019;Liu et al,2021;Pichler et al,2021;Yuan et al,2021)。海洋环境中的PAHs 主要通过海洋生物的摄食以及皮肤渗透等途径进入生物体中,其对海洋生物构成的威胁不容忽视(Collier et al,2013;Pulster et al,2021)。例如,苯并(a)芘(BaP)能通过激活MAPKs 从而抑制栉孔扇贝(Chlamys farreri) 血细胞的免疫防御能力(刘静,2009)。Wessel 等(2007)调查发现,BaP、琢-乙炔基雌二醇和硫丹暴露对长牡蛎(Crassostrea gigas)具有胚胎发育毒性和遗传毒性,且胚胎畸形率和DNA 损伤水平具有明显的相关性。
PAHs 具有较高的亲脂性,与水相比,微塑料的疏水表面使其更容易浓缩PAHs,并且二者对生物的胁迫作用可能会相互影响(Teuten et al,2009;Gouin et al,2011;Koelmans et al,2016)。研究表明,小眼长臂鰕虎鱼(Pomatoschistus microps)暴露于吸附芘的微塑料96 h,其代谢酶活力被抑制,免疫力下降(Oliveira et al,2013)。当贻贝(Mytilus spp.)暴露于聚苯乙烯中(含或不含荧蒽)时,联合暴露组贻贝组织病理学损伤和抗氧化标记物水平最高(Paul-Pont et al,2016)。研究表明,与单独暴露于微塑料的斑马鱼(Danio rerio)相比,多氯联苯、溴化阻燃剂和甲基汞等污染物共存会导致斑马鱼肝和脑中的生物标志物基因过表达,器官稳态显著改变(Rainieri et al,2018)。Tang 等(2020)发现微塑料的存在提高了双酚A 对泥蚶(Tegillarca granosa)的免疫毒性和神经毒性。由此可见,微塑料和PAHs 联合作用可能会对海洋生物产生更大的毒性效应,因此,亟待开展微塑料与PAHs 的联合毒性效应研究。
菲律宾蛤仔是沿海滩涂重要的经济贝类,在生态系统中起着重要的作用。菲律宾蛤仔是滤食动物,生命周期长,对盐度和温度的高波动具有耐受性,对污染物具有高蓄积能力,符合作为生物指示物 种的 标 准(Tanguy et al,2008;Sacchi et al,2013)。有研究报道,菲律宾蛤仔能从其生活环境中摄取并积累大量的微塑料(Davidson et al,2016;Cho et al,2019)。但迄今为止,关于微塑料的毒性研究大多集中于牡蛎和贻贝(Von Moos et al,2012;Avio et al,2015;Sussarellu et al,2016;Ribeiro et al,2017;Teng et al,2021)。因此,在本研究中,我们探讨了两种不同粒径聚苯乙烯微球和芘单一及联合暴露(21 d)对菲律宾蛤仔的毒性效应,在个体(如肥满度和摄食率)、组织(如氧化应激和脂质过氧化水平)和细胞(如血淋巴免疫调节)水平探讨两种污染物对菲律宾蛤仔的毒性效应。同时,运用综合生物标志物响应指数法(IBR)评价了微塑料和芘对菲律宾蛤仔的毒性作用,以期为微塑料和有机污染物的生态风险评估以及国家制定相关应对策略与政策提供科学依据。
1 材料与方法
1.1 实验材料
在山东省烟台沿海(36毅16忆N—38毅23忆N,119毅34忆E—121毅57忆E) 采集了1200 只壳形完整、大小相近的野生菲律宾蛤仔(壳长3.5依1.0 cm,壳高2.6 依0.8 cm,n= 30),在实验室用过滤海水洗净。菲律宾蛤仔置于玻璃罐(60 cm伊60 cm伊100 cm)中,暂养14 d。在暂养期内,每天更新所有海水并连续充气,投喂螺旋藻溶液,浓度为4.3 伊107cells/mL。每天使用YSI 设备(YSI 型号85,Yellow Springs,OH,USA)测定所有玻璃缸中的水质参数,水温为19.6 依0.3 益,pH 为8.1 依0.1,盐度为31.8 依0.4。
聚苯乙烯微球原料分散体是乳浊液(2.5%w/v,10 mL),含有0.05%的NaN3,购自天津倍思乐中心,通过扫描电子显微镜(SEM)(S-4800,Hitachi)检查聚苯乙烯的尺寸和形貌(图1)。其直径为0.34 依0.008 滋m 和6.34 依0.087 滋m。芘(CAS:129-00-0)购自萨恩化学技术有限公司,由于芘在水中的溶解度低,因此,在二甲亚砜(DMSO,MP Biomedicals,USA)中制备芘的储备溶液。各芘处理组的溶剂DMSO 浓度均保持在0.001%,预计该浓度不会对菲律宾蛤仔产生不利影响(Venier et al,1997;Zhang et al,2019)。已有研究表明,吸附BaP的聚苯乙烯暴露对紫贻贝(Mytilus galloprovincialis)的毒性要高于单独聚苯乙烯暴露;与大尺寸聚苯乙烯(4.5 滋m)相比,小尺寸聚苯乙烯(0.5 滋m)对紫贻贝具有更高的毒性(Gonz佗lez-Soto et al,2019)。因此,为探讨不同尺寸微塑料对菲律宾蛤仔的毒性效应及差异,本研究选择微米级(6 滋m)和纳米级(0.3 滋m)两种尺寸聚苯乙烯微塑料开展暴露试验。

图1 扫描电子显微镜(SEM)表征聚苯乙烯微塑料
1.2 实验设计
本实验设置4 个单一暴露处理组,包括两种尺寸的聚苯乙烯(0.3滋m(SMPs)和6滋m(BMPs))和两个浓度的芘溶液(10 滋g/L(L-pyrene)和100 滋g/L(H-pyrene))。在单一暴露组的基础上设置2 伊2 双因素设计,共计4 个联合暴露处理组(SMPs+Lpyrene、SMPs+H-pyrene、BMPs+L-pyrene、BMPs+H-pyrene)。同时设置洁净海水和溶剂(DMSO)对照组。实验中设置的芘暴露浓度10 滋g/L 为环境相关浓度(Zhang et al,2019),高浓度100 滋g/L是为了探究芘对贝类的毒性效应,并且已有室内研究报道了类似浓度会对生物体产生毒性效应(Tang et al,2020)。微塑料暴露浓度设置为20 滋g/L,该浓度高于现实环境浓度,但预测未来在部分海域可能会出现(Everaert et al,2018),相关研究也表明类似暴露浓度会对一些海洋生物产生毒性效应(Oliveira et al,2013;Skdokur et al,2020)。
微塑料的原液悬浮液在去离子水中配制,浓度为0.25 g/L 并在使用前进行超声波处理。芘溶液采用DMSO 配制成质量为10 mg/L 的母液,根据实验需要用过滤海水进行稀释。每个玻璃缸养殖60 只实验动物(100 L)。实验期间养殖条件与适应期一致,每天定时投饵,更换海水,换水后重新添加芘和微塑料至设定浓度。每天重投暴露介质后2 h 内不投喂螺旋藻,以避免藻类与塑料颗粒之间发生相互作用(Teng et al,2021;Wang et al,2021)。此外,注意调节气石的位置和曝气强度,使暴露介质和饵料在海水中分布相对均匀。
1.3 生理指标测定
各暴露组随机选取8 只菲律宾蛤仔,解剖后将壳和全部软组织置于60 益烘箱烘至恒重。计算样品干肉重与干壳重的比例(FW/SW 伊100%)来获得菲律宾蛤仔的肥满度指数(Condition Index,CI)。
根据Coughlan(1969)之前所述的方法测定摄食率(Clearance Rate,CR)。每组20 只菲律宾蛤仔转移到100 L 海水的玻璃缸暂养1 h,然后加入初始浓度为4.3 伊107cells/mL 的螺旋藻液。期间连续充气,使藻液在海水中分布相对均匀。测定开始时,在玻璃缸中取20 mL 水样进行分析,随后分别在30 min、60 min、90 min 和120 min 采集水样。使用数字流式细胞摄像系统(VS-IV,Fluid Imaging Technology,USA) 测定藻类细胞浓度。CR 通过以下公式计算:
CR=V 伊(lnC0-lnCt)/N 伊t
其中,CR 是摄食率(L/h),灾是测试容器中海水的体积(蕴),C0是初始藻细胞浓度(cells/mL),Ct是贼时间后藻细胞浓度(cells/mL),晕为容器中菲律宾蛤仔数量,贼是实验时间(h)。
1.4 血细胞免疫指标测定
实验结束后,用无菌注射器抽取1.5 mL 血淋巴细胞,用双层300 目筛绢过滤到Eppendorf 离心管,迅速与等体积预冷的抗凝剂混合,以防止血细胞聚集。各组样品分装两份,分别用于菲律宾蛤仔血淋巴细胞凋亡率和吞噬活性的测定。利用台式高速冷冻离心机(5804R,Eppendorf,Germany) 进行预处理。将分装好的血淋巴在2000 g 条件下离心10 min,弃去上清,加入1 mL PBS 缓冲液重悬血淋巴,重复重悬一次。加入各指标相应的缓冲液来进行相关指标的检测。
血淋巴细胞凋亡率测定方法简述如下:使用500 滋L 缓冲液重悬血淋巴细胞。按照试剂盒(Annexin V-FITC/PI,上海碧云天生物技术有限公司)说明,先加入5 滋L Annexin V-FITC,18 益避光孵育5 min,再加入5 滋L PI,18益避光孵育5 min。对经过上述处理后的样品用流式细胞仪(FACSAriaTM,Becton,Dickinson and Company)进行分析(FL-1 通道检测Annexin V-FITC 绿色荧光,FL-2 通道检测PI 红色荧光)。各样品中血淋巴细胞凋亡率的结果用FITC 阳性和PI 阴性细胞数目占总细胞数目的百分比来表示。
血淋巴细胞吞噬活性测定方法简述如下:用500 滋L PBS 重悬血细胞,加入PBS 稀释成2.3%的荧光微球(YG 2.0 微米,Polysciences,Germany),使其终浓度为0.3%,18 益避光孵育1 h 后加入400 滋L 6%的福尔马林溶液中止反应,并用流式细胞仪分析(微球绿色荧光用FL-1 通道检测)。血细胞吞噬活性用吞噬3 个或3 个以上微球的血细胞数目占血细胞总数的百分比来表示。
1.5 氧化应激指标测定
暴露结束后,分别称取菲律宾蛤仔的消化腺和鳃组织各0.1 g 左右。按照1 颐10(w/v)的比例加入匀浆介质。使用IKA 匀浆机(T10 Ultra Turrax basic,IKA,Germany)完全均质化(6000 r/min 匀浆4 次,每次20 s)。待匀浆液冷却后,在4 益,10 000 g 下离心15 min,收集上清液即为10%组织匀浆。菲律宾蛤仔组织内丙二醛(malonic dialdehyde,MDA)含量、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽巯基转移酶(glutathione S-transferase,GST)活性均采用南京建成生物工程研究所试剂盒中描述的方法进行测定。组织总蛋白浓度采用BCA 法测定,参照碧云天生物公司相关试剂盒进行,单位为mg/L。抗氧化酶活性的活力单位为U/mg 蛋白。脂质过氧化水平以组织内的MDA 含量表示,单位为nmol MDA/mg 蛋白。
1.6 综合生物标志物分析
为了将鳃和消化腺组织所有测量到的生物标志物反应整合到一个通用的“应激指标”中,按照Sanchez 等(2013)建立的综合生物标志物分析法(Integrated Biomarker Response,IBR),评价微塑料和芘单一及联合暴露对菲律宾蛤仔的毒性效应。该方法根据Belieff 等(2002)介绍的IBR 指数法基础上改进而来。
1.7 统计分析
结果显示为平均值依标准偏差。分别使用Shapiro-Wilk 和Levene 检验对所有数据进行方差的正态性和齐性检验。使用单因素方差分析(ANOVA)评估所有暴露组中生物学参数的统计学差异。当方差的正态性和齐性不满足时,使用非参数Kruskal-Wallis H 检验和Mann-Whitney U 检验来分析数据。显著性水平设定为0.05。使用SPSS 16.0 进行统计分析。
2 研究结果
2.1 生理指标
研究发现,除了联合暴露组(SMPs+H-pyrene)外,其余暴露组菲律宾蛤仔的CI 与对照组相比没有显著差异,并且SMPs+H-pyrene 暴露组菲律宾蛤仔的CI 显著高于H-pyrene 暴露组(p <0.05)。单一微塑料暴露组CR 显著低于对照组(p <0.05),但与联合暴露组相比没有显著差异。联合暴露组CR 低于单一芘暴露组,说明微塑料的存在增加了芘的毒性效应(图2)。

图2 微塑料和芘暴露对菲律宾蛤仔生理指标(a:肥满度;b:摄食率)的影响
2.2 免疫指标
微塑料和芘暴露后,菲律宾蛤仔血细胞免疫指标结果如图3 所示。各暴露组血细胞凋亡率均高于对照组,其中,在SMPs 和高浓度芘存在的条件下,血细胞凋亡率较对照组水平显著增加了6.93%(p <0.05),并且二者联合暴露组血细胞凋亡率最高。在单一芘暴露组,细胞凋亡率随芘剂量的增加从10.94%增加到14.45%。对血细胞吞噬活性而言,各暴露组吞噬活性均低于对照组,其中,除BMPs 暴露组外,其他各暴露组较对照组水平均有显著变化(p <0.05)。
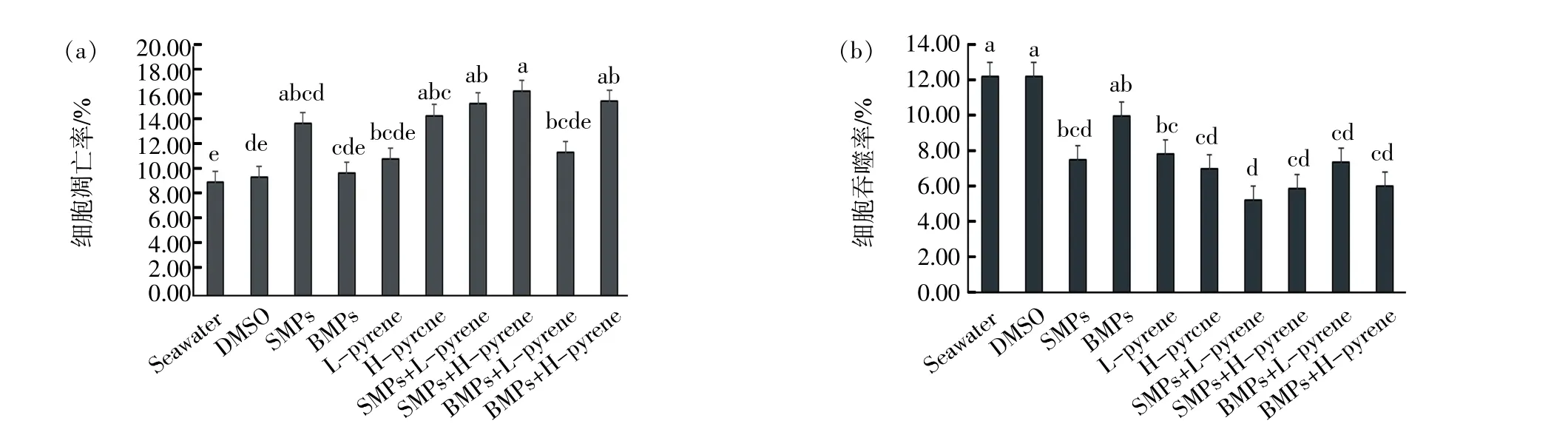
图3 微塑料和芘暴露对菲律宾蛤仔血细胞免疫相关指标(a:细胞凋亡率;b:细胞吞噬活性)的影响
2.3 抗氧化反应
微塑料和芘单一及联合暴露对菲律宾蛤仔鳃和消化腺组织抗氧化酶和脂质过氧化水平的影响如图4所示。SMPs 和SMPs+H-pyrene 暴露组菲律宾蛤仔鳃组织MDA 含量较对照组水平分别显著增加0.37和0.44 mmol/mg 蛋白(p <0.05);SMPs 暴露组鳃组织MDA 含量较BMPs 组含量增加0.32 mmol/mg蛋白(p <0.05);SMPs 和两种浓度芘联合暴露组菲律宾蛤仔消化腺组织MDA 含量较对照组水平分别显著增加0.61 和0.57 mmol/mg 蛋白(p <0.05)。SMPs 和微塑料+L-pyrene 暴露组菲律宾蛤仔鳃组织CAT 活性显著高于对照组(p <0.05);在消化腺组织中,单一芘暴露组的CAT 活性显著高于对照组(p < 0.05) 且联合暴露组的CAT 活性低于单一暴露组。菲律宾蛤仔鳃组织SOD 活性与对照组相比无显著差异;微塑料+H-pyrene 联合暴露组的消化腺SOD 活性较对照组显著降低12.17 U/mg 蛋白和9.59 U/mg 蛋白(p <0.05)。联合暴露组和H-pyrene 单一暴露组鳃组织GST 活性均显著低于对照组(p <0.05);在消化腺组织中,联合暴露组和单一芘暴露组GST 活性显著高于对照组(p<0.05)。
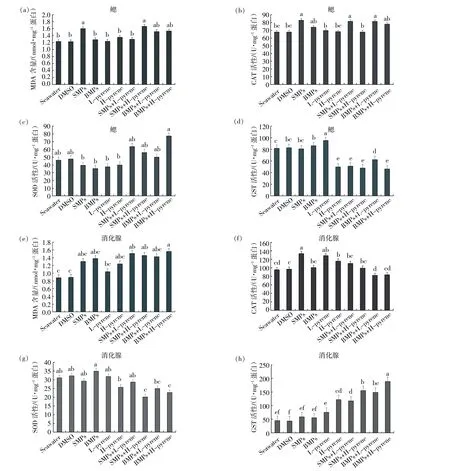
图4 微塑料和芘暴露对菲律宾蛤仔鳃和消化腺中的抗氧化酶活性和脂质过氧化水平的影响
2.4 综合生物标志物指数
采用综合生物标志物指数法,对菲律宾蛤仔鳃和消化腺组织的抗氧化酶活性和脂质过氧化水平生物标志物的响应值进行分析。结果如图5 所示,在鳃组织中,联合暴露组和单一芘暴露组的GST 活性变化幅度最大,微塑料单一暴露组的MDA 含量变化幅度最大。而在消化腺组织中,联合暴露组和微塑料单一暴露组的MDA 含量变化幅度最大,低浓度芘单一暴露组的CAT 活性变化幅度最大,高浓度芘单一暴露组中的GST 活性变化幅度最大。所有暴露组的IBR 值较对照组水平均有所升高,其中SMPs 单一暴露组最高。微塑料和芘联合暴露能够引起比单一压力源(芘和BMPs)更高的IBR值。根据IBR 值计算结果,微塑料和芘对消化腺组织的总体影响高于鳃组织。

图5 微塑料和芘暴露后菲律宾蛤仔生物标志物星状图和综合生物标记物响应指数
3 讨论
3.1 生理指标
肥满度指数(CI)作为生物体健康状况的指标,可以直接用于评估环境压力(Tejeda-Vera et al,2007;Luna-Acosta et al,2017)。在本研究中,除了高浓度芘暴露组,其余暴露组菲律宾蛤仔CI与对照组相比都没有显著差异。同样,Gonz佗lez-Soto 等(2019)发现暴露于聚苯乙烯和BaP(7 d和26 d)的贻贝(M.galloprovincialis)CI 与对照组相比没有显著差异。此外,蛤类(Scrobicularia plana)暴露于1 mg/L 粒径为20 滋m 的聚苯乙烯14 d,其CI 也没有发生显著变化(Ribeiro et al,2017)。联合暴露组(SMPs+H-pyrene)菲律宾蛤仔CI 显著高于H-pyrene 暴露组,说明芘对菲律宾蛤仔CI 的影响大于微塑料。如图2(b)所示,SMPs+H-pyrene暴露组CR 低于H-pyrene 暴露组,这可能是由于复合暴露组菲律宾蛤仔摄入吸附芘的微塑料较少,从而导致其CI 高于H-pyrene 暴露组。
微塑料单一或联合暴露都显著抑制了菲律宾蛤仔的摄食率(CR)。前期研究发现,随着聚氯乙烯微塑料暴露浓度的增加,贻贝(Mytilus edulis)的CR 降低(Rist et al,2016)。双壳类有较强的滤水能力,因此,其鳃组织易受到海水中污染物的影响。一方面,双壳类会根据环境中食物颗粒的数量和水质来调节瓣膜的开度,CR 的大幅度降低可能是因为微塑料颗粒引起菲律宾蛤仔鳃瓣膜关闭;另一方面,微塑料可能通过损伤上皮细胞或引起堵塞而对生物造成潜在的伤害,从而导致CR 被抑制(Bacon et al,1998)。本研究还发现联合暴露组菲律宾蛤仔的CR 低于单一暴露组,表明微塑料和苯并芘联合胁迫效应更为明显。有研究表明,比起单独暴露于微塑料和铬,两种污染物联合暴露下,小眼长臀鰕虎(Pomatoschistus microps)幼鱼捕食性能显著下降(Lu侏s et al,2015)。Green 等(2017)发现暴露于25 滋g/L 的聚乳酸或高密度聚乙烯微塑料的贻贝(M. edulis) CR 下降,但牡蛎(Ostrea edulis)的CR 增加。不同的暴露时间、微塑料和污染物类型以及生物生活方式可能会导致研究结果的差异。因此,需要开展更多的研究,以确定相关的研究结果是否在双壳类动物中普遍适用。
3.2 血淋巴免疫指标
在本研究中,微塑料和芘单独或联合暴露均能诱导菲律宾蛤仔血细胞凋亡率的增加,并且联合暴露组血细胞凋亡率高于单一暴露组,表明联合暴露下菲律宾蛤仔免疫系统受到的损害更为严重。与本研究结果类似,经聚苯乙烯微塑料和多溴联苯醚暴露后,栉孔扇贝(Chlamys farreri)血细胞细胞凋亡率增加,并且微塑料会增强多溴联苯醚对栉孔扇贝(C.farreri)的免疫毒性(滕瑶,2018)。Sendra 等(2020)研究聚苯乙烯对紫贻贝(M.galloprovincialis)不同血细胞亚群的免疫毒性,发现微塑料暴露导致凋亡信号增加以及吞噬活性降低。本研究结果显示,SMPs 暴露组细胞凋亡率高于BMPs 暴露组。Browne 等(2008)研究发现小于9.6 滋m 的聚苯乙烯颗粒可从贻贝(M.edulis)肠道转移到血细胞内;颗粒大小影响聚苯乙烯的转移能力,在体腔液中,较小的(3.0 滋m)颗粒比较大的(9.6 滋m)颗粒多60%。因此,SMPs 暴露组细胞凋亡率增加可能是小粒径(0.3 滋m)微塑料在血细胞大量积累所致。
在贝类免疫反应中,吞噬作用是贝类血细胞的主要防御手段,当异物和病原体入侵机体的时候,血细胞主要通过吞噬过程清除外来物(吴芳丽等,2016)。微塑料和芘单独或联合暴露对菲律宾蛤仔血细胞的吞噬活性有抑制作用,与相应剂量的微塑料和芘单独暴露相比,联合暴露可降低菲律宾蛤仔的吞噬活性,说明这两种污染物对菲律宾蛤仔具有明显的免疫毒性。聚苯乙烯被证实会影响紫贻贝(M. galloprovincialis) 血细胞溶酶体膜的稳定性(Canesi et al,2015),从而抑制吞噬作用(Sun et al,2017;Su et al,2018)。李佳娜(2019) 发现微塑料暴露组血细胞吞噬活性都低于对照组,但没有显著性差异,仅有雌二醇和微塑料联合暴露组血细胞吞噬活性显著低于对照组,预示着两种污染物的联合暴露会导致毒性增强。Tang 等(2020) 也发现暴露于微塑料和双酚A 的泥蚶(T. granosa)体内血细胞总数减少,颗粒细胞比例下降并且细胞类型组成改变。颗粒细胞是最具吞噬活性的血细胞(Liu et al,2016),因此,联合暴露组泥蚶血细胞吞噬活性被显著抑制。前期研究也表明,双壳贝类暴露于污染物(如微塑料)可能会导致血细胞数量减少(Von Moos et al,2012;Tang et al,2020)。本研究中菲律宾蛤仔血细胞凋亡率的增加可能会导致血细胞数量的降低,具有吞噬功能的细胞数量降低可能会引起血细胞吞噬率降低。因此,暴露组菲律宾蛤仔血细胞凋亡率升高可能是吞噬活性降低的原因之一。浓度也是污染物对生物体产生毒性效应的重要影响因素。在芘单独暴露组中,血细胞吞噬活性随芘剂量的增加而降低,表明芘可能以剂量依赖的方式引起血细胞免疫反应的变化。Croxton 等(2012)研究发现5 滋g/L 芘和BaP 均能轻微诱导牡蛎(Crassostrea virginica)血细胞的吞噬活性增加,但随着浓度的增加,吞噬活性降低。贻贝(M.edulis)暴露于PAHs 浓度为500 滋g/L 的饵料两周后,其血细胞吞噬能力显著降低(Grundy et al,1996)。
3.3 抗氧化酶活性和脂质过氧化水平
当机体受到外界环境胁迫时,通常会诱导产生过量的活性氧(ROS)。ROS 的过量产生能够导致蛋白质、DNA 和膜脂质发生氧化损伤,并伴随着脂质过氧化程度加剧(Hemnani et al,1998;Winterbourn et al,2008;Lushchak et al,2011)。生物体内存在复杂的抗氧化系统,主要包括酶类抗氧化剂(SOD、CAT、GST 等)和低分子量的活性氧清除分子,以保护机体免受活性氧的损伤。因此,测定清除ROS 的抗氧化酶活性和脂质过氧化水平,可以评估生物体受到氧化胁迫的程度(Hu et al,2015;Velez et al,2016;Zhang et al,2016;Coppola et al,2017)。
MDA 是脂质过氧化的终产物,生物体内的MDA 含量可以反映海洋生物体内氧化损伤程度(Damiens et al, 2007; Tomanek et al, 2011;Ferreira et al,2019)。在本研究中,所有胁迫暴露组的MDA 含量均高于对照组水平。产生上述结果的原因是生物体的抗氧化防御机制不足以保护机体免受氧化应激胁迫,从而导致了机体产生更高水平的脂质过氧化。研究表明,微塑料和污染物均能导致海洋生物体内出现严重的氧化损伤(Vlahogianni et al,2007;于庆云 等,2013;Yu et al,2018)。本研究中SMPs 暴露组鳃组织MDA 含量显著高于BMPs 暴露组,表明小粒径微塑料对菲律宾蛤仔的氧化损伤程度大于大粒径微塑料,这可能是由于小粒径微塑料更容易在生物组织内富集所导致(Deng et al,2017;Hariharan et al,2021;Wright et al,2013)。除了SMPs 暴露组,鳃组织的BMPs 和芘联合暴露组MDA 含量均高于单一暴露组。Sheng等(2021)研究也发现,暴露于微塑料和三氯生的斑马鱼体内也检测到脂质过氧化,并且二者对肝脏MDA 含量的联合作用表现为相加效应。
通常情况下,SOD 和CAT 是抗氧化防御系统的第一条防线,用以清除生物体内因污染胁迫产生的ROS(Miller et al,2008)。SOD 可以催化超氧自由基(·O2-) 转化为过氧化氢(H2O2) 和分子氧(O2),然后CAT 可以催化H2O2分解产生氧气(O2)和水(H2O) (Lesser et al,2006)。GST 具有清除体内自由基及解毒的双重功能,能够催化谷胱甘肽与进入体内的外源性物质相结合,最终促使这类物质排出生物体(Sheehan et al,2001)。微塑料和芘暴露对菲律宾蛤仔体内不同抗氧化酶的影响具有一定差异性。在鳃组织中,微塑料单独或和芘联合暴露导致CAT 活性升高。与之类似,Magara 等(2018) 发现微塑料暴露会影响贻贝(M. edulis)鳃的氧化应激系统,使CAT 活性增加。本研究中单一暴露组鳃组织中SOD 活性低于微塑料和芘联合暴露组,表明当两种污染物同时存在时,鳃组织氧化应激反应增强。SOD 和CAT 活性上升可能是由于污染物在菲律宾蛤仔体内的代谢过程中出现过多自由基,组织反馈性增强抗氧化系统酶活性,以清除多余的自由基。Magara 等(2019)发现,微塑料和荧蒽暴露后贻贝(M.edulis)鳃组织SOD 活性变化和本研究呈现相同的变化趋势。Webb 等(2020)发现贻贝(Perna canaliculus)暴露于添加三氯生的微塑料时,其鳃组织SOD 活性升高。在联合暴露下,菲律宾蛤仔鳃组织GST 活性被抑制,而除H-pyrene 处理组,其余单一暴露组菲律宾蛤仔鳃组织GST 活性升高。有研究表明,短时间低剂量污染物暴露可导致机体GST 活性的诱导表达,但长时间或者高剂量的胁迫则能够抑制GST 的活性或表达(任加云等,2006)。
联合暴露组消化腺组织CAT 和SOD 活性低于单一暴露组。Skdokur 等(2020)研究发现,在微塑料和汞联合暴露条件下,菲律宾蛤仔(R.philippinarum)消化腺组织CAT 活性被抑制,而鳃组织CAT 活性受到诱导升高,这与我们的研究结果类似。CAT 和SOD 活性被抑制可能是因为联合胁迫产生了更多的自由基蓄积,导致抗氧化系统损伤和补偿机制的丧失。微塑料和芘暴露激活了菲律宾蛤仔消化腺组织的GST 活性。Gehringer 等(2004)研究发现,有毒物质进入动物体内,主要通过肝脏的谷胱甘肽还原机制解毒,这可能是GST在本研究中活性较高的原因之一。然而,GST 活性的增加可能并不足以防止氧化损伤,因为本研究发现消化腺脂质过氧化增加。此外,在单一微塑料暴露下,消化腺GST 活性与对照组相比没有显著性差 异。 前 期 研 究 发 现, 紫 贻 贝 (M.galloprovincialis)在1.5 g/L 微塑料(<100 滋m)暴露7 d 后,其消化腺组织GST 活性并未发生变化(Avio et al,2015)。本研究发现,相比于L-pyrene暴露组,H-pyrene 暴露组中,脂质过氧化水平增加且消化腺CAT 和SOD 活性以及鳃组织CAT 和GST 活性均下降。可见,鳃和消化腺组织抗氧化酶活性和脂质过氧化水平的反应并不一致,可能是由于污染物的生物利用度差异导致。
3.4 综合生物标志物分析
综合生物标志物分析已被广泛应用于污染物对水生动物的综合毒性效应评价(Damiens et al,2007;Raftopoulou et al,2010),高IBR 值表明被测生物体遭受了较高的胁迫压力(Turja et al,2014)。在本研究中,消化腺的IBR 值高于鳃,表明污染物对消化腺的毒性作用更大。Teng 等(2021)运用IBR 定量评价了聚乙烯(PE)和聚对苯二甲酸乙二醇酯(PET)胁迫后,牡蛎(C.gi原gas)鳃和消化腺组织中生物标志物的变化情况,发现消化腺组织对微塑料胁迫响应值大于鳃组织。本研究中,H-pyrene 暴露组IBR 响应值高于Lpyrene 暴露组。Kim 等(2016)发现鲤鱼(Cypri原nus carpio)暴露于PAHs 时,IBR 值随PAHs 浓度的增加而增加。同样,李磊等(2018) 通过IBR评价了BaP 暴露后脊尾白虾(Exopalaemon carini原cauda) 的生物标志物响应,结果发现IBR 值与BaP 暴露浓度存在剂量依赖效应,且肌肉和肝胰脏组织对BaP 胁迫响应存在差异性,表明IBR 可作为评价多个生物标志物对PAHs 暴露响应的定量工具。BMPs 和芘联合暴露组的IBR 值高于单一暴露组,这表明BMPs 和芘对菲律宾蛤仔复合毒性效应表现为协同效应。
4 结论
本文以菲律宾蛤仔为研究对象,探讨了微塑料和芘对其生理活动、免疫防御和氧化应激的影响。结果发现,微塑料的存在显著抑制了菲律宾蛤仔的摄食率。微塑料和芘暴露均能导致菲律宾蛤仔出现不同程度的氧化应激现象,联合暴露对菲律宾蛤仔的氧化损伤程度高于单独暴露且能够显著抑制血细胞的吞噬活性。相较于较大粒径微塑料(6 滋m),小粒径微塑料(0.3 滋m)加剧了鳃组织的脂质过氧化程度和芘对血细胞的免疫毒性。由此可见,微塑料和有机污染物联合作用可能会对海洋生物产生更大的毒性效应。因此,开展微塑料与有机污染物的联合毒性效应研究,将是今后微塑料毒性评价的重要方向之一。
