山奈酚羟丙基-β-环糊精包合物的制备与评价*
2021-02-15刘乐乐杨礼诚李冬影闫紫薇雷梦甜杨黎燕
刘乐乐,杨礼诚,李冬影,闫紫薇,雷梦甜,杨黎燕,张 彦
(1.西安医学院 药学院,陕西 西安 710021;2.西北农林科技大学食品科学与工程学院,陕西 西安 712100)
山奈酚(Kaempferol),又名山奈素、四羟基黄酮、百蕊草素Ⅲ等,属黄酮醇类化合物,结构中的二苯基丙烷使山奈酚具有疏水性特点,羟基与氢自由基的结合增强了山奈酚的抗氧化活性[1-4]。最新研究表明,山奈酚具有抗癌、抗氧化、抗病毒、抗炎、抗菌、增强机体免疫等多种药理作用[5]。山奈酚为黄芪-藿香-金银花配伍的第二活性化合物,其对甲型流感通路、糖基化终末产物-糖基化终末产物受体(AGEs-RAGE)信号通路、白介素-17信号通路等有一定的调节作用,可能会在新冠病毒的预防及治疗方面有广阔的应用前景[6-7]。
羟丙基-β-环糊精(Hydroxypropyl-beta-cyclodextrin,HP-β-CD)是对β-环糊精进行结构修饰后的水性衍生物,是β-环糊精与1,2-环氧丙烷缩合而成的亲水性衍生物。与药物进行包合后,可大大提高药物在水中的溶解度,增加药物的稳定性和生物利用度。与β-环糊精相比较,水溶性大大提高,且表面活性低,对人体胃肠道、皮肤、眼睛刺激性较小、溶血活性低,不易在体内蓄积。现已有多种羟丙基-β-环糊精包合物制成的口服药物、注射剂、鼻腔给药、眼部及舌下给药等多种药物剂型[8-9]。
实验采用溶液-搅拌法制备山奈酚-羟丙基-β-环糊精包合物,对其进行物相鉴定,并考察其还原能力及不同pH下的释药性能。
1 实验部分
1.1 试剂与仪器
山奈酚:标准品,纯度≥98%,辰光生物科技有限公司;羟丙基-β-环糊精(HP-β-CD):山东恒台新大精细化工有限公司;无水乙醇:天津市科密欧化学试剂有限公司;以上试剂均为分析纯;实验用水为蒸馏水。
集热式恒温加热磁力搅拌器:DF-101S,巩义市予华仪器有限责任公司;超声波清洗器:PS-40A,上海甄明科学仪器有限公司;离心机:TDL-40B,上海安亭科学仪器厂;恒温磁力搅拌器:B11-2,上海司乐仪器有限公司;酶标仪:ReadMax1900,上海闪谱生物科技有限公司;冷冻干燥仪:FD-1,郑州长城科工贸有限公司;紫外分光光度计:UV-6000T,上海元析仪器有限公司;傅里叶红外光谱仪:EQUINOx55,德国Bruker公司;熔点仪:RY-1G,上海佳航仪器仪表有限公司。
1.2 实验方法
1.2.1 山奈酚含量测定方法的建立
1.2.1.1 检测波长的确定
分别将羟丙基-β-环糊精的水溶液和山奈酚的无水乙醇溶液在200~600 nm波长进行紫外光谱扫描,选择山奈酚最大吸收波长,且羟丙基-β-环糊精无吸收处作为检测波长。
1.2.1.2 标准曲线的绘制
精密称定山奈酚标准品10 mg,加无水乙醇定容于100 mL容量瓶得100 μg/mL山奈酚母液备用。分别取0.5、1.0、1.5、2.0、2.5、3.0 mL的山奈酚母液于25 mL容量瓶,无水乙醇定容至刻度,得2~12 μg/mL系列质量浓度梯度的山奈酚溶液,无水乙醇作空白,于1.2.1.1选定的波长处平行测定3次不同质量浓度下山奈酚乙醇溶液的吸光度。以各质量浓度的平均吸光度为纵坐标,山奈酚质量浓度为横坐标,绘制山奈酚标准曲线,得回归方程[10]。
1.2.1.3 回收率试验
在25 mL容量瓶中分别加入上述100 μg/mL山奈酚母液0.5 mL、1.5 mL、3.0 mL,加入适量羟丙基-β-环糊精,无水乙醇定容,最大吸收波长处测定吸光度,每个质量浓度平行测定3次,根据标准曲线计算出溶液中山奈酚实际质量浓度并取平均值,以质量浓度平均值计算回收率[11]。
1.2.1.4 精密度实验
25 mL容量瓶中分别加入上述100 μg/mL山奈酚母液0.5、1.5、3.0 mL,加入适量羟丙基-β-环糊精,无水乙醇定容,山奈酚最大吸收波长处测吸光度,每个质量浓度平行测定3次,根据标准曲线计算溶液中山奈酚质量浓度,分别在当天4 h、8 h测定其吸光度,计算山奈酚的实际质量浓度,得出日内精密度;分别于24 h、48 h测定吸光度,带入回归方程得山奈酚质量浓度计算日间精密度。
1.2.2 制备包合物
精密称取100 mg山奈酚,适量无水乙醇溶解,以n(羟丙基-β-环糊精)∶n(山奈酚)=2∶1称取羟丙基-β-环糊精于圆底烧瓶中,10 mL蒸馏水溶解,60 ℃恒温磁力搅拌下,将山奈酚的乙醇溶液逐滴加入到HP-β-CD水溶液中,搅拌3 h,放至室温,离心,上清液冷冻干燥,得山奈酚-羟丙基-β-环糊精包合物[12]。
1.2.3 包合物的鉴定
1.2.3.1 紫外光谱(UV)的鉴定
分别取适量山奈酚、羟丙基-β-环糊精、山奈酚与羟丙基-β-环糊精的物理混合物和山奈酚-羟丙基-β-环糊精包合物,无水乙醇溶解,定容至10 mL容量瓶中,蒸馏水为空白,于200~600 nm波长进行紫外光谱扫描。
1.2.3.2 红外光谱(IR)的鉴定
分别取山奈酚、羟丙基-β-环糊精、山奈酚与羟丙基-β-环糊精的物理混合物和山奈酚-羟丙基-β-环糊精包合物适量,经KBr压片,记录傅立叶红外光谱[13]。
1.2.3.3 熔点的测定
分别测定山奈酚、羟丙基-β-环糊精及山奈酚-羟丙基-β-环糊精包合物熔点。熔封的毛细管取少量样品于管底,放入熔点仪观察,记录样品开始熔化至完全熔化的温度,确定熔程。
1.2.4 羟丙基-β-环糊精对山奈酚的增溶作用
精密称取适量羟丙基-β-环糊精,配得0.01 mol/L羟丙基-β-环糊精水溶液。精密量取0.01 mol/L的羟丙基-β-环糊精水溶液0、2.0、4.0、6.0、8.0、10.0 mL于6个锥形瓶中,分别加入10.0、8.0、6.0、4.0、2.0、0.0 mL蒸馏水,配得10 mL浓度分别为0.0,2.0,4.0,6.0,8.0,10.0 mmol/L的羟丙基-β-环糊精水溶液。分别加入过量山奈酚,超声10 min,密封,置于恒温振荡器,转速150 r/min,避光振荡48 h,静置,上清液过0.45 μ滤膜,滤液于最大吸收波长处测吸光度,计算山奈酚质量浓度及增溶倍数。分别于25、37、45 ℃温度下平行测定3组山奈酚包合物的增溶倍数。以羟丙基-β-环糊精的质量浓度为横坐标,山奈酚质量浓度为纵坐标,绘制3个温度下的相溶解度图。根据Higuchi的分类法确定相溶解度图类型,分析包合反应的发生,确定包合比。
1.2.5 体外释药动力学分析
采用动态透析法,分别选择pH=1的盐酸溶液、pH=6.8的磷酸盐缓冲溶液为释放介质,取包合物100 mg于预先处理好的透析袋中,两端系紧,投入40 mL释放介质中,于37 ℃恒温磁力搅拌器80 r/min搅拌,分别于0.5、1、4、8、18、24、48 h取样4 mL,每次取样后补加同温度等体积的释放介质,最大吸收波长测定取样吸光度,计算山奈酚浓度及释放率,绘制体外释药曲线[14]。
1.2.6 还原能力的测定
称取适量包合物、山奈酚标准品,分别配得相当于山奈酚质量浓度为4、8、12、16、20 μg/mL的乙醇溶液,以同质量浓度的维生素C醇溶液为参比,测定其还原能力。取0.4 mL待测液,加入0.4 mL的质量分数1%铁氰化钾,混匀,50 ℃水浴20 min,加0.4 mL质量分数10%三氯乙酸,混匀,离心10 min(8 000 r/min)取上清液0.1 mL,加0.1 mL蒸馏水、15 μL质量分数0.1%三氯化铁,混匀静置10 min,取200 μL于96孔板,酶标仪700 nm波长处测得吸光度,平行测定3组,取平均值,以蒸馏水代替待测液测定空白吸光度,以吸光度大小评价药物的还原能力。
2 结果与讨论
2.1 山奈酚含量测定方法的建立
2.1.1 检测波长的确定
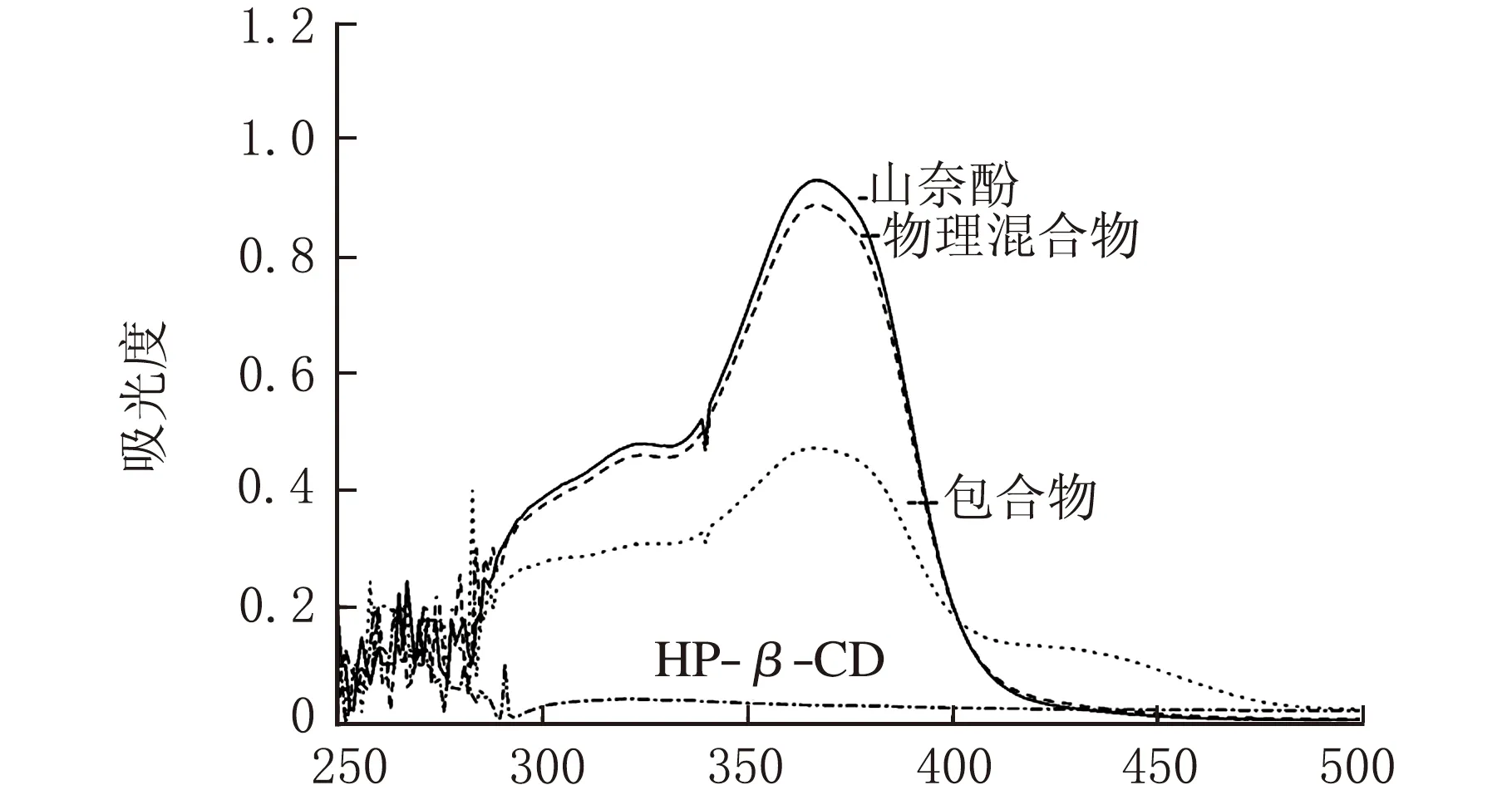
山奈酚和羟丙基-β-环糊精的紫外吸收光谱扫描见图1。
波长/nm
由图1可知,山奈酚乙醇溶液在367 nm处有最大吸收,HP-β-CD水溶液在此处基本无吸收。
因此以367 nm为山奈酚含量测定的检测波长。
2.1.2 标准曲线的绘制
按1.2.1.2方法,得到山奈酚标准回归方程y=0.080 2x-0.023 7,R2=0.999 2,山奈酚标准溶液质量浓度在2~12 μg/mL与吸光度呈现良好线性关系。

ρ/(μg·mL-1)
2.1.3 回收率实验
回收率实验结果见表1。

表1 回收率实验结果
由表1可知,平均回收率为(99.41±0.65)%,变异系数为0.56%。该检测方法稳定,准确,可用于山奈酚-羟丙基-β-环糊精包合物中山奈酚的含量测定。
2.1.4 精密度实验
精密度实验结果见表2。

表2 日内精密度和日间精密度
由表2可知,检测3个浓度的山奈酚溶液,其日内、日间变异系数RSD均小于3%,符合药典要求,该检测方法稳定性准确性较好,可用于山奈酚-羟丙基-β-环糊精中山奈酚的含量测定。
2.2 包合物的鉴定
2.2.1 紫外光谱(UV)的鉴定
山奈酚、山奈酚与羟丙基-β-环糊精的物理混合物、山奈酚-羟丙基-β-环糊精包合物及羟丙基-β-环糊精的紫外吸收光谱图见图1。
由图1可知,山奈酚、山奈酚与羟丙基-β-环糊精的物理混合物、山奈酚-羟丙基-β-环糊精包合物均在367 nm有一稳定而强烈的吸收峰、在339 nm处有一小尖锐的峰,而羟丙基-β-环糊精在367 nm处无吸收峰。由于山奈酚被包载于羟丙基-β-环糊精的内部空腔中,包合物在300~400 nm处的紫外吸收值大幅降低,比山奈酚和物理混合物的吸收峰均有大幅度降低,因此可以推断山奈酚与羟丙基-β-环糊精发生了包合作用。在形成包合物时,羟丙基-β-环糊精结合山奈酚为非共价键形式。
2.2.2 红外光谱(IR)的鉴定
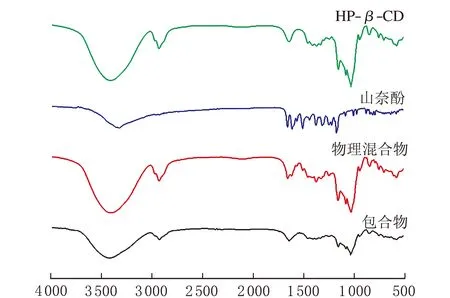
羟丙基-β-环糊精、山奈酚、山奈酚与羟丙基-β-环糊精的物理混合物及山奈酚-羟丙基-β-环糊精包合物的红外吸收光谱图见图3。
波数/cm-1

2.2.3 熔点的测定
熔点测定结果显示,山奈酚熔程为246~251 ℃,羟丙基-β-环糊精熔程为263~273 ℃,物理混合物熔程为251~266 ℃,包合物熔程为271~275 ℃。包合物的熔点与物理混合物相比较熔程显著缩短,并与山奈酚及物理混合物皆有差异,初步表明有新的物相生成。
2.3 体外释药动力学分析
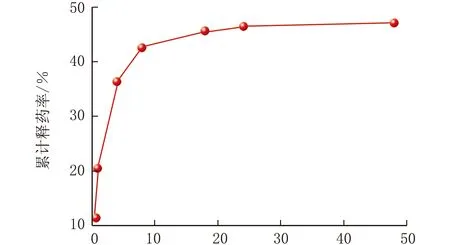
包合物在pH=6.8的磷酸盐缓冲溶液的释药曲线见图4。
t/h
由图4可知,山奈酚-丙基-β-环糊精包合物在pH=6.8磷酸盐缓冲溶液中,前8 h释药较快,24 h后逐渐达到释药平衡,但释药率仅47.19%,表明该包合物在pH=6.8的环境中释药率较差。对此释药曲线分别用零级释放方程(Mt/M∞=kt),一级释放方程(Mt/M∞=1-e-kt),Higuchi方程(Mt/M∞=kt0.5),Ritger-Peppas方程(Mt/M∞=ktn)进行拟合,拟合结果见图5和表3。由图5、表3可知,此包合物在pH=6.8的环境中释药曲线符合一级模型方程(R2=0.974 17),表明此包合物中包载药物的释放与时间呈现正相关。

t/h

表3 包合物在pH=6.8释放介质中的释药拟合结果
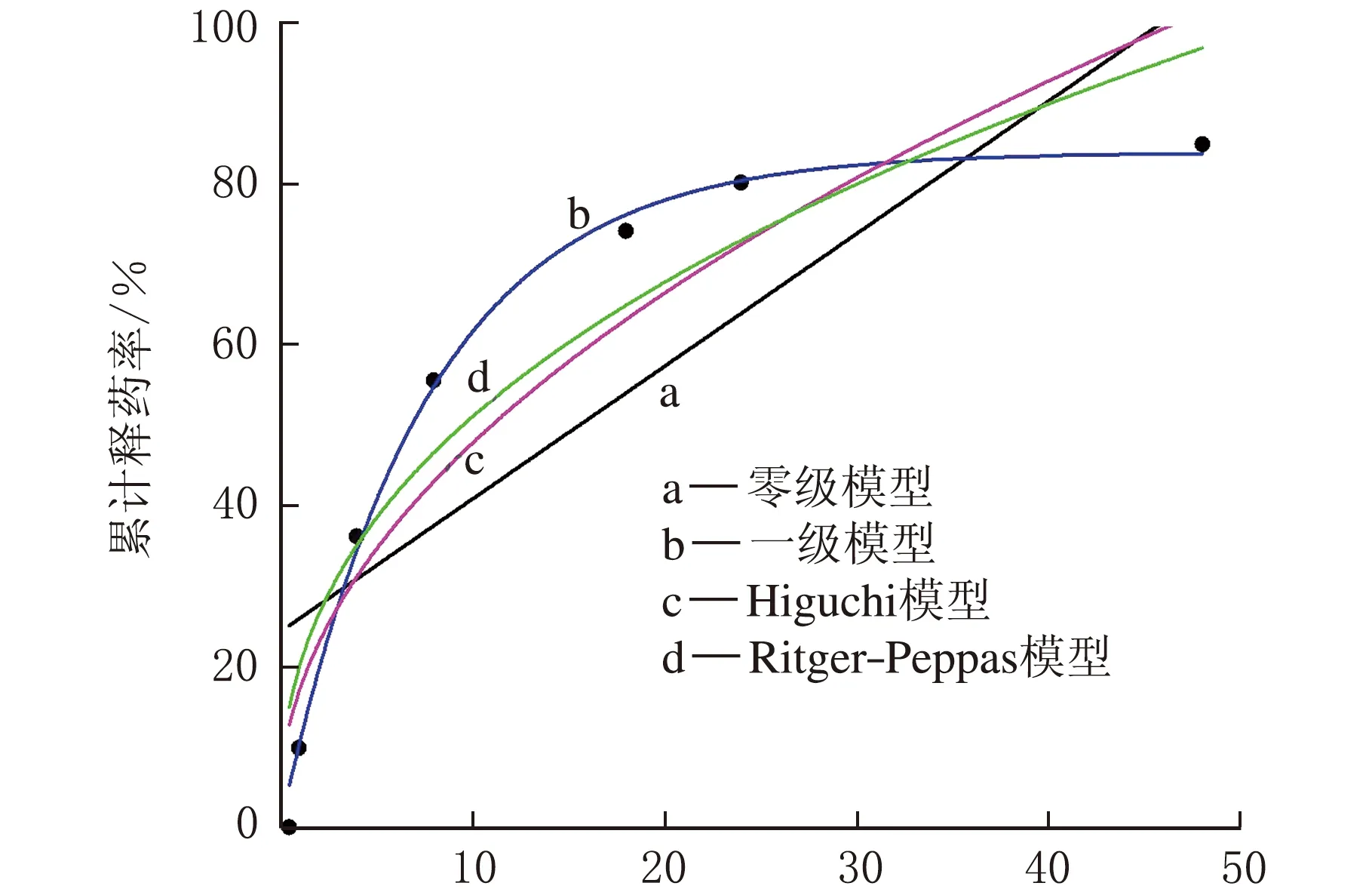
包合物在pH=1的介质中释药曲线见图6。

t/h
由图6可知,山奈酚-羟丙基-β-环糊精包合物在pH=1的释放介质中,释药率与时间呈指数正相关,24 h内药物释放较快,48 h释药率可达84.89%,表明该包合物在pH=1的环境中释药率较好。
对此释药曲线分别用零级释放方程(Mt/M∞=kt),一级释放方程(Mt/M∞=1-e-kt),Higuchi方程(Mt/M∞=kt0.5),Ritger-Peppas方程(Mt/M∞=ktn),拟合结果见图7和表4。
t/h

表4 包合物在pH=1释放介质中的释药拟合结果
由表4可知,此包合物在pH=1的环境中释药曲线符合一级动力学模型方程(R2=0.993 68),即此包合物的体外释放量在单位时间内按恒定的比例释放。
2.4 还原能力的测定
不同浓度下山奈酚、包合物及维生素C的还原能力对比见图8。

ρ(药物浓度)/(μg·mL-1)
由图8可知,山奈酚、包合物及维生素C在700 nm的吸光度随着药物质量浓度的增大而增强,表明还原铁离子能力与质量浓度呈正比关系。山奈酚被包合后仍具有还原能力,且还原能力与未包合的山奈酚相当,略有增大。两者与阳性对照维生素C相比略低。
3 结 论
制备的包合物经紫外图谱、红外图谱、熔点鉴定结果表明,山奈酚与羟丙基-β-环糊精的包合并非简单的物理混合,山奈酚被包载于羟丙基-β-环糊精中;包合物的体外释药动力学实验表明,包合物在pH=1的盐酸溶液中释药性能较好,释药率随着时间延长而增大直至达平衡,48 h释药率可达84.89%。包合物在pH=1和pH=6.8条件下释药曲线均对一级动力学方程拟合较好,但其缓释性能的差异还有待考察;包合物与山奈酚还原能力测定结果显示,包合物与单纯未包合的山奈酚相比,还原能力相当,该包合物具有一定的研究意义。
