载吲哚美辛嵌段聚合物胶束的表征、释药性能及血液相容性*
2021-02-15巩志强符佳乐郭光惠王小宁
巩志强,李 欣,符佳乐,郭光惠,王小宁
(西安医学院 药学院,陕西 西安 710021)
心脑血管疾病是当今致死性疾病之首,严重威胁着人类的生命健康,中国死于中风等心脑血管性疾病的人数已超过250万/a。血栓栓塞是多种心脑血管疾病发病的原因,其形成具有多种机制,其中动脉硬化、血管内皮损伤、内外凝血系统异常或血流动力学异常等是主要的诱发原因[1]。吲哚美辛(indometacin,IDM)为常用的非甾体抗炎药,具有抗炎、解热及镇痛作用,对环氧合酶-2(cyclooxygenase-2,COX-2)有非特异性抑制作用。研究表明,吲哚美辛可抑制血小板凝集,与肝素等抗凝药联合使用可以发挥抗血栓协同作用[2]。由于吲哚美辛的溶解度很低(水溶液中0.02 mg/mL),吲哚美辛普通制剂如片剂、胶囊剂等生物利用度低,长期口服会产生对胃肠道有较强的刺激性,容易引发消化道出血、溃疡等不良反应,因此,设计开发吲哚美辛新型制剂以增加溶解度、提高生物利用度以及减少不良反应至关重要[3]。
嵌段聚合物胶束是由两亲性嵌段共聚物在水中自组装形成的一种分子聚集体,具有“核-壳”结构,亲水段形成外壳,疏水段形成胶束的内核[4]。使用嵌段聚合物胶束可将疏水性吲哚美辛药物包裹于胶束内核中,有望增大吲哚美辛的溶解度,减小刺激,提高生物利用度[5]。聚(2-乙基-2-噁唑啉)[poly(2-ethyl-2-oxazoline),PEOz]是一种亲水性高分子材料,可以作为胶束的亲水段使用,同时其生物相容性好,已通过美国食品与药品管理局的认证[6]。PEOz链形成的亲水外壳可形成立体位阻,使胶束避免被摄取清除,因此能够延长药物的体内循环时间[7]。作者合成双嵌段共聚物聚(2-乙基-2-噁唑啉)-聚乳酸(PEOz-PLA),包载IDM构建纳米胶束体系,研究该胶束的理化性质、体外释药性质及血液相容性,为IDM的新剂型研究提供依据。
1 实验部分
1.1 试剂与仪器
2-乙基-2-噁唑啉(EOz):纯度大于99%,北京百灵威科技有限公司;对甲苯磺酸甲酯(MeOTs):纯度大于99%,上海阿拉丁生化科技股份有限公司;D,L-丙交酯(D,L-LA):纯度大于99%,济南岱罡生物科技有限公司;异辛酸亚锡、乙腈、氯仿、甲苯、乙酸乙酯、丙酮:分析纯,国药集团化学试剂有限公司;高纯氮气:纯度大于99.999%,由西安医学院实验中心提供;吲哚美辛:药用级,纯度大于99%,上海英索生物科技中心;新西兰兔:雌性,200~250 g,成都达硕实验有限公司。
智能磁力搅拌器:ZNCL-BS-X19,巩义市瑞力仪器设备有限公司;集热式恒温加热磁力搅拌器:DF-101S,巩义市予华仪器有限责任公司;傅里叶红外光谱仪:T-27,德国BRUKER公司;超声波清洗器:KQ5200E,昆山市超声仪器有限公司;紫外-可见分光光度计:Cary60,安捷伦科技(中国)有限公司;台式高速离心机:H1850,湖南湘仪实验室仪器开发有限公司;旋转蒸发仪:R201L,上海谱振生物科技有限公司;激光粒度分析仪:ZEN-3600,马尔文仪器公司;电子分析天平:AX224ZH,美国奥豪斯公司;真空干燥箱:DZF6050,上海一恒科学仪器有限公司;pH计:PHS-3C,上海雷磁仪电仪器公司;透射电子显微镜,FEI-TECNAI:荷兰Philips公司。
1.2 PEOz-PLA的合成
采用阳离子开环聚合法合成PEOz-OH[8]。具体操作如下。EOz、MeOTs和乙腈用氢化钙除水,备用。取30.36 g EOz和6.55 g MeOTs(引发剂)置于双口圆底瓶中,加入100 mL乙腈,氮气保护、t=100 ℃搅拌反应36 h,冷却至室温,加入KOH甲醇溶液0.1 mol/L,48 mL,室温搅拌反应2 h。将反应液置于单口圆底瓶中,旋蒸除去有机溶剂,加入80 mL三氯甲烷复溶,布氏漏斗抽滤除去不溶性盐,重复多次,以彻底除去生成的对甲苯磺酸盐。旋蒸除去有机溶剂,加入10 mL四氢呋喃复溶,逐滴加入到剧烈搅拌的冷无水乙醚中,析出沉淀,抽滤,得到白色沉淀,真空干燥24 h,得PEOz-OH。将D,L-LA用乙酸乙酯重结晶3次,室温下真空干燥24 h。将PEOz-OH置于100 mL圆底烧瓶中,加入约70 mL甲苯,采用分水器共沸除水,使挥发出来的甲苯变澄清后停止加热。加入需要量重结晶后的D,L-LA和催化剂辛酸亚锡[m(辛酸亚锡)∶m(D,L-LA)=0.5%],氮气保护、t=140 ℃反应36 h。旋蒸除去有机溶剂,用二氯甲烷复溶,逐滴加入剧烈搅拌的冷乙醚中,析出沉淀,抽滤,得到白色固体,真空干燥24 h,得到PEOz-PLA,合成路线见图1。
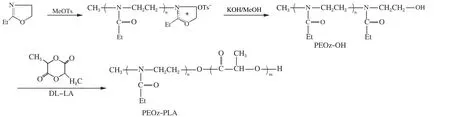
图1 PEOz-PLA的合成路线图
1.3 聚合物材料的结构表征
将少量PEOz-PLA溶解于CDCl3中,以TMS为内标在室温下测定聚合物的1H NMR谱,根据谱图计算PEOz-OH和PEOz-PLA的分子量。
1.4 胶束的粒径、分布及形态
1.4.1 空白胶束溶液的制备
采用溶剂挥发法制备空白胶束。精密称取10 mg PEOz-PLA材料溶解于1 mL三氯甲烷中,超声溶解形成聚合物溶液。向50 mL烧杯中加入10 mL水,置n=700 r/min搅拌,用1 mL注射器吸聚合物溶液以15滴/min的速度滴入水中,滴加完毕后搅拌10 min,40 ℃旋蒸除去溶液中的三氯甲烷,用220 nm滤膜过滤得到聚合物PEOz-PLA胶束溶液。
1.4.2 载药胶束溶液的制备
精密称取1 mg IDM溶解于1 mL甲醇之中,得到质量浓度为1 mg/mL的药物溶液,在剧烈搅拌下,将1 mL药物溶液加入到10 mLρ(空白胶束)=1 mg/mL溶液中,继续剧烈搅拌4 h,t=40 ℃旋蒸除去溶液中的三氯甲烷,用0.22 μm微孔滤膜过滤得到载药胶束溶液。
1.4.3 胶束的粒径、分布及形态
采用马尔文激光粒度测定仪测定空白胶束溶液及载药胶束溶液的粒径及PDI值。其中多分散度表示粒子分散的均匀程度,其数值越小,表明粒子的分散程度越均匀。每个制剂的结果为3次测定结果的平均值。
用透射电子显微镜观察载药聚合物胶束的形态。取一滴1.4.2方法的载药胶束溶液滴于镀有碳膜的铜网上,2 min后取出铜网,从铜网边缘吸除多余液体,将铜网晾干后即可放入透射电镜中观察。
1.5 IDM的含量测定方法学考察
1.5.1 标准曲线的绘制
精密称取IDM对照品5.0 mg于100 mL容量瓶中,加入丙酮50 mL,振摇10 min,溶解,磷酸盐缓冲液(pH=7.4)稀释至刻度,制成50 μg/mL的对照品储备液。精密吸取对照品储备液,配制质量浓度梯度为10、15、20、25、30、35 μg/mL的系列溶液,在320 nm波长处,测定吸光度A,以吸光度A为纵坐标,质量浓度ρ为横坐标,绘制标准曲线。
1.5.2 精密度实验
取ρ(IDM)=20 μg/mL溶液,按照1.5.1方法测定条件连续测定6次吸光度值,计算RSD值。
1.5.3 稳定性实验
取ρ(IDM)=20 μg/mL溶液,分别在0、2、4、6、12 h按照1.5.1方法测定条件测定吸光度值,计算RSD值。
1.5.4 加样回收率实验
分别取10、20、30 μg/mL系列质量浓度IDM标准溶液(n=3),加入处方比例的空白胶束材料,超声分散,加蒸馏水定容,按照1.5.1项测定条件测其吸光度值,计算样品在低、中、高质量浓度范围内的回收率及RSD值。
1.6 包封率、载药量的测定
按照1.4.2方法制备载药胶束溶液,载药后的溶液用0.22 μm微孔滤膜过滤,滤膜用20 mL丙酮溶液洗脱,收集洗脱液,按照1.5测定方法,测定洗脱液中ρ(IDM),计算游离IDM的质量,包封率计算见公式(1)。滤液(载药胶束)进行冷冻干燥,测得载药胶束总质量,载药量计算见公式(2)。
包封率=m(含药)/m(药总投入量)×100%
(1)
载药量=m(含药)/m(总载药胶束)×100%
(2)
1.7 体外药物释放
精密吸取1.4.2方法载药胶束溶液10 mL置于透析袋(截留相对分子质量3 500)内,封紧两端,置于100 mL的磷酸缓冲液(pH=7.4)中,加入1滴吐温80,t=37 ℃、n=100 r/min于恒温摇床中振荡。分别于1、2、4、6、8、10、12 h取出释放液,每次取3 mL,同时补充3 mL的新鲜释放介质。取出的释放介质经0.22 μm的滤膜滤过后,用1.5.1方法测定IDM的含量,计算累积释放率(Q),见公式(3)。
(3)
式中:Cn(mg/mL)为不同取样点的释放液质量浓度,Ci(mg/mL)为每个取样点的取样液质量浓度,V(mL)为释放介质体积,Vi(mL)为取样体积,m(mg)为总药量。
1.8 体外溶血实验
按照文献[9]方法制备体积分数2%红细胞悬液。取7个试管分别加入不同体积的溶液,1~5号管加供试品溶液(终浓度分别为1、10、50、100、150 mg/mL的PEOz-PLA材料溶液),以生理盐水为阴性对照组,蒸馏水为阳性对照组。将各管轻轻混匀后,置于37 ℃恒温水浴中进行孵育,分别于0.5、1、2、3、4、6、8、12 h对试管内液体进行离心(3 000 r/min,5 min),取上清液于416 nm处用紫外-可见分光光度计测定吸收度(A),溶血率计算见公式(4)。溶血实验结果见表1。

表1 溶血实验表
溶血率=(A样品-A阴性)/(A阳性-A阴性)
(4)
2 结果与讨论
2.1 结构表征
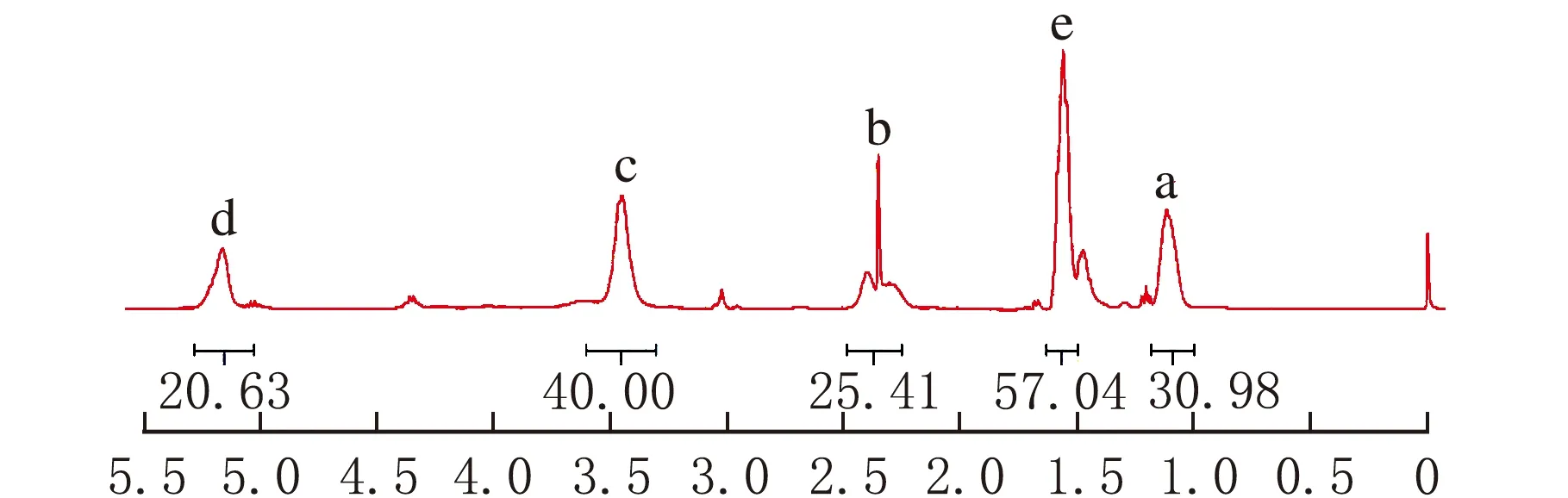
PEOz-PLA的核磁共振氢谱图见图2。
由图2可知,δ=1.14为PEOz-OH侧链—CH3上质子的化学位移峰,δ=1.56为PLA的—CH3上质子的化学位移峰,δ=3.46、δ=2.41分别为PEOz-OH主链及侧链的—CH2—上质子的化学位移峰,δ=3.04mPEOz-OH主链末端—CH3上质子的化学位移峰,δ=5.21为PLA的—CH—上质子的化学位移峰。PEOz-OH的分子量由端甲基上的质子峰(δ=3.02)与侧链上的甲基质子峰积分面积比得出。见公式(5)。
δ
MPLA=72(MPEOz/99)/(EOz/LA)
(5)
通过积分面积比计算PLA的分子量。根据计算,实验合成的聚合物分子量为PEOz1 000-PLA1 500。
2.2 粒径、分布和形态
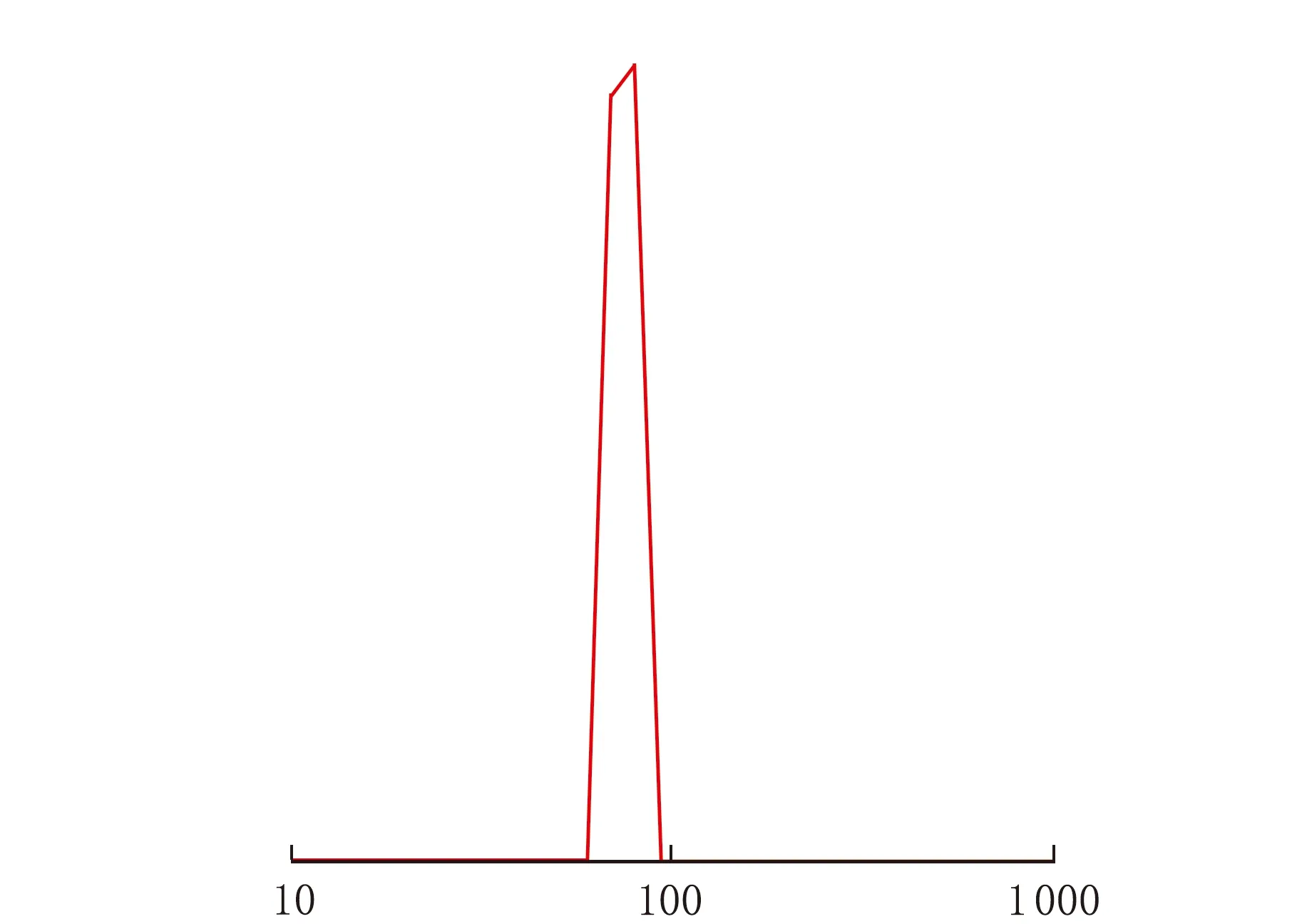
空白胶束和载药胶束的粒径分布见图3。
d/nma 空白胶束
由图3可知,空白胶束的粒径较小,为(73.5±10.2)nm,载药后,由于内核中装载药物,粒径显著增大,为(137.8±23.4)nm,空白胶束和载药胶束的多分散系数PDI均小于0.3,说明胶束分散性较好,粒径均一。
采用透射电镜观察载药胶束的形态,结果见图4。
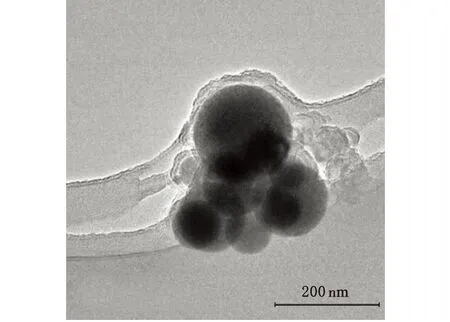
图4 载药胶束的透射电镜图
由图4可知,形成聚合物胶束的内核部分由于包载了药物,呈暗黑色,聚合物胶束呈圆球形,粒径约为100 nm。与激光粒度仪测定的粒径结果相比,透射电镜测得的粒径偏小,这可能由于激光粒度仪测定的为粒子外层水合后的粒径,因此透射电镜的测试结果是客观的[10]。
2.3 包封率和载药量
2.3.1 吲哚美辛含量测定方法学考察
以吸光度(A)为纵坐标,质量浓度(ρ)为横坐标绘制标准曲线,得标准曲线方程为A=0.019+0.012,r=0.999 9,表明IDM在ρ=10.0~35.0 μg/mL峰面积与质量浓度线性关系良好。精密度实验、稳定性实验的RSD值为0.68%和1.26%,说明t<12 h样品溶液稳定。
按照1.5.4的方法进行加样回收率实验,得到的回收率结果见表2。
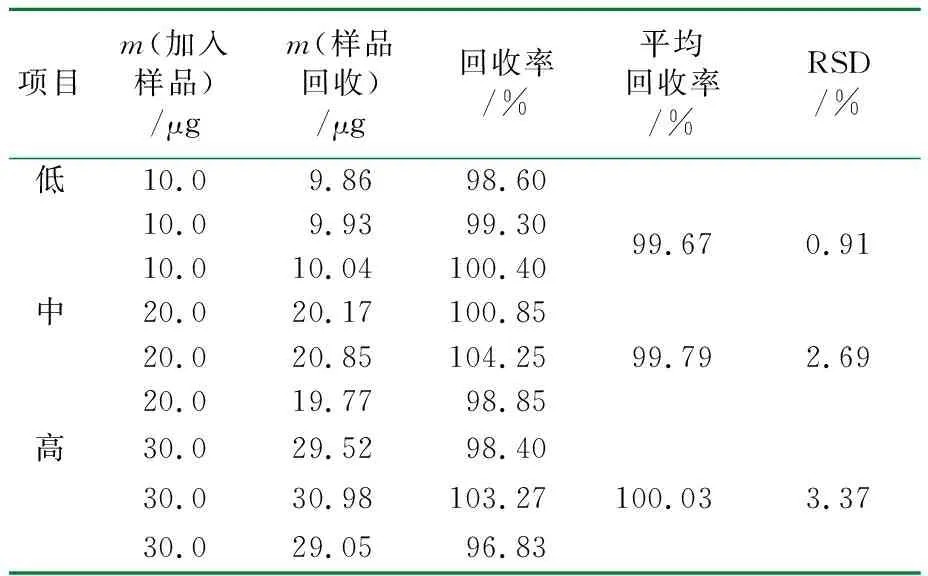
表2 加样回收率实验
由表2可知,样品在低、中、高质量浓度范围内回收率均为90%~110%,RSD值均小于5%,表明该测定方法回收率良好。
2.3.2 包封率和载药量结果
按1.6的公式计算载药胶束的包封率为(75.40±5.28)%,载药量为(15.61±4.67)%。
2.4 体外药物释放
载药胶束的体外释药曲线见图5。
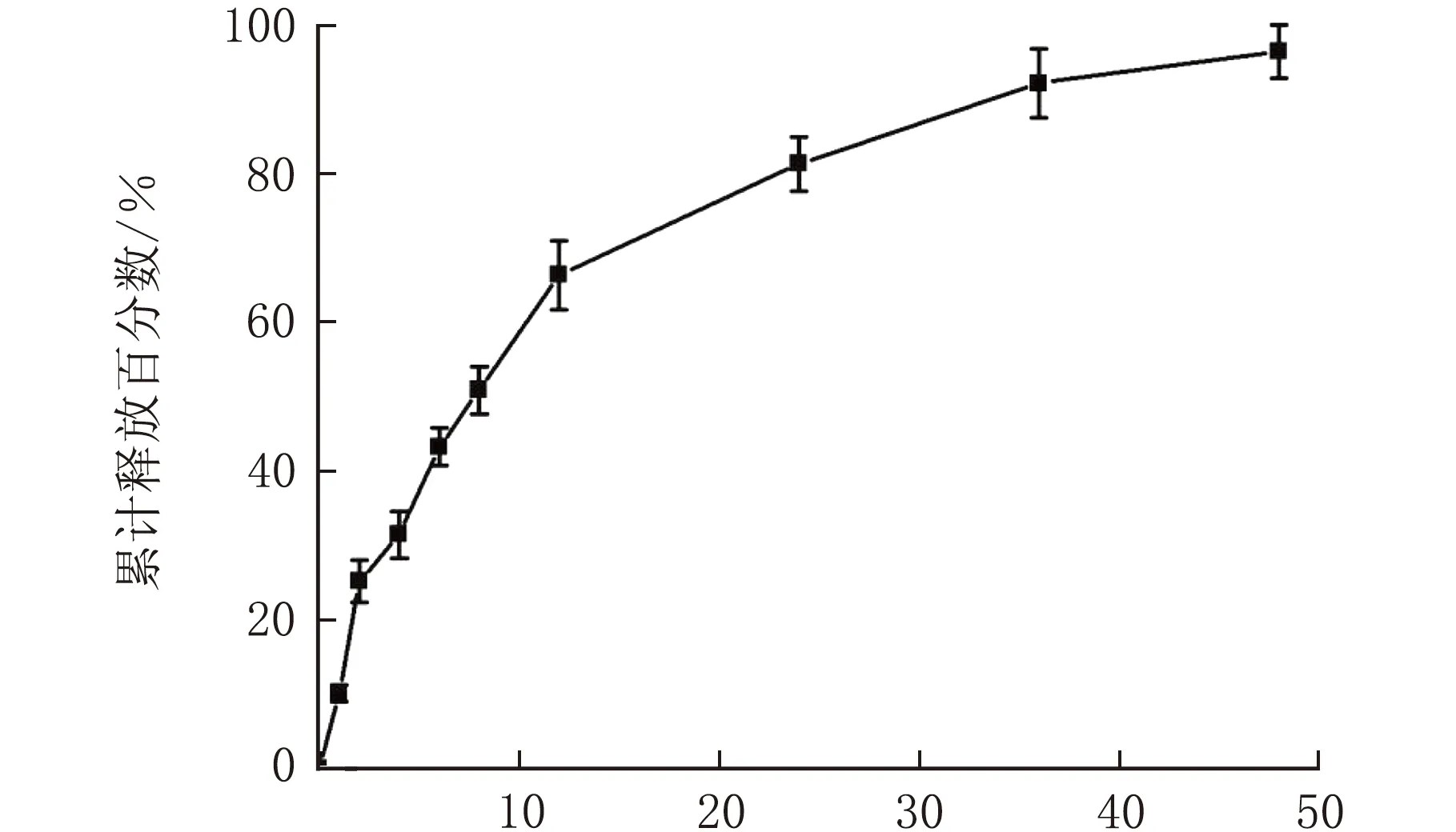
t/h
由图5可知,t=2、4 h时载药胶束的累计释放百分数分别为(50.06±2.79)%、(59.82±4.56)%,存在一定的突释现象,t=12 h,载药胶束的释放度为(66.29±4.61)%,t=24 h,载药胶束的累计释放度为(81.18±3.59)%,且释药时间可长达48 h,因此,载药胶束具有较好的缓释效果。这是由于嵌段共聚物胶束内核为疏水性,与吲哚美辛间具有较强的内聚力,可延缓药物从核心向外的扩散,使其释药速率十分缓慢[11]。
对载药胶束的释放过程分别进行零级、一级和Higuchi方程拟合,得出释药方程见表3。

表3 拟合结果
由表3可知,载药胶束的药物体外释放过程符合Higuchi方程(r2接近1),说明药物通过扩散的方式进行释放。
2.5 体外溶血实验
通过静脉注射药物时,胶束材料将与血液中大量的血红细胞接触。因此,通过体外溶血实验研究胶束材料的血液相容性非常必要[12]。不同质量浓度的胶束材料的溶血实验结果见图6。

t/h
由图6可知,随着ρ(胶束材料)的增大,溶血率逐渐增大,ρ(胶束材料)=150 mg/mL时,与血液接触0.5 h,溶血率即达到(91.87±1.23)%,当ρ(胶束材料)=1 mg/mL时,接触24 h时,溶血率均小于5%。这些结果表明,ρ(胶束材料)≤1 mg/mL具有良好的血液相容性,该质量浓度满足给药的要求,因此研究制备的载药制剂具有通过静脉内注射治疗血栓的潜力。
3 结 论
(1)研究合成了PEOz-PLA聚合物材料,制备的空白胶束的粒径较小,为(73.5±10.2)nm,载药后粒径显著增大,为(137.8±23.4)nm,空白胶束和载药胶束的PDI均小于0.3,说明胶束分散性较好,粒径均一;
(2)载药胶束的包封率为(75.40±5.28)%,载药量为(15.61±4.67)%,载药胶束具有较好的缓释效果,体外释放符合Higuchi方程;
(3)体外溶血实验结果表明,ρ(胶束材料)≤1 mg/mL具有良好的血液相容性,制备的载药制剂具有通过静脉内注射治疗血栓的潜力。
