浑浊型饲用微生态菌剂悬浮剂的制备及稳定性研究
2021-02-14高爱武李蕴华王志铭岳林芳成立新于朝晖
高爱武,凤 英,李蕴华,王志铭,岳林芳,成立新,于朝晖,宝 华
(1.内蒙古农业大学,内蒙古 呼和浩特 010018;2.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031)
动物微生态制剂又称为微生物活菌剂,是指利用动物肠道中分离得到的正常有益微生物,经过干燥、包埋或冷冻干燥等特殊工艺制成的活菌剂[1]。微生态制剂具有改善动物机体肠道菌群环境、产生酶类和促生长因子、提高机体免疫力和促进消化吸收等功能,因其安全、可直接饲喂受到众多养殖企业和科研人员的关注[2-4]。国内外动物养殖中普遍使用的饲用微生态制剂主要包括乳酸菌类、酵母菌类、芽孢杆菌类和曲霉类,常见的制备方式有单一菌制剂或复合菌制剂等。
目前,国内饲用微生态菌剂绝大部分是干粉制剂,便于运输和保存,也可有效保存活菌数。饲用微生态干粉制剂使用时可直接撒在饲料表面或混合于饲料中。由于微生态菌剂干粉的粒径较小,在使用过程中极易出现如下问题:微生态制剂干粉直接撒在饲草料上,出现混合不均匀、粉尘漂移、通过粗饲料缝隙漏到食槽底部等现象,造成动物单体饲喂量不精确,动物实际采食微生态制剂少,导致微生态制剂的浪费和损耗;部分使用者将微生态干粉制剂溶于水中使用,容易出现微生态菌剂沉淀或不易溶解等现象,因此,造成微生物在水中分散不均匀,严重影响微生态制剂的利用准确度和效果。
生产实践中常将微生态菌剂或其他功能物质添加到合适的悬浮剂中,让其均匀分散,形成稳定的悬浮体系。悬浮剂是一种液体混合体系,能够防止悬浮体系中的不溶物如微生态菌剂、固体粒子等发生沉降或聚集,从而提高悬浮体系的稳定性[5]。这类制备方法在微生物农药菌剂生产[6]、化妆品乳液生产[7]以及食品功能性悬浮液[8]的生产方面得到了较广泛的应用。而饲用微生态菌剂悬浮剂的研制及应用鲜有报道,研发一种适用于饲用微生态菌剂的悬浮剂有助于解决养殖生产中出现的上述问题,也可开发更多饲用微生态菌剂新产品。该研究以符合饲料添加剂安全标准的黄原胶和羧甲基纤维素钠为主要稳定剂成分,研制饲用微生态菌剂悬浮剂,并对其稳定性加以评价,以期为饲用微生态制剂的推广利用提供更为有效和便捷的方法。
1 材料与方法
1.1 试验材料
饲用微生态菌剂干粉购自北京好实沃生物技术有限公司,黄原胶、羧甲基纤维素钠、氯化钠、磷酸二氢钾、氢氧化钠购自国药集团,甘氨酸、吐温80购自北京索莱宝科技有限公司,琼脂粉、蛋白胨、牛肉膏购自广东环凯微生物科技有限公司。
1.2 仪器与设备
高速冷冻离心机,型号:30R,贝克曼公司产品;台式离心机,型号:TGL-20B型,上海安亭科学仪器厂产品;紫外—可见分光光度计,型号:U-2910,日本日立公司产品;高速分散器,型号:XHF-DY,宁波新芝生物科技股份有限公司产品;数字式黏度计,型号:NDJ-5S,上海菁海仪器有限公司产品;超净工作台,型号:Heraguard ECO,赛默飞世尔科技公司产品;高压灭菌锅,型号:SX-500,TOMY KOGYD产品;电子天平,型号:SQP,赛多利斯科学仪器有限公司产品。
1.3 试验方法
1.3.1混悬用粉剂的制备准确称取微生态菌剂干粉20 g、甘氨酸15 g、吐温80 2 g,之后置于大烧杯中,加入1 000 mL蒸馏水,制得混合菌液。准确称取一定量的黄原胶和羧甲基纤维素钠,以4∶1(W∶W)的比例充分混合均匀,之后将混合好的稳定剂分别按0.05%、0.10%、0.15%、0.20%、0.25%的比例(W∶V)加入制备好的混合菌液,用高速分散器混合均匀,得到添加不同比例稳定剂的饲用微生态菌剂悬浮剂。以不添加稳定剂的混合菌液作为空白对照。
1.3.2饲用微生态菌剂悬浮剂的稳定性测定以上述制备的添加不同比例稳定剂的饲用微生态菌剂悬浮剂为对象,进行稳定性评价,主要包括悬浮剂稳定系数、黏度、存放稳定性和活菌总数。
1.3.2.1悬浮剂稳定系数测定参照郎秀杰等[9]报道的方法,做适当改进。将制备好的悬浮剂,用高速分散匀浆器以10 000 r/min混匀30 s,间隔20 s,重复操作3次。分别取30 mL匀浆后的悬浮剂,每个样品稀释10倍,3 500 r/min离心20 min。离心后取上清液,在600 nm的波长下测定悬浮剂稀释样液的吸光度A1,测定上清液的吸光度A2,悬浮剂的稳定系数为R,按下列公式计算其稳定系数,测定3次,取平均值。

1.3.2.2悬浮剂黏度测定参照郭宏雨等[10]报道的方法,稍加改动。将制备好的悬浮剂,用高剪切分散匀浆器以10 000 r/min混匀30 s,间隔20 s,重复操作3次。用数字式黏度计于常温下测定悬浮液的黏度,测定3次,取平均值。
1.3.2.3悬浮剂存放稳定性测定参照杨旭[11]和陈祖满[12]报道的方法,适当加以改进。悬浮剂的存放稳定性通常用其存放期间的分层程度表示。将制备好的悬浮剂,用高速分散器以10 000 r/min混匀30 s,间隔20 s,重复操作3次。之后取50 mL匀浆后的混悬液,加入50 mL的具塞量筒,密封试管塞,记下悬浮剂的初始高度,标记为H1,于常温下静置8 h后,再记下试管中上部清液层的高度H2,用公式(2)计算悬浮剂存放稳定性。每个处理3个平行样品,测定后计算平均值。

式(2)中:H0表示分层程度,单位:%;H1表示悬浮剂液面总高度,单位:cm;H2表示悬浮剂上层清液层的高度,单位:cm。H0可反映体系的稳定性,数值越小,说明在试验时间内,分层现象越不明显,体系越稳定。
1.3.2.4悬浮剂活菌总数测定将制备好的悬浮剂,用高速分散器以10 000 r/min混匀30 s,间隔20 s,重复操作3次。取匀浆后的悬浮剂进行活菌计数,方法参照《饲料中细菌总数的测定》(GB/T 13093—2006)[13]。每个处理3个平行样品,测定后计算平均值。
1.3.2.5冷贮存稳定性测定参照谢兰芬等[14]报道的方法,并加以改进。将制备好的悬浮剂于4℃下静置存放24 h,然后用高速分散器以10 000 r/min混匀30 s,间隔20 s,重复操作3次。取匀浆后的悬浮剂,测定黏度和活菌计数,测定活菌总数。每个处理3个平行样品,测定后计算平均值。
1.4 数据分析
试验数据用Excel处理,结果以平均值±标准差表示,统计分析采用SPSS22.0软件,对试验结果进行单因素方差分析(One-Way ANOVA),应用多重比较Tukey和LSD检测各试验组数据之间的差异性。图中和表中数据标注相同小写字母,表示差异不显著(P>0.05);标注不同小写字母表示差异显著,显著性水平为P<0.05。
2 结果与分析
2.1 微生态菌剂悬浮剂稳定系数的比较
微生态菌剂悬浮剂稳定系数的变化结果见图1。由图1可知,随着稳定剂黄原胶和羧甲基纤维素钠添加比例的增加,悬浮剂的稳定系数逐渐增加。与不添加稳定剂的空白对照组相比,添加0.05%和0.10%的稳定剂后,体系的稳定系数显著(P<0.05)升高,分别达到75.44%和77.30%,但两者没有显著(P>0.05)差异。当稳定剂添加量增大到0.20%时,体系的稳定系数进一步增大,达到了91.38%,且与0.25%添加量组(91.78%)无显著(P>0.05)差异。
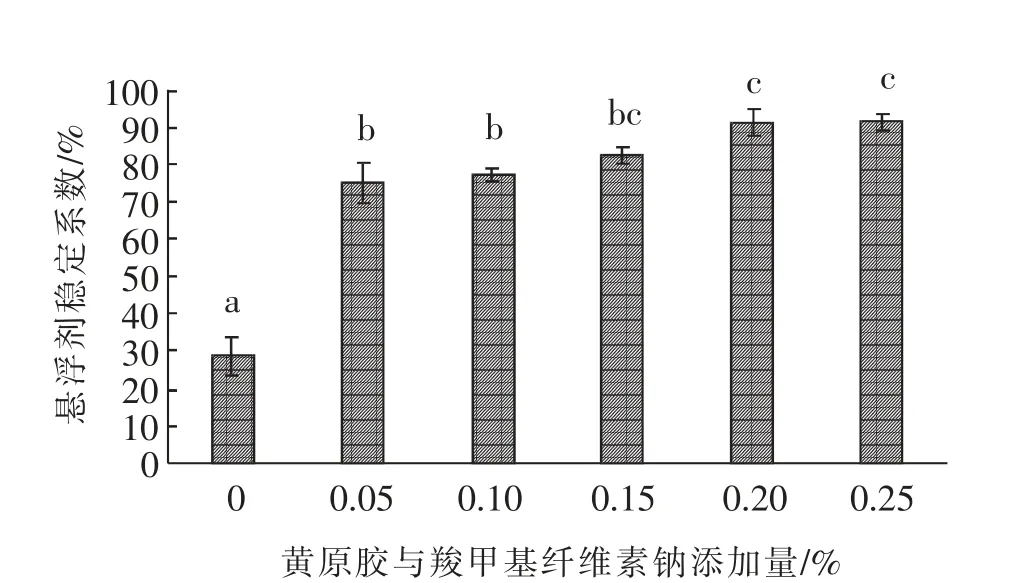
图1 稳定剂添加量对悬浮剂稳定系数的影响
2.2 微生态菌剂悬浮剂黏度的比较
图2为饲用微生态菌剂悬浮剂的黏度随稳定剂添加比例变化的结果。由图2可以看出,悬浮体系的黏度随着稳定剂添加量的增加呈现增大趋势。当体系不添加稳定剂时,黏度值为223.07 mPa·s,稳定剂的添加量达到0.20%和0.25%时,体系的黏度显著增加(P<0.05),分别达到744.43 mPa·s和853.57 mPa·s。

图2 稳定剂添加量对悬浮剂黏度的影响
2.3 微生态菌剂悬浮剂存放稳定性的比较
表1为稳定剂添加量对饲用微生态菌剂悬浮剂存放稳定性的影响结果。

表1 稳定剂添加量对悬浮剂存放稳定性的影响 单位:%
由表1可知,随着稳定剂添加量的增加,饲用微生态菌剂的分层现象得到极大缓解。当不添加稳定剂时,经过8 h的静置存放,菌剂溶液的分层程度达到97.11%,显著(P<0.05)高于添加稳定剂的各个处理组;而添加0.05%的稳定剂后,分层程度明显(P<0.05)小于对照组,下降为34.81%,当稳定剂的添加比例增大到0.20%时,在8 h的静置期间,已测量不到体系的分层现象,可以认为,0.20%的稳定剂添加量可以完全实现饲用微生态菌剂悬浮剂的稳定存放,确保不出现分层,保证体系的稳定性。该研究选择静置存放时间8 h作为评定悬浮体系存放稳定性的时间间隔,这是因为在使用过程中推荐的使用方法为现用现配,这样既有利于维持微生态菌剂中的活菌数,又可以减少存放需要的冷藏条件,达到使用便利的效果。
2.4 微生态菌剂悬浮剂活菌总数的比较
稳定剂添加量对饲用微生态菌剂悬浮剂活菌总数的影响结果见表2。
由表2可知,在所有测定条件下,体系中的活菌数均维持在109CFU/mL以上,说明该研究制备的饲用微生态菌剂悬浮剂可以保证较高的活菌数。在不经过冷藏时,微生态菌剂水溶液中加入稳定剂后,体系中的活菌总数整体呈现下降趋势,当稳定剂添加量达到0.10%时,体系中的细菌总数出现显著(P<0.05)下降,之后细菌总数的变化变得相对稳定,随着稳定剂添加量继续增加,各组细菌总数没有表现出显著差异。

表2 稳定剂添加量对悬浮剂活菌总数的影响 单位:109 CFU/mL
2.5 微生态菌剂悬浮剂冷贮存后稳定性的变化
饲用微生态菌剂悬浮剂经过冷贮存的稳定性变化通过悬浮剂的黏度和活菌总数表示,黏度的变化结果见图3,活菌总数的结果见表3。
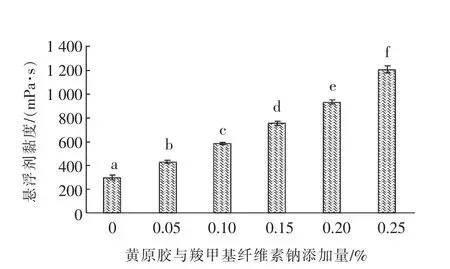
图3 稳定剂添加量对冷贮存悬浮剂黏度的影响
24 h的冷贮存后悬浮剂的黏度变化呈现与常温条件下相似的变化规律,随着稳定剂添加量的增加,体系的黏度呈现逐渐增大趋势,体系的黏度由300.73 mPa·s(稳定剂添加量为0)增加到1 206.90 mPa·s(稳定剂添加量为0.25%),稳定剂添加比例每增加0.05%,体系的黏度均出现显著增加(P<0.05)。
由表3可知,将制得的微生态菌剂悬浮剂置于4℃条件下,经过24 h的低温保存,在所有稳定剂浓度情况下,悬浮体系中的活菌总数出现不同程度的下降,说明长时间低温保存对微生态菌剂中的细菌活性造成一定不利影响。与空白对照组相比,稳定剂的添加量达到0.10%时,冷贮存后悬浮体系的活菌数出现显著下降(P<0.05),这一变化趋势与不经冷贮存的悬浮剂的变化一致,说明稳定剂的加入抑制了体系中微生物的活性。

表3 稳定剂添加量对悬浮剂冷贮存后活菌总数的影响 单位:109 CFU/mL
3 讨论
对于一个分散体系来说,黏度是衡量其在一定的剪切作用下体系稳定性的重要指标。添加黄原胶的饲用微生态菌剂悬浮液是一种典型的假塑性流体,当搅拌产生的剪切速率增加时,体系的黏度会出现下降,即悬浮液发生剪切变稀行为[15]。因此,在较低的剪切速率下,包含黄原胶的悬浮液具有相对较高的黏度;逐步增加搅拌速率,即提高剪切速率能造成体系黏度下降;当剪切作用停止后,黄原胶悬浮液的黏度会迅速恢复正常[16-18]。因此,制备饲用微生态菌剂悬浮剂时,添加黄原胶作为稳定剂,为了实现菌剂在体系中的均匀分布,需要考虑匀浆时转速对体系稳定性的影响。
黏度表示的是液体流动过程中内部分子间产生的内摩擦力,能够反映悬浮剂体系内大分子之间、大分子与溶剂分子的相互作用力,这种作用力受温度影响[19]。当温度升高时,溶液中的溶质分子获得更高的内能,热运动加剧,分子间的相互作用力减小,内摩擦力降低,溶液黏度下降[20]。该试验结果表明,冷贮存后体系的黏度与相同稳定剂添加比例的常温组别相比,均出现一定程度的增加,反映了温度对微生态菌剂悬浮剂黏度的影响。这是因为随着温度的降低,悬浮剂体系内的各种大分子链的活动能力减弱,溶液的流动性变差,从而导致微生态菌剂悬浮剂溶液的黏度增大。
对于饲用微生态菌剂悬浮剂的使用,理想的情况是体系的黏度控制在一定的范围内,既不能太小,也不能太大。黏度太小不利于微生态菌剂在体系中稳定悬浮,容易造成菌体沉降,体系出现分层。而过高的黏度不利于微生态菌剂的顺利喷洒。该研究的目的是制备能够进行方便快捷喷洒的饲用微生态菌剂悬浮剂,使饲用微生态菌剂均匀悬浮于溶液中。在使用时通过压力喷壶或其他喷洒装置,可将微生态菌剂均匀喷洒出去,并黏附于饲料颗粒。过高的黏度将增加微生态菌剂喷洒时的阻力,并容易造成喷头堵塞等问题,因此,在进行饲用微生态菌剂悬浮剂制备时,需控制在适当的黏度范围内。
4 结论
随着稳定剂添加量增大,制成的悬浮剂稳定系数、黏度都呈递增的趋势,当稳定剂添加量≥0.15%,悬浮剂体系逐渐趋于稳定,当稳定剂添加量达到0.20%时,无分层现象出现。无论在常温还是冷贮存24 h后,制成的悬浮剂中活菌的存活率均保持在109CFU/mL以上,能够保证饲用微生态菌剂的有效活菌数。
