西妥昔单抗联合放化疗治疗宫颈癌的临床效果
2021-02-13王艳霞孙国庆宋俊霞
王艳霞 孙国庆 宋俊霞
(1 河南圣德医院放射治疗科,河南 信阳 464000; 2 焦煤集团中央医院妇科)
宫颈癌是女性常见的恶性肿瘤,其发病率在全球女性生殖系统癌症中位居第二,仅次于乳腺癌,其死亡率位居全球女性生殖系统肿瘤的首位[1]。近年来,我国宫颈癌患者的发病呈年轻化趋势,对女性的身心健康造成极大的危害。调查显示,约有66.7%的宫颈癌患者确诊时已处于中晚期,错过最佳手术时机[2]。目前,放疗和化疗是无法手术治疗的宫颈癌患者最为常用的治疗手段[3]。西妥昔单抗为分子靶向药物,属于表皮生长因子受体(EGFR)酪氨酸激酶抑制剂,可竞争性抑制EGFR与其配体结合,从而降低EGFR对肿瘤增殖、浸润的促进作用[4]。研究显示,宫颈癌患者血清中EGFR的表达水平增高,给予西妥昔单抗后可抑制其表达[5],但是关于西妥昔单抗联合放疗对无法手术治疗的宫颈癌患者的疗效仍需探讨。鉴于此,本研究针对108例无法手术治疗的宫颈癌患者的资料进行回顾性分析,探讨该治疗方案的临床效果与安全性。
1 资料与方法
回顾性分析我院2013年1月—2015年9月收治的108例无法手术治疗的宫颈癌患者的临床资料。纳入标准:①经活检证实为宫颈癌,均明确临床分期且临床资料完整者;②肿瘤直径≥4 cm、盆腔淋巴结多发转移者;③因无法耐受切除手术、预期手术效果不佳、患者自身意愿等原因未实施手术者;④随访资料完整者。排除标准:①实施其他方案治疗者;②转移性宫颈癌或切除术后复发者;③耐受性差中断治疗者;④伴有其他脏器功能障碍者;⑤存在精神障碍或其他系统性疾病者;⑥妊娠期或哺乳期女性患者。根据治疗方式不同,分为基础化疗+放疗组(A组)52例和西妥昔单抗联合放化疗组(B组)56例。
A组患者均采用的是基础化疗+放疗。基础化疗方案包括顺铂、氟尿嘧啶+顺铂、顺铂+多西紫杉醇(DP)方案和顺铂+紫杉醇(TP)方案,均静脉滴注,持续治疗2个周期。放疗:采用320排CT增强扫描定位的精准放疗,照射范围上界:第4、5腰椎间;下界:闭孔下缘;外界:两侧真骨盆外1.5 cm,盆腔放射剂量45 Gy/25 F,若患者阴道受侵,则需再给予阴道受侵部位补量20 Gy/4 F,总疗程为7周。
B组在A组放化疗的基础上给予西妥昔单抗治疗。西妥昔单抗(德国默克里昂制药公司,批准文号:S20050095,规格:100 mg∶20 mL),初始剂量以400 mg/m2体表面积静脉滴注120 min,其后每周250 mg/m2体表面积静脉滴注60 min,每周1次,持续7周。
记录两组患者治疗前和治疗后1个月时血清中鳞状上皮细胞癌抗原(SCC)、糖类抗原125(CA125)和癌胚抗原(CEA)水平,以及治疗后1个月内不良反应,主要包括恶心、呕吐、便秘、骨髓抑制、痤疮样皮疹、生殖系感染、膀胱刺激征等症状。患者的临床疗效参照《实体瘤治疗疗效评价标准——RECIST》评价[6],可分为完全缓解(CR)、部分缓解(PR)、稳定(SD)与进展(PD)。CR:目标病灶消失且维持≥4周;PR:目标病灶体积缩小≥30%且维持≥4周;SD:目标病灶体积缩小<30%或增大<30%,且维持≥4周;PD:目标病灶体积增大≥30%或出现新病灶。随访3年,随访方式为电话或到院复诊,计算两组患者3年生存比例。
2 结 果
2.1 两组患者的一般资料比较
A组患者年龄29~65岁,平均(42.45±6.83)岁;其中原位癌10例,浸润癌42例;病理类型:鳞癌43例,腺癌7例,腺鳞癌2例;临床分期:Ⅱb期25例,Ⅲa期7例,Ⅲb期10例,Ⅳ期10例;化疗方案:顺铂方案7例,氟尿嘧啶+顺铂方案15例,DP方案16例,TP方案14例。B组患者年龄26~63岁,平均(42.42±6.96)岁;其中原位癌9例,浸润癌47例;病理类型:鳞癌45例,腺癌8例,腺鳞癌3例;临床分期:Ⅱb期27例,Ⅲa期8例,Ⅲb期11例,Ⅳ期10例;化疗方案:顺铂方案8例,氟尿嘧啶+顺铂方案16例,DP方案17例,TP方案15例。两组患者的一般临床资料比较差异无显著性(P>0.05)。
2.2 两组患者的临床疗效及不良反应各指标比较
B组患者的临床疗效优于A组(Z=10.78,P<0.05)。见表1。

表1 两组患者的临床疗效比较[例(χ/%)]
两组患者治疗后1个月时血清中SCC、CA125、CEA水平较治疗前均显著下降(t=16.80~23.71,P<0.05);B组患者治疗前后血清中SCC、CA125、CEA水平的差值全部显著高于A组(t=-27.95~-4.40,P<0.05)。见表2。

表2 两组患者治疗前后血清中肿瘤标志物水平比较
两组患者治疗后1个月内恶心、呕吐、便秘、骨髓抑制、生殖系感染的不良反应发生比例比较无显著差异(P>0.05);A组患者痤疮样皮疹、膀胱刺激征发生比例比较明显低于B组(P=0.04、0.02);A、B组患者3年生存比例为69.23%、80.36%,两组比较有显著差异(χ2=5.14,P<0.05)。结果见表3。
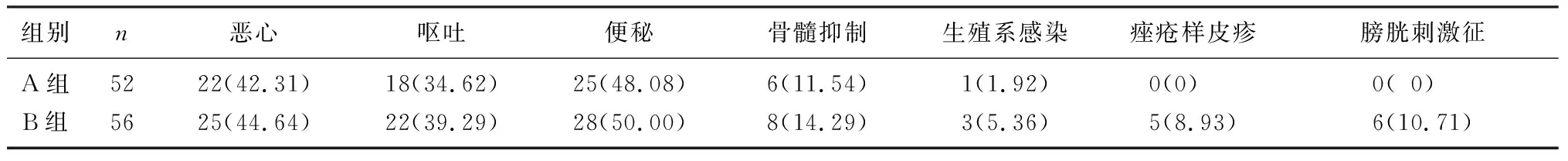
表3 两组患者治疗前后不良反应发生情况比较[例(χ/%)]
3 讨 论
宫颈癌的发生与多种因素存在密切关联,该病常见的危险因素包括人乳头瘤病毒感染、吸烟、多个性伴侣等[7-8]。目前临床上针对无法手术治疗的宫颈癌患者多主张实施放化疗,但是疗效不甚理想,且安全性不佳,患者的远期生存率较低。研究显示,在无法手术治疗的宫颈癌患者中同步放化疗可有效提高疗效,且并不会显著增高不良反应发生率,还可提高远期生存率,但理想的联合放化疗方案仍有待进一步探讨[9]。西妥昔单抗对鼻咽癌放疗患者具有增敏作用,且能够抑制宫颈癌组织中EGFR的表达,故本研究尝试将该药物与放化疗联用治疗无法手术治疗的宫颈癌患者。
西妥昔单抗属于一种特异性的EGFR人鼠嵌合型免疫球蛋白抗体,能够与人体正常细胞和肿瘤细胞的EGFR胞外段特异性结合,从而对EGFR与其配体的结合过程产生竞争性抑制作用,有助于阻断受体相关激酶的磷酸化,抑制细胞增殖,还可诱导细胞凋亡[10-11]。研究显示,西妥昔单抗能够控制恶性肿瘤患者血管内皮生长因子和金属蛋白激酶的产生,启动抗体依赖性免疫细胞介导的细胞毒作用,通过上述多种途径发挥抗肿瘤效应[12]。精准放疗是目前常用的放疗手段,能充分考虑到放疗对机体正常组织的损害,从而尽可能缩小放疗范围,并最大程度发挥对恶性肿瘤细胞杀灭作用[13]。在精准放疗实施过程中,临床医师能够借助计算机对恶性肿瘤患者进行个体化治疗,不仅能满足不同剂量梯度,还可提高局部肿瘤的灭活度,降低副作用[14]。本研究结果示,B组患者临床疗效明显优于A组,提示在单纯基础化疗和精准放疗同时联合应用西妥昔单抗对无法手术治疗的宫颈癌患者临床效果良好。
SCC属于肿瘤相关抗原,存在于鳞状细胞癌的细胞浆内,其水平升高与宫颈鳞癌患者的临床特征紧密相关,且能够预测患者的远期生存率,即血清中SCC水平越高,宫颈鳞癌患者的远期生存率越低,两者呈负相关[15-16]。CA125在宫颈癌、卵巢癌、子宫内膜癌等恶性肿瘤患者血清中的水平均异常升高,与临床分期、淋巴结转移和分化程度均呈明显相关性,且该因子水平能够用于预测放化疗效果,指导临床治疗方案的选择[17]。CEA属于一种蛋白多糖复合物,广泛存在于结肠癌、宫颈癌、肝癌等恶性肿瘤中,具有人胚胎抗原决定簇,是广谱肿瘤标志物,且与宫颈癌患者的临床病理特征均具有密切的关系[18]。本次研究中将西妥昔单抗与放疗联合应用于实施基础化疗的无法手术治疗的宫颈癌患者中,结果显示治疗1个月以后,两组患者血清中SCC、CA125、CEA水平均较治疗前显著下降,B组患者治疗前后血清中SCC、CA125、CEA水平的差值均显著高于A组,提示对无法手术治疗的宫颈癌患者给予西妥昔单抗联合放化疗能够显著控制其血清肿瘤标志物水平。
本研究结果显示,治疗后1个月内,两组患者恶心、呕吐、便秘、骨髓抑制、生殖系感染发生比例差异无显著性,A组患者痤疮样皮疹、膀胱刺激征发生比例明显低于B组,B组患者3年生存比例明显高于A组,提示西妥昔单抗联合放疗可增加无法手术治疗的宫颈癌患者痤疮样皮疹、膀胱刺激征的发生风险,也可提高3年生存比例。痤疮样皮疹、膀胱刺激征分别是西妥昔单抗、放疗常见的不良反应,提示临床医生在治疗过程中需注意观察患者局部皮肤是否有异常,是否有膀胱刺激征表现,做好预防和控制。有研究显示,西妥昔单抗能够增强鼻咽癌患者对放疗的敏感性,提高有效性,从而有助于提升远期生存率[19-20]。但是西妥昔单抗是否能够增强无法手术治疗的宫颈癌患者放疗的敏感性,仍需进一步探讨。
综上,在无法手术治疗的宫颈癌患者中行西妥昔单抗联合基础放化疗,不仅能够提升疗效,降低血清肿瘤标志物水平,还可提高患者3年生存比例。但是该方案可增加痤疮样皮疹和膀胱刺激征的发生比例,需引起高度重视。另外,本研究仍存在明显不足:①随访时间短,治疗后5年的生存率仍需随访统计;②西妥昔单抗是否能够增强此类患者放疗的敏感性及其作用机制仍有待深入探讨。
