池塘养殖红螯螯虾个体大小与肠道细菌的关系分析
2021-02-12袁若男杨慧赞黄黎明杜雪松
袁若男,杨慧赞,黄黎明,黄 峥,杜雪松,马 元,吕 敏,王 瑞
(广西壮族自治区水产科学研究院,广西 南宁 530021)
【研究意义】红螯螯虾(Cheraxquadricarinatus)属十足目甲壳类动物,原产于澳大利亚,具有体型大、繁殖力强和生长快等特点,是优质淡水养殖虾种[1]。但在红螯螯虾养殖过程中发现,同一养殖池塘中既有个体大的红螯螯虾,也有个体小的红螯螯虾,且个体大小差异明显,不利于红螯螯虾养殖业的可持续发展。肠道是虾类重要的消化吸收器官,不同的肠道微生物在虾类肠道中共同生存、相互制约,形成了一个动态平衡的微生物结构[2]。利用复合菌剂可缓解高密度养殖红螯螯虾肠道菌群群落间的竞争,显著减弱环境胁迫相关的代谢(膜运输和细胞运动),也可显著降低基于碳、氮、磷基本营养元素的代谢(脂肪代谢、氨基酸代谢和碳水化合物代谢),提高红螯螯虾的免疫力和存活率[3]。因此,探究红螯螯虾肠道微生物与其个体大小间的关系,对筛选虾类益生菌、促进红螯螯虾养殖业的健康发展具有重要意义。【前人研究进展】前人研究认为,在缺乏肠道微生物情况下宿主的正常发育受阻,免疫功能收到损害[4],潜在的有害菌和益生菌均是宿主肠道微生物群的重要成员[5],肠道有害菌在许多系统性疾病如乳糜泻[6]和帕金森病[7]的发病机制中发挥直接作用[8],通过增加有益菌群改变肠道微生物组成,可提高有益代谢产物的生成,增强宿主对病原体的抵抗力,促进宿主生长[9]。微生物在肠道中定殖且在宿主的生长发育、营养代谢、病原防御和免疫调节等方面发挥重要作用,其中一些微生物在促进宿主营养代谢方面既可作为营养来源供宿主利用,也可产生一些酶促进宿主对食物的消化,从而使宿主获得有利于自身生长发育和维持健康所需的营养[10-11]。乳酸杆菌因其产生抗微生物物质(乳酸和细菌素)、消化酶(淀粉酶、脂肪酶和蛋白酶等)和辅酶(叶酸和钴胺素)等被认为是非常重要的有益菌[12-13],其分泌的细菌素可降低动物肠道的pH,通过竞争营养物质改变肠道的群落结构,减少病原菌的生存机会[14]。Panigrahi等[15]研究表明,在生物絮凝系统中添加芽孢杆菌可提高印度白对虾(Penaeusindicus)的生长速度和免疫力。Du等[16]用戊糖乳杆菌HC-2喂养凡纳滨对虾(Litopenaeusvannamei),能改善其营养结构,增强免疫调节作用,显著提高其免疫基因表达、免疫酶活性和消化酶活性。Shui等[17]研究认为,在相同条件下饲养的红色沼泽小龙虾,其肠道微生物群存在的差异可能不是养殖水体中微生物差异的简单反映,而是物种特异性饮食、肠道形态、营养水平和系统发育的结果。在肠道细菌与其个体大小的关系方面,Wu等[5]研究表明,放线菌是一类能在草鱼肠道中发挥分解纤维素作用的细菌;王微微等[10]对比大、小个体草鱼肠道微生物差异,结果发现放线菌仅存在于大个体草鱼肠道中,且大个体草鱼具有较强的纤维素消化降解能力;Ni等[18]研究发现,同一池塘中大个体草鱼可能会抢占食物资源,并抑制小个体草鱼的摄食行为,造成小个体草鱼营养摄入不足,致使得小个体草鱼肠道黏膜中厚壁菌门比例较少。Semova等[19]研究结果显示,大个体草鱼的肠道黏膜微生物中拥有比小个体草鱼更高比例的厚壁菌门,可能与厚壁菌门细菌能促进肠上皮细胞吸收有关。【本研究切入点】目前,有关红螯螯虾的肠道微生物对其个体生长影响的研究鲜见报道。【拟解决的关键问题】利用高通量测序技术对池塘养殖红螯螯虾的肠道16S rDNA基因V3~V4区进行测序分析,探究红螯螯虾个体大小与肠道细菌组成及其多样性和功能的关系,为红螯螯虾益生菌筛选及健康养殖提供参考依据。
1 材料与方法
1.1 试验材料
红螯螯虾采自广西南宁市苏圩镇同一池塘同一批次放养的红螯螯虾养殖基地,池塘水温27.2 ℃。样品分为大个体组(PB组)和小个体组(PS组),每组3个重复。无菌采集红螯螯虾的后肠,将5尾的后肠及其内容物混合为1个重复,保存于-80 ℃冰箱备用。红螯螯虾个体样本信息如表1所示。
1.2 细菌基因DNA提取及高通量测序
从-80 ℃冰箱中取出红螯螯虾样品,冰上融化后,按照HiPure Stool DNA Kit[购自Magen(中国)生物公司]说明提取总DNA。采用PCR扩增肠道菌群16S rDNA基因的V3~V4区序列,使用引物为341F(5′-CCTACGGGNGGCWGCAG-3′)和806R(5′-GGACTACHVGGGTATCTAAT-3′)。PCR反应体系50.0 μL:10×KOD Buffer 5.0 μL,2 mmol/L dNTPs 5.0 μL,上、下游引物(10 μmol/L)各1.5 μL,KOD聚合酶1.0 μL,MgSO4(25 mmol/L)3.0 μL,DNA模板100 ng,补超纯水至50.0 μL。扩增程序:94 ℃预变性2 min;98 ℃ 10 s,62 ℃ 30 s,68 ℃ 30 s,进行30个循环;68 ℃延伸5 min。PCR产物经2%琼脂糖凝胶电泳检测后,参考AxyPrep DNA Gel Extraction Kit(购自Axygen Biosciences公司,美国)说明进行回收,采用ABI StepOnePlus Real-Time PCR System进行定量后送至广州基迪奥生物科技有限公司在Illumina平台进行PE250测序。
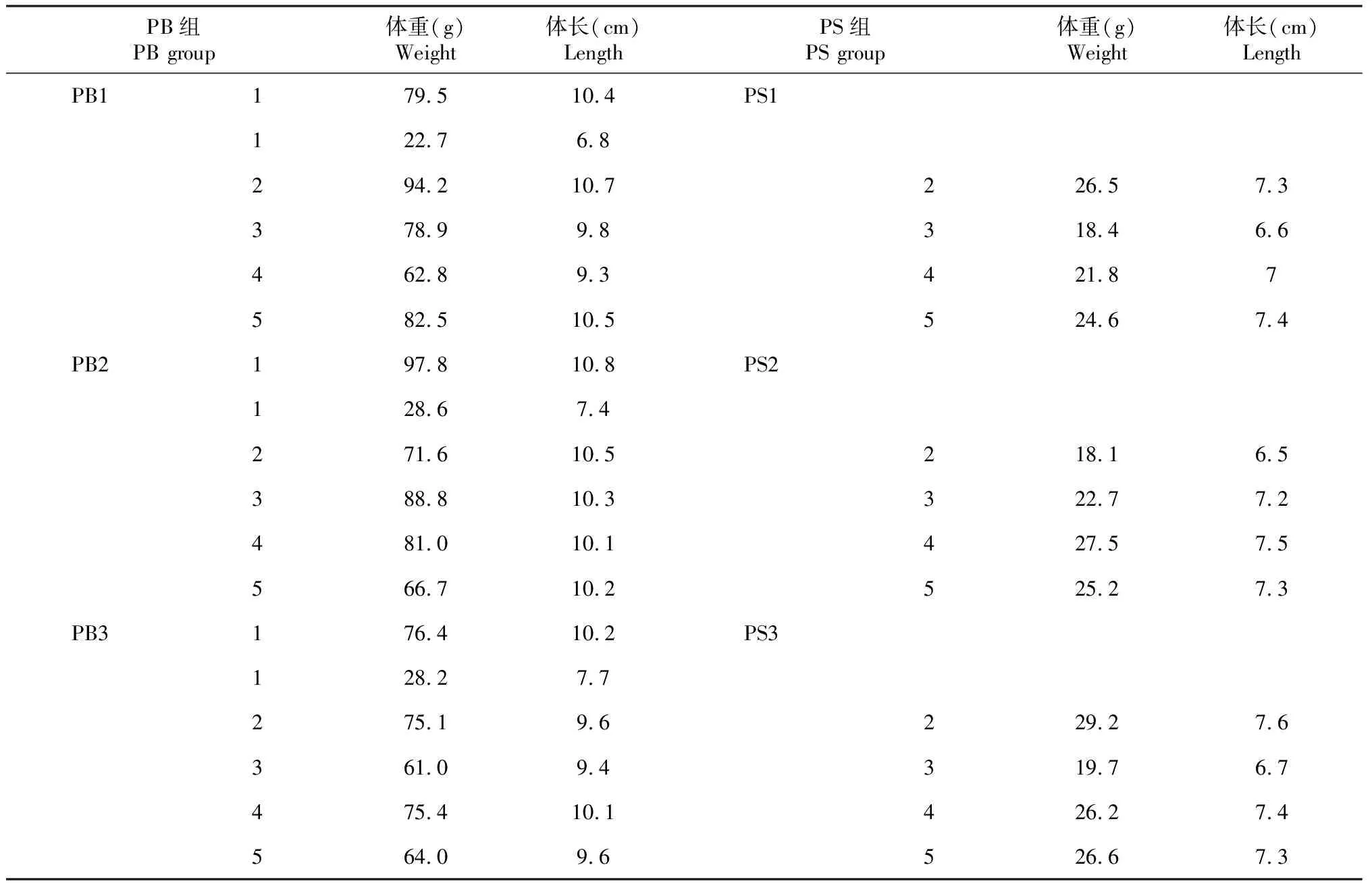
表1 池塘养殖的红螯螯虾样品信息
1.3 高通量测序结果生物信息学分析
红螯螯虾肠道细菌高通量测序结果借助基迪奥公司在线实时交互式数据分析平台Omicsmart(http://www.omicsmart.com)进行分析。主要分析步骤:Illumina MiSeq高通量测序,序列拼接和质控;采用USEARCH的UPARSE算法进行样品运算分类单元(OTU)聚类分析,相似度大于97%的序列聚为一类,计算获得每个OTU在各样品中的Tags绝对丰度和相对信息;采用RDP Classifier的Naïve bayesian assignment算法,参考Greengene数据库的物种注释(设定置信度的阈值为0.8~1.0)对代表性OTUs进行物种注释;进行Alpha多样性(Chao1指数、Ace指数、Simpson指数和Shannon指数)分析;在生物学分类的门、目、属水平进行细菌群落结构和相对丰度分析;使用Tax4Fun对16S序列的SILVA数据库注释进行KEGG功能预测及KO丰度统计,预测功能通过Welch’s T检验,获得丰度均值显著差异的功能聚类。
1.4 统计分析
试验数据采用SPSS 26.0进行单因素方差分析(One-way-ANOVA),以R语言Vegan包和Excel 2016制图。
2 结果与分析
2.1 红螯螯虾的个体生长差异分析
由表2可知,PB组的15尾红螯螯虾平均体长为(10.10±0.47)cm,平均体重为(77.05±10.99)g;PS组的15尾红螯螯虾平均体长为(7.18±0.37)cm,平均体重为(24.40±3.67)g。T检验结果显示,两组红螯螯虾样本的体长和体质量在统计学上均存在极显著差异(P<0.01,下同)。
2.2 肠道菌群16S rDNA基因的高通量测序结果分析
由表3可知,对红螯螯虾后肠样品进行测序,经优化共获得727 528个有效序列,其中有物种注释序列661 047个。从图1可看出,红螯螯虾肠道细菌中共检出1433个OTUs,其中,PB组共检出1211个(PB1、PB2和PB3分别检出930、1083和1013个)OTUs,PS组共检出587个(PS1、PS2和PS3分别检出663、732和633个)OTUs;PB组和PS组肠道微生物共同的OTUs有365个(占总OTUs数的25.47%),PB组和PS组肠道微生物各自独有846和222个OTUs(分别占总OTUs数的59.04%和15.49%),归属于23门51纲97目150科236属。说明PB组和PS组红螯螯虾肠道细菌种类具有一定共性,但PB组红螯螯虾肠道细菌的种类比PS组更丰富。

表2 PB组和PS组红螯螯虾的体型差异
2.3 红螯螯虾肠道细菌的菌群多样性分析结果
红螯螯虾肠道细菌群落Alpha多样性分析结果(表4)显示,PB组的Chao1指数和Ace指数均极显著高于PS组,表明PB组菌群的物种丰富度极显著高于PS组;PB组的Shannon指数极显著高于PS组,说明PB组菌群的多样性极显著高于PS组;PB组和PS组的覆盖度分别为99.747%和99.750%,表明测序深度已基本覆盖样品的所有物种,未被检测到菌种的概率极低,所得测序数据基本能代表细菌群的真实情况。从图2可看出,所有样品的稀释曲线均趋向平坦,说明测序数据量合理,可反映样本中绝大多数微生物的信息。
2.4 红螯螯虾肠道细菌的群落组成分类及比较
2.4.1 在门水平上的分类及比较 从图3可看出,红螯螯虾肠道细菌群落在门水平主要为变形菌门、软壁菌门、厚壁菌门、浮霉菌门、蓝藻菌门、梭菌门、放线菌门、古生菌门、绿弯菌门和拟杆菌门;PB组的优势菌门是厚壁菌门,在门组成中占比42.87%,PS组的优势菌门是变形菌门,在门组成中占比59.77%;软壁菌门在PB组和PS组的门组成中占比均较高,分别为27.19%和30.29%;浮霉菌门、放线菌门和古生菌门在PB组门组成中占比高于在PS组的占比。此外,PB组的变形菌门在门组成中占比仅为18.45%,而PS组的厚壁菌门在门组成中占比仅6.79%。说明池塘养殖大、小个体红螯螯虾的肠道细菌群落在门水平上具有一定共性也存在较大差异。

表3 不同样本红螯螯虾肠道细菌的OTUs和Tags数量统计
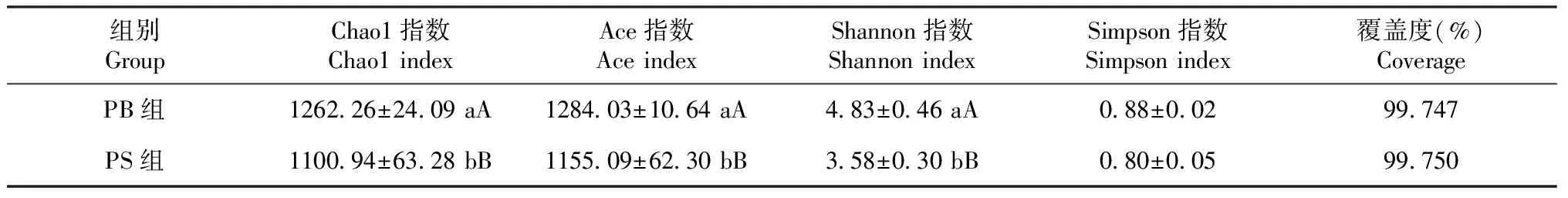
表4 PB组和PS组红螯螯虾肠道细菌的Alpha多样性分析结果
2.4.2 在目水平上的分类及比较 从图4可看出,红螯螯虾肠道细菌群落相对丰度排名前10位的菌目分别为肠杆菌目、支原体目、梭菌目、乳杆菌目、假单胞菌目、出芽菌目、气单胞菌目、弧菌目、叶绿体和芽单胞菌目;肠杆菌目在PS组目组成中占比57.01%,在PB组目组成中占比9.17%;梭菌目在PB组目组成中占比41.25%,在PS组目组成中占比1.11%;支原体目在PB组和PS组目组成中占比均较高,分别为26.89%和29.17%;乳杆菌目、假单胞菌、出芽菌目、气单胞菌目和芽单胞菌目在PB组与PS组目组成中占比虽较低,但组间存在较大差异。可见,池塘养殖大个体红螯螯虾肠道细菌群落梭菌目、假单胞菌目和出芽菌目等在目水平上的占比高于小个体红螯螯虾。
2.4.3 在属水平上的分类及比较 从图5可看出,PB组红螯螯虾肠道细菌群落相对丰度大于1.00%的属共有9个,分别为假丝酵母菌属(Candidatus_bacilloplasm,26.87%)、柠檬酸杆菌属(Citrobacter,4.99%)、 梭菌属(Clostridium_sensustricto_ 1,30.83%)、不动杆菌属(Acinetobacter,3.76%)、气单胞菌属(Aeromonas,2.70%)、梭状芽胞杆菌属(Clostridium_sensustricto_11,2.79%)、邻单胞菌属(Plesiomonas,2.28%)、副杆菌属(Paraclostridium,1.75%)和弧菌属(Vibrio,1.25%),而未鉴定的细菌属占总细菌属12.42%;PS组相对丰度大于1.00%的属共有4个,分别为假丝酵母菌属(29.00%)、柠檬酸杆菌属(36.07%)、乳球菌属(Lactococcus,4.53%)和不动杆菌属(1.18%),而未鉴定的细菌属占总细菌属22.25%。说明梭菌属和梭状芽胞杆菌属是池塘养殖大个体红螯螯虾肠道细菌群落的特有菌属。
2.5 红螯螯虾肠道的细菌群落功能分析
红螯螯虾肠道细菌群落通过KEGG功能预测及KO丰度统计发现,大多数富集的KEGG通路与代谢功能相关,排名前10位的功能聚类分别为碳水化合物代谢、膜运输、氨基酸代谢、信号转导、能量代谢、辅助因子和维生素代谢、核苷酸代谢、翻译、复制和修复及传染病(图6)。Welch’s T检验结果(图7)表明,PS组红螯螯虾肠道菌群的影响因子及聚糖生物合成与代谢功能的丰度显著高于PB组(P<0.05,下同),氨基酸代谢、外源生物降解与代谢、萜类化合物和聚酮类化合物的代谢、其他次生代谢产物的生物合成及运输和分解物代谢功能的丰度显著低于PB组。说明池塘养殖的小个体红螯螯虾在脂代谢方面强于大个体,而大个体红螯螯虾在氨基酸代谢、聚酮类代谢、外源生物降解和代谢、消化系统和免疫系统等方面均强于小个体。
3 讨 论
本研究基于16S rDNA高通量测序技术对同一池塘、同一批次养殖的红螯螯虾肠道微生物V3~V4区进行测序分析,获得大量、全面且深入的菌群信息,发现PB组与PS组红螯螯虾肠道细菌菌群具有一定共性,也存在较明显差异。其中,PB组独有的OTUs数为846个,占OTUs总数的59.04%,PS组独有的OTUs数为222个,占OTUs总数的15.49%;Alpha多样性分析结果显示,PB组肠道细菌的丰富度和多样性均极显著高于PS组,这种差异的产生可能与大个体红螯螯虾能优先抢占食物资源和更好的生活空间、小个体红螯螯虾长期处于更低社会等级及受到环境胁迫和摄食压力较大有关[20]。
本研究结果显示,在红螯螯虾后肠细菌群落门组成中,PS组的变形菌门占比59.77%,软壁菌门占比30.29%、厚壁菌门占比6.79%,而PB组的变形菌门占比18.45%,软壁菌门占比27.19%,厚壁菌门占比42.87%,说明变形菌门在小个体红螯螯虾的肠道细菌中占较大比例,在大个体红螯螯虾的肠道细菌中所占比例相对较小,但厚壁菌门在大个体红螯螯虾的肠道细菌中占比较大,在小个体红螯螯虾的肠道细菌中所占比例相对较小,与前人研究结果[17,21-24]相似。
Guo等[23]研究表明,暴露于亚硝酸盐和硫化物中的克氏原螯虾(Procambarusclarkii),其肠道细菌多样性降低,组成受到破坏,微生物群落功能及其稳定性受到损害。张棋麟等[25]研究发现,暴露于氯化汞中的斑马鱼,其肠道菌群在门水平的相对丰度受到显著影响,变形菌门和厚壁菌门相对丰度显著下降。Jin等[26]研究结果显示,斑马鱼暴露于高浓度杀菌剂抑菌唑21 d后,其肠道内变形菌门相对丰度降低,厚壁菌门相对丰度显著升高。Shu等[27]研究认为,变形菌门已被鉴定为活性污泥中最丰富的菌门之一,在降解复合碳和去除氮方面发挥着关键作用。变形菌门是虾类肠道中最丰富、定殖最有效的细菌菌门,其丰度增加会提高虾类的潜在疾病风险[22,28]。本研究结果与上述研究结果相似,小个体红螯螯虾肠道菌群的变形菌门在其门组成中的占比显著高于大个体红螯螯虾,说明小个体红螯螯虾可能更容易受到虾类疾病影响。厚壁菌门细菌是人类和动物(包括克氏原螯虾[29])的主要有益菌,可产生短链脂肪酸为肠粘膜细胞提供营养,有助于调节肠道的微生态环境[30],依赖于饮食而富集且相对丰度与饮食热量摄入呈正相关[19],可提高鱼类对食物的消化率和免疫性能,抵御肠道致病菌的破坏作用[31-32],还可通过调节乳酸菌和链球菌增强鱼类的氨基酸合成和代谢途径[33]。本研究中,大个体红螯螯虾肠道菌群厚壁菌门的相对丰度明显高于小个体红螯螯虾,表明大个体红螯螯虾可能更容易消化食物,具有更高的免疫力。
4 结 论
大个体红螯螯虾肠道细菌群的丰富度和多样性极显著高于小个体红螯螯虾,有益菌的相对丰度高于小个体红螯螯虾,肠道细菌功能中的氨基酸代谢、消化系统功能和免疫系统功能均显著强于小个体红螯螯虾。因此,在相同的养殖环境和饲养方法下,红螯螯虾肠道细菌群落是影响红螯螯虾生长性能、消化代谢和抗病能力的重要因素之一。
