2-苯乙醇生物合成的研究进展
2021-02-10严伟高豪蒋羽佳钱秀娟周杰董维亮章文明信丰学姜岷
严伟 ,高豪 ,蒋羽佳 ,钱秀娟 ,周杰 ,2,董维亮 ,2,章文明 ,2,信丰学 ,2,姜岷 ,2
(1 南京工业大学生物与制药工程学院,材料化学工程国家重点实验室,江苏 南京 211816;2 南京工业大学江苏先进生物与化学制造协同创新中心(SICAM),江苏 南京 211816)
1 2-苯乙醇概述
2-苯乙醇(2-PE)是一种具有玫瑰花香味的脂肪醇,因其具有温和的、淡雅的玫瑰花般的气味,被认为是食品和化妆品工业中的重要香料成分[1]。此外,它还可被用作合成其他香料或药物化合物的底物,如苯乙酸、苯乙醛和乙酸苯乙酯等[2-3]。在自然界中,2-PE 主要从玫瑰、茉莉花、番茄和荞麦等花卉和植物组织的精油中提取[4-5]。然而,由于这些植物中的2-PE 浓度非常低,因此萃取过程非常复杂,并且花卉的收获也会受到天气、植物病害和贸易限制等因素的影响。从玫瑰或其他植物的精油中提取天然2-PE 的成本非常高,如提取天然2-PE 的原料玫瑰精油国际市场的价格就已高达 3500~6000 美元/kg[6]。所有这些因素都是导致天然2-PE的供应不足和成本过高的主要原因[7]。
目前,全球市场上2-PE 的年产量已经超过10 000 t,其主要生产方法是苯-环氧乙烷合成法和氧化苯乙烯加氢法,国际市场上苯-环氧乙烷合成法产品占40%,氧化苯乙烯加氢法产品占60%。苯-环氧乙烷合成法生产的产品所含微量杂质不同,香气差异较大,大多不能用于香料,国内主要采用氧化苯乙烯加氢法[8]。化学合成过程一般在高温、高压、强酸或强碱环境等恶劣条件下操作,会产生许多不良副产物,如乙苯、苯乙烯等,这不仅增加了下游成本,而且严重降低了2-PE 的级别[9]。对环保工艺日益增长的需求以及消费者对“天然”产品的偏好极大地刺激了香料和香料生物生产工艺的发展[10]。许多具有2-PE 生产能力的野生型菌株已经被分离并鉴定,其中大多数是真核生物,包括酿酒酵母(Saccharomyces cerevisiae)、马克斯克鲁维酵母(Kluyveromyces marxianus)、解脂耶氏酵母(Yarrowia lipolytica)、米曲霉(Aspergillus oryzae)、黑曲霉(Aspergillus niger)、季也蒙毕赤酵母(Meyerozyma guilliermondii)等[11-19]。然而,除了叶微杆菌(Microbacterium foliorum)、变形杆菌(Proteus vulgaris)和嗜冷杆菌(Psychrobactersp.)外,很少有原核生物可以合成2-PE。生物转化过程通常在温和的条件下进行,产物选择性高。此外,根据美国食品和药物管理局以及相关的欧洲法规规定,如果用于生产过程的底物是天然的,则生物生产的2-PE 会被认为是“天然的”[20]。目前,利用生物转化法生产2-PE 已取得重大突破。其中,合成生物学着力于构建“非自然存在下的生化系统”,通过利用不同的生物元件,构建全新的菌株代谢网络,从而高效合成人类需求的代谢产物。通过使用有效的代谢工程策略可以调节不同酶的基因表达水平,以找到最佳平衡,进而改善代谢通量并减少代谢负担或其他副作用,从而将廉价的葡萄糖或苯丙氨酸转化为高附加值的2-PE。本文作者全面综述2-PE合成的各种途径、调控机制以及提高2-PE产量的策略。同时,讨论了农工废弃物作为2-PE生产原料的利用和原位产物分离(ISPR)技术的应用。
2 微生物中2-苯乙醇的生物合成路径
目前,2-PE 的生物合成主要有3 种途径(图1)。其中,艾氏途径是最重要的途径,在氮限条件下,L-苯丙氨酸(L-Phe)通过三步酶催化反应转化为2-PE。第2个途径是莽草酸途径,它是以葡萄糖等碳水化合物为底物从头合成2-PE。然而,这种复杂的反应途径具有强烈的反馈抑制作用,导致2-PE生产效率低下。最后一种是苯乙胺途径,它与艾氏途径类似,在植物中起着更重要的作用。
2.1 艾氏途径
艾氏途径广泛存在于各种微生物中,它负责将支链氨基酸(亮氨酸、缬氨酸和异亮氨酸)、芳香族氨基酸(苯丙氨酸、酪氨酸和色氨酸)和含硫氨基酸(蛋氨酸)分解代谢成相应的杂酸或高级醇[21]。该途径最初是由艾氏(Ehrlich)描述的,因此用其名字进行命名[22]。如图1 所示,在该途径中,L-Phe 首先被转氨酶(ARO8,ARO9,BAT1/TWT1 和BAT2/TWT2)氨基化为苯丙酮酸,然后被苯丙酮酸脱羧酶(YDR380w/ARO10,YDL080C/THI3,PDC1,PDC5 和 PDC6)脱羧为苯乙醛,最后通过醇脱氢酶(ADH1,ADH2,ADH3,ADH4 和 ADH5)或甲醛脱氢酶(SFA1)还原为2-PE[21]。

图1 2-苯乙醇的生物合成途径Fig.1 2-PE synthetic pathways
在艾氏途径中关键酶的表达水平会受到相关转录因子的调控和氮调控策略的调节。其中,Zn2CyS6家族转录激活因子ARO80 是2-PE 合成中最重要的调控因子之一。研究结果表明,ARO80可以与aro9和aro10的启动子组成性结合,在芳香族氨基酸的存在下,ARO80可以激活aro9与aro10的表达。在芳香族氨基酸作为唯一氮源的条件下,芳香族氨基酸通过氨基酸通透酶Gap1 进入细胞,Aro80 接受芳香族氨基酸的诱导信号后与aro9和aro10基因启动子上的CCG 重复序列结合,激活艾氏途径关键酶基因的表达[23-24]。除ARO80 以外,与碳代谢有关的锌簇蛋白CAT8 同样是艾氏途径中一个重要的激活因子,它在调节受芳香醇影响的基因(如Adh2)的差异表达中起着重要作用[25-27]。同时,CAT8 的表达还会受到具有两个Cys2His2锌指结构的转录因子MIG1 的调控,CAT8 的过表达或MIG1 的缺失可以有效增加aro9和aro10的转录,从而使更多的苯丙氨酸转化为苯乙醛[28]。
此外,艾氏途径中关键酶的表达水平也会受到氮源种类的影响。当培养基中存在优选氮源(铵或天冬酰胺)时,氮分解代谢物阻抑(NCR)的全局氮调控会严重限制酵母使用非优选氮源(亮氨酸、苯丙氨酸、蛋氨酸和脯氨酸)的能力[29]。从分子生物学的角度来看,目前已经鉴定出4 个可以影响NCR 敏感基因的转录和翻译水平的GATA 因子,其中包括两个激活因子(Gln3 和Gat1/Nil1)以及两个阻遏因子(Dal80/Uga43 和Gzf3/Nil2/Deh1)[30]。当优选氮源存在时,Gln3 和Gat1 被隔离在细胞质中,无法参与靶基因的转录调控。当无优选氮源存在时,Gln3 和Gat1 就会转移到细胞核中,从而激活NCR 敏感基因的表达[图 2(a)]。另外,Gln3 还会受到 pr 病毒样 URE2蛋白的负调控,携带失活URE2的细胞即使在优选氮源存在时也能够利用非优选氮源[31]。此外,雷帕霉素也可以影响到氮调控,经过雷帕霉素处理可以模拟氮饥饿环境,从而导致Gln3 和Gat1 的核定位和NCR 敏感基因的激活。研究表明,影响艾氏途径中关键酶表达水平的转录调控系统和NCR调节呈现复杂的互补调节和部分自身调节,ARO80 是ARO80 靶启动子招募GATA 因子所必需的,而GATA因子也可通过氨基酸通透性的转录调控间接影响ARO80 的活性[30],两者之间相互协作共同调控艾氏途径中关键酶的表达。此外,芳香醇的合成还会受到细胞密度的正反馈调节[32]。一般来说,由于芳香醇是群体感应分子,可以使酵母在氮饥饿的情况下转变为丝状体,因此高密度的细胞每个细胞可以产生更多的芳香醇。转录组分析显示,在高细胞密度时[32],aro9和aro10的转录水平显著增强。图2(b)显示了通过艾氏途径合成2-PE的总体调控图,但其调控机制尚不清楚。

图2 苯乙醇生物合成的代谢网络调控Fig.2 Regulatory network of 2-PE synthesis
2.2 莽草酸/苯丙酮酸途径
莽草酸/苯丙酮酸途径是酵母等微生物中从头合成2-PE 的途径。该途径将碳水化合物代谢与芳香族化合物合成联系起来,其中包括3种芳香族氨基酸(苯丙氨酸、酪氨酸和色氨酸)和其他芳香族次级代谢物。首先葡萄糖经过糖酵解途径和磷酸戊糖途径被转化为磷酸烯醇式丙酮酸和4-磷酸赤藓糖,这两种物质再经过4步酶促反应转化为莽草酸,接着莽草酸经过代谢转化为苯丙酮酸。苯丙酮酸随后如艾氏途径[33]所述(图1)通过脱羧和脱氢被转化为2-PE。米曲霉、马克思克鲁维酵母和酿酒酵母等均表现出具有利用葡萄糖合成2-PE 的能力,但是由于其生物合成途径复杂,代谢支路多且存在多种反馈抑制因子,2-PE 的产量很低。在最佳生长条件下,芳香族氨基酸的胞内浓度足以使苯丙氨酸和酪氨酸敏感的同工酶基本上失活[34]。因此,寻找能够增加L-Phe或苯丙酮酸池的优质菌株是提高利用莽草酸途径合成2-PE 效率的关键。
2.3 苯乙胺途径
苯乙胺途径是与艾氏途径相类似的途径,该途径首先是在酿酒酵母和米曲霉中得到研究[15,33]。在该途径中,L-Phe 首先被脱羧成苯乙胺,然后被氧化脱氨成苯乙酸,最后被还原成2-PE(图1)。苯乙胺途径在诸如番茄等植物中起着非常重要的作用[35]。并且,在矮牵牛花和玫瑰花瓣中已经发现了该途径的替代方法,其中L-Phe 可以通过苯乙醛合酶(PAAS)一步转化为L-苯乙醛。所有这些天然途径的研究与发现为构建基因工程菌株提供了有效酶的良好来源。
3 提高生物合成2-苯乙醇产量的策略
培养基成分和培养条件对2-苯乙醇的合成影响很大。为提高2-苯乙醇生产的经济性,研究人员对菌种诱变选育、基因编辑、培养基组成优化、发酵条件优化等常规策略进行了广泛研究,并取得了很大进展。
3.1 底盘菌株的筛选与构建
2-苯乙醇可由许多微生物进行合成。然而,由于其产量仍然太低,现在并不适合于工业化生产。但是对于艾氏途径和莽草酸途径的研究为利用基因编辑等技术提高2-PE的产量提供了广阔的前景。例如:通过过量表达ARO8 和ARO10,S.cerevisiaeS288在培养60 h后可以合成2.61 g/L 2-PE,比原始菌株高出36.8%[36]。为了加快L-Phe 在酿酒酵母中的转运速度,Chen 等[37]通过过量表达MT2 和S.cerevisiaeYS58 来源的Gap1 基因来提高芳香族氨基酸转运体的表达水平,2-PE 产量分别增加了26.5%和25.3%。此外,ARO80、GLN3、GAT1 和CAT8等全局调控因子的引入,使2-PE 产量分别显著增加 58%、34.7%、30.6% 和 62%[7,28,37]。最近,在最佳发酵条件下,一个由L-Phe 转运体Gap1、转氨酶ARO8、苯丙酮酸脱羧酶ARO10、醇脱氢酶ADH2和谷氨酸脱氢酶GDH2组装而成的人工构建菌株S.cerevisiaeYS58(G1-A8-A10-A2)-GDH 在5 L 发酵罐中的2-PE 合成产量达到6.3 g/L(转化率为95%),显示出2-PE 产业化的良好前景[38]。
除艾氏途径外,利用莽草酸途径从头合成2-PE 同样具有重要意义。Aoki和 Uchida[15]获得了一株经过化学诱变处理的突变株Z. rouxiiNISL3355,使2-PE 产量提高了约38 倍。类似地,Kim 等[39]获得了一株马克思克鲁维酵母的抗苯丙氨酸类似物(对氟苯丙氨酸)抗性突变体,该突变体在不添加L-Phe 的情况下从20 g/L 葡萄糖中可以产生1.3 g/L 2-PE。相比于传统的诱变选育等方法,通过基因工程改造对于2-PE 的合成则更加有效。最近,Daran 等[40]在酿酒酵母中过量表达ARO4、ARO7、3ABP、TKL1、ARO10、PYK1D146N、EcaroL、ARO3K222L,并敲除aro3和aro8,最终使得2-PE 的产量达到 1.59 g/L。类似地,Xu 等[41]通过过 量 表 达ylPAR4、ylARO10、ylARO7、ylPHA2、scARO7G141S,并敲除ylPYK,使得Y.lipolyticaYL35以葡萄糖为底物可以合成2.42 g/L 2-PE,为目前利用莽草酸途径合成2-PE的最高产量。
虽然酵母具有天然的2-PE 合成途径,但发酵过程通常很长(2~4 d),这增加了设备成本和能源消耗,进一步限制了工业化的可扩展性。因此,除了酵母以外,大肠杆菌也取得了重大突破[42]。由于艾氏途径不完整,野生的大肠杆菌无法合成2-PE,通过引入玫瑰来源的PAAS基因,经过发酵48 h 该克隆菌株可以产0.34 g/L 2-PE。Guo 等在大肠杆菌 MG1655 中共表达aro8、KDC和yigB使 2-PE 的产量增加到 0.28 g/L[43]。同样的,Atsumi等[44]通过在大肠杆菌 BW25113 中共表达kivD和ADH2也获得了类似的结果,2-PE产量最终可以达到0.88 g/L。在艾氏途径中,提高还原力NAD(P)H是合成2-PE 的一个重要因素。在全细胞转化系统中,Hwang 等[45]将来源于枯草芽孢杆菌的葡萄糖脱氢酶引入大肠杆菌,通过氧化葡萄糖来促进NAD(P)H的再生,从而使2-PE的产量提高了3倍。在另一项研究中,将来源于枯草芽孢杆菌的谷氨酸脱氢酶在大肠杆菌BW25113(31G)中过表达,以加速还原力的再生,最终工程菌株的2-PE 产量提高了250%。为了改善辅因子与还原力不足的问题,Wang等[46]开发了一种辅因子自给自足的系统,将谷氨酸脱氢酶与转氨酶和乙醇脱氢酶偶联,可同时再生共底物(2-酮酸)和氧化还原力[NAD(P)H],最终使生物催化效率提高了3.8倍。和酵母一样,大肠杆菌同样拥有莽草酸途径,通过引入一条从L-Phe到2-PE的路线,可以使其利用葡萄糖从头 合 成 2-PE。 Guo 等[47]通 过 过量 表 达aroGfbr、pheAfbr、kdc、yjgB和aro8等基因,最终获得可以利用葡萄糖合成1016 mg/L 2-PE 的工程菌株DG02。Koma 等[48]在大肠杆菌中进一步引入了T7启动子来增强Azospirillum brasilense来源的苯丙酮酸脱羧酶基因(ipdC)和Lactobacillus brevis来源的乙醇脱氢酶基因(adhC)的表达,同时敲除内源的苯乙醛脱氢酶基因(feaB)。该工程菌株最终利用葡萄糖合成7.7 mmol/L(0.94 g/L)2-PE。Kang 等[49]优化了莽草酸途径中 4 种关键酶aroFfbr、pheAfbr、kdc和adh1的协同表达,重组大肠杆菌可以利用葡萄糖合成285 mg/L 2-PE。
生物转化在2-PE 生产中显示出广阔的前景。然而,和其他醇类物质一样,高浓度的2-PE 对微生物细胞有一定的毒性,当发酵液中的2-PE 浓度达到一定程度时,就会抑制微生物的生长,而且2-PE 和乙醇联合作用产生的毒性比它们各自产生的毒性作用累加要高。2-PE 的抑菌作用机理很复杂,但通常认为主要是由其物化特性引起,而不是对特定受体的抑制。抑制作用的主要部位可能是原生质膜,影响糖类和氨基酸运输系统,此外,由于膜的通透性增加,加速了离子和小分子代谢产物跨膜向胞外扩散,扰乱了跨膜质子电势。因此,该特性导致的生产力受限仍然是一个显著的瓶颈,这促使研究人员去寻求性能更优的菌株[50]。商业上用于从葡萄糖生产甘油的菌株Candida glycerinogenesWL2002-5 表现出 4 g/L 的高 2-PE 耐受性。利用该菌株通过分批发酵可以产生5 g/L 2-PE,是目前使用野生型菌株合成2-PE 的最高产量[51]。另外,2-PE 的生产已经实现了与随机突变相结合的巨大进展。例如,经过紫外线辐射处理后,S. cerevisiaeCWY13210 的突变菌株与原始菌株相比,2-PE 耐受性和产量分别提高了50%和9.1%[52]。同样,通过紫外线照射获得的S.cerevisiaeBD-25-39 突变体可以合成5.4 g/L 2-PE,比原始菌株提高10.2%[53]。值得注意的是,由于2-PE 具有亲脂性,仍然难以完全消除其所引起的毒性。因此,仍然需要更有效的诱变和筛选方法。此外,引入一些耐受性因子,例如与膜相关的热休克蛋白HSP12,可以保护脂质体膜的完整性,避免其受到不利环境的影响[54]。
3.2 培养基成分的优化
在工业发酵过程中,发酵培养基的成分对于代谢产物的效价和产率至关重要。如上所述,氮源的利用遵循特定的顺序[55]。因此,L-Phe总是作为唯一氮源来激活艾氏途径。但是,少量的有机氮源,如酵母提取物则有利于细胞生长而不抑制艾氏途径[53,56]。有趣的是,Barbosa 等[57]发现,通过添加少量无机氮源,如磷酸二铵(DAP),可显著减少乙醇和乙酸的形成,并增加2-PE的产量。这可能是由于氮源的加入促进了NADH 的再生,但其机制仍有待进一步阐明。碳源的主要功能是维持菌株生长并提供必要的辅因子,如2-酮酸和NADH[58]。一般情况下,随着碳源的增加,2-PE的产量也会增加,但这种提高是有限的[58]。此外,不同的碳源可以改变L-Phe的消耗百分比、2-PE和2-苯乙基衍生物的摩尔产率[59]。通过与果糖、蔗糖、麦芽糖和糖蜜进行比较,发现葡萄糖是S.cerevisiaeCWY132 合成 2-PE 的最适碳源[56]。但是为了降低成本,廉价的碳源(如粗甘油和其他工业废料)则具有更好的价值。此外,维生素和矿物质对生产2-PE 也有很大影响。例如,与初始条件相比,K.marxianusCBS 600 在发酵条件优化后需要的维生素剂量是初始条件的80 倍,这表明在生物转化条件下优化后的代谢压力更大[11]。在恶劣条件下,Ca2+和Mg2+都可以通过增加膜稳定性来保护细胞[60]。当 MgSO4添加量增加到 0.4 g/L 时,2-PE 产量提高了1.65 倍。当KH2PO4增加到6 g/L时,2-PE的产量也出现了类似的增加[56,61]。
3.3 发酵过程参数优化
一般来说,香料的合成过程对培养温度非常敏感。高温可以增强一些与酒精产生有关的酶的表达,如BAT1/2[62]。然而,超过最佳温度范围,醇类的生成量将显著降低。以酿酒酵母为例,当培养温度从30 ℃增加到40 ℃时,2-PE产量下降到1/3~1/23[16]。在 20~35 ℃的培养温度下,L-Phe的消耗量在80.5%~90.1%之间变化;当温度升高到40 ℃时,L-Phe的消耗量显著降低21.9%[14]。除了温度之外,pH 也会通过影响酶活性从而影响芳香物质的产量和成分[63]。艾氏途径中的关键酶如ARO8 和ARO9 是碱性上调的,而ARO10 则是相反的碱性下调[64];因此,需要采用折中的pH 来平衡整个艾氏途径。此外,pH 也会改变基质的离子状态,影响吸附剂对2-PE 的吸附容量[65]。在以氨基酸为唯一氮源且葡萄糖受限的有氧条件下,氨基酸主要转化为杂酸[66]。然而,在厌氧条件下,氨基酸几乎完全转化为杂醇[67]。杂酸(和杂醇)的分布与培养条件密切相关。基于此,Tian 等[68]在发酵培养基中加入了一些抗坏血酸以提高系统的还原水平,抑制副产物的产生。在这一改良系统中生产的2-PE 与标准2-PE 样品表现出最接近的香气相似性[68]。
除培养条件外,发酵方式对2-PE 产量也有影响。据文献记载,2-PE 的合成过程与细胞生长密切相关[69],当葡萄糖浓度超过一定水平时,在有氧条件下会产生大量乙醇。乙醇的积累对2-PE 的产生有很大的协同抑制作用[50]。为了防止发酵过程中产生比1 g/L高的乙醇,Rong等[70]利用活性干酵母生产2-PE。在该体系中,酵母降解乙醇以提供还原力NADH,最终可以利用8 g/L 的L-Phe 合成7.6 g/L的2-PE。
3.4 统计实验设计
鉴于培养基组成和培养条件对2-PE 生产的影响,需要进行更合理的优化研究。近年来,统计实验设计如单因素优化、遗传算法、Box-Behnken中心组合设计、响应面法等已被广泛使用(表1)。Etschmann 等[11]利用遗传算法优化了 13 种培养基成分和培养温度,最终,利用K. marxianusCBS 600 将 2-PE 的产量提高了 87%。Mei 等[61]采用单因素、正交设计、Box-Behnken 中心组合设计和响应面法对培养基成分进行优化,利用S. cerevisiaeBD将2-PE的产量由1.19 g/L提高到4.18 g/L。统计方法的采用不仅减少了工作量,而且评估了多个参数之间的相互作用,特别是在利用复杂的农产工业废物方面。例如,当Plackett-Burman 设计、steepest ascent设计和Box-Behnken设计结合起来优化可发酵培养物的培养基成分、酸碱度和发酵时间时,2-PE产量提高了3.3倍[71]。

表1 基于统计设计的2-PE发酵工艺优化Tab.1 Statistics-based optimized fermentation processes for 2-PE production
4 利用农业和工业废料生物合成2-苯乙醇
农业和工业废物被认为是复杂碳水化合物、蛋白质、脂类和各种营养物质的储存库[72]。将这些废物生物转化为增值产品,如2-PE,不仅可以防止废物处置造成的环境污染,还可以增加经济价值。例如,葡萄含有复杂的成分,包括糖、有机酸、酚类化合物、蛋白质、维生素等,当使用它作为碳源并供应5 g/L L-Phe 时,利用K.marxianusCBS 6556 可以合成 0.77 g/L 2-PE[73]。糖蜜是一种众所周知的工业废料,富含混合糖和微量元素。当使用甜菜糖蜜作为碳源并添加7 g/L L-Phe时,利用K. marxianusCBS 600 可以合成0.89 g/L 2-PE[74]。在使用K.marxianusATCC 10022 进行固态发酵时,以L-Phe 及干燥的固体甘蔗渣为原料可合成2-PE 10.2 mg/g[75]。当在甘蔗糖蜜废水中添加6 g/L L-Phe 时,使用微生物混合培养物可获得0.99 g/L 2-PE[63]。另外,季也蒙毕赤酵母、发酵单胞菌和酿酒酵母等都可以利用乳清培养基通过分批发酵的方式合成1.17~3.28 g/L 2-PE[76]。烟草废料是一种众所周知的可再生资源,因为它含有丰富的芳香族化合物,是合成香料的潜在前体。在不添加任何L-Phe 的情况下使用酿酒酵母可以从39.28 g/L 烟草废料和10 g/L 葡萄糖中产生1.55 g/L 2-PE[71]。此外,木薯废水、番茄、辣椒渣等也都含有丰富的碳水化合物和营养物质,为2-PE 的生产提供了可替代的底物[77-79]。然而,应该指出的是,由于这些农用工业废物中成分复杂且未知,2-PE的产量仍然很低且不稳定。
5 2-苯乙醇原位产物分离技术
香料生产的瓶颈之一是由于其疏水特性会使得脂质膜结构成为优先结合的目标,导致跨膜梯度的崩溃,从而丧失细胞活力[80]。不同的微生物对于香料的细胞毒性表现出不同的耐受水平。例如,2.0 g/L 外源2-PE 可以完全抑制马克思克鲁维酵母的生长[81];而酿酒酵母则可以耐受高达4 g/L 的 2-PE[17]。为了减轻细胞毒性增加 2-PE 的产量,有机溶剂萃取、疏水吸附、有机渗透汽化、环糊精(CDs)络合和超临界CO2萃取等ISPR 技术已被广泛用于去除发酵液中的2-PE。表2 列举了已发表文献中关于原位产物分离(ISPR)技术在2-PE 生产中的应用。

表2 用于2-PE生产的不同的原位产物分离(ISPR)技术Tab.2 Different in situ product removal(ISPR)techniques for 2-PE production
5.1 液-液萃取
液-液萃取法(LLE)采用有机溶剂从有机相中连续提取疏水产物,因其简单、廉价、易扩展等特点而被广泛应用于香精生产。例如,当使用油酸作为萃取剂时,使用酿酒酵母可以获得12.6 g/L 2-PE,与没有使用提取技术相比,2-PE 的含量增加了8.6 g/L[69]。用油醇作为萃取剂,使K.marxianusCBS 600 的 2-PE 产量提高了 3 倍[74]。此外,聚丙二醇 1500 和 1200 (PPG 1500 和 PPG 1200)等高分子萃取剂在2-PE 分离中同样表现出良好的萃取性能。在以PPG 1500 为萃取剂的补料分批发酵中,萃取剂中的2-PE 浓度超过22 g/L,总浓度达到 7.5 g/L[82]。当以 PPG 1200 为萃取剂时,有机相中2-PE 含量为26.5 g/L,2-PE Ac 含量为6.1 g/L,2-PE总质量浓度达到10.5 g/L。
在液-液萃取中,发酵液被泵入抽提装置以连续回收2-PE[图3(a)]。2-PE生产可以得到显著改善,但仍存在一些缺陷。首先,有机溶剂会对细胞活力和代谢活性造成严重的毒性。因此,理想的萃取剂应具有良好的生物相容性和较高的分配系数。其次,乳状液的形成将影响液体和溶剂相的分离[83]。最后,也是最重要的一点,液-液分离系统中使用的有机溶剂,特别是高碳含量的有机溶剂,很难蒸发从而去除2-PE,残留的溶剂会严重影响2-PE 的质量[81]。因此,寻找合适的有机溶剂是液-液分离操作的关键。考虑到2-PE 的脂溶性,使用一些脂肪酸/油脂作为萃取剂可作为一种2-PE 回收的方法。菜籽油首先被证实可以将2-PE 的整体浓度提高2.7 倍[84]。此外,疏水中空纤维膜可以被用来阻挡催化介质中的有机溶剂,从而避免乳状液的形成[85]。但需要注意的是,该膜易受污染。
近年来,不相容离子液体(ILS)因其可忽略的蒸气压、不可燃性和高热稳定性而成为绿色非有机溶剂受到越来越多的关注[86]。通过对9 种离子液体的生物相容性、分配系数(Kd)和萃取效率的综合考察,发现3 种基于[NTf2]-的离子液体具有很大的提高2-PE 产量的潜力。使用基于[NTf2]-的 ILS[87],观察到 2-PE 的总产量增加了3.5倍。此外,[NTf2]-、[TCM]-和[TCB]-基离子液体可以有效地从水相中回收2-PE[88-89]。
5.2 液-固萃取
为了进一步提高萃取效率,研究了一种液-固萃取系统(LSE)。在这个系统中,有机溶剂被包裹到聚合物基质中,这不仅解决了微生物毒性和乳状液的问题,而且还简化了下游的加工过程[图3(b)]。将癸二酸二丁酯包埋在聚乙烯的聚合物基质中后,不仅没有形成乳状液,2-PE的产率还提高了1倍[83]。通过将癸二酸二丁酯嵌入到海藻酸盐微胶囊中,设计了一条将LSE体系与膜工艺相结合的新工艺。在该体系中,不会形成乳状液,使用S. cerevisiaeGIV2009,最终2-PE浓度提高到5.6 g/L,比使用单相时提高了1.8 g/L[90]。虽然LSE 的性能优于LLE,但溶剂固定化会增加成本,使生产过程复杂化。
5.3 疏水吸附
原位产物吸附(ISPA)是一种常见的ISPR 技术,它使用树脂或其他吸附介质来避免底物或产物的抑制[图3(c)]。ISPA 因其操作相对简单、易放大、对有毒物质不敏感、易于再生和成本低而被广泛应用于生物技术过程[91]。为了回收2-PE,人们研究了各种树脂。非极性大孔树脂D101 对2-PE 的吸附能力较强,对L-Phe 的吸附能力较低。在添加2 g/L 水合树脂D101 的条件下,S.cerevisiaeBD可获得6.17 g/L 2-PE产量[65]。当使用7%(干重)的交联聚苯乙烯树脂HZ818 时,用S.cerevisiaeP-3 从 12 g/L L-Phe 中得到 6.6 g/L 2-PE,摩尔产率为0.744,比对照[92]提高了66.2%。当大孔树脂FD 0816 作为连续生物转化系统的吸附剂时,摩尔产率最高,为0.90[93]。然而,树脂对2-PE 的吸附容量很低,而且吸附过程受发酵液的影响很大[94]。该文对几种聚合物吸附剂进行了测试,以确定具有较高选择性的吸附剂。例如:将Hytrel®8206应用于固-液两相分离生物反应器系统,在3 L 的发酵体积内可获得13.7 g/L 2-PE。当采用半连续反应器结构时,2-PE的最高浓度为20.4 g/L,水相为1.4 g/L,聚合物相为97 g/L[81]。
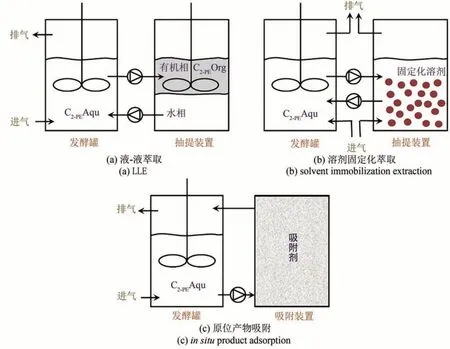
图3 应用于2-PE生产中的ISPR技术Fig.3 ISPR techniques for 2-PE production
5.4 其他分离技术
5.4.1 有机渗透汽化
渗透汽化是一种膜分离过程,在膜分离过程中,一层致密的无孔膜将液体溶液从气相中分离出来。在装有聚辛基甲基硅氧烷(POMS)膜的有机渗透汽化装置中,分批培养获得了2.2 g/L 和1.3 g/L 的双倍 2-PE 浓度[60]。然而,这些膜很容易被污染,仍然需要探索更合适的膜材料[95]。
5.4.2 与环糊精(CDs)络合
CDs是具有疏水内部和亲水外部的超分子主体化合物。众所周知,CDs及其衍生物与许多有机化合物形成包合物。在最佳条件下,β-CD 对2-PE 的萃取率为 1 mol/mol[96]。
5.4.3 超临界CO2萃取
超临界流体(SCFs)具有高吸附能力、高扩散系数和低黏度等特点,被广泛应用于从土壤、水和沉淀物中提取有机污染物[97]。无毒和不可燃的二氧化碳(CO2)是目前工业中使用的最流行和最便宜的超临界流体材料[98]。特别是超临界CO2在玫瑰混凝土挥发油的提取过程中表现出优异的性能[99]。然而,直接利用超临界CO2萃取是不可能的,因为CO2对细胞活力有很大的影响。因此,在提取[93]之前进行细胞分离是必要的。
6 小结与展望
由于植物提取的局限性和化学合成工艺的缺陷,生物合成2-PE 受到越来越多的关注。虽然在机理认识和提高2-PE 效价方面取得了很大突破[105],但在经济上仍不具备工业化的可行性。为了将实验室研究成果转化为工业过程,底盘菌种开发、生物过程优化和ISPR 技术设计之间的深度集成综合开发是必要的。
在自然界中,许多真菌可以自主合成2-PE,但产量仍然很低。代谢工程对于改善2-PE 的生产至关重要,它可以减轻反馈抑制,增强前体转运,提高关键酶活性,并干扰副产物的形成。通过对2-PE 合成途径的改造或引入耐受因子,选择耐受性好、产2-PE 能力强的菌株可能是获得较好的2-PE 生产候选菌株的唯一途径。此外,目前对2-PE 合成的调控机制还没有进行深入的研究。更好地理解艾氏途径/莽草酸途径涉及的生物化学,特别是酶及其代谢调节,是指导进一步遗传修饰的基础。
培养基组成和培养条件对2-PE 的生产有很大影响。从经济的角度来看,高增值产品的生产率和产品质量远比实际产量重要。然而,培养基成分的改变无疑会增加生物催化法合成2-PE 的生产成本,不利于该技术的工业化应用。因此,进一步研究利用农业或工业副产品为主要原料,如制糖工业的副产品糖蜜,可以节约生产成本,有利于该工艺的工业化应用。目前报道的不利用原位产物分离技术的2-PE 最高生产率只有0.12 g/(L·h)[53],为了更好地实现2-PE 商业化生产,更多的研究应该集中在2-PE的生产率上。
ISPR 技术已广泛应用于2-PE 生产中,尤其是LLE 和ISPA。然而,LLE 系统中残留有机溶剂的去除困难限制了其应用。与LLE 相比,ISPA 具有更大的工业放大潜力。在实际生产中,ISPR 技术必定会增加生产过程的复杂性和成本,因此,仍需进一步研究开发更多的高容量吸附材料运用于完整细胞的原位产物分离技术,如合成聚合物。随着生物技术和跨学科的快速发展,采用更先进的发酵方式,如将不同的生物材料应用到微生物发酵过程中,设计使用可以同时合成并分离2-PE的新型反应器等,同时结合ISPR 技术,使用优质菌株,将进一步提高2-PE 的生产效率。此外,对“天然”香料日益增长的需求将使得利用生物法合成2-PE的商业前景更加广阔。
