基于合成生物技术构建高效生物制造系统的研究进展
2021-02-10张晓龙王晨芸刘延峰李江华刘龙堵国成
张晓龙,王晨芸,刘延峰 ,李江华 ,刘龙,堵国成
(1 江南大学糖化学与生物技术教育部重点实验室,江苏 无锡 214122;2 江南大学未来食品科学中心,江苏 无锡214122;3江南大学工业生物技术教育部重点实验室,江苏 无锡 214122)
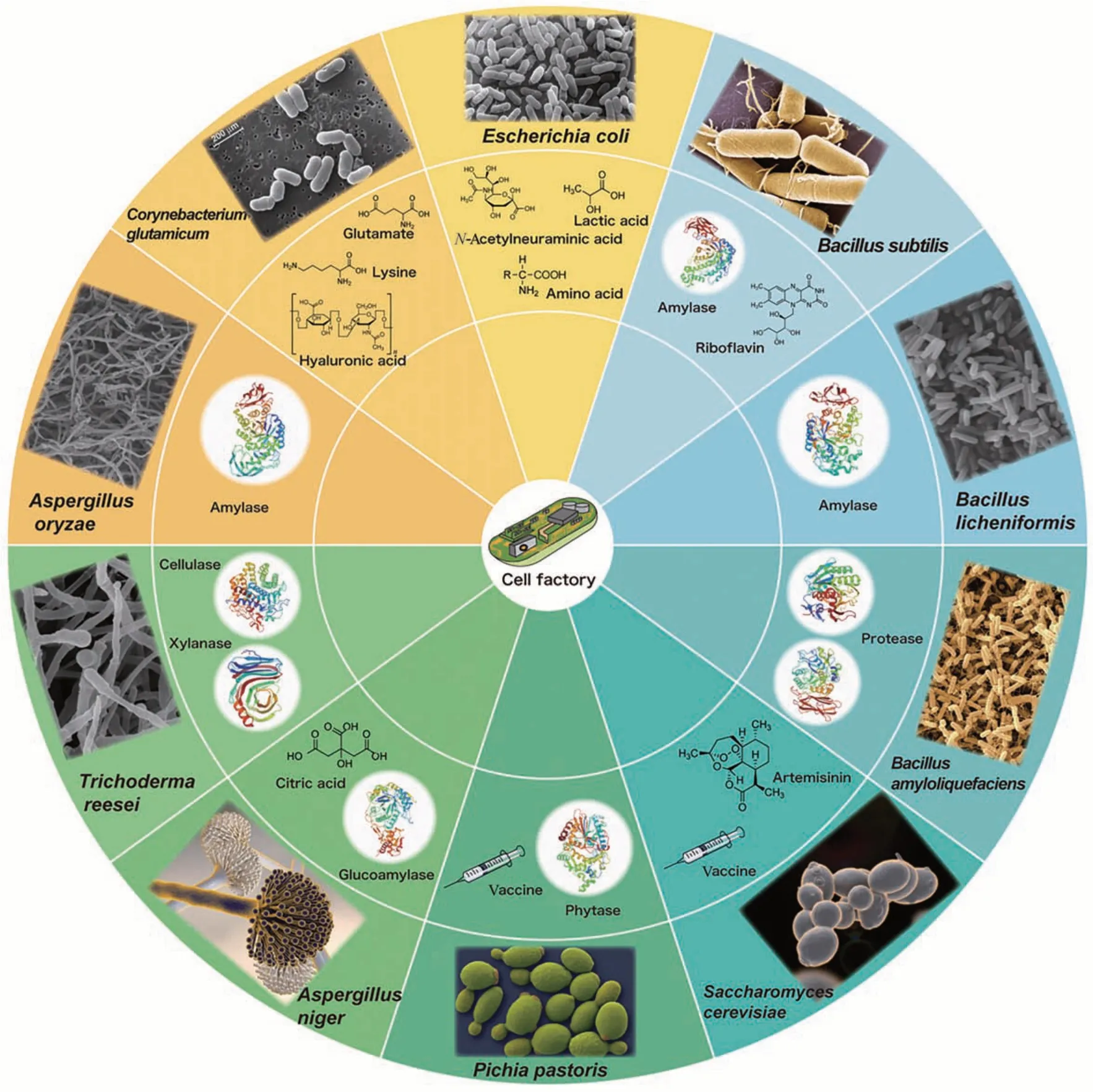
生物制造技术最早可追溯到几千年前,当时人类已经懂得使用天然微生物进行酿酒制醋,但天然的生物制造系统已逐渐无法满足当下工业生产的需求,因此如何获得绿色高效、多元稳健的生物制造系统是目前亟待解决的关键问题之一。随着基因编辑工具、多组学及生物信息学等技术的交叉发展,基于合成生物技术构建非天然的高效生物制造系统变得日益简便。本文首先概述了当前常用于构建高效生物制造系统的合成生物技术;其次,对大肠杆菌、芽孢杆菌属、谷氨棒酸杆菌以及酵母属等典型模式宿主制造系统的代谢特性与产品应用进行了总结探究。最后,对构建高效生物制造系统的发展趋势进行了展望。
1 合成生物技术路线概述
合成生物学是基因组工程、酶工程、代谢工程和生物信息学等技术交叉发展形成的一门学科。在此,本文依据策略的目的性,将常见的合成生物技术划分为以下4个模块进行简要概述(图1):
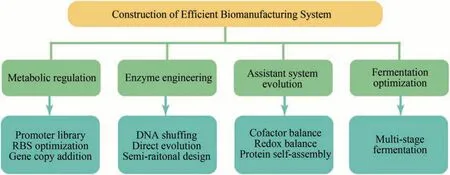
图1 高效生物制造系统的构建Fig.1 Construction of high-efficiency biomanufacturing system
(1)合成途径关键基因的代谢调控 提高合成途径的代谢通量是代谢工程的关键目标之一。首先,通过生物信息学确定目标代谢物的合成途径,并基于启动子工程、核糖体结合位点(RBS)优化、增加基因拷贝数等策略,强化关键基因的表达量,从而使得代谢通量更多地流向目的产物的代谢合成途径。其次,抑制或敲除生物制造系统内源性的支路竞争途径。传统的静态调控策略虽然可以一定程度上优化生物制造系统,但会导致新问题的出现,即生物制造系统自身生长与目标产物代谢合成存在底物能量竞争矛盾。因此,为了进一步构建高效的生物制造系统,动态调控策略应运而生。相比于静态调控策略,基于响应元件构建的动态调控系统可以使得生物制造系统在特定时间点自发性地实现代谢通量的配比流向,从而平衡菌体生长与产品合成之间的底物能量竞争矛盾[1-2]。
(2)酶工程 丰度是“量”,活性是“质”,丰度与活性共同决定了酶的“质量”——催化效率。提高丰度虽可以一定程度上优化酶的催化效率,但当丰度提高至某一阈值后,酶的催化效率会无法继续显著提高,甚至会出现催化效率下降等现象,此时对酶进行“质”层面的优化改造显得尤为重要[3]。高催化活性的作用酶是高效生物制造系统的基石,其不仅可以提高产物代谢合成效率,同时有助于降低酶的丰度,从而缓解生物制造系统超负荷运行的问题。酶工程主要包括基于结构分析的半理性设计和基于定向进化策略的非理性设计。半理性设计的优势在于其突变文库较小,无需高通量筛选,但该策略受限于实验和模拟获取酶蛋白结构的数量和精确性。基于定向进化策略的非理性设计可以通过DNA shuffling、较大范围的底物结合口袋关键氨基酸的饱和突变、胞内外突变文库的构建等技术实现特定酶的定向进化,建立合适的高通量筛选模型是非理性设计策略的关键。
(3)辅助系统优化 除对相关代谢途径的关键基因的调控表达外,调控适配优化针对目标产物的特异性辅助系统亦至关重要,其可以平衡辅因子循环、缓解蛋白合成压力、毒性产生及解除副产物抑制等问题[4]。Gu 等[5]在产 GlcNAc 的工程菌中重构还原力代谢途径,替换丙酮酸到乙酰辅酶A、苹果酸到草酰乙酸等内源代谢途径,避免NADH 的过剩,进而实现胞内氧化还原平衡,最终GlcNAc 的发酵产量提高了4.06 倍。另外,分子伴侣参与的蛋白加工辅助系统,对于酶蛋白的大量合成有重要意义[6]。设计构建多重基因回路,采用细胞微室和蛋白自组装等策略,可以显著平衡产物代谢与细胞生长的代谢竞争,缓解代谢中间产物对生物制造系统自身的毒害性[7-8]。Wang等[9]开发了基于定量调控水蛭透明质酸酶消除透明质酸“荚膜层”的策略,解除了透明质酸在胞外包裹细胞对其形态和代谢的影响,最终低分子量透明质酸产量高达74.1 g/L。
(4)发酵过程控制与优化 随着合成生物技术的快速发展,单批次需要进行发酵验证的宿主数量愈发扩增,如仍采用常规摇瓶或发酵罐直接进行发酵性能验证,将会导致科研工作效率降低。因此逐渐形成了从96 孔板发酵规模开始,依次到500 mL 锥形瓶、1~5 L 玻璃无压力发酵罐、10~50 L 不锈钢压力发酵罐小试、2~5 t 发酵中试、20~60 t发酵罐(或100 t级别发酵罐)的多级发酵验证过程。由于不同规模级别发酵设备的差异性,宿主在不同发酵规模过程中其生长代谢过程不尽相同,其最适的发酵过程参数亦需依据放大准则进行调整优化[10]。宿主、目标产物及代谢工程改造策略的差异造成了发酵过程的高度特异性与复杂性,因此发酵过程的控制与优化目前尚无高度普适性策略。
以上是当前合成生物技术领域中应用较为广泛的4种策略,基于这几种合成生物技术,研究人员已构建出许多发酵性能优异、鲁棒性强的非天然生物制造系统。然而千里之行始于足下,构建满足需求的高效生物制造系统的首要任务则是选择适合的天然宿主作为出发点,不同的天然宿主其代谢特性与适用范围具有高度的差异性,如果最初的天然宿主选择正确,采用合成生物技术对其进行改造则事半功倍。因此,本文接下来将对目前典型模式宿主进行概述,并对其优劣势与适用范围进行详细比对总结。
2 典型模式宿主系统及适用范围
2.1 大肠杆菌
发酵周期短、遗传背景清晰、具有成熟的基因编辑工具以及多元化的代谢调控策略使得大肠杆菌成为最重要的非糖基化重组蛋白表达系统(表1)[11-12]。大肠表达系统通常分为宿主、质粒复制子、启动子(lac、tac、T7、araPBAD、pL 和cspA等)、亲和标签(poly-Arg-tags、poly-His-tags、FLAG-tags、c-Myc-tags、Strep Ⅱ-tags 等短肽和麦芽糖结合蛋白MBP 等融合蛋白)[13]、裂解序列(肠激酶、凝血酶、Ⅹa 因子和TEV)、抗性标记和终止子等[14]。
(1)宿主 BL21(DE3)菌株,Lon蛋白酶和胞外蛋白酶OmpT的缺失减少了内源性蛋白酶对目的蛋白表达的影响;其次,hsdSB突变使其失去DNA 甲基化和降解能力。AD949 菌株,其硫氧还蛋白还原酶(trxB)存在突变,有利于二硫键的形成。HMS174 菌株,DNA 重组和修复蛋白基因(recA)的突变,可以避免质粒多聚体导致的质粒低稳定性问题。以上所述大肠杆菌宿主均含有λDE3系统,可以使用T7表达系统。
(2)质粒 依据目的基因预期表达水平选择具有不同复制子的质粒。例如,野生型ColE1 为15~20 拷贝、pET 系列拥有衍生自 ColE1 的 pMB1复制子为15~60 拷贝、衍生自pMB1 的pUC 系列为500~700 拷贝。以上3 个系列的质粒的复制子均来源于ColE1。为了实现双质粒共存,可以选择10~12拷贝的带有p15A复制子的pACYC和pBAD质粒,甚至可以进一步选择拷贝数低于5 的pSC101质粒,实现三质粒共存。
(3)启动子 启动子在一定程度上决定了其控制基因的转录水平。lac 启动子作为初始启动子表达强度较弱,而由色氨酸启动子的-35 区和lac启动子的-10 区组成的tac 启动子,其表达强度显著提高。T7启动子是应用较为广泛的启动子之一,基于T7溶菌酶或者lac O 机制可以设计构建诱导型表达系统。严格诱导型启动子araPBAD,AraC 蛋白具有阻遏/激活双重作用,无阿拉伯糖时,AraC 蛋白通过结合阻遏抑制转录;存在阿拉伯糖时,AraC 蛋白激活并促进启动子的转录[15]。低温诱导型启动子cspA,当温度为15 ℃时该启动子开始表达[16]。高温诱导型启动子PR,当温度为30 ℃时,热敏型阻遏蛋白CI857结合抑制转录,当温度升至37 ℃时 PR启动子开始表达[17]。
(4)亲和标签和裂解标签 亲和标签poly-His-等可用于Western blot 或树脂纯化,麦芽糖结合蛋白(MBP)、N-利用底物蛋白A(NusA)、硫氧还蛋白(Trx)、谷胱甘肽-S-转移酶(GST)、泛素蛋白(ubiquitin)、类泛素蛋白修饰分子SUMO和钙结合蛋白Fh8 等,可以增加目的蛋白溶解度。由于MBP 具有内在伴侣活性,其促溶效果比GST更加显著,且MBP 可以与直链淀粉-琼脂糖结合,GST 可以与谷胱甘肽-琼脂糖结合,因而具有这两种标签的融合蛋白可通过亲和色谱进一步纯化。Fh8 在去除标签后仍拥有较好的溶解性,而其他标签在去除后无法预测最终的溶解度[18]。此外,β折叠标签可以使蛋白在钙存在的条件下选择性沉淀,类弹性蛋白多肽标签(ELP)可以通过转变温度的可逆沉淀来纯化蛋白[19]。由于带His 标签的TEV具有高特异性,切割后仅留下丝氨酸或甘氨酸残基,其已成为应用最广泛的裂解序列[20]。表达毒性蛋白时,一方面可以通过选取弱化表达强度的C41(DE3)菌株;另一方面则可以选取Lpp、LamB 和LTB 等分泌型信号肽[21]或借助二硫键异构酶Ⅰ(DsbA)的信号肽序列通过信号识别颗粒(SRP)途径将毒性蛋白表达分泌至细胞周质空间[22-23]。相比于细胞质,大肠杆菌的周质空间更有利于二硫键的形成,因此含有二硫键的蛋白更适合表达分泌至周质空间[24]。强化分子伴侣ClpB、GroES-GroEL、DnaK、DnaGrpE 等的表达会显著提高蛋白表达质量[25]。低温培养的生物制造系统不仅可以降低蛋白质的合成速率,而且可以减弱蛋白疏水相互作用导致的聚集性,有助于蛋白折叠质量的提高[26]。
尽管大肠杆菌是表达异源蛋白最常用的表达系统,然而其适用范围仍存在一定的局限性。大肠杆菌不适用于表达需要翻译后修饰的蛋白,例如二硫键异构化、酯化、糖基化、脯氨酸顺反异构化、磷酸化或硫酸化等[27]。大肠杆菌蛋白表达系统也不适于表达膜蛋白,以及大于60 kDa 的蛋白[14]。为了解决天然大肠杆菌宿主的蛋白表达缺陷,基于合成生物技术,通过基因工程优化其二硫键形成系统,并引入异源糖基化、磷酸化和乙酰化系统,增强其表达部分需要翻译后修饰蛋白的能力[28-30]。
同样的,大肠杆菌也是制备生物制品的理想底盘细胞。弱化TCA 循环,强化糖酵解途径,内源性代谢产物如丙酮酸[31]、苹果酸[32-33]、乙酰辅酶A[34]等均可在大肠杆菌内实现高效生产。Huang 等[35]以大肠杆菌 W3110 为出发菌株,通过敲除转录调节因子MetJ、强化途径酶MetA 表达使得L-甲硫氨酸的发酵产量高达9.75 g/L。Yang等[36]首次在大肠杆菌BL21(DE3)实现了以葡萄糖为底物从头合成N-乙酰神经氨酸(NeuAc),并设计构建了响应NeuAc 的生物传感器进行代谢调控,NeuAc 的发酵产量提高至8.31 g/L。大肠杆菌不仅在代谢合成内源性化合物领域具有强大的工业潜力,其在重构异源合成途径以代谢生产非内源性产物领域也具有极大的应用前景。例如,类胡萝卜素[37]、柠檬烯[38]、丹参素[39]等萜类化学物均在大肠杆菌中成功实现了代谢合成。
2.2 芽孢杆菌属
枯草芽孢杆菌、地衣芽孢杆菌和解淀粉芽孢杆菌等宿主以其出色的蛋白质分泌系统、恶劣环境耐受性强而被广泛应用[29,40]。相比于大肠杆菌极易形成不溶性包涵体、潜在的脂多糖和内毒素风险[41],芽孢杆菌属宿主具有食品安全等优势。
枯草芽孢杆菌是碱性丝氨酸蛋白酶与中温淀粉酶制备生产的首选生物制造系统,其也被广泛用于核苷酸、维生素、表面活性剂、维生素B2复合物核黄素[42]、透明质酸[43]以及抗生素(例如杆菌肽和枯草杆菌素)的发酵生产。此外,由于枯草芽孢杆菌具有典型的芽孢形成能力、细胞分裂以及生物膜系统,其亦成为微生物机理研究的典型模式微生物之一[44]。
地衣芽孢杆菌是高温淀粉酶制备生产的最佳生物制造系统,其在高温培养环境中拥有极佳的液化和糊化特性。早在1973 年,地衣芽孢杆菌就已被发现其能表达天然高温淀粉酶[45],之后Declerck 等[46]对其耐高温特性进行了关键氨基酸解析,拓宽其工业应用范围[47]。此外,地衣芽孢杆菌还被用于银纳米颗粒[48-49]、生物絮凝剂[50]、聚γ-谷 氨 酸[51]、 2,3-丁 二 醇 的 生 物 合 成[52-53]。2004 年 , Veith 等[54]对 具 有 工 业 应 用 潜 能 的Bacillus licheniformisDSM13 菌株进行基因组规模测序,清晰的遗传背景为其后续CRISPR 基因编辑调控工具开发[55-56]等领域的研究奠定了基础。
解淀粉芽孢杆菌常用于中性或碱性蛋白酶的工业化生产[57]。Sha等[58]以解淀粉芽孢杆菌NS为出发宿主,通过采用模块化工程策略,抑制副产物的代谢合成,阻断目标产物降解途径,推动了低分子量聚γ-谷氨酸生物合成进展。此外,解淀粉芽孢杆菌也可用于表面活性素[59-60]、果聚糖[61]、S-腺苷甲硫氨酸[62]以及银纳米颗粒[63]的生物合成。
2.3 谷氨酸棒杆菌
谷氨酸棒杆菌是一种革兰氏阳性、非致病性的土壤细菌,其具有耗糖迅速、易高密度发酵[64]、无碳源分解代谢阻遏效应[65]、对有毒醇和芳香族化合物有较高耐受性[66-67]等代谢特性。
作为较为成熟的生物制造系统,谷氨酸棒杆菌的表达系统、基因编辑工具、代谢调控策略已有较为全面的研究[68]。谷氨棒酸杆菌内可以实现pVWEx1、 pEKEx3 和 pECXT99A 三个 质 粒共存 ,可用于多途径模块化工程,以及多种调控元件的表达优化[69-70],基于sacB 标记的条件致死的基因编辑方法[71]、基于Cre/loxP 系统的基因编辑策略[72]以及基于 CRISPR 的基因编辑工具[73]均能够用于构建更加高效的谷氨棒酸杆菌制造系统。谷氨酸棒杆菌是L-谷氨酸和L-赖氨酸等氨基酸的优势底盘细胞,近期研究表明其也拥有成为透明质酸优势底盘细胞的潜力,通过途径关键酶优化表达水平,以及解除产物对细胞的包裹效应,透明质酸达到74.1 g/L[9]。此外,基于谷氨酸棒杆菌可以吸收和利用各种芳香族化合物,因此通过合成生物技术对其进行改造后有望成为高效的芳香族化合物制造系统[70,74]。
2.4 酿酒酵母和巴斯德毕赤酵母
2.4.1 酿酒酵母
作为典型真核模式菌株,酿酒酵母具有较好的pH 与渗透压耐受性,使其成为生产生物能源、蛋白、类异戊二烯、脂肪酸和脂肪醇、芳香族化合物等生物制品的重要宿主。相比于大肠杆菌等原核生物,酿酒酵母具有内质网、线粒体等细胞器,在异源表达蛋白酶尤其是细胞色素P450 酶时具有原核生物无法比拟的优势。其次,酿酒酵母的遗传背景和胞内代谢调控机制具有高度的可知性、完整性与系统性。例如酿酒酵母染色体复制机制解析[75],酿酒酵母氮源代谢、磷酸代谢等机制解析[76],酿酒酵母氧化应激凋亡机制研究[77],酿酒酵母蛋白质复合物和互作研究[78-80],酿酒酵母孢子形成过程解析[81],酿酒酵母细胞壁动态感知和调控过程解析[82],终止子文库[83]、转录调控网络数据库[84]、酿酒酵母数据库[85]等,这些研究报道极大提升了酿酒酵母的工业化应用前景。
酿酒酵母常用的启动子主要为组成型强启动子主要为TEF1 和GPD,以及半乳糖诱导型的GAL1 启动子。质粒分为附加型质粒(Yep),是基于内源性2 μ 复制起点的高拷贝质粒,以及着丝粒质粒(YCp),是基于自主复制序列(ARS)和酵母着丝粒序列(CEN)的组合的低拷贝质粒。酿酒酵母具有强大的DNA 组装能力,50 bp碱基重叠即可组装3~5 个基因的10 kb 片段,125 bp 碱基重叠即可组装8个基因约19 kb的片段[86-87]。
酿酒酵母作为理想的生物制造系统之一,其被广泛应用于生物能源、食品、医药化工等领域。
(1)生物能源 为了缓解粮食危机,开发以非食品原为底物的第二代生物乙醇制备技术是实现资源可持续化的有效途径之一[88]。来源于玉米秸秆、木片和农业残留物的木质纤维素水解产物含有60%~70%的葡萄糖以及30%~40%的木糖,天然微生物在存在葡萄糖的条件下会限制木糖的利用效率,因此高效代谢木糖是将木质纤维素生物质转化为生物能源最重要的前提条件。酿酒酵母没有内源性的木糖代谢途径,基于合成生物技术引入木糖还原酶(XR)、木糖醇脱氢酶(XDH)、木糖异构酶(XI)重构木糖代谢途径,使得酿酒酵母可以将木糖转变为木酮糖,之后木酮糖在内源性木酮糖激酶(XK)的催化下生成5-磷酸木酮糖从而进入磷酸戊糖途径。酿酒酵母偏好葡萄糖作为碳源,并且拥有复杂的葡萄糖感知和调控机制[89],为了实现木糖和葡萄糖的同时高效利用,适配木糖代谢途径关键酶表达水平、维持胞内环境稳态尤为重要。Hou 等[90]通过引入异源不受葡萄糖抑制的木糖转运蛋白(Meyerozyma guilliermondii来源的转运蛋白Mgt05196p 的突变体N360F),在葡萄糖存在的条件下酿酒酵母的木糖摄取速率依然显著提高。
(2)乙酰辅酶A 乙酰辅酶A 是重要的生物制品,可以衍生合成多种化学品。酿酒酵母内的乙酰辅酶A代谢机制较为复杂,两个乙酰辅酶A合成酶(ACS1 和ACS2)的活性被严格调控,ACS1 被葡萄糖抑制,ACS2 在葡萄糖为碳源时表达,基于此,Kozak 等[91]在酿酒酵母内重构来源于沙门氏菌的突变体ACS 和醛脱氢酶(ALD6),显著提高乙酰辅酶A的代谢池。
(3)萜类化合物 萜类化合物是由多个单元的焦磷酸异戊烯基焦磷酸酯(IPP)及其异构体焦磷酸二甲基烯丙酯(DMAPP)组成的有机化合物。相比于大肠杆菌,酿酒酵母更适合表达涉及细胞色素P450 酶的萜类代谢途径途径。MVA 途径是酿酒酵母中唯一的IPP 合成途径,并且具有很高的合成效率,且IPP 理论上可占细胞干重的5%。香叶醇[92]、柠檬烯[93]、人参皂苷[94]、青蒿酸[95]等萜类化合物均已在酿酒酵母中实现了高效合成,其中青蒿酸作为合成生物学里程碑式的产物,其在酿酒酵母内的发酵产量高达25 g/L。2019 年Keasling 等[96]以酿酒酵母作为底盘细胞,首次成功实现了大麻素及其相关衍生物的异源代谢合成。
(4)芳香族化合物 芳香族化合物衍生自酪氨酸、苯丙氨酸和色氨酸三种芳香族氨基酸[97]。芳香族氨基酸主要通过由糖酵解途径的磷酸烯醇式丙酮酸(PEP)和磷酸戊糖途径的赤藓糖-4-磷酸(E4P)为前体合成分支酸(chorismate)的莽草酸途径(shikimate pathway),分支酸进一步生成邻氨基苯甲酸(anthranilate)和苯甲酸酯(prephenate),而邻氨基苯甲酸生成色氨酸,苯甲酸酯生成苯丙氨酸和酪氨酸。色氨酸可进一步衍生形成喹啉生物碱(喜树碱)和吲哚生物碱(长春碱),而苯丙氨酸和酪氨酸进一步衍生形成类黄酮(柚皮素)、芪类(白藜芦醇)和苄基异喹啉生物碱(吗啡)[98]。Luttik等[99]通过引入对酪氨酸抑制不敏感的ARO4酶,将酿酒酵母胞内苯丙氨酸和酪氨酸浓度提高3倍。
(5)蛋白质合成 据估计,在营养培养基上生长至对数期的酿酒酵母,每个细胞平均拥有200 000 个 核 糖 体 和 15 000~60 000 条 mRNA(30%为核糖体蛋白),受限于可用核糖体数量,每秒合成约13 000 个蛋白质分子。翻译延伸因子是胞内最丰富的蛋白质之一,含量可达105~106[100]。因此,酿酒酵母是疫苗、医用蛋白生物合成的重要宿主,目前酿酒酵母作为生物制造系统已成功应用于乙型肝炎表面抗原、胰岛素、胰高血糖素、尿酸氧化酶、巨噬细胞集落刺激因子和血小板衍生生长因子等物质的生物合成,但是,酿酒酵母蛋白质糖基化过高、较低的蛋白表达能力成为其扩大工业应用范围的主要限制因素[101]。
2.4.2 巴斯德毕赤酵母
极佳的蛋白分泌能力、优异的翻译后修饰(糖基化与二硫键)以及胞外内源性蛋白极少使得毕赤酵母成为异源蛋白表达的理想生物制造系统之一。2009 年 de Schutter 等[102]首次对毕赤酵母进行全基因组的解析。毕赤酵母拥有极强的甲醇诱导型启动子AOX1,启动子AOX1 启动子被甲醇强诱导,被葡萄糖、甘油和乙醇抑制。山梨醇不会抑制或诱导AOX1 启动子,因此与甲醇混合补料,可以提高细胞密度和生产速率。毕赤酵母在表达木聚糖酶、甘露聚糖酶和漆酶等半纤维素酶方面拥有显著优势,特别是表达含糖基化的酶时,目的蛋白酶会具有更好的热稳定性,从而减少工业处理步骤中的冷却过程,节约能源和时间。此外,毕赤酵母作为生物制造系统也被广泛应用于人促红细胞生成素、磷脂酶C、人超氧化物歧化酶、胰蛋白酶、人血清白蛋白、胶原蛋白和人单克隆抗体等医用蛋白的生物合成[103]。
典型模式宿主系统及适用范围总结于表1。

表1 典型模式宿主系统及适用范围总结Tab.1 Summary of various typical model organism system and their scope of application
3 展 望
基于合成生物技术对现有天然存在的生物制造系统进行目的性的改造,使其满足工业化生产需求的高版本底盘细胞是解决资源可持续化发展的重要途径之一[104-105]。本文简述了合成生物技术的研究发展,并着重总结了当前典型模式菌株的代谢特性及其应用范围,然而目前构建高效的生物制造系统仍然在以下方面值得进一步探索:
(1)制定合成生物技术工具元件标准的必要性 目前,合成生物技术发展处于快速发展的初级阶段,合成生物技术新工具和新策略开发速度较快,然而大部分合成生物学元件处于缺乏行业标准约束的自由定义的状态,导致业内共享难度较大,不利于合成生物学的长久发展。因此,应为在特定条件下的特定目的制定标准化工具元件,以其作为基准来标注新工具和新策略的有效性,便于科研创新的原创性和健康发展。
(2)制定合成生物技术数据标准的必要性随着基因编辑和高通量自动化实验平台的发展,合成生物技术领域的数据量呈现爆发式的增长,如何统计、分析和使用数据成为新时代合成生物所面临的重要问题。尽管目前发表刊物已经加强对原始数据的要求,但是如何强化数据的有效性仍然具有挑战。例如,仅改动一个基因、一个微量元素、一个培养温度,都可能会对目的数据产生巨大的影响。因此,制定数据标准有助于从纷繁众多的数据中择取有效数据具有重要作用。
(3)开发标准自动化工作平台的必要性 合成生物学是一门背景复杂、学科交叉的前沿生命科学学科,为了探究表象特征背后复杂的调控机制,往往需要大量的有效实验数据,一般情况下,越大量的有效数据意味着越接近真相本质。为此,开发标准自动化工作平台,不仅可以显著提高数据量,而且可以避免人为因素引入的非必要误差。
(4)开发更加精细化、多元化、全局化、普适化的合成生物技术 目前的合成生物技术设计和应用方面仍存在调控范围局限、普适性差、手段单一等缺点,而对于非典型模式宿主而言,基因编辑工具不足、代谢调控策略的滞后性都将导致生物制造系统构建效率低下,严重限制了如极端微生物等非典型模式宿主的应用。因此,开发更加精细化、多元化、全局化、普适化的合成生物技术具有重要意义。
(5)简便、系统的构建高效的生物制造系统典型的模式宿主其代谢机理研究虽较为成熟,但却呈现出模块化、孤立化的特点。当对某一基因节点进行代谢改造时,往往会带来非预期范围内的结果。机器学习与合成生物技术的交叉发展有望让构建高效的生物制造系统变得全面、系统、简便。建立全细胞数学模型,将细胞全局数字化。基于全细胞数学模型构建高效的生物制造系统时,可以进行“自上而下”的预测-输入代谢改造策略后输出全局预期结果,或进行“自下而上”模拟-输入预期改造结果输出所需的代谢改造策略。
