化学品体外生物合成途径设计、元件组装和应用
2021-02-10万逸尘许孔亮郑仁朝郑裕国
万逸尘 ,许孔亮 ,郑仁朝 ,郑裕国
(1 浙江工业大学生物工程学院,生物有机合成技术研究浙江省重点实验室,浙江 杭州 310014;2 浙江工业大学生物工程学院,生物转化与生物净化教育部工程研究中心,浙江 杭州 310014)
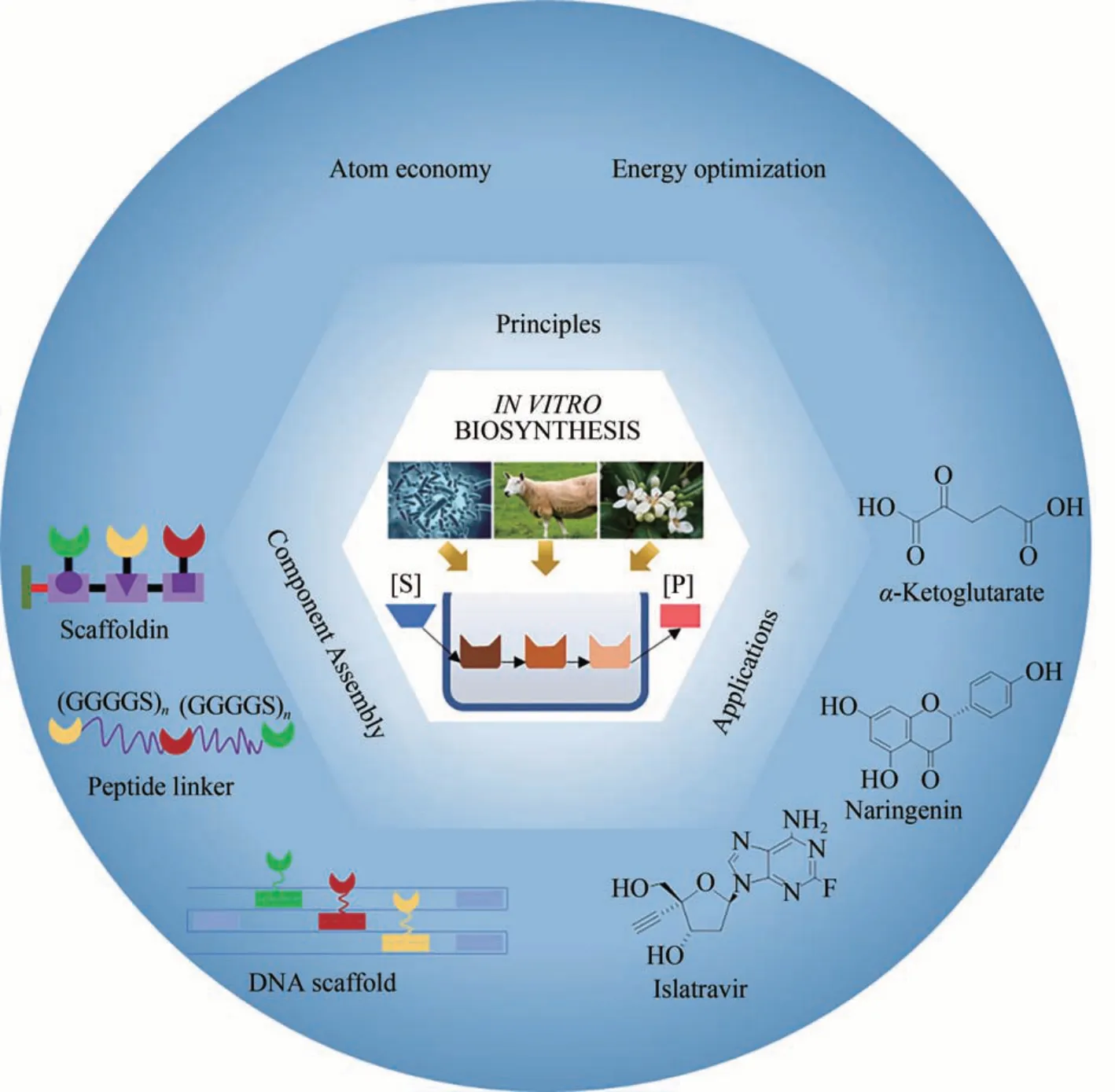
化学工业是国民经济的支柱产业之一。随着社会进步和人民生活水平的提高,对化学品精细化、高端化、多样化的需求日益旺盛。作为传统化学合成技术的补充,环境友好的生物合成技术正引起普遍关注,成为实现社会可持续发展的重要突破口[1-3]。近年来,随着合成生物学和蛋白质工程等现代生物技术的进步,国内外研究人员开发了一系列高性能的工业菌种和细胞工厂,满足对医药化学品、日用化学品、食品和饲料添加剂、农药及其中间体等多种化学品生产的需要[4-5]。然而,由于细胞代谢高度网络化、生长偶联依赖等瓶颈问题,体内生物合成(全细胞生物合成)的物质与能量转化效率往往难以满足高效生产化学品的需求[6-10]。
体外生物合成(无细胞生物合成)是指以纯化的酶或细胞提取物为催化剂,制备所需化学品的一种合成方法。由于避开了胞内复杂环境的影响,体外生物合成展现了催化效率高、物质转化率高等显著优势[11-13],能够有效满足化学品工业生产的需要。此外,通过酶元件的设计与组装调控构建新的人工合成途径,使其具有途径设计多样、可控性强和酶元件来源丰富等特点。近年来,国内外众多研究团队通过构建化学品体外生物合成系统,实现了多种化学品的体外生物合成,如糖类化学品[14]、有机酸类化学品[15]和醇类化学品[16]等。本文分析总结了体外生物合成途径设计的两个重要原则,包括原子经济性原则和能量最优原则;介绍了体外生物合成中用于酶元件组装的3类常见的生物大分子,包括连接肽、蛋白支架和DNA 等;并介绍了近年来生物体外合成在化学品生产中的应用案例,包括氨基葡萄糖[14]、甘油葡萄糖 苷[17]、α-酮戊二酸[15]、丙酮 酸[18]、 乙醇[16]、丙二醇[19]、Islatravir[20]和氮霉素[21]等。通过对体外生物合成的途径设计、酶元件的组装方式以及具体应用案例的综述,本文最后对化学品体外生物合成的发展趋势进行了展望。
1 体外生物合成途径设计
途径设计是构建整个体外生物合成系统的关键所在。然而,面对结构和性质不同的化学品,很难设计出一条体外生物合成的“通用”途径[22]。只有不断积累前人的经验,解决途径设计中存在的每一个困难,体外生物合成系统的构建才能取得进展[22]。体外生物合成的途径设计可以参考两个重要的原则,即原子经济性原则和能量最优原则。
1.1 原子经济性原则
作为“绿色化学”的重要概念之一,原子经济性是指在化学品合成过程中,合成方法和工艺应被设计成能将原料尽可能多地转化到最终产物中[23]。在化学品体外生物合成途径设计中,可以考虑以下几点以满足原子经济性的需要:①选择与产物结构类似的起始原料以提高原料利用效率;②设计理论转化率高的合成途径以提高原料的转化率;③选用合适的酶元件以提高反应的催化效率[24]。
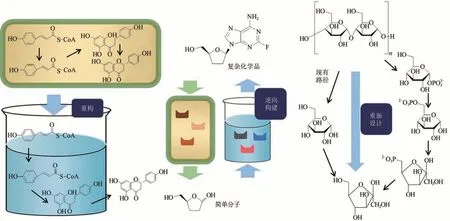
图1 参考原子经济性原则构建的体外生物合成途径Fig.1 Designing in vitro biosynthetic pathways via principle atom economy
除了代谢合成,生物体内还存在将复杂的化学品代谢分解成简单分子的途径。通过逆向构建目标化学品的分解途径,筛选合适的酶元件,可实现由简单分子合成目标化学品,该方法被称为生物逆向合成(bioretrosynthesis)(图 1 中)[29-30]。以2,3-二脱氧肌苷(去羟肌苷)的合成为例,Bachmann等[31]通过借鉴生物中肌苷分解成核糖的代谢路径,在体外逆向构建了以2,3-二脱氧核糖为底物,核糖激酶、磷酸戊糖变位酶和嘌呤核苷磷酸化酶为催化剂,设计了2,3-二脱氧肌苷的合成途径。并通过对核糖激酶、磷酸戊糖变位酶和嘌呤核苷磷酸化酶的改造,提高了对非天然底物及中间体(2,3-二脱氧核糖)的选择性并增加了底物周转率,对2,3-二脱氧核糖的选择性相较于改造前提升了9500 倍,同时2,3-二脱氧肌苷的产量也提升了50 倍。此外,Islatravir[20]、莫能菌素A(monension A)[32]等化学品的体外生物合成也借鉴了生物逆向合成的设计思路。
对于一些不改变起始原料的化学品合成路线,还可以重新设计其合成途径,选择合适的酶元件进行催化,提高底物的转化率以满足原子经济性的需求(图1 右)。以果糖的生产为例,目前工业上以淀粉为原料,通过淀粉水解酶和葡萄糖异构酶两种酶催化生产果糖,由于中间产物葡萄糖与终产物果糖的化学势相近,导致该方法果糖的转化率最高仅能达到50%左右。Moradian 等[22]重新设计了一条以淀粉为原料体外生物合成果糖的途径,该路径以淀粉磷酸化酶、葡萄糖变位酶、转醛缩酶和3-磷酸甘油醛磷酸酶为催化剂,由于其中间体产物的化学势都均高于果糖,且反应均为可逆反应,理论上其转化率可达100%。由于未筛选到对果糖-6-磷酸选择性高的3-磷酸甘油醛磷酸酶,在最后一步选择了对果糖-6-磷酸选择性高的转醛缩酶,并设计了基于3-磷酸甘油醛磷酸酶的甘油醛再生系统,使该体外生物合成系统的果糖∶葡萄糖比值达到了92∶8,远远高于商用的果糖生产途径。Meng 等[33]通过借鉴前人的工作,将筛选到的对果糖-6-磷酸选择性较好的热稳定性磷酸酶,与α-糖苷磷酸化酶、磷酸葡萄糖变位酶、磷酸葡萄糖异构酶3种酶联用,最终使该淀粉磷酸化合成果糖的体外途径的果糖∶葡萄糖比值达到2∶1。
此外,在化学品体外生物合成中,将多个酶组装串联在一起也是提高产物产率的方法之一[34],能够满足体外生物合成的途径设计中原子经济性的要求。酶催化串联反应源于大自然中生命有机体为了维持生命过程而进化出的各种代谢通路,多酶催化串联策略在复杂天然产物合成中的应用已有相关综述报道[35]。
1.2 能量最优原则
作为生物体内最主要的能量来源,化学品体外生物合成中常需要三磷酸腺苷(adenosine triphosphate,ATP)的参与。能量最优原则是指在途径设计中,合成方法和工艺应被设计成不需要额外添加ATP或尽可能少地使用ATP[22]。
目前已开发了许多非ATP 依赖型的化学品体外生物合成的路径,降低了原有路径的成本。以磷酸二羟基丙酮合成为例,原有的合成路线以二羟基丙酮为原料,在二羟基丙酮激酶的催化下合成磷酸二羟基丙酮,该方法会消耗大量ATP。Wang 等[36]设计了一个非ATP-依赖型的体外生物合成系统,用以合成磷酸二羟基丙酮[图2(a)]。该系统以淀粉作为原料,通过α-葡聚糖磷酸化酶将其磷酸化为葡萄糖-1-磷酸,再通过磷酸葡萄糖变位酶、磷酸葡萄糖异构酶、焦磷酸磷酸果糖激酶以及D-果糖-1,6-二磷酸醛缩酶合成磷酸二羟基丙酮。该体外生物合成途径无需额外添加ATP 及辅酶,具有一定优势。
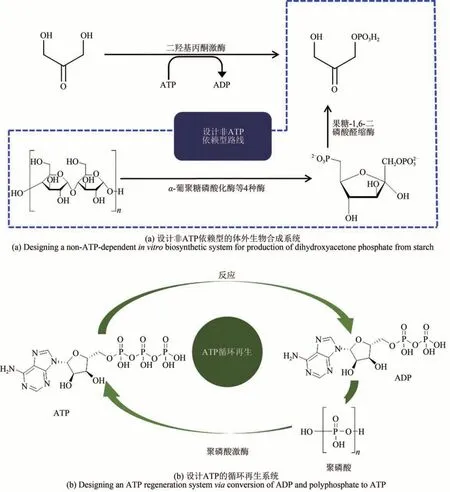
图2 参考能量最优原则构建体外生物合成途径Fig.2 Designing in vitro biosynthetic pathways via principle energy optimization
对于一些需要ATP 参与的体外生物合成系统,可以通过构建ATP 的循环再生系统或者重新设计合成途径以减少ATP 用量,降低生产成本[37-38]。Zhang 等[39]在设计由谷氨酸、甘氨酸和半胱氨酸合成谷胱甘肽的体外生物合成路线中,加入了一个由聚磷酸激酶和聚磷酸组成的ATP 循环再生系统 [图 2(b)][40],可以使生成的二磷酸腺苷(adenosine diphosphate,ADP)重新转变为ATP。相较于昂贵的ATP,体外反应进程中消耗的仅仅是低成本的聚磷酸。此外,还可以重新设计合成途径来减少ATP 用量,以L-乳酸的合成为例,传统体外合成生产L-乳酸的反应路径为Embden-Meyerhof 路线[41],该路线第 1 步需将葡萄糖磷酸化,而该步骤需要消耗ATP。Okano 等[42]重新设计从葡萄糖生产L-乳酸的体外生物合成路线,新设计的路线不再磷酸化葡萄糖,而是使用葡萄糖脱氢酶、葡萄糖酸脱水酶、2-酮-3-脱氧葡萄糖酸醛缩酶、甘油酸激酶和乳酸脱氢酶进行催化,该路径ATP 使用量比原路径少50%,从而降低了成本。
2 体外生物合成元件组装
作为体外生物合成的重要催化元件,酶具有催化效率高、底物专一性强、环境温和等优点。众所周知,生物体的代谢过程由多种酶协同完成,胞内酶可以形成复杂的多酶复合体,其催化反应高度有序,从而提高其催化效率[43]。因此,在化学品体外生物合成中,可以利用生物大分子将酶元件组装构建成多酶复合体,以起到提高整体反应速率、避免副反应、提高产品转化率、消除中间产物抑制等作用[44-45]。目前比较常见的用于多酶组装的生物大分子主要有连接肽、蛋白支架和DNA等(图3)。
由于数据的前一半数据受循环卷积影响,所有有效数据为后一半数据。此时,用近端值减去滤波输出,便可得到第p块的误差信号e(p),用一块内的累加值对滤波器系数进行更新,如式(8)所示:
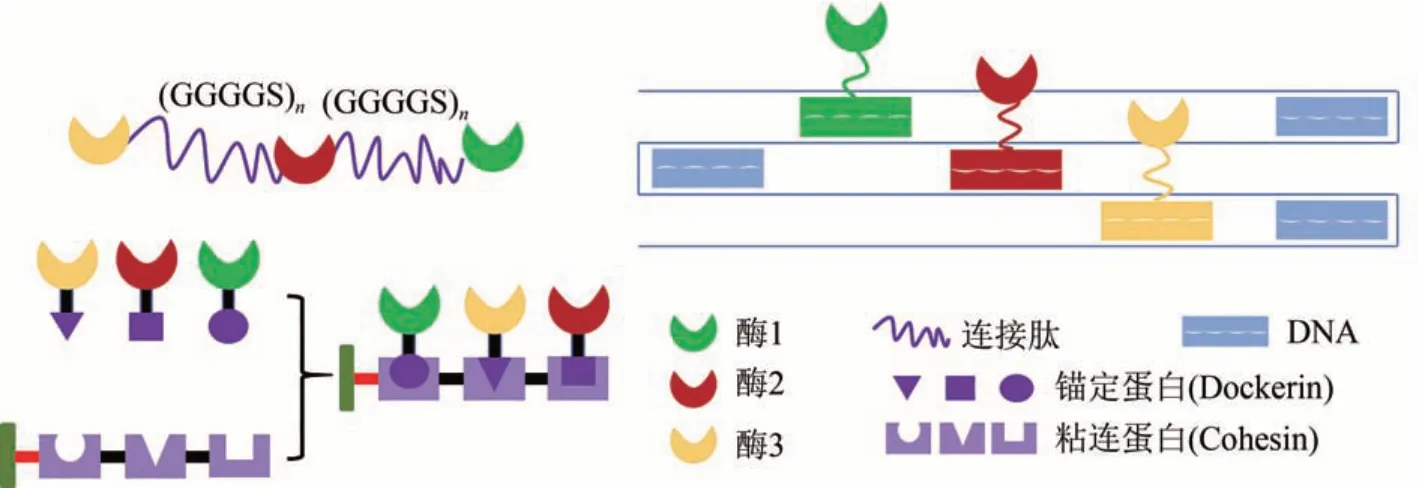
图3 用于多酶组装的生物大分子Fig.3 Biomolecules for multi-enzyme assembly
2.1 基于连接肽的元件组装
在自然界发现的一些多酶复合体中,酶与酶之间是由一小段多肽(连接肽)进行连接的[46-47]。连接肽可将异源酶连接起来,使酶元件之间紧密贴近(图3 左上)[45],这种方式构建的多酶系统可避免因多酶直接融合而产生的蛋白错误折叠、活性降低甚至失活等问题[48]。Fan 等[49]在甲醇合成果糖-6-磷酸的体外合成系统中,使用柔性连接肽(GGGGS)3和(GGGGS)6将甲醇脱氢酶(methanol dehydrogenase,Mdh)、6-磷酸己糖合酶(hexulose-6-phosphate synthase,Hps)和 6-磷酸-3-己糖异构酶(6-phospho-3-hexuloisomerase,Phi)顺序连接,构建了Mdh-Hps-Phi三酶组装体。连接肽使酶与酶之间产生协同作用,提高了该体外合成系统的分子动力学优势,其甲醇氧化速率是游离酶混合物的5.8 倍,总反应速率提升了 1.6 倍。Lerchner 等[50]使用较短的连接肽将2,2,6-三甲基环己烷二酮还原酶和ω-氨基转移酶进行组装构建多酶系统,用以催化异山梨醇(300 mmol/L)合成山梨醇二胺,其转化率是游离酶混合物的2倍。
2.2 基于蛋白支架的元件组装
在自然界中,蛋白支架(scaffoldin)是组成纤维小体结构的多肽,其上的粘连蛋白(cohesin)可与锚定蛋白(dockerin)产生特异性亲和结合[51-52]。通过在酶元件上设计连接锚定蛋白,在蛋白支架上设计与其对应的粘连蛋白,可以构建具有级联顺序的多酶系统,并通过底物通道效应提高酶催化效率[53-54]。You 等[54]在 3-磷酸甘油醛合成果糖-6-磷酸的体外生物合成系统中,基于蛋白支架设计了磷酸丙糖异构酶、醛缩酶、果糖-1,6-双磷酸酶的多酶催化系统,其对果糖-6-磷酸的合成速率约是游离酶的10 倍,转化率约为8 倍。Jeong 等[55]将β-琼脂酶、脱水半乳糖苷酶和 L-阿拉伯糖异构酶通过设计的蛋白支架组装成三酶复合结构,并以D-半乳糖为原料合成D-塔格糖,D-塔格糖的浓度可高达4.2 g/L,与游离酶混合物相比,其产量增加了1.4倍。
2.3 基于DDNNAA的元件组装
利用DNA 碱基之间的特异性结合,对其序列进行设计可以自组装成多种结构,如DNA 支架[56]、DNA 折纸或 DNA 水凝胶[57]等。在体外生物合成中,利用酶表面具有的活性残基与DNA 寡核苷酸序列间的生物结合,可以使不同酶组装成多酶复合结构,并控制其相对位置[58]。相较于上述两种酶元件组装方式,使用DNA 组装多酶系统可以精准控制酶的空间位置和酶之间的距离,降低传质阻力以达到最理想的催化效率[59]。Xin等[60]成功开发了一种新的DNA组装策略,通过组装葡萄糖氧化酶和辣根过氧化物酶,催化葡萄糖高效转化为葡萄糖酸。这两种酶被组装在一个带有支撑臂结构的DNA 中,通过改变支撑臂的长度控制中间产物的扩散距离,使酶活相较于游离酶提高了88%。Fu等[61]在果糖-6-磷酸合成苹果酸的体外合成系统中,将果糖-6-磷酸脱氢酶和苹果酸脱氢酶组装在一个DNA 支架上,并在酶之间设计了一个带有辅助因子的摆动DNA 臂。这种人工构建的DNA 摇臂可以促进底物在两种偶联的脱氢酶之间转移,其酶活相比游离酶提高了25倍[62]。
3 体外生物合成的应用前景
利用上述合成途径和组装策略,国内外研究人员构建了一系列的化学品体外生物合成系统,实现了多种大宗化学品的绿色合成。本文将对糖类、有机酸、醇类及其他化学品的体外生物合成的应用作举例介绍,主要包括氨基葡萄糖、甘油葡萄糖苷、丙酮酸、α-酮戊二酸、丙二醇、乙醇、Islatravir和氮霉素等。
3.1 糖类化学品
氨基葡萄糖被广泛应用于食品、化妆品和制药工业中[63]。目前用于生产氨基葡萄糖的方法主要有化学法和微生物发酵法。化学法需要强酸水解且操作步骤繁杂,并伴有毒副产物产生[63];微生物发酵法产生的氨基葡萄糖易被微生物代谢消耗,且产物积累会抑制微生物生长而致产量降低[63]。Meng 等[14]设计了一条氨基葡萄糖的体外生物合成路径(图4),该方法以淀粉/麦芽糊精和氨水为原料,α-糖苷磷酸化酶、磷酸葡萄糖变位酶、磷酸葡萄糖异构酶、氨基葡萄糖-6-磷酸脱氨酶、氨基葡萄糖-6-磷酸磷酸酶为催化剂,当麦芽糊精浓度为10 g/L 时,其氨基葡萄糖的产量可达7.9 g/L,对应的摩尔转化率为75.8%。为探究该体外生物合成路径的工业应用潜力,作者对该体系进行了放大,当麦芽糊精浓度为50 g/L时,其氨基葡萄糖的产量可达23.7 g/L。虽然该产量与目前微生物发酵法的最高水平(120 g/L 左右)还存在一定差距[64],但是该氨基葡萄糖的体外合成路线具有催化效率高、原子经济性好和可控性强等优点,展现出了一定的工业应用前景。此外,Lv等[65]构建了一条以蘑菇及植物中的几丁质为原料合成氨基葡萄糖的体外合成路线,通过甲壳素酶和脱乙酰酶(来源于Cyclobacterium marinum)两步合成氨基葡萄糖,该方法以废弃的植物资源为原料,具有一定的环保效益,同时可被甲壳类过敏的消费者食用。
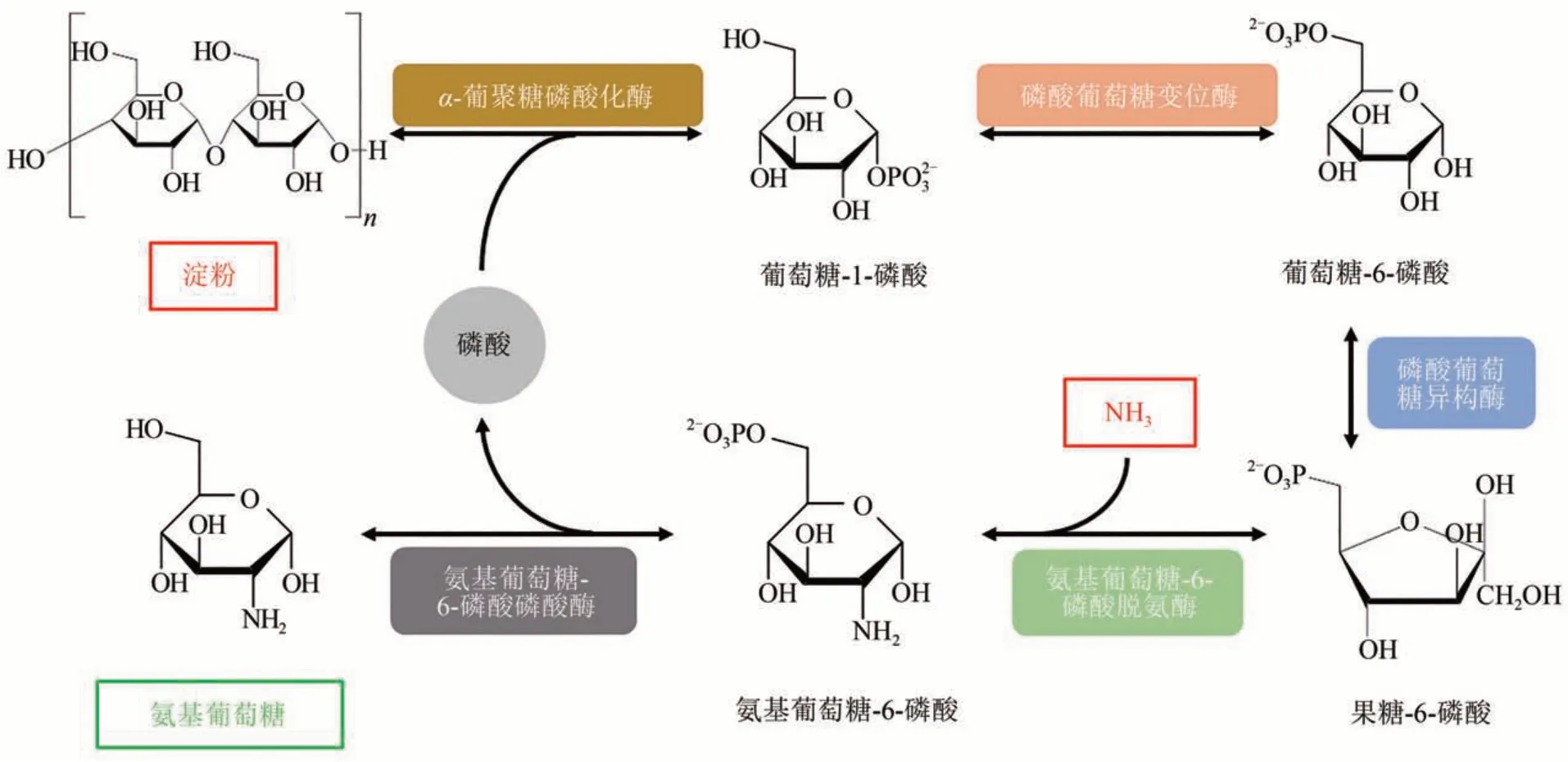
图4 使用淀粉生产氨基葡萄糖的体外生物合成途径Fig.4 In vitro biosynthesis pathway for conversion of starch and inorganic ammonia to glucosamine
甘油葡萄糖苷(α-glucosylglycerol)是由一分子甘油和一分子葡萄糖通过糖苷键形成的一种糖苷型化合物,可作为化妆品中的保湿剂[66-67]。Zhang 等[17]构建了两条甘油葡萄糖苷的体外生物合成路线。其中一条以蔗糖为原料,经蔗糖磷酸酶、葡萄糖基甘油磷酸酶催化合成;另一条以麦芽糖为原料,经麦芽糖磷酸酶、葡萄糖基甘油磷酸酶催化合成。通过对反应条件的优化,两条途径的转化率均可高达97%,甘油葡萄糖苷产量高达452 g/L。
此外,果糖、2-脱氧-5-核糖、甘露糖等糖类化学品也可以通过体外生物合成方法进行生产(表1)。

表1 糖类化学品的体外生物合成Tab.1 In vitro biosynthesis of carbohydrates and its derivatives,including glucosamine,N-acetyl glucosamine,glycerol glucoside,glucose-6-phosphate,fructose,fructose-6-phosphate,fructose-1,6-diphosphate,2-deoxy-5-ribose,d-tagatose,mannose and xylulose-5-phosphate.
3.2 有机酸类化学品
α-酮戊二酸是三羧酸循环和氨基酸合成的重要中间体,可作为膳食补充剂、伤口愈合类化合物的原料以及杂环化学合成的基础原料[75]。目前,α-酮戊二酸一般使用琥珀酸和草酸二乙酯与氰醇进行化学合成,其产率约为75%,但由于使用有毒的原料,该方法会产生有毒的废物(如氰化物)[76]。环境友好的生物合成可作为化学法的替代方式,但体内生物合成需要精确控制其培养条件[77](如硫胺素和氮浓度、pH和通气量等),且产生的丙酮酸和其他有机酸等副产物会抑制细胞的生长。因此,Beer 等[15]设计了类糖醛酸的氧化途径,该方法以葡萄糖醛酸为底物,使用尿酸盐脱氢酶、草酸盐脱水酶、5-酮-4-脱氧葡萄糖酸脱水酶和α-酮戊二酸半醛脱氢酶催化合成α-酮戊二酸(图5)。这种体外生物合成方式所需酶级联步骤较短,并且单次反应只消耗两个单位的NAD+。由于最后一步由α-酮戊二酸半醛脱氢酶催化的氧化反应为不可逆反应,因此总反应的热力学平衡强烈倾向于产物。在添加辅酶循环再生系统后,10 g/L 的D-葡萄糖醛酸可生产2.8 g/L的α-酮戊二酸。
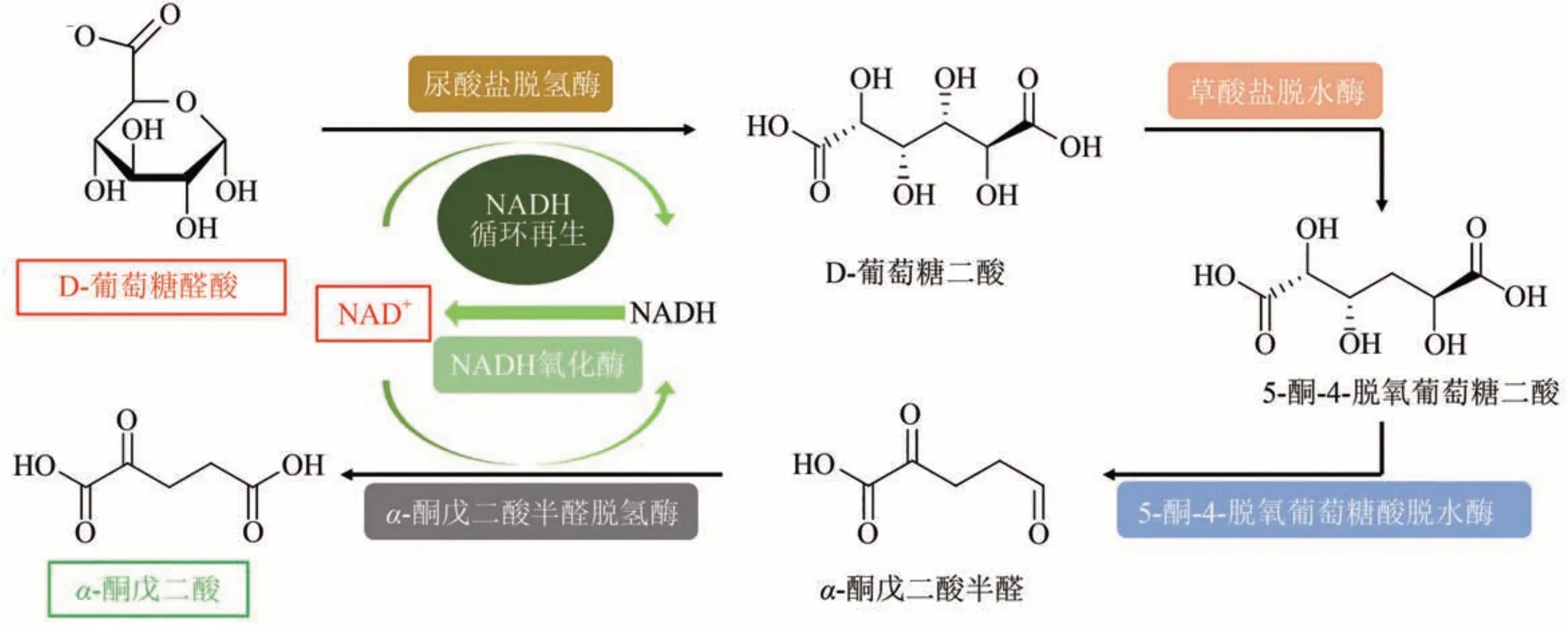
图5 使用D-葡萄糖醛酸生产α-酮戊二酸的体外生物合成途径Fig.5 In vitro biosynthesis pathway for conversion of D-glucuronic acid to α-ketoglutarate
丙酮酸是一种酸性较弱的有机酸,作为生物细胞糖代谢及体内多种物质相互转化的重要中间体,在药品、食品、农业、医疗等行业有重要的作用。Honda等[18]利用甲壳素为原料构建了丙酮酸的体外生物合成系统,使用了12种嗜热酶,其中包括3-磷酸甘油醛脱氢酶、不依赖辅因子的磷酸甘油酸突变酶、烯醇化酶和丙酮酸激酶等。在添加了辅酶再生系统、ATP再生系统与腺苷酸激酶后,丙酮酸产量提高到了2.1 mmol/L(底物浓度为0.5 mg/mL)。
此外,乳酸[41]、D-2-氨基丁酸[78]、半胱氨酸[28]、葡糖二酸[79]等有机酸类化学品也可以通过体外生物合成方法进行生产(表2)。

表2 有机酸类化学品的体外生物合成Tab.2 In vitro biosynthesis for organic acid chemicals,including α-ketoglutarate,pyruvate,lactic acid,D-2-aminobutyric acid,cysteine and glucaric acid
3.3 醇类化学品
乙醇是一种常用的化学品,在化工、医疗、食品、农业生产中都有广泛的用途[80]。在乙醇的微生物发酵生产中,菌体对温度和溶剂条件的低耐受性是导致其转化效率低下的主要原因。Guterl等[16]构建了以葡萄糖为原料合成乙醇的体外生物合成系统,该系统首先以葡萄糖脱氢酶、二羟酸脱水酶、2-酮-3-脱氧葡萄糖酸醛缩酶、甘油醛脱氢酶为催化剂构建了葡萄糖合成丙酮酸的高效中间体平台,再利用丙酮酸脱羧酶与乙醇脱氢酶催化丙酮酸催化合成乙醇(图6)。当葡萄糖浓度为25 mmol/L时,乙醇的浓度经19 h 可达到28.7 mmol/L。此外,基于丙酮酸的中间体平台,该路径还可用于异丁醇的生产,经23 h 的酶催化,19.1 mmol/L 的葡萄糖可转化为10.3 mmol/L的异丁醇。
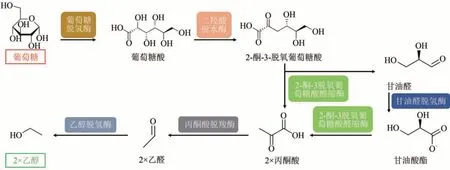
图6 使用葡萄糖生产乙醇的体外生物合成途径Fig.6 In vitro biosynthesis pathway for conversion of glucose to ethanol
1,3-丙二醇是生产不饱和聚酯、多种药物及中间体、表面活性剂和乳化剂的原料[81]。传统上以甘油为原料发酵生产1,3-丙二醇的方法由于体内复杂的 代 谢 路 径 , 仅 能 达 到 60% 的 产 率[81-82]。Rieckenberg 等[19]构建了由甘油生产 1,3-丙二醇的体外生物合成路径,以甘油脱水酶、丙二醇氧化还原酶同工酶和氢化酶为催化剂,构建了两步级联反应,其中氢化酶作为辅因子再生模块可消耗氧气为体外生物合成系统供给NADPH,该体外生物合成途径有着很高的原子经济性(转化率接近100%)。同时,通过添加辅酶维生素B12、ATP和镁,延长了甘油脱氢酶的耐久性,相比于发酵过程,该路径可简化在工业化生产中下游的分离步骤。
此外,正丁醇、异丁醇、肌醇、二氨基山梨醇等醇类化学品也可以通过体外生物合成方法进行生产(表3)。
3.4 其他化学品
除了上述3 类大宗化学品,体外生物合成系统还可用于合成其他具有不同结构和功能的化学品,包括一些复杂的天然产物和药物,如Islatravir、氮霉素、异戊二烯、间苯三酚和柚皮素等(表4)。
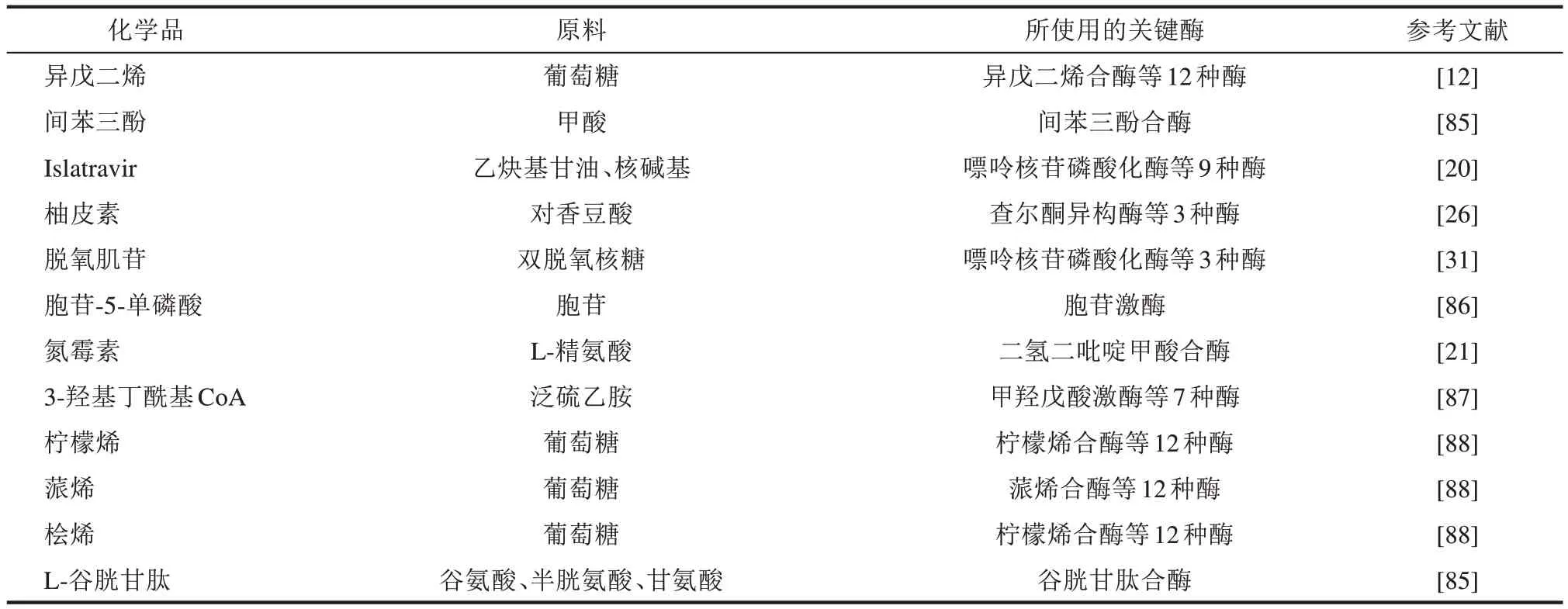
表4 其他化学品的体外生物合成Tab.4 In vitro biosynthesis for other chemicals,including isoprene,phloroglucinol,islatravir,naringenin,deoxyinosine,cytidine-5-monophosphate,azomycin,3-hydroxybutyryl limonene,pinene,hinokene and L-glutathione
核苷型类似物Islatravir 是一种人类免疫缺陷病毒(human immunodeficiency virus,HIV)逆转录酶易位抑制剂,目前正在进行临床试验研究,有望用于HIV 暴露前的预防感染,以及降低治疗的给药频率[89]。由于需要构建多个保护基以保护Islatravir 的活性基团和2-脱氧核糖核苷的立体选择性,目前多种化学合成路线均需要长达 12~18 步的合成步骤[90]。默克公司的Huffman 等[20]在细菌核苷补救途径的启发下,采用逆向合成思路(图1),设计了一条无需保护基步骤的Islatravir 的体外生物合成路线,该方法以脱氧核糖-5-磷酸醛缩酶、磷酸突变酶、嘌呤核苷磷酸化酶等酶为催化剂,以2-乙炔基甘油为原料,经过三步催化步骤合成Islatravir(图7)。通过优化酶催化的各个路径,首次实现了Islatravir 的体外规模化合成,其总产量高达51%,纯度高达95%。
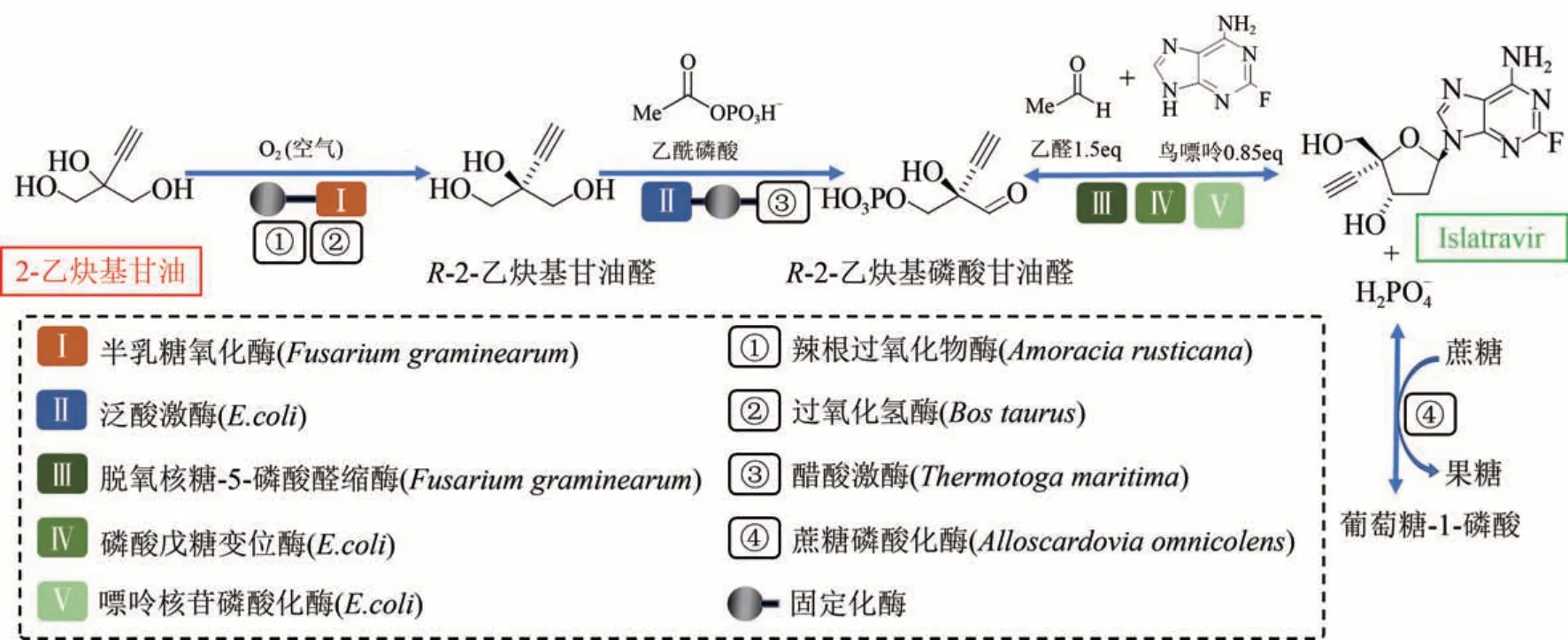
图7 Islatravir的体外生物合成途径Fig.7 In vitro biosynthesis pathway for conversion of ethynyl glycerol,acetaldehyde and guanine to islatravir
氮霉素(azomycin)是一种硝基咪唑类抗生素药物,是目前治疗厌氧细菌感染的最有效的药物之一。Eguchi 等[91]发现在菌株Streptomyces eurocidicus中,L-精氨酸可通过2-氨基咪唑转化为氮霉素。受前人工作的启发,Hedges 和Ryan[21]以L-精氨酸为原料,吡哆醛-5-磷酸依赖型精氨酸氧化酶、二氢二吡啶甲酸合酶、胍基乙醛脱水酶、铁氧化酶为催化剂,首次构建了氮霉素的体外生物合成系统,该工作为今后体外生物合成氮霉素或其他硝基咪唑类化学品提供了借鉴。
4 总结与展望
21 世纪以来,以合成生物学和蛋白质工程为代表的现代生物技术的迭代进步,为化学品体外生物合成的发展提供了强有力的保障。以美国和欧盟为代表的发达国家和地区在化学品体外生物合成领域的发展快速,我国在该领域内的自主创新也展现出强劲活力。然而,作为一种新兴的绿色合成方式,化学品体外生物合成还处于技术发展的初期阶段,目前还存在一定的挑战,具体表现如下:
(1)化学品体外生物合成的途径设计困难。化学品体外生物合成技术现有的发展多是基于自然界中已发现的生物合成途径。然而,绝大部分化学品并没有天然合成途径,这给很多化学品体外生物合成的途径设计带来了一定困难。
(2)化学品体外生物合成的关键酶元件缺乏。酶元件是构建化学品体外生物合成途径的关键,然而,很多理论转化率很高的途径,由于缺少合适的酶元件,难以达到预期的效果。
(3)化学品体外生物合成的成本较高。很多化学品体外生物合成需要ATP 及辅酶的参与,然而,昂贵的ATP 及辅酶原料极大增加了体外生物合成的成本。同时,酶在体外的稳定性和可重复使用率较差,也是造成体外生物合成的成本居高不下的重要原因之一。
针对上述化学品体外生物合成技术存在的挑战,笔者分析总结了体外生物合成途径设计的两个重要原则,包括原子经济性原则和能量最优原则;介绍了体外生物合成中用于酶元件组装的3类常见生物大分子,包括连接肽、蛋白支架、DNA等;并对近年来体外生物合成在化学品生产中的应用案例作了介绍,包括氨基葡萄糖、甘油葡萄糖苷、丙酮酸、α-酮戊二酸、乙醇、1,3-丙二醇、Islatravir和氮霉素等。最后,笔者对化学品体外生物合成的发展趋势进行展望,具体如下:
(1)随着计算机技术的发展,可以使用人工智能技术对代谢路径进行大数据分析和理论计算,以筛选出最优的途径供体外生物合成使用。
(2)随着非理性设计到理性设计的蛋白质改造技术以及新酶设计能力的不断提高,希望可以快速获得具有理想催化功能的关键酶元件供体外生物合成使用。此外,还可通过酶元件与绿色环保的化学催化剂串联/并联使用,实现化学品的体外绿色合成。
(3)开发辅因子再生系统或者人工仿生辅酶,降低辅因子的使用成本。同时,期望通过重构体外生物合成的途径,设计出不需要ATP 或辅酶参与的路线,以降低化学品体外生物合成的成本。
(4)开发具备工业应用前景的酶固定化或自组装技术,提高酶在体外生物合成系统中的稳定性,增加酶的回收和重复使用率,降低体外生物合成的成本。
总之,随着体外生物合成设计能力的不断提高,体外生物合成的途径设计将朝着智能化、高效化发展,化学品体外合成的效率也将逐步提高,体外生物合成有望涵盖所有化学品的生物合成。同时,也希望通过合成生物学技术的辅助,使化学品体外生物合成的成本不断降低,并成为未来化学品合成的主要方式之一。
