大肠杆菌生产饲用氨基酸的研究进展
2021-02-10郭亮高聪柳亚迪陈修来刘立明
郭亮 ,高聪 ,柳亚迪 ,陈修来 ,刘立明
(1江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2江南大学国际食品安全联合实验室,江苏 无锡214122)

随着畜牧业的快速发展,人们对畜牧饲料蛋白的需求日益剧增。非洲猪瘟、疯牛病目前没有疫苗,倒逼养殖企业加强生物防控,减少甚至不用动物性蛋白,避免携带病毒[1]。众所周知,蛋白质的营养实际上是由氨基酸提供,通过添加必要的氨基酸可以降低动物膳食中的粗蛋白水平,同时满足动物营养需求[2-4]。在动物饲料中添加适宜含量的氨基酸,不仅可以最大限度地满足动物的蛋白需求,调控动物的生长和饲料转化率,而且大大降低粗蛋白用量,提高饲料利用率,节约饲养成本[5-8]。因此,研究人员发展了利用饲用氨基酸作为氨基酸添加剂,替代天然蛋白成分,生产配合饲料的方法。饲用氨基酸主要是指植物性饲料缺乏的必需氨基酸(如赖氨酸、甲硫氨酸、色氨酸、苏氨酸)和一些小品种氨基酸(如缬氨酸和精氨酸)[9-12]。目前饲用氨基酸的生产方法主要有3 种:动植物提取、化学炼制和生物炼制[13-14]。由于动植物提取的原料受限、生产工艺复杂、生产成本高、环境污染大等缺点,在工业上未得到广泛应用[15-16]。化学炼制具有原料不可再生、反应步骤多、伴有副反应发生、反应条件苛刻、安全性低差等问题,在实际生产中被逐渐淘汰[17]。依靠微生物为基础的生物炼制,不仅利用可再生生物质资源为原料,而且具有成本低廉、产品纯度高、反应条件温和、环境污染小等优势,为解决动植物提取和化学炼制中的问题提供了一种有效解决方案,因而被广泛应用于饲用氨基酸生产[18-27]。
由于大肠杆菌遗传背景清晰、生长迅速与培养简单,成为了研究最为广泛和深入的模式微生物[15,28]。利用合成生物学技术,改造大肠杆菌细胞构建的细胞工厂,利用生物质为原料可绿色高效合成饲用氨基酸[20,29-34]。本文重点关注了赖氨酸、甲硫氨酸、色氨酸等饲用氨基酸的生物合成途径,介绍了大肠杆菌合成饲用氨基酸的生产瓶颈,综述了大肠杆菌细胞工厂合成饲用氨基酸的研究进展,并展望了未来饲用氨基酸菌株改造的重点方向。
1 天冬氨酸族氨基酸大肠杆菌细胞工厂
1.1 天冬氨酸族氨基酸的生物合成途径
由于天冬氨酸是赖氨酸、苏氨酸和甲硫氨酸共同前体,因此,将赖氨酸、苏氨酸和甲硫氨酸统称为天冬氨酸族氨基酸。赖氨酸具有增强动物食欲、增强抗病能力和促进外伤治愈的作用。赖氨酸是植物性饲料中最缺乏的一种氨基酸,分别是猪和禽类饲料的第一与第二限制性氨基酸;苏氨酸是继赖氨酸和甲硫氨酸之后家禽饲料中的第三限制性氨基酸;甲硫氨酸是家禽的第一限制性氨基酸,猪的第二限制性氨基酸[5-8]。
葡萄糖经糖酵解途径形成的丙酮酸,经羧化反应生成草酰乙酸,草酰乙酸在天冬氨酸氨基转移酶(AAT)的作用下形成天冬氨酸[35]。如图1所示,天冬氨酸经天冬氨酸激酶(AK Ⅰ、AK Ⅱ或AK Ⅲ)和天冬氨酸半醛脱氢酶(ASD)催化生成天冬氨酸半醛。天冬氨酸半醛,一方面经过二氢吡啶二羧酸合酶(DS)、二氢吡啶二羧酸还原酶(DR)、四氢二吡啶琥珀酰酶(THS)、N-琥珀酰二氨基庚二酸氨基转移酶(SDAT Ⅰ、SDAT Ⅱ)、N-琥珀酰二氨基庚二酸脱琥珀酰酶(SDD)、二氨基庚二酸差向异构酶(DE)与二氨基庚二酸脱羧酶(DDC)催化合成赖氨酸,另一方面天冬氨酸半醛经高丝氨酸脱氢酶(HD Ⅰ、HD Ⅱ)脱羧形成高丝氨酸[3]。高丝氨酸经高丝氨酸激酶(HK)和苏氨酸合酶(TS)催化形成苏氨酸[36-37],经O-琥珀酰高丝氨酸转琥珀酰酶(HST)、琥珀酰高丝氨酸裂解酶(SHL)、胱硫醚β-合成酶(CL)、半胱氨酸甲基转移酶(HMT Ⅰ、HMT Ⅱ)催化形成甲硫氨酸[38-40]。
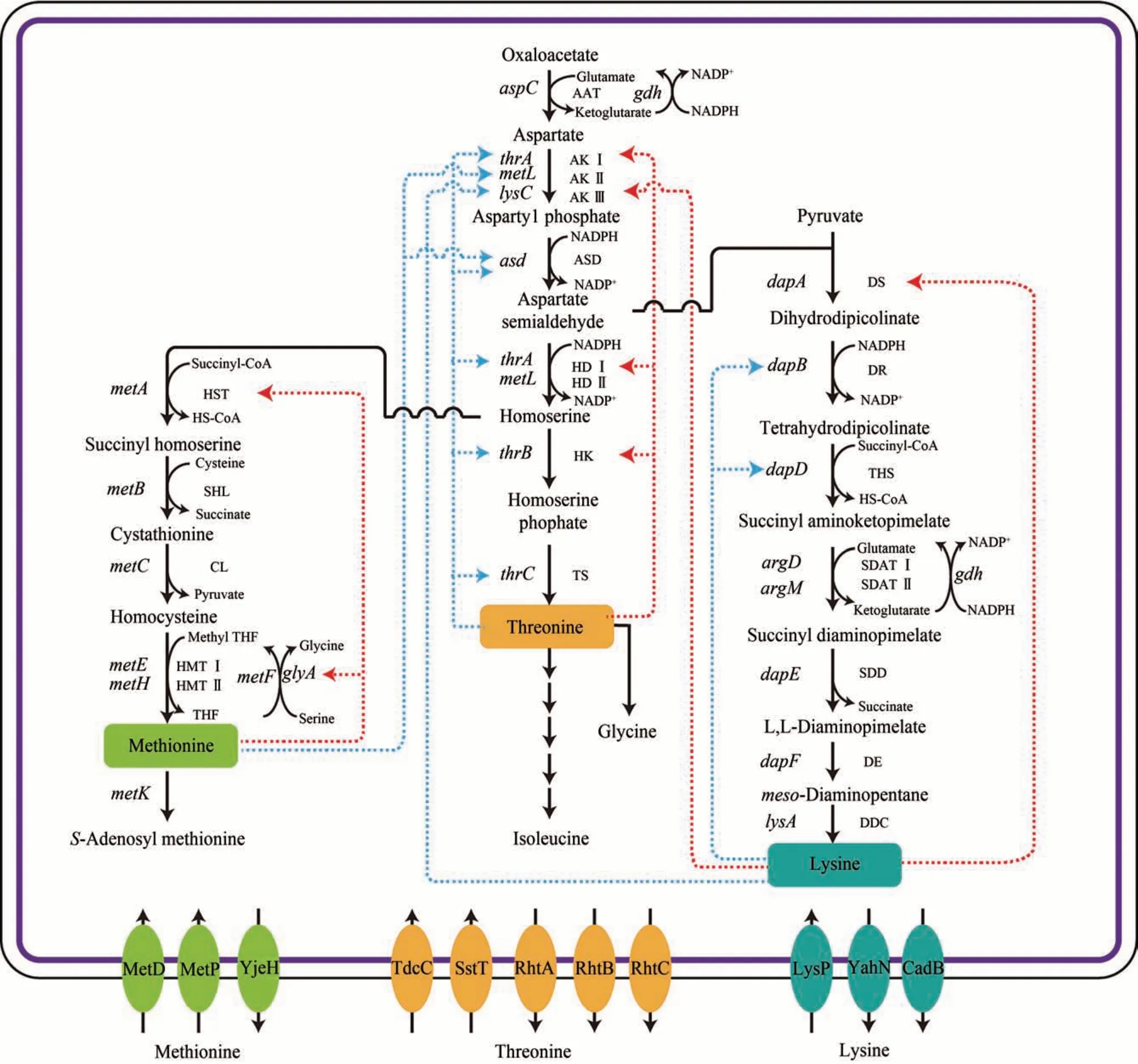
图1 大肠杆菌天冬氨酸族氨基酸的合成路径及其反馈调节示意图Fig.1 Metabolic pathways of aspartate family amino acids and feedback regulations involved in E.coli
大肠杆菌细胞工厂合成天冬氨酸族氨基酸主要存在以下问题:①天冬氨酸族氨基酸生物合成途径的关键酶受到反馈抑制和反馈阻遏,例如天冬氨酸激酶同工酶AK Ⅰ(thrA)、AK Ⅱ(metL)和AK Ⅲ(lysC)分别受苏氨酸、甲硫氨酸和赖氨酸反馈调节[35,41];②从天冬氨酸合成 1 mol 苏氨酸、1 mol 赖氨酸和1 mol 甲硫氨酸,分别需要3 mol、4 mol和3 mol的NADPH,在合成过程中可能导致还原力不平衡[35,42];③大肠杆菌内源的赖氨酸、苏氨酸和甲硫氨酸的合成路径之间,竞争代谢流,减弱了合成目标化学品的代谢流[3];④大肠杆菌存在本源赖氨酸和苏氨酸的分解途径,可能会分解赖氨酸和苏氨酸[35];⑤在大肠杆菌细胞内合成的氨基酸如何有效分泌到胞外[35,43-46]。
1.2 赖氨酸大肠杆菌细胞工厂的构建与优化
研究人员在E.coliΔmetΔthr(CCTCC M2013239)菌株中,过表达磷酸烯醇式丙酮酸羧化酶(Ppc)、吡啶核苷酸转氢酶(PntB)、天冬氨酸酶(AspA),构建了合成赖氨酸的底盘微生物E. coliNT1003,在最优发酵条件下赖氨酸产量为134.9 g/L,葡萄糖得率为45.4%[47]。近年来,围绕大肠杆菌细胞工厂生产赖氨酸的研究工作集中在增加前体供应[48]、解除赖氨酸对关键酶的反馈抑制[49]和适应性进化等策略[50]。草酰乙酸是合成赖氨酸等天冬氨基酸族氨基酸的重要前体物质,减少支路代谢消耗草酰乙酸的羧化反应与增强合成草酰乙酸的羧化反应,可以增加前体草酰乙酸的供应[48,51]。例如,过表达大肠杆菌本源的磷酸烯醇式丙酮酸羧化酶(Ppc),增强合成草酰乙酸的羧化反应,使赖氨酸的产量增加22.22%[48]。在大肠杆菌中引入谷氨酸棒杆菌来源的磷酸烯醇式丙酮酸羧化酶(Ppc),同时敲除丙酮酸激酶(PykA 和PykF),实现了天冬氨酸的积累,在此基础上,进一步敲除天冬氨酸氨裂解酶(AspA)和苹果酸脱氢酶(Mdh),使赖氨酸前体天冬氨酸的积累量增加到6.95 mmol/L[51]。解除赖氨酸对关键酶的反馈抑制可以强化赖氨酸合成路径效率。例如,通过比对谷氨酸棒杆菌和大肠杆菌二氢吡啶二羧酸合酶(DS)的序列和结构,将谷氨酸棒杆菌DS 抑制剂结合位点周围的残基,引入到大肠杆菌DS 中,减弱了赖氨酸对DS的反馈抑制,使赖氨酸得率增加45%[49];通过将天冬氨酸激酶(AK Ⅲ,由lysC编码)第344 位的氨基酸残基由苏氨酸(T)替换为甲硫氨酸(M),减弱了赖氨酸对天冬氨酸激酶的反馈抑制,通过将二氢吡啶二羧酸合酶(DS,由dapA编码)第56位的氨基酸残基由组氨酸(H)替换为赖氨酸(K),减弱了赖氨酸对DS 的反馈抑制,将突变体lysCT334M和dapAH56K引入到工程菌E. coliLATR11(E. coliMG1655 衍生菌株)中,使赖氨酸的产量增加了63%[48]。适应性进化是指微生物种群在一定选择压力条件下不断进化,从而获得理想表型的方法[52]。为了进一步提高大肠杆菌细胞工厂赖氨酸的生产性能,Wang 等[50]利用突变的 DNA 聚合酶校对元件(DnaQ),搭建了一个基因组复制工程辅助连续进化系统(GREACE),使随机突变率提高了317 倍。并利用GREACE 技术,筛选到突变体E.coliRS3,使赖氨酸产量提高了14.8%,增加到155 g/L。利用代谢组学和基因组学技术,对突变菌株E.coliRS3进行分析,发现突变菌株主要通过瓜丁胺酶(SpeBA302V)、 ATP 合酶亚基(AtpBS165N)和前蛋白转位酶(SecYM145V)的突变,改善细胞在应激条件下的完整性和强化赖氨酸合成的代谢通量。本研究团队[53]在前期诱变育种获得赖氨酸生产菌株E.coliCCTCC M2019435的基础上,基于酶约束模型ec_iML1515,预测出20 个合成赖氨酸的关键靶点(靶点分布在前体物质积累、产物合成路径强化和能量供给)。并通过实验对靶点进行筛选,发现过表达二氢硫辛酰胺脱氢酶、黄素还原酶、乙酰辅酶A合成酶、二氨基二甲酸脱羧酶、天冬氨酸激酶,使赖氨酸产量分别提高了63.8%、108.7%、55.6%、50.0%和123.6%。在此基础上,利用动态FBA 的模拟,将发酵周期缩短了47.7%,使赖氨酸产量增加至193.6 g/L(表1)。
1.3 苏氨酸大肠杆菌细胞工厂的构建与优化
研究人员在筛选得到E.coliTWF001(CCTCC M2017730)菌株中,通过敲除转录因子IclR,在基因组上用trc启动子强化异柠檬酸裂解酶(AceB)、苹果酸合酶(AceA)和天冬氨酸转氨酶(AspC)的表达,获得合成苏氨酸的底盘微生物E. coliTWF006,使苏氨酸的产量增加到12.1 g/L[41]。为了进一步提高苏氨酸的产量,发展了强化苏氨酸合成路径[41]、阻断冗余代谢支路[54,71]和辅因子工程[55]等策略。例如,在E.coliTWF006中过表达高丝氨酸激酶(ThrB)、苏氨酸合酶(ThrC)、天冬氨酸半醛脱氢酶(ASD)和抗反馈调节的天冬氨酸激酶(ThrA),强化苏氨酸合成路径,使苏氨酸产量增加了31%,达到15.85 g/L[41]。张雪等[54]将天冬氨酸激酶(ThrA)第345位的色氨酸残基突变为苯丙氨酸残基,解除了苏氨酸对天冬氨酸激酶的反馈抑制,使苏氨酸的产量增加了2.56 倍。在苏氨酸合成路径中,阻断冗余代谢支路包括敲除lysA(二氨基庚二酸脱羧酶编码基因),阻断赖氨酸的合成;敲除metA(O-高丝氨酸琥珀酰转移酶编码基因),阻断甲硫氨酸的合成;敲除tdh(苏氨酸脱氢酶编码基因),阻断苏氨酸向甘氨酸转化;将ilvA(苏氨酸脱水酶编码基因)的第290 位碱基由C 替换为T,降低苏氨酸脱水酶催化活性减少苏氨酸向异亮氨酸的转化[71]。辅因子工程策略可以改善苏氨酸合成过程中NADPH 的供给,维持高效的代谢合成路径。例如,Li 等[55]在E.coliTHRD(TCCC 11825)发酵过程中,发现甜菜碱通过促进6-磷酸葡萄糖脱氢酶编码基因(zwf)的转录,增加了6-磷酸葡萄糖脱氢酶的活性,强化辅因子NADPH 的供给,使苏氨酸产量增加13.3%,达到117.1 g/L。此外,研究人员还提出了平衡代谢流分配策略[36]和两阶段调控策略[56],改善苏氨酸生产。Fang等[36]在工程菌E. coliTWF001 中,利用温度敏感性调控元件和阻遏蛋白,建立了温控调节开关,调控丙酮酸羧化酶(PYC)的表达,实现碳流在丙酮酸和草酰乙酸之间的转换。在发酵前期,将温度控制在37 ℃,关闭PYC 表达,使碳流充分进入TCA 循环用于生长;在发酵后期,将温度提高到42 ℃,开启PYC 表达,让丙酮酸经PYC 羧化合成草酰乙酸合成苏氨酸,使苏氨酸对葡萄糖的得率达到 124.03%。Liu 等[56]将工程菌E.coliTHRD 的发酵过程分为细胞生长阶段和产物合成阶段,并利用基因开关实现工程菌两阶段转换。在细胞生长阶段,过表达丙酮酸羧化酶、磷酸烯醇式丙酮酸羧激酶与柠檬酸合成酶,增加糖酵解途径到TCA 途径的碳通量,从而增加葡萄糖利用和改善细胞生长。在产物合成阶段,通过基因开关将碳流导向苏氨酸合成路径,同时表达谷氨酸脱氢酶、甲酸脱氢酶和吡啶核苷酸转氢酶,构建谷氨酸和NADPH 再生成系统,为苏氨酸合成提供底物和辅因子,最终使苏氨酸产量增加了2.02倍(表1)。
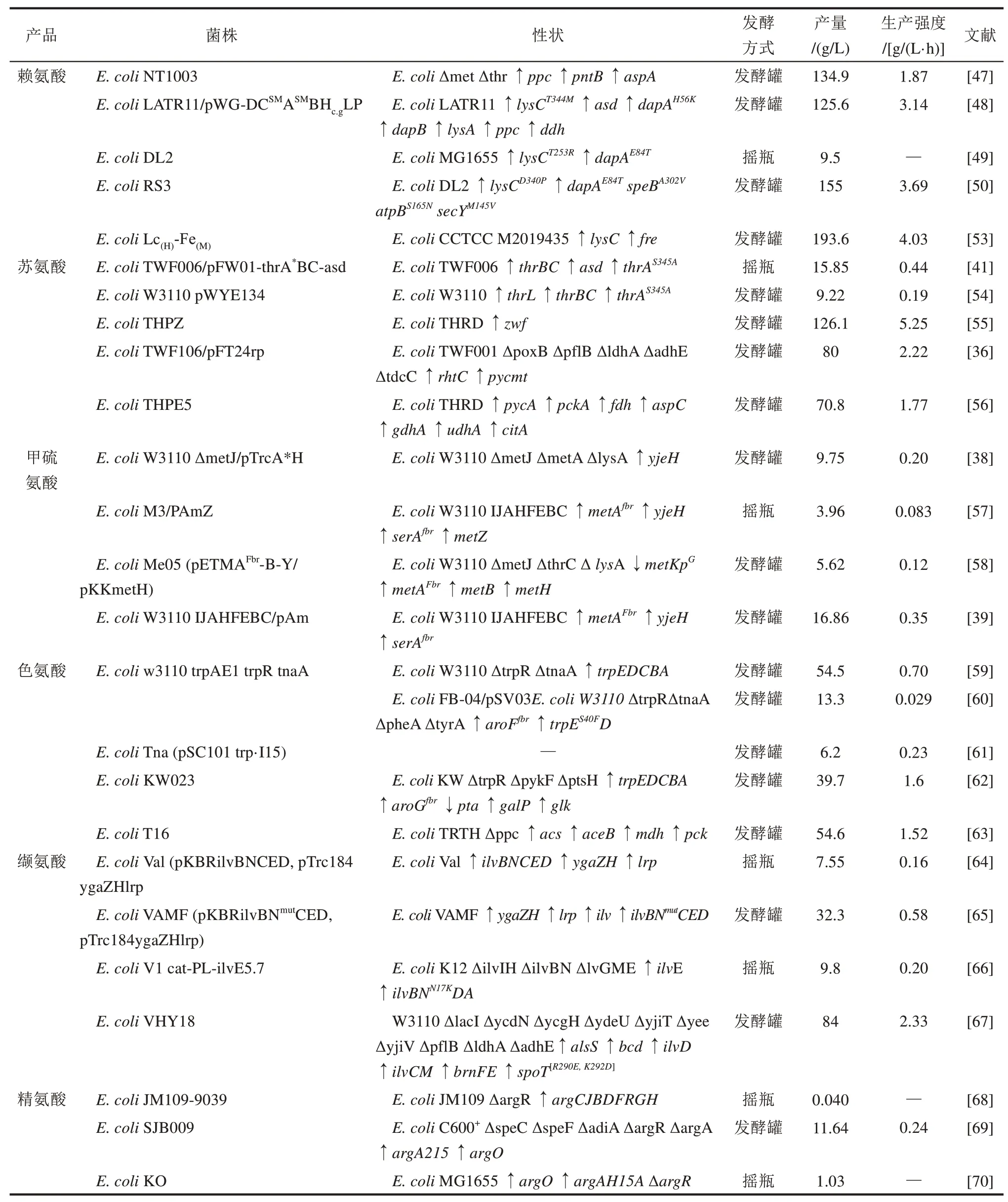
表1 大肠杆菌细胞工厂生产饲用氨基酸进展比较Tab.1 Comparison of feed amino acid production by E.coli cell factories
1.4 甲硫氨酸大肠杆菌细胞工厂的构建与优化
Huang 等[38]以 W3110 为出发菌株,通过敲除负转录因子(MetJ),过表达O-琥珀酰高丝氨酸转琥珀酰酶(MetA)和甲硫氨酸转运蛋白(YjeH),构建了合成413.16 mg/L 甲硫氨酸的底盘微生物W3110 ΔmetJ/pTrcA*H。在甲硫氨酸生物合成途径中,甲硫氨酸的C4骨架、硫和甲基分别由O-琥珀酰高丝氨酸、半胱氨酸与甲基四氢叶酸提供。因此,强化甲硫氨酸前体供应,可以提高甲硫氨酸大肠杆菌细胞工厂的生产性能,例如可以通过上调O-琥珀酰高丝氨酸转琥珀酰酶、解除甲硫氨酸的反馈调节、阻断赖氨酸与苏氨酸的支路代谢,增强 C4骨架O-琥珀酰高丝氨酸的供应[38,57];通过硫源优化,可以强化硫供体半胱氨酸的供应[38];通过敲除purU或者外源添加甘氨酸,可以增加甲基供体甲基四氢叶酸的供应[57]。Tang等[57]在工程菌E. coliW3110 IJAHFEBC(W3110 ΔmetI ΔmetJ ΔlysA Trc-metH Trc-metF Trc-cysE Trc-serB Trc-serC)中,过表达O-琥珀酰高丝氨酸转琥珀酰酶,增加O-琥珀酰高丝氨酸的供应,使甲硫氨酸的产量从2.8 g/L 增加到3.22 g/L。同时,在发酵过程中添加甲基供体甘氨酸,使甲硫氨酸的产量增加到3.96 g/L。 Huang 等[38]在 工 程 菌E. coliW3110 ΔmetJ/pTrcA*H 中,敲除转录因子metI阻断甲硫氨酸内转运系统MetD,使甲硫氨酸的产量增加43.65%。同时,敲除二氨基庚二酸脱羧酶编码基因(lysA)阻断赖氨酸合成路径,使甲硫氨酸的产量增加8.5倍。在此基础上,通过外源添加Na2S2O3增加硫的供应,使甲硫氨酸的产量增加11.45%,再通过发酵工艺优化使甲硫氨酸的产量进一步增加到 9.75 g/L。Li 等[58]以 W3110 为出发菌株,通过敲除二氨基庚二酸脱羧酶编码基因(lysA)、高丝氨酸激酶编码基因(thrB)、苏氨酸合酶编码基因(thrC),阻断甲硫氨酸的竞争代谢路径。然后,敲除负转录调控因子编码基因(metJ),下调甲硫氨酸抑制因子编码基因(metK)的表达,并利用pN25 启动子强化琥珀酰高丝氨酸裂解酶(MetB)的表达,强化甲硫氨酸合成路径,获得工程菌E. coliMe05,在此基础上,过表达甲硫氨酸合酶(MetE 和MetH)和5,10-亚甲基四氢叶酸还原酶(MetF),获得合成甲硫氨酸的工程菌E.coliMe05(pETMAFbr-B-Y/pKKmetH),使甲硫氨酸的产量增加到5.62 g/L。随着研究的深入,发现仅仅依靠单因素叠加调控,无法实现甲硫氨酸代谢通量的最大化,基于模块组合的多层次调控策略可能更具合理性,例如 Huang 等[39]首先,采用 CRISPRi 技术,对合成甲硫氨酸底盘微生物的中心代谢路径和氨基酸合成路径中80 个靶点基因进行调控,获得控制甲硫氨酸合成的关键靶点。然后,根据甲硫氨酸生物合成的复杂性和多层次性,提出了基于分支途径功能的模块化策略,将甲硫氨酸生物合成路径分为碳模块、硫模块和一碳模块。并利用筛选到的关键靶点对这些模块进行调控,逐步提升甲硫氨酸的产量,最终使甲硫氨酸的产量增加到16.86 g/L(表1)。
2 色氨酸大肠杆菌细胞工厂
2.1 色氨酸的生物合成途径
作为一种必需氨基酸,L-色氨酸在人类与动物的生长发育过程中起着重要作用,被广泛应用于食品、医药与饲料添加剂等领域。色氨酸具有特殊的结构,其代谢产物不仅参与体内多种生理、营养、代谢过程,也参与体内蛋白质合成的调节[5-8]。在大肠杆菌细胞中,色氨酸的合成路径由中心代谢途径、莽草酸途径和色氨酸分支途径组成[72-74]。中心代谢途径是指葡萄糖经糖酵解途径(EMP)和戊糖磷酸途径(HMP),形成的磷酸烯醇式丙酮酸(PEP)与赤藓糖-4-磷酸(E4P),在3-脱氧-D-阿拉伯庚酮糖-7-磷酸(DAHP)合酶(AroG)的催化下缩合形成DAHP 的过程。莽草酸途径是指DAHP 经过3-脱氢奎宁酸合酶(AroB)、3-脱氢奎宁酸脱水酶(AroD)、莽草酸脱氢还原酶(AroE)、莽草酸激酶(AroK)、5-烯醇式丙酮酰胺莽草酸合酶(AroA)、分支酸合酶(AroC)催化形成分支酸的过程。色氨酸分支途径是指分支酸经邻氨基苯甲酸合酶(TrpE)、邻氨基苯甲酸焦磷酸转移酶(TrpD)、邻氨基苯甲酸异构酶(TrpC)、色氨酸合酶(TrpB)、吲哚甘油3-磷酸(TrpA)作用形成色氨酸的过程[73,75-76](图2)。

图2 大肠杆菌色氨酸合成代谢路径Fig.2 Schematic of the tryptophan biosynthetic pathway in E.coli
大肠杆菌细胞工厂合成色氨酸主要存在以下瓶颈:①色氨酸的生物合成途径中关键酶AroG、TrpE 存在反馈阻遏,例如AroG 受苯丙氨酸和酪氨酸协同反馈抑制,色氨酸增强这种抑制,当3种氨基酸共同存在时最大抑制作用接近90%;TrpE 不仅受色氨酸反馈抑制,而且还受色氨酸的反馈阻遏[62,73]。②色氨酸对色氨酸合成路径关键酶(色氨酸操纵子trpEDCBA)与转运蛋白(mtr)存在反馈阻遏[77-79]。③芳香族氨基酸合成支路与色氨酸合成途径的竞争代谢流,减弱了色氨酸合成的代谢流[73]。④在大肠杆菌色氨酸的代谢调控中,采用降解色氨酸的方式调控胞内色氨酸的浓度,色氨酸酶(TnaA)将色氨酸降解为吲哚、氨和丙酮酸[80]。
2.2 色氨酸大肠杆菌细胞工厂的构建与优化
大肠杆菌细胞中存在天然的色氨酸生物合成途径,通过强化本源代谢路径,可以实现大肠杆菌色氨酸的合成。Aiba 等[59]在色氨酸操纵子阻遏蛋白(TrpR)和色氨酸酶(TnaA)双缺菌株中,强化色氨酸操纵子基因的表达,并通过化学诱变,构建了可以生产30 g/L 色氨酸的大肠杆菌细胞工厂;在此基础上,研究人员通过加入表面活性剂,降低发酵液中色氨酸的溶解度,加速色氨酸结晶,使色氨酸产量增加到54.5 g/L。近年来,围绕大肠杆菌细胞工厂生产色氨酸的研究工作主要集中在阻断支路代谢和色氨酸分解代谢、解除色氨酸反馈调节与增加前体供应。敲除或者弱化芳香族氨基酸合成支路关键酶PheA(预苯酸脱水酶)和TyrA(预苯酸脱氢酶),可以阻断色氨酸合成途径的竞争支路,增加色氨酸合成的代谢流[73];敲除色氨酸酶(TnaA)可以减弱色氨酸的分解[80],例如敲除tnaA的,使工程菌E.coliFB-02/pSV03的色氨酸产量增加了1.7倍,达到7.8 g/L。在此基础上,敲除pheA和tyrA,使色氨酸的产量增加了0.7 倍达到13.3 g/L[60]。解除色氨酸反馈调节主要包括解除色氨酸对色氨酸合成路径关键酶的反馈阻遏与解除中间代谢物对关键酶的反馈抑制。通过敲除trpR(编码阻遏蛋白TrpR基因),解除了阻遏蛋白TrpR,对色氨酸合成路径关键酶(色氨酸操纵子trpEDCBA)与转运蛋白(mtr)的反馈阻遏[77-79]。例如,在工程菌E. coliAE1 (pSC101 trp·I15)中敲除trpR,获得工程菌E. coliRam(pSC101 trp·I15),使色氨酸产量增加了5.4 倍[61]。筛选抗反馈调节的突变体,是解除中间代谢物对色氨酸合成关键酶反馈抑制的有效手段。例如将AroG(DAHP 合酶)第150 位的氨基酸残基由脯氨酸突变为亮氨酸(P150L),或者把第146位的天冬氨酸突变为天冬酰胺(D146N),可以完全解除苯丙氨酸对AroG的反馈抑制[81];将TrpE(邻氨基苯甲酸合酶)第40 位的丝氨酸突变为苯丙氨酸(S40F),可以完全解除色氨酸对TrpE 的反馈抑制[78]。在苯丙氨酸合成菌株中,将AroG 的第146 位氨基酸残基由天冬氨酸突变为天冬酰胺(D146N),使苯丙氨酸的产量增加了51.4%[82]。色氨酸有两个关键前体:PEP 和E4P,它们是色氨酸合成路径中关键中间代谢物DAHP 的限制性底物,直接决定色氨酸合成能力[83]。目前增加胞内PEP 含量的常用策略包括:①阻断PEP 竞争支路代谢,例如敲除PykF 与PykA(丙酮酸激酶),与敲除Ppc(磷酸烯醇式丙酮酸羧化酶)[84];②阻断磷酸烯醇式丙酮酸-糖磷酸转移酶系统(PTS),减少葡萄糖转运过程中PEP 的消耗[85-86];③敲除碳储存调控因子(CsrA),增强糖酵解途径碳通量[87];④增强PEP循环再利用,例如过表达PpsA(磷酸烯醇式丙酮酸合酶)[88]。目前增加胞内E4P 含量的主要策略:①过表达TktA(转酮酶)[89];②敲除Pgi(磷酸葡萄糖异构酶)[90]。例如,Zhang等[62]首先通过表达色氨酸操纵子(trpEDCBA)、抗反馈调节的DAHP合酶(AroGfbr)和敲除色氨酸阻遏蛋白(TrpR),构建了合成色氨酸的底盘微生物,并通过敲除pykF和ptsH,增加胞内PEP 含量,使色氨酸产量增加到11 g/L。为了恢复细胞生长,通过组合优化葡萄糖激酶(GalP)和半乳糖渗透酶(Glk)的表达,使色氨酸的产量增加到37 g/L,在此基础上,通过抑制乙酰磷酸转移酶表达减弱乙酸的积累,使色氨酸的产量进一步增加到39.7 g/L,对葡萄糖的转化率增加到16.7%[62]。Chen 等[63]在前期构建合成色氨酸底盘微生物E.coliTRTH 的基础上,利用不同强度的启动子和不同拷贝数的质粒组合优化乙酰辅酶A 合酶,重构了TCA 循环,增加了前体PEP 的供应,减弱了乙酸的积累,获得工程菌E.coliT16,使色氨酸的产量增加到54.6 g/L(表1)。
3 缬氨酸大肠杆菌细胞工厂
3.1 缬氨酸的生物合成途径
缬氨酸不仅可以促进哺乳动物的乳汁分泌,而且还可以提高动物的免疫力,增加动物细胞外伤治愈的作用[5-8]。葡萄糖经糖酵解途径合成缬氨酸重要前体丙酮酸,2 分子丙酮酸在乙酰羟酸合酶(IlvBN、IlvGM 和IlvIH)作用下缩合成2-乙酰羟酸。然后,在乙酰羟酸还原异构酶(IlvC)的催化下,将2-乙酰羟酸催化生成双羟基异戊酸。最后,双羟基异戊酸经过二羟酸脱水酶(IlvD)脱水形成2-酮异戊酸,2-酮异戊酸在转氨酶B(IlvE)作用下形成缬氨酸[64](图3)。
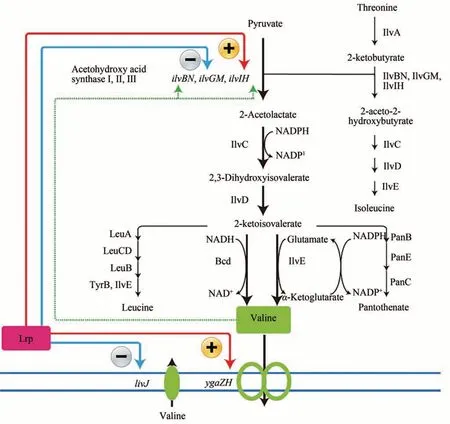
图3 大肠杆菌缬氨酸合成代谢路径Fig.3 Schematic of valine biosynthetic pathway in E.coli
大肠杆菌细胞工厂合成缬氨酸主要存在以下问题:①乙酰羟酸合酶受缬氨酸反馈抑制,而且亮氨酸、异亮氨酸和缬氨酸对转氨酶B存在协同反馈抑制[65];②强化缬氨酸转运,降低胞内缬氨酸的积累,减缓缬氨酸积累造成的反馈抑制[64,91];③由于乙酰羟酸还原异构酶催化活性需要辅因子NADPH 提供还原力,因此缬氨酸合成需要提供充足的辅因子[66];④缬氨酸关键前体丙酮酸也可合成丙氨酸、乙酰辅酶A、草酰乙酸等,这些代谢物的合成,竞争了缬氨酸的前体物质[64]。
3.2 缬氨酸大肠杆菌细胞工厂的构建与优化
通过改造大肠杆菌本源代谢路径,可以实现缬氨酸的合成。例如,Park 等[64]通过定点突变获得抗反馈调节的乙酰羟酸合酶Ⅲ,并在基因组上用tac 启动子强化缬氨酸操纵子(ilvGMEDA)的表达,同时敲除苏氨酸脱水酶(IlvA)、2-异丙基苹果酸合酶(LeuA)和3-甲基-2-氧代丁酸羟甲基转移酶(PanB),再强化乙酰羟酸合酶(IlvBN)表达,获得工程菌E. coliVal 可以生产1.31 g/L 的缬氨酸。为了进一步提高缬氨酸的产量,开发了强化代谢合成路径效率、辅因子工程和转运子工程策略。强化代谢合成路径效率包括强化前体供应和解除路径酶的反馈抑制。例如Park 等[64]利用网络模型模拟基因敲除对缬氨酸生产的影响,发现敲除丙酮酸脱氢酶(AceF)、磷酸丙糖异构酶(TpiA)、磷酸果糖激酶(PfkA/B)和苹果酸脱氢酶(Mdh),可以增加缬氨酸前体丙酮酸的积累,并通过实验验证发现敲除AceF、PfkA 和Mdh,使缬氨酸产量增加1.27 倍。研究人员发现将乙酰羟酸合酶小亚基(IlvN)的第20~22 位氨基酸残基分别由甘氨酸(G)、缬氨酸(V)、甲硫氨酸(M)替换为天冬氨酸(D)、天冬氨酸(D)和苯丙氨酸(F),解除了缬氨酸对乙酰羟酸合酶的反馈抑制,使缬氨酸的产量增加了22%[65]。辅因子工程策略包括修饰辅因子特异性与辅因子再生。例如,在缬氨酸生产过程中,使用枯草芽孢杆菌来源NADH 依赖性的亮氨酸脱氢酶(BsLeuDH),替换大肠杆菌本源NADPH 依赖性的氨基转移酶(EcilvE), 使 缬 氨 酸 产 量 增 加 了 2.2 倍[66]。Hao 等[67]通过借鉴改变谷氨酸棒杆菌乙酰羟酸还原异构酶辅因子偏好性的方法,将大肠杆菌乙酰羟酸还原异构酶(EcilvC)的第67 位氨基酸残基由亮氨酸(L)替换为谷氨酸(E)、第68 位氨基酸残基由精氨酸(R)替换为苯丙氨酸(F)、第75位氨基酸残基由赖氨酸(K)替换为谷氨酸,使EcilvC 从NADPH 依赖性改变成为NADH 依赖性。在此基础上,利用BsLeuDH 替换EcilvE,使缬氨酸产量增加了5.6 倍。为了强化缬氨酸合成过程中辅因子的供给,强化吡啶核苷酸转氢酶的表达,将NADH/NAD+的比例从11.0 增加到11.9,使缬氨酸产量增加了5.3%;而敲除乳酸脱氢酶、丙酮酸甲酸裂解酶和乙醇脱氢酶减少辅因子的消耗,将NADH/NAD+的比例从11.0 增加到13.5,使缬氨酸的产量增加了23.5%[67]。研究表明,增强缬氨酸的转运,是降低胞内缬氨酸积累水平、缓解缬氨酸积累引起反馈抑制的有效策略[64]。例如,在E.coliVHY13 中,过表达谷氨酸棒杆菌来源的缬氨酸转运蛋白(BrnFE),使缬氨酸产量增加了72%[67]。在工程菌E.coliVal 中,过表达大肠杆菌本源的缬氨酸转运蛋白(YgaZH),使缬氨酸产量增加了47.1%[64](表1)。
4 精氨基酸大肠杆菌细胞工厂
4.1 精氨酸的生物合成途径
精氨酸在生命活动过程中有着十分重要的作用,参与哺乳动物细胞内的氨解毒、激素的分泌(包括生长激素、催乳素、胰岛素、胰高血糖素等)以及免疫系统等多种生化反应,主要是促进动物生长发育、提高幼仔的存活率、改善肉质、提高饲料利用率等[5-8]。糖酵解途径形成的丙酮酸,以乙酰辅酶A 的形式进入柠檬酸循环,柠檬酸循环中的α-酮戊二酸在谷氨酸合酶或者谷氨酸脱氢酶的催化下形成精氨酸的前体谷氨酸。如图4所示,根据乙酰化的作用方式,可以将微生物精氨酸合成路径分为线性途径、经济循环途径和新合成途径3 种[92]。其中,大肠杆菌本源的精氨酸生物合成途径是线性途径[92]。在线性合成路径中,谷氨酸在N-乙酰谷氨酸合酶(ArgA)的作用下合成乙酰谷氨酸,再经过乙酰谷氨酸激酶(ArgB)、N-乙酰谷氨酸半醛脱氢酶(ArgC)、乙酰鸟氨酸转氨酶(ArgD)、乙酰鸟氨酸酶(ArgE)、鸟氨酸转氨甲酰酶(ArgF)、精胺琥珀酸合酶(ArgG)和精氨琥珀酸酶(ArgH)作用下,形成精氨酸[69,93][图4(a)]。在经济循环途径中由于不存在乙酰谷氨酸合酶,乙酰鸟氨酸在乙酰鸟氨酸转移酶(ArgJ)的催化下形成鸟氨酸,同时将乙酰基转移到谷氨酸上生成乙酰谷氨酸,即乙酰鸟氨酸转移酶同时发挥乙酰谷氨酸合酶和乙酰鸟氨酸酶的作用,从而使乙酰基团在精氨酸合成途径中循环利用[92][图 4(b)]。此外,在野油菜黄单胞菌(Xanthomonas campestris)中,发现一条合成精氨酸的新途径,在该合成途径中,乙酰鸟氨酸被乙酰鸟氨酸氨甲酰转移酶(ArgF′)催化生成乙酰瓜氨酸,然后乙酰瓜氨酸被催化脱乙酰生成瓜氨酸,再由瓜氨酸合成精氨酸[94][图4(c)]。
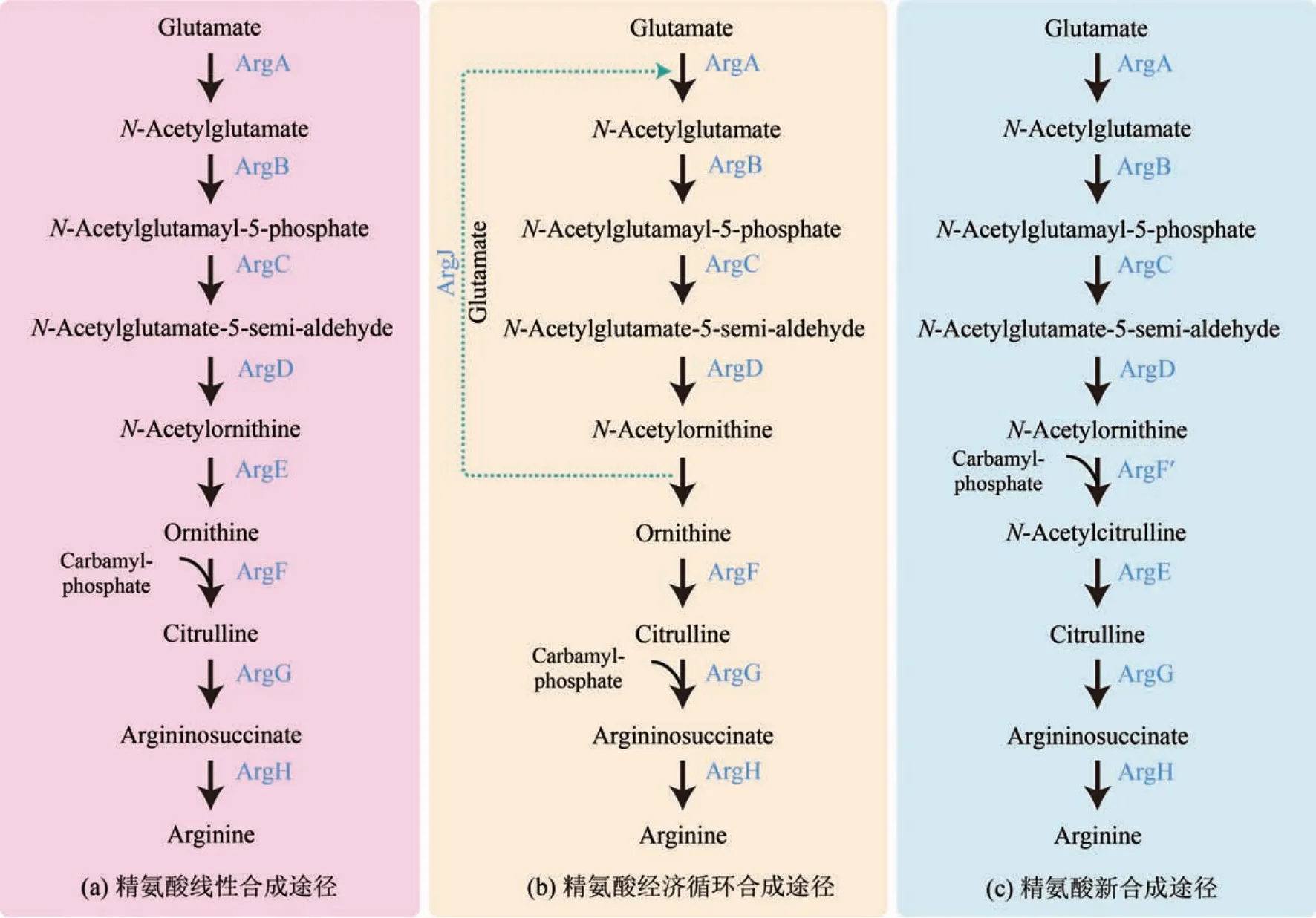
图4 微生物体内精氨酸合成代谢路径Fig.4 Schematic of arginine biosynthetic pathway in microorganisms
大肠杆菌细胞工厂合成精氨酸主要存在以下瓶颈:①精氨酸合成路径关键酶N-乙酰谷氨酸合酶,以及其合成路径酶(ArgB、ArgC、ArgD、ArgE、ArgF、ArgG 和ArgH)均受到精氨酸的反馈抑制[95];②精氨酸与ArgR(精氨酸合成途径阻遏蛋白)相互作用,反馈阻遏精氨酸合成路径[96];③谷氨酸不仅是合成精氨酸的前体物质,同时也用于合成脯氨酸、鸟氨酸、瓜氨酸,减弱了合成精氨酸的代谢流[92];④由于大肠杆菌中存在精氨酸分解代谢途径(例如精氨酸酶途径、精氨酸脱亚氨基酶途径、精氨酸琥珀酰转移酶途径等),胞内合成的精氨酸如不及时转运到胞外,会增加精氨酸分解代谢的风险[92,97]。
4.2 精氨酸大肠杆菌细胞工厂的构建与优化
Rajagopal等[98]在抗反馈调节N-乙酰谷氨酸合酶突变株E.coliEE11、E.coliEE17 和E.coliEE51 中 ,过表达氨基甲酸酯磷酸合酶和精氨酸酶,使精氨酸产率提高了 3~15 倍。Xu 等[68]在E.coliJM109 中,过量表达钝齿棒杆菌(Corynebacterium crenatumSYPA5-5)来源的 argCJBDFRGH 基因簇(argR 已失活),可以积累40 mg/L 的精氨酸。为了进一步强化精氨酸大肠杆菌细胞工厂的生产性能,发展了阻断竞争代谢路径、强化精氨酸转运、解除精氨酸对关键酶的反馈抑制等策略。例如Ginesy等[69]以E.coliC600+为出发菌株,首先敲除SpeC(鸟氨酸脱羧酶)、SpeF(鸟氨酸脱羧酶)和AdiA(精氨酸脱羧酶),阻断竞争代谢路径;敲除ArgR(精氨酸合成途径阻遏蛋白)和过表达抗反馈调节的ArgA215,解除精氨酸的反馈抑制,使精氨酸产量增加到3.03 g/L。在此基础上,研究人员通过敲除本源ArgA 和增加ArgA215 的拷贝数,使精氨酸产量进一步增加到4.11 g/L。然后,通过表达ArgO(精氨酸转运蛋白),强化精氨酸的转运,获得工程菌E.coliSJB009,使精氨酸产量增加到11.64 g/L。Ginesy 等[99]对发酵条件进一步优化,在最优发酵条件下,使工程菌E. coliSJB009 精氨酸得率增加到0.16 g/g。此外,Sander等[70]在E.coliMG1655中过表达精氨酸转运蛋白(ArgO)和抗反馈调节的ArgAH15A,同时敲除ArgR,获得工程菌E. coliKO,可以生产1.03 g/L 的精氨酸。但是,研究人员发现敲除ArgR 会影响工程菌生长,降低发酵生产性能。利用代谢组学和蛋白质组学技术分析,发现敲除ArgR 导致鸟氨酸氨基甲酰基转移酶活性增加17 倍,干扰了精氨酸-嘧啶的分支点,限制了嘧啶核苷酸的生物合成,导致ArgR 缺失菌株生长不良。利用CRISPRi 技术在基因组上下调ArgR,使工程菌的细胞生长速率增加2倍[70](表1)。
5 展 望
在饲料中添加饲用氨基酸,可以适当降低原料中的蛋白质水平,降低饲料生产成本,降低氮排放,减少环境污染。然而,由于天然大肠杆菌细胞工厂合成饲用氨基酸的生产性能较低,不具备工业生产的经济可行性。因此,需要借助合成生物学与代谢工程技术,重新设计与优化大肠杆菌细胞工厂,提高饲用氨基酸细胞工厂的生产性能。目前,研究人员利用合成生物学技术,改造大肠杆菌细胞工厂,实现了色氨酸、苏氨酸和缬氨酸工业化生产,改造谷氨酸棒杆菌细胞工厂实现了精氨酸、赖氨酸工业化生产。然而,由于甲硫氨酸代谢合成网络的复杂性,导致微生物细胞工厂还难以实现甲硫氨酸的工业化生产。
随着市场对饲用氨基酸需求的不断增加,氨基酸生产市场的同质性竞争日趋激烈,提高工程菌株鲁棒性,降低饲用氨基酸生产成本,与提升饲用氨基酸生产技术水平是未来的发展方向。提高大肠杆菌细胞工厂的鲁棒性,不仅可以增强大肠杆菌细胞工厂对有害环境的耐受能力,而且还可以提升饲用氨基酸发酵性能,简化发酵过程控制和产品分离提纯工艺,降低生产成本,例如通过与合成生物学相结合的诱变育种策略,提高了工程菌对噬菌体的鲁棒性。目前,主要以“粮食作物生物质”为原料生产饲用氨基酸,存在“与人争粮、与粮争地”等问题。利用合成生物学与代谢工程技术,构建了以甘油、木质纤维素水解液和细菌细胞裂解液等非粮生物质为原料的饲用氨基酸生产菌株,不仅可以降低饲用氨基酸发酵生产成本,而且还可以实现“不与人争粮、不与粮争地”的目标,例如,研究人员利用合成生物学技术与代谢工程技术,对大肠杆菌细胞工厂进行改造,实现了以木质纤维素水解液为底物生产赖氨酸,以细菌细胞裂解液作为氮源生产色氨酸,以甘油为底物生产色氨酸。
然而,由于大肠杆菌细胞精密的调控机制、复杂的代谢调控网络以及外界胁迫环境,限制了饲用氨基酸大肠杆菌细胞工厂性能的进一步提升。此外,基于基因敲除和过表达的静态调控策略,通过剪接代谢路径,构建的合成目标化学品代谢通路,常常导致宿主菌代谢流扰动与失衡,增加细胞代谢负荷,降低了大肠杆菌细胞工厂的生产性能,限制了饲用氨基酸生产技术水平提升。因此,开发大肠杆菌全细胞代谢网络模型,计算和设计饲用氨基酸的最优合成路径;发展新型生物传感器,建立响应外界环境与胞内代谢物的基因回路,精确调节饲用氨基酸合成路径的物质流和能量流;研究外界胁迫环境对大肠杆菌细胞的影响,特异性增强大肠杆菌细胞对外界胁迫环境的耐受性,是未来的发展方向。
