血清LDH、TK1与骨髓增生异常综合征患者临床预后的相关性
2021-02-10张亚芬
张亚芬
(商丘市第一人民医院 血液科,河南 商丘 476100)
骨髓增生异常综合征(myelodysplastic syndromes,MDS)属于髓系造血系统恶性肿瘤,可引起难治性血细胞减少、造血功能障碍等,预后较差。目前,临床以综合性治疗为主,包括支持治疗、骨髓增生异常综合征化疗、免疫调节治疗等,虽然具有一定的效果,但受骨髓原始细胞比例、血细胞减少等因素的影响,患者仍存在预后不良的风险[1]。因此,早期预测患者预后不良的风险具有一定的价值。血液细胞发育异常的形态改变是MDS患者发病的基本特征,乳酸脱氢酶(lactic dehydrogenase,LDH)是造血细胞重要的代谢酶,可反映恶性肿瘤患者基因调控功能及能量代谢情况,参与MDS发生、发展进程[2]。胸苷激酶1(thymidine Kinase1,TK1)是肿瘤增殖标志物,与肿瘤细胞生长状况密切相关。临床研究发现,血清TK1在血液恶性肿瘤患者中呈高表达[3]。由此推测,血清LDH、TK1水平可能与MDS预后具有一定联系。本研究旨在观察血清LDH、TK1水平在MDS患者中的表达,并分析二者与患者临床预后的相关性。
1 资料与方法
1.1 一般资料本研究经商丘市第一人民医院医学伦理委员会审批,选取2018年3月至2021年3月商丘市第一人民医院收治的110例MDS患者为研究对象,均签署知情同意书。110例MDS患者中,男63例,女47例;年龄53~76岁,平均(65.80±2.01)岁;国际预后评分系统(international prognostic scoring system,IPSS)[4]中危-1为59例,中危-2为39例,高危为12例。
1.2 入选标准(1)纳入标准:①MDS符合《骨髓增生异常综合征诊断与治疗中国专家共识(2014年版)》[5]中相关标准,且经血细胞形态学、骨髓穿刺等检查确诊;②为初诊MDS患者;③IPSS危险度分层为中、高危;④参照上述治疗共识在医院接受规范性治疗,且均获得至少5个月随访结果;⑤患者预计生存时间>6个月。(2)排除标准:①治疗前具有放化疗史;②因心肌梗死、脑出血、感染性疾病等导致临床治疗无效;③合并实体肿瘤性疾病;⑤随访期间病死。
1.3 预后评估及分组方法所有患者入院后,均接受规范性治疗,包括地西他滨化疗及支持治疗(输血、免疫调节、抗感染等)等,持续治疗4个月。治疗结束2周左右,结合《血液病疗效及诊断标准》[6]评估患者短期预后情况:完全缓解(complete response,CR)为心悸、头痛、出血、皮疹等症状完全消失,血象恢复正常,且骨髓造血检查其增生程度基本正常,骨髓原始细胞<5%;部分缓解(partial response,PR)为较治疗前,患者症状及体征有所改善,血象有所恢复,且骨髓检查中可见骨髓原始幼稚细胞比例在5%~20%;未缓解(non-remission,NR)为均未达到以上标准。患者评估为CR、PR表示临床治疗有效,纳入预后良好组,NR表示治疗无效,纳入预后不良组。
1.4 血清LDH、TK1水平检测方法于治疗前,采集患者清晨空腹>8 h外周肘静脉血6 mL,分成2份,其中1份以3 500 r·min-1离心处理15 min,离心半径为13.5 cm,取血清,采用广州科方生物技术股份有限公司生产的试剂盒检测血清LDH水平,方法为速率法;采用广州春康生物科技有限公司生产的试剂盒检测TK1水平,方法为酶联免疫吸附测定法;相关操作需严格按照说明书进行。
1.5 基线资料分析方法询问并统计患者性别(男、女)、年龄、IPSS危险度分层(中危-1、中危-2、高危)、WTO分型[难治性血细胞减少伴有多系发育异常(refractory cytopenia with multilineage dysplasia,RCMD)、难治性贫血伴有原始细胞过多-Ⅰ(refractory anemia with excessive blastsⅠ,RAEB-Ⅰ)、RAEB-Ⅱ]及相关实验室指标,如白细胞计数(white blood cell,WBC)、血小板(blood platelet,PLT)[取另1份血液样本,放于希森美康pocH-100i全自动血液分析仪上对WBC、PLT水平进行检测]等资料。
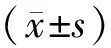
2 结果
2.1 110例MDS患者预后情况110例MDS患者经评估,CR为8例,PR为62例,NR为40例。40例预后不良,占36.36%(40/110);70例预后良好,占63.64%(70/110)。
2.2 MDS患者血清LDH、TK1水平与基线资料预后不良组患者血清LDH、TK1水平高于预后良好组,差异有统计学意义(P<0.05);组间其他基线资料比较,差异无统计学意义(P>0.05)。见表1。
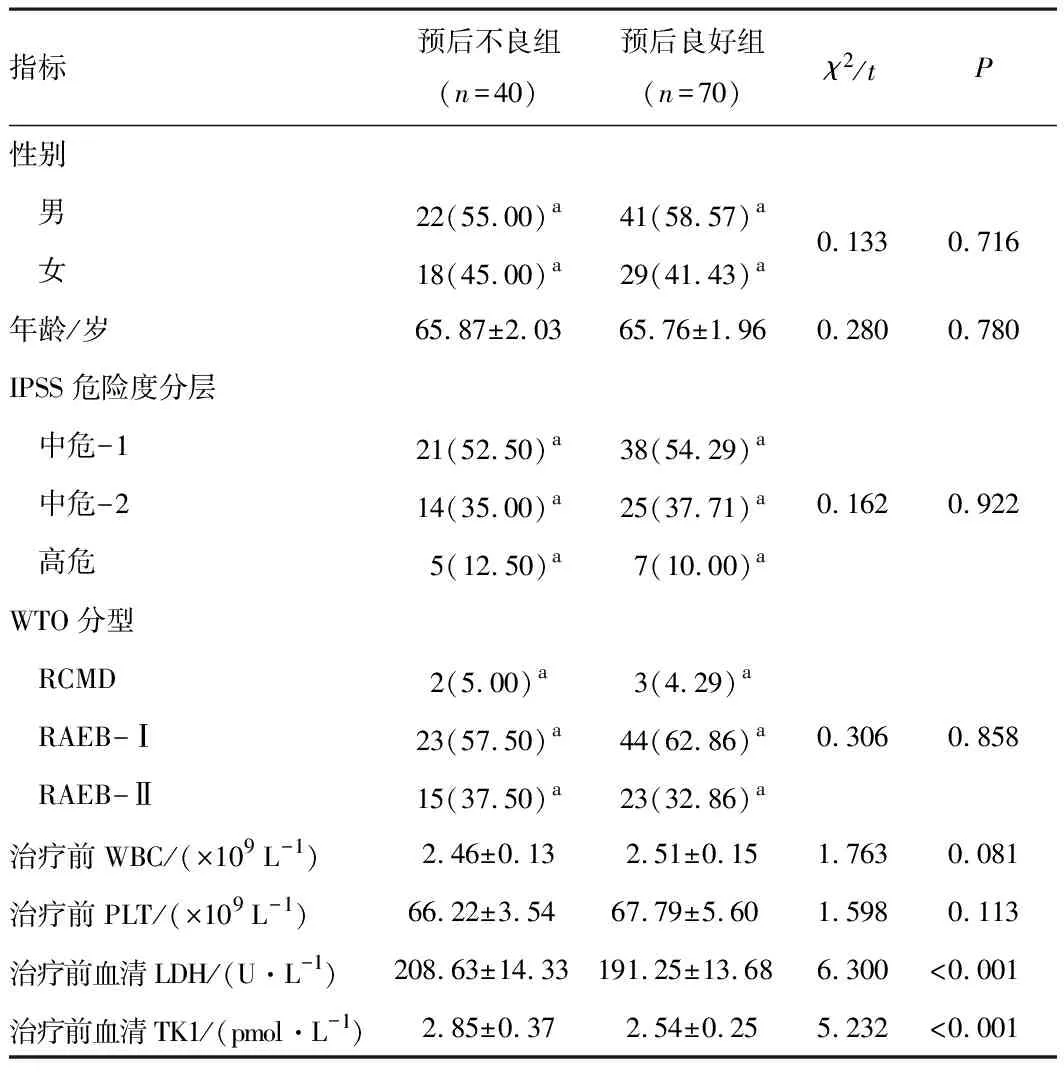
表1 两组MDS患者血清LDH、TK1水平与基线资料比较
2.3 血清LDH、TK1水平与MDS患者临床预后相关性的logistic回归分析将MDS患者临床预后作为因变量(预后不良=1,预后良好=0), 将MDS患者治疗前血清LDH、TK1水平作为自变量(均为连续变量),经logistic回归分析,结果显示,治疗前血清LDH、TK1过表达与MDS患者预后不良有关(P<0.05)。见表2。
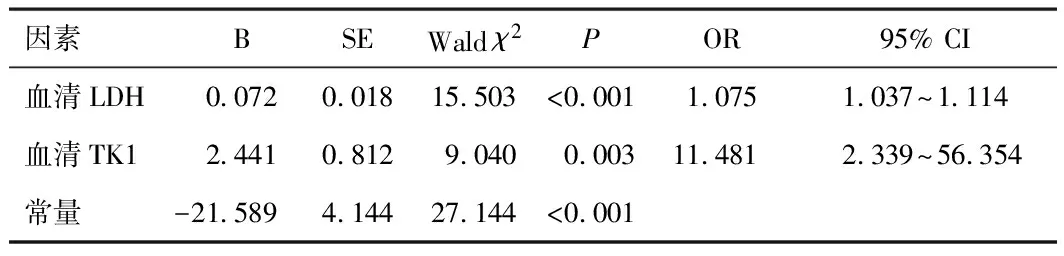
表2 血清LDH、TK1水平与MDS患者临床预后相关性的 logistic回归分析
3 讨论
目前,MDS患者的临床预后主要用IPSS评估,通过观察患者染色体核型、骨髓原始细胞、突变基因等情况来预测患者的预后情况,但需进行骨髓穿刺,具有创伤性,临床应用受限。因此,早期寻找可评估、预测MDS患者临床预后的指标具有重要意义。
MDS属于恶性克隆性血液疾病,因细胞发育过程中出现形态学异常改变,引起造血功能障碍及一系列病理变化[7]。LDH是糖酵解的关键酶,是细胞代谢必不可少的物质,可维持内环境的稳定,其水平的失调可引起细胞代谢异常及抑癌基因活性异常,导致恶性肿瘤细胞发生、发展、侵袭等。TK1是存在于细胞质中的激酶,参与细胞代谢过程,且与细胞周期的调控密切相关,可体现恶性肿瘤细胞的增殖情况。因LDH、TK1的异常改变均可导致细胞形态学异常,推测MDS患者血清LDH、TK1水平可能与临床预后具有一定的联系。
本研究结果显示,与预后良好组相比,预后不良组治疗前血清LDH、TK1水平较高,进一步经logistic回归分析发现,治疗前血清LDH、TK1过表达可增加MDS患者预后不良的风险。LDH是糖酵解的最后一步,当细胞功能损伤时,LDH释放入血后含量增加,其过表达提示糖酵解代谢活跃,导致乳酸不断堆积,引起细胞环境变化,酶蛋白基因表达异常,引起能量代谢障碍与细胞组织损伤。临床研究指出,LDH水平可反映细胞的增殖程度,而造血细胞恶性增殖过度、细胞组织损伤与预后密切相关[8]。TK1参与DNA复制和细胞增殖,细胞的无限增殖、分化凋亡受阻,导致髓系祖细胞不断增殖和积聚,引起细胞周期和抑癌基因进一步失调,促进疾病不断进展,预后相对较差。此外,冉玉等[9]研究指出,乳酸可作为一种炎症介质,导致肿瘤内的慢性炎症增强,引起肿瘤转移。因此,TK1过表达可导致恶性肿瘤增殖、转移的风险增加,预后较差。但本研究仅观察治疗前血清LDH、TK1水平在MDS患者中的表达,未深入探究MDS患者治疗过程血清LDH、TK1水平动态变化情况,两指标与预后的关系还需今后进一步研究证实。
综上所述,血清LDH、TK1过表达与MDS患者临床预后相关,LDH、TK1过表达提示患者临床预后不良的风险较高,未来临床可考虑监测血清LDH、TK1水平,对评估MDS患者临床预后具有一定作用。
