C57BL/6小鼠关节软骨细胞的提取及凋亡模型的建立
2021-02-10余真妍杨洪宾纪帅帅
余真妍,杨洪宾,纪帅帅,刘 阳,霍 强*
(1蚌埠医学院药学院药物化学教研室,蚌埠 233030;2南京医科大学药学院药剂学教研室;*通讯作者,E-mail:620793985@qq.com)
骨关节炎是一种严重影响患者生活质量的关节退行性疾病[1],发病因素多,过程复杂,致病机制至今仍未知[2]。虽然发病机制尚不明确,但是越来越多的证据表明软骨细胞的活化及其失调与骨关节炎的发病机制密切相关[3]。软骨细胞是在软骨中发现的唯一一种细胞,其具有生成和维持胶原和蛋白聚糖等软骨基质的功能。在关节软骨破坏过程中,软骨细胞是分泌炎性因子的主要细胞[4],但是软骨细胞体外增殖能力有限,容易去分化失去原有表型。目前关于关节软骨细胞的分离及体外培养主要见于人[5]、兔[6]、大鼠[7]、猪[8]等,而对于来源于C57BL/6小鼠的软骨细胞培养报道较少。同时,近年来大量研究表明软骨细胞凋亡与骨关节炎的发病密切相关[9]。基于骨关节炎课题研究的需要,我们采用两步酶消化配合机械吹打法从C57BL/6小鼠关节中提取得到高活力的软骨细胞,并采用经典凋亡诱导剂星形孢菌素(staurosporine,STS),构建软骨细胞凋亡模型,为骨关节炎药物的开发提供可参考的实验方法。
1 材料与方法
1.1 材料
C57BL/6小鼠10只,SPF级,15-18 g,雄鼠,由常州卡文斯实验动物有限公司提供;星形孢菌素购自阿拉丁试剂(上海)有限公司;胎牛血清购自浙江天航生物科技有限公司;0.25%胰蛋白酶、DMEM低糖培养基购自美国Gibco公司;4%多聚甲醛固定液、甲苯胺蓝购自上海麦克林生化科技有限公司;Ⅱ型胶原酶购自美国Sigma公司;增强型CCK-8试剂盒购自上海碧云天生物技术有限公司;凋亡试剂盒购自江苏凯基生物技术股份有限公司;牛血清白蛋白、Ⅱ型胶原兔多克隆抗体、Cy3标记山羊抗兔lgG、DAPI、Annexin Ⅴ-FITC/PI试剂盒、引物、RNA提取液、RT First Strand cDNA Synthesis Kit、2×SYBR Green qPCR Master Mix购自武汉赛维尔生物科技有限公司;超净工作台购自德国Heraeus公司;二氧化碳培养箱购自日本Sanyo公司,LX-800酶标仪购自美国Bio-tek公司;倒置相差显微镜购自日本Nikon公司;IX71倒置荧光显微镜购自日本Olympus公司;荧光定量PCR仪购自伯乐生命医学产品(上海)有限公司。
1.2 方法
1.2.1 C57BL/6小鼠关节软骨细胞的分离、提取和培养 将10只15-18 g C57BL/6小鼠颈椎脱臼处死后,75%酒精浸泡5 min,用手术刀将皮肤切开,沿髌骨下缘打开关节囊,切断髌韧带、内外副韧带及前后交叉韧带,离断膝关节,去除股骨和胫骨表面的结缔组织。用手术刀将各个肢体软骨层约1/2削下,尽量削薄,放在含双抗的PBS培养皿中,将取下的软骨组织剪成1 mm×1 mm的小碎片,移至15 ml离心管中,使用含双抗的PBS冲洗两遍,洗去软骨表面的血液及滑膜组织。加入3倍体积的0.25%胰蛋白酶,放入37 ℃,5% CO2培养箱消化20 min。加入培养基终止消化,1 500 r/min,离心5 min,弃上清,加入0.2% Ⅱ型胶原酶重悬后,放至37 ℃,5% CO2培养箱中消化8 h,中途每隔2 h拿出来,在超净台上用巴氏吸管吹打2 min,使胶原酶与软骨组织充分接触。加入DMEM完全培养基终止消化,反复吹打后过200目滤网,收集滤液,1 500 r/min,离心5 min,弃上清,用DMEM完全培养基重悬后放入37 ℃,5% CO2培养箱中。如剩余的软骨组织呈团块状,未呈现出透明纤维状,可再加入0.2% Ⅱ型胶原酶继续消化,但确保消化时间不能超过12 h,否则过度消化会影响软骨细胞的活性。24 h后初次换液,之后每隔两天换液一次,待细胞长到80%以上时进行传代,传代时加入0.25%胰蛋白酶消化,显微镜下观察细胞消化状态,待细胞变圆变亮且漂浮在溶液中时,加入与胰蛋白酶等体积的完全培养基终止消化,巴氏吸管吹打制成单细胞悬液,离心后重悬,按1 ∶3传代培养。显微镜下观察软骨细胞贴壁生长情况,拍照记录前5代软骨细胞形态变化。
1.2.2 甲苯胺蓝染色鉴定C57BL/6小鼠关节软骨细胞 将软骨细胞接种于六孔板中,每孔待细胞长满到80%后,倾去培养液,PBS清洗3次,加入4%多聚甲醛溶液固定30 min。倾去4%多聚甲醛溶液,PBS清洗3次,加入75%的乙醇固定30 min。倾去75%的乙醇溶液,PBS清洗3次,晾干。加入0.1%甲苯胺蓝染色20 min。PBS清洗3次,无水乙醇再迅速清洗1次。晾干,显微镜下观察,拍照。
1.2.3 Ⅱ型胶原免疫荧光染色鉴定C57BL/6小鼠关节软骨细胞 将第3代C57BL/6小鼠关节软骨细胞按照每孔2×104个细胞接种到放有爬片的六孔板中,待细胞长到约80%后,取出细胞爬片。PBS清洗3次,4%多聚甲醛固定30 min。PBS清洗3次,3% BSA室温封闭30 min,轻轻甩掉封闭液,加入1 ∶200经PBS稀释的一抗(Ⅱ型胶原),放于湿盒内4 ℃孵育过夜。PBS清洗3次,加入Cy3标记山羊抗兔(1 ∶300),避光室温孵育50 min。PBS清洗3次,避光,滴加DAPI染液,避光室温孵育10 min。PBS清洗3次,爬片晾干后用抗荧光淬灭封片剂封片,倒置荧光显微镜下观察,拍照。
1.2.4 RT-PCR检测C57BL/6小鼠关节软骨细胞Ⅱ型胶原mRNA的表达 RT-PCR分别检测5代C57BL/6小鼠关节软骨细胞Ⅱ型胶原mRNA的表达情况。根据Trizol实验说明提取总RNA,再根据反转录PCR说明书进行操作。反应体系在25 ℃反应5 min,42 ℃反应30 min,85 ℃反应5 s,完成cDNA的合成。PCR反应体系扩增目的基因及内参照β-actin,Ⅱ型胶原引物序列:上游5′-ACGCTACACTCAAGTCACTGAACAAC-3′,下游5′-TCAATCCAGTAGTCTCCGCTCTTC-3′;β-actin引物序列:上游5′-GTGACGTTGACATCCGTAAAGA-3′,下游5′-GTAACAGTCCGCCTAGAAGCAC-3′。PCR反应:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火30 s,60 ℃延伸30 s,40个循环,每个循环结束后采集荧光,最后绘制熔解曲线。待测基因mRNA相对表达量以其扩增物的Ct值表示。
1.2.5 CCK-8法检测C57BL/6小鼠关节软骨细胞增殖情况 分别将传代培养的5代C57BL/6小鼠软骨细胞用0.25%胰蛋白酶消化,900 r/min,离心4 min,DMEM完全培养基重悬细胞制成单细胞悬液,以每孔2×103的密度分别均匀接种于9块96孔板中,每块板每代设置6个复孔。每隔两天换一次液,连续9 d,每天固定时间点取出一块96孔板加入10 μl的CCK-8试剂,37 ℃,5% CO2培养箱孵育2 h,酶标仪450 nm处测定各孔OD值,取平均值。
1.2.6 流式细胞仪检测星形孢菌素对软骨细胞促凋亡作用 Annexin Ⅴ-FITC/PI双染色法检测第3代软骨细胞凋亡情况,软骨细胞以2×104/ml接种于6孔板中,24 h后换为无血清培养基。在培养基中分别加入终浓度为0,5,10,20 μmol/L的星形孢菌素及200 μmol/L H2O2阳性对照刺激软骨细胞24 h。细胞凋亡刺激后,先收集细胞培养上清,用不含EDTA的胰酶消化处理贴壁的细胞,用已收集的培养基上清终止消化,1 500 r/min,4 ℃离心5 min收集约1×105个细胞。用预冷的PBS清洗细胞2次,收集细胞。向收集的细胞中加入100 μl预冷的1×Binding Buffer,轻柔重悬细胞。向重悬细胞中加入5 μl Annexin Ⅴ-FITC和5 μl PI,轻柔混匀。室温条件下避光反应10 min后,加入400 μl预冷的1×Binding Buffer,轻轻摇匀,1 h内用流式细胞仪检测细胞凋亡情况。
1.2.7 AOEB法检测星形孢菌素对软骨细胞促凋亡作用 为进一步验证星形孢菌素对软骨细胞的促凋亡作用,用吖啶橙/溴乙锭(AOEB)法检测第3代细胞凋亡情况,将软骨细胞分为正常组和10 μmol/L星形孢菌素作用组,用终浓度为10 μmol/L的星形孢菌素作用软骨细胞24 h。收集细胞,PBS洗涤细胞2次,并配成2×105/ml细胞悬液,将AO与EB溶液等体积混匀,吸取25 μl的细胞悬液同1 μl的AO与EB混合液轻轻摇匀,吸取上述10 μl的混合液置于一干净的载玻片上,并用盖玻片盖上细胞,荧光显微镜510 nm激发波长观察细胞凋亡情况。
1.3 统计学分析
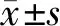
2 结果
2.1 C57BL/6小鼠关节软骨细胞形态学特征
分离培养的原代C57BL/6小鼠关节软骨细胞呈类圆形,悬浮于培养基中,大小均一,具有较强的折光性,倒置显微镜显示,细胞在未贴壁前呈类球形,悬浮于培养基中,12 h内逐渐贴壁,贴壁细胞大多数呈圆形,24 h内基本贴壁,贴壁细胞大多数呈圆形或椭圆形,培养7 d后,原代细胞90%融合,胞体丰满,胞质均匀,核大而圆,细胞紧密排列呈“铺路石”状外观,此时的软骨细胞为第1代(P1)。消化传代后,6 h左右可完全贴壁,传代后细胞增殖速度加快,4 d左右就可见90%细胞融合。细胞随着培养时间的增加,逐渐分化。不同代数细胞呈现出不同的形态,由第1代的类圆形,第2代的三角形,到第3代的三角形及短梭形;3代后主要呈长梭形且形态不规则,胞核增大,胞质边缘模糊化(见图1)。随着传代次数增加,细胞中梭形细胞逐渐增多,传代周期延长,镜下细胞长而大,折光性差,部分细胞脱落,悬浮于培养液中。
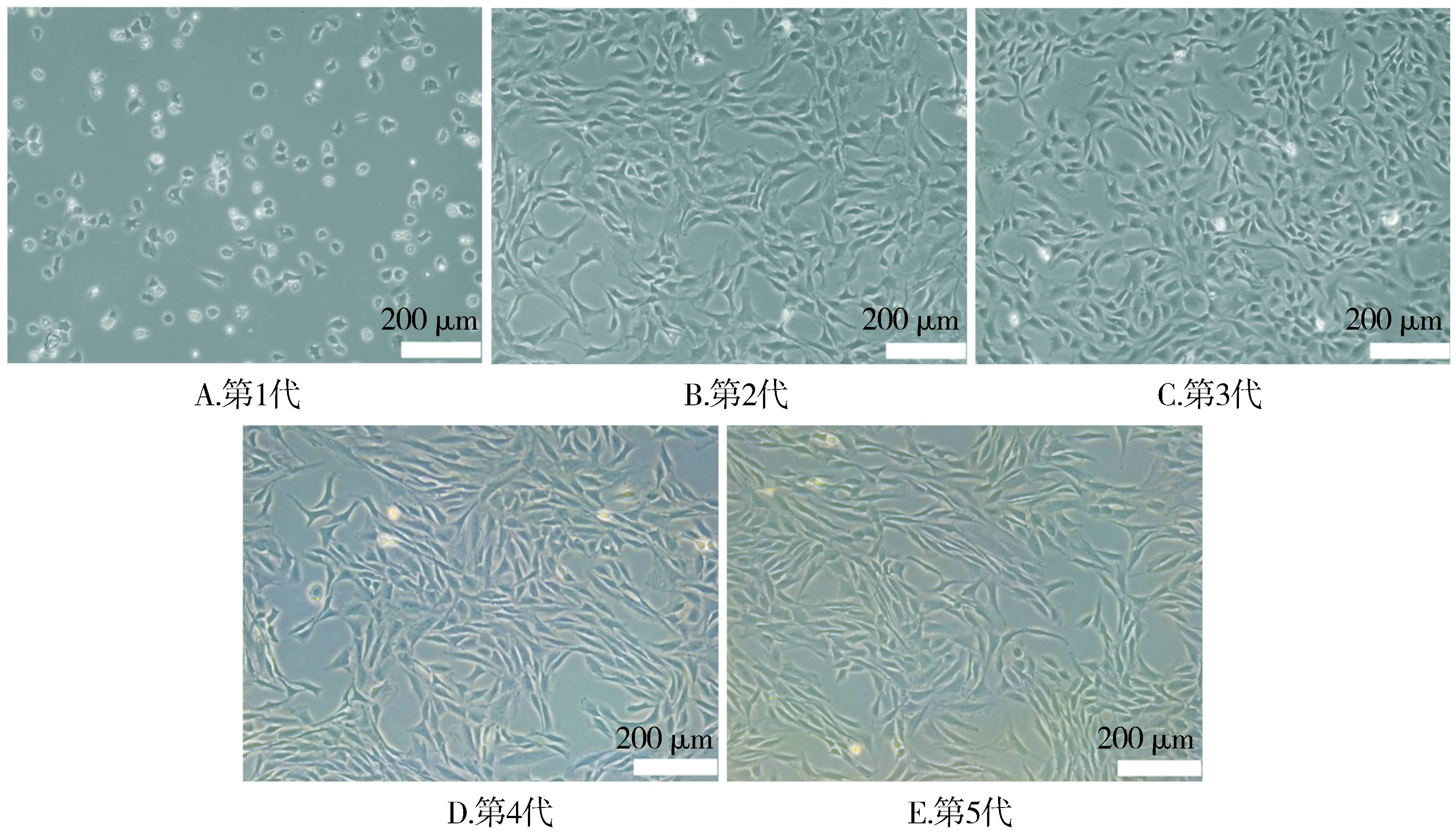
图1 不同代数C57BL/6小鼠关节软骨细胞的形态变化Figure 1 Morphological changes of different generations of articular chondrocytes from C57BL/6 mouse
2.2 甲苯胺蓝染色鉴定C57BL/6小鼠关节软骨细胞
C57BL/6小鼠关节软骨细胞第1,3,5代甲苯胺蓝染色结果见图2。第1,3,5代关节软骨细胞经甲苯胺蓝染色后,胞内呈蓝色异染颗粒,胞核呈深蓝色异染颗粒。并且随着传代数目的增加,细胞内的异染颗粒颜色逐渐变浅。因此,甲苯胺蓝染色结果证明提取的细胞为软骨细胞。
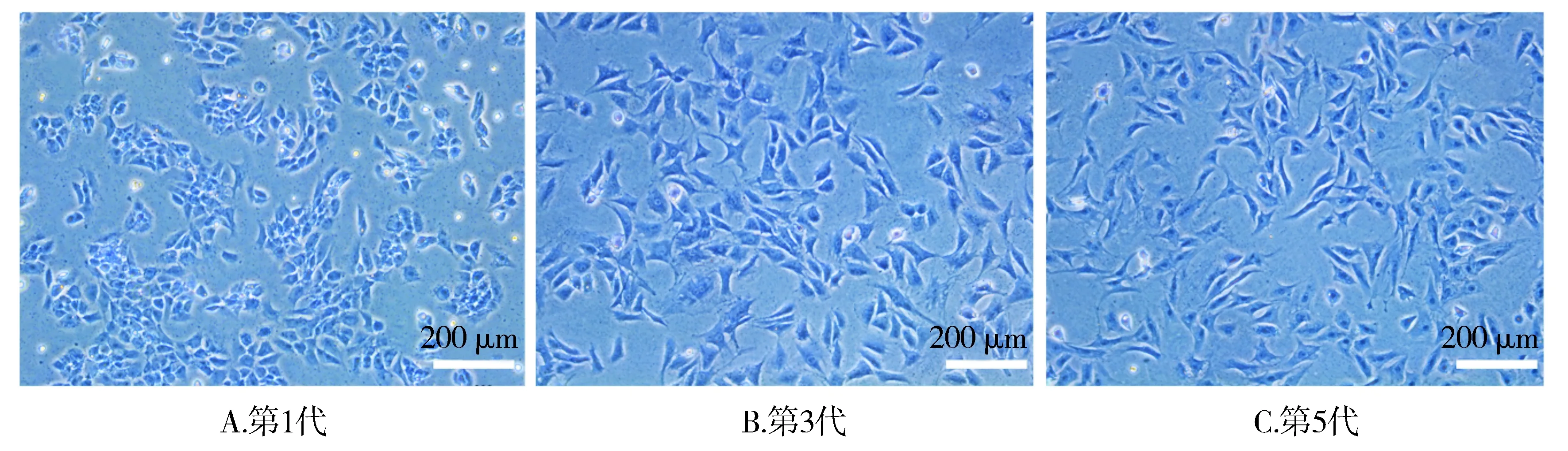
图2 不同代数C57BL/6小鼠关节软骨细胞甲苯胺蓝染色结果Figure 2 Toluidine blue staining of different generations of articular chondrocytes from C57BL/6 mouse
2.3 Ⅱ型胶原免疫荧光染色鉴定C57BL/6小鼠关节软骨细胞
C57BL/6小鼠第3代关节软骨细胞Ⅱ型胶原免疫荧光染色结果显示,在细胞的细胞质中Ⅱ型胶原染色表达红色荧光,细胞核经DAPI染色表达蓝色荧光,图片重合后蓝色荧光位于红色荧光内(见图3)。因此,Ⅱ型胶原免疫荧光结果证明培养的细胞为软骨细胞。

图3 Ⅱ型胶原免疫荧光染色结果Figure 3 Immunofluorescence staining of type Ⅱ collagen
2.4 RT-PCR法检测C57BL/6小鼠关节软骨细胞Ⅱ型胶原mRNA表达情况
5代C57BL/6小鼠关节软骨细胞Ⅱ型胶原mRNA相对表达情况见图4。与第1代软骨细胞相比,第2代和第3代软骨细胞Ⅱ型胶原mRNA的相对表达量差异无统计学意义,而第4代和第5代软骨细胞Ⅱ型胶原mRNA相对表达量显著降低,差异有统计学意义(均P<0.001)。
与第1代(P1)软骨细胞相比,***P<0.001图4 不同代数软骨细胞Ⅱ型胶原mRNA表达Figure 4 The mRNA expression of type Ⅱ collagen in chondrocytes of different generations
2.5 CCK-8法检测C57BL/6小鼠关节软骨细胞增殖情况
根据CCK-8法分别测定的5代C57BL/6小鼠关节软骨细胞的细胞活力,绘制软骨细胞生长曲线,结果见图5。细胞的生长曲线呈S型,随着培养天数的增加,3 d后细胞进入对数生长期,6 d后处于平台期,细胞生长逐渐缓慢,7 d后细胞增殖能力开始呈下降趋势。第4代和第5代软骨细胞生长平缓,增殖高峰低,且这一变化随着传代次数增多愈加明显,与第1代软骨细胞相比,第4代和第5代软骨细胞的细胞活力显著降低,差异有统计学意义(均P<0.05,见图5)。
2.6 流式细胞仪检测星形孢菌素对软骨细胞促凋亡作用
Annexin Ⅴ-FITC/PI双染色流式结果见图6。0,5,10,20 μmol/L星形孢菌素及H2O2分别作用软骨细胞24 h后,细胞的凋亡率分别为(10.48±0.18)%,(42.97±2.02)%,(63.97±1.67)%,(64.52±2.55)%,(64.71±1.53)%。与H2O2组相比,0 μmol/L和5 μmol/L组凋亡率降低(均P<0.001),10 μmol/L和20 μmol/L组凋亡率差异无统计学意义。因此,10 μmol/L的星形孢菌素作用软骨细胞24 h促凋亡最适宜。
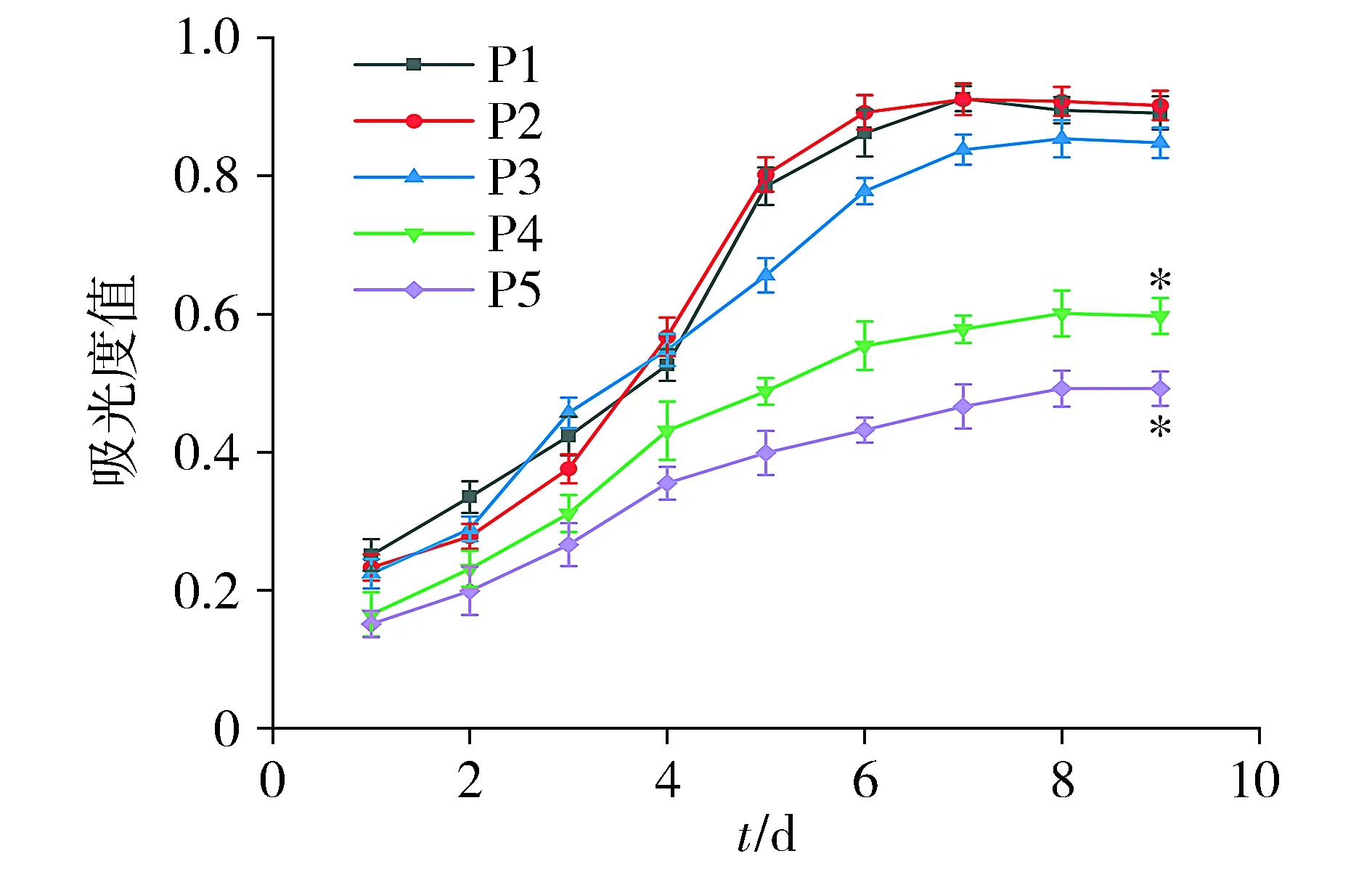
与第1代(P1)软骨细胞相比,*P<0.05图5 不同代数C57BL/6小鼠关节软骨细胞CCK-8检测结果Figure 5 Growth curves of different generations of articular chondrocytes from C57BL/6 mice

图6 流式细胞仪分析检测软骨细胞凋亡率Figure 6 Apoptosis of chondrocytes detected by flow cytometry
2.7 AOEB法检测星形孢菌素对软骨细胞促凋亡作用
吖啶橙/溴乙锭法(AOEB)软骨细胞荧光显微镜观察结果见图7。正常组细胞核质体被吖啶橙(AO)均匀染成绿色,大小形状单一,坏死细胞呈椭圆形,核质体被溴乙锭(EB)均匀染成橙色,大小形状单一。星形孢菌素10 μmol/L组作用24 h,凋亡早期细胞核质体被AO均匀染成绿色,细胞形状不规则,如新月形;凋亡晚期细胞,核质体被EB均匀染成橙色,染色质浓缩,细胞核碎裂成点状,大小不一,可见胞质芽状突起。
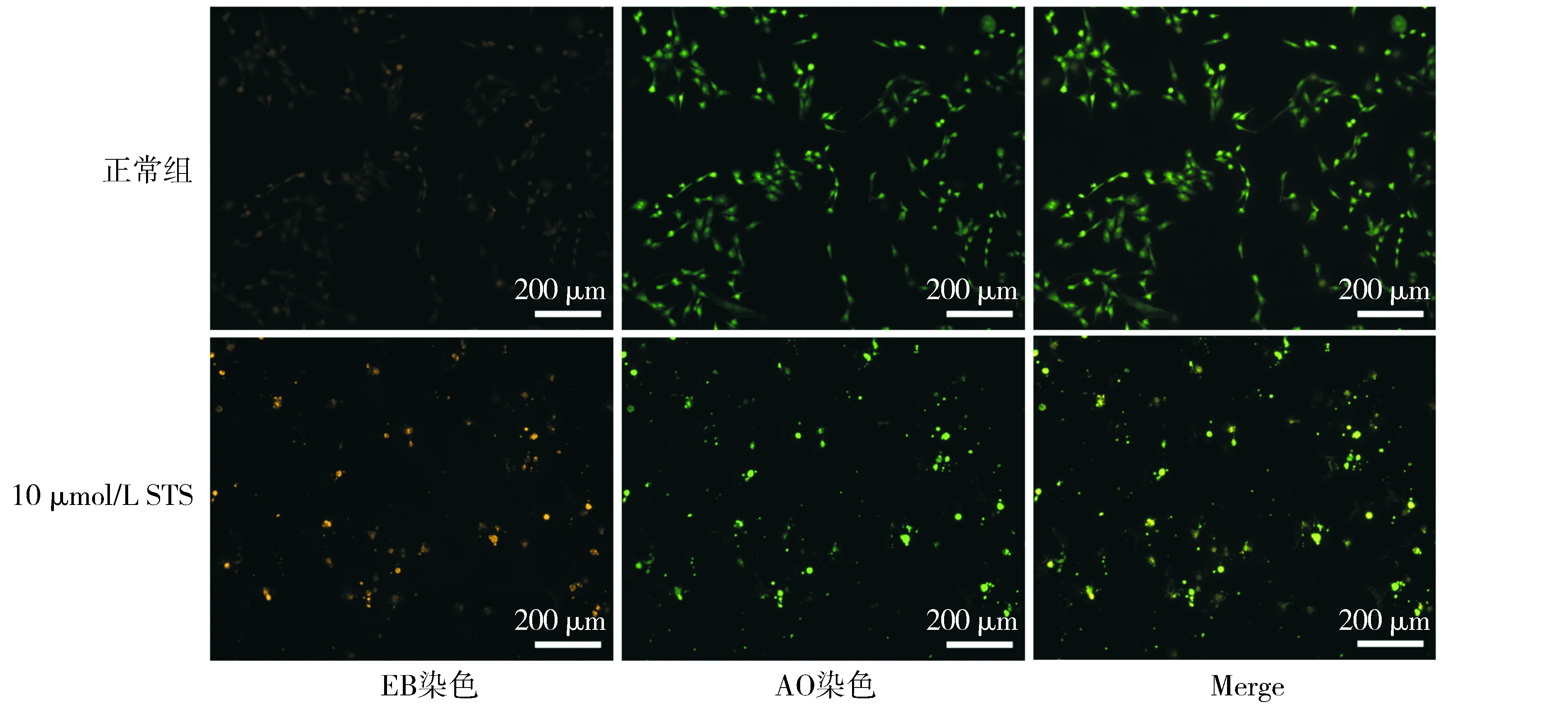
图7 荧光显微镜观察第3代软骨细胞AOEB染色情况Figure 7 AOEB staining of the third generation chondrocytes under fluorescence microscope
3 讨论
正常的软骨是一种特殊的结缔组织,其主要成分是软骨细胞和基质,不含纤维血管组织[10]。体外培养软骨细胞是研究正常软骨细胞生物学特性及骨关节炎发病机制的重要手段。长久以来,由于人们认为软骨细胞不具备分裂增殖的能力[11],所以未进行软骨细胞体外培养研究。自1967年Manning和Bonner使用胰蛋白酶和胶原酶联合来消化关节软骨,把软骨细胞从软骨基质中分离出来,获得了数量多、活性好的软骨细胞,改变了软骨细胞不能分裂的传统观点[12]。本研究采用两步酶消化法配合机械吹打提取C57BL/6小鼠关节软骨细胞,通过两步酶消化法分离出大量高活力的小鼠关节软骨细胞,配合适当的机械吹打,有助于Ⅱ型胶原酶与软骨细胞的充分接触,分离出更多数量的C57BL/6小鼠关节软骨细胞。
软骨细胞是在软骨中发现的唯一一种细胞,具有生成和维持胶原和蛋白聚糖等软骨基质的功能,主要包括Ⅱ型胶原蛋白和蛋白聚糖,是软骨基质的主要成分,Ⅱ型胶原表达阳性是软骨细胞的特征性标志[13]。本研究中对软骨细胞的特征性标志Ⅱ型胶原及蛋白聚糖进行检测,表明培养的细胞是软骨细胞。正常的软骨细胞随着传代次数的增加Ⅱ型胶原逐渐转化成Ⅰ型胶原,且分泌蛋白聚糖的水平也会降低,从而出现去分化现象[14]。软骨细胞甲苯胺蓝着色深浅程度及Ⅱ型胶原mRNA的表达量与传代次数呈正相关。根据赵明等[15]的形态学及免疫组织化学研究结果表示,体外培养3代以内的软骨持表型的稳定,而3代后的软骨细胞呈现出增殖缓慢及衰老的现象。因此,本研究主要考察3代内的软骨细胞的形态变化,并利用3代内的软骨细胞用于后续的实验研究。
星形孢菌素是一种强效的ATP竞争性激酶抑制剂,能够有效抑制蛋白激酶活性,抑制多种人癌细胞增殖,诱导细胞凋亡方法是激活胱天蛋白酶-3[16]。以往学者进行软骨细胞的凋亡诱导时,使用的星形孢菌素浓度各不相同。Ahmed等[17]利用1 μmol/L星形孢菌素处理肥大软骨细胞24 h诱导凋亡;Mukherjee等[18]发现软骨细胞的活力依赖于星形孢菌素的浓度与作用时间,当随着星形孢菌素浓度(0.1,1,10 μmol/L)和作用时间(2,4,8 h)的增加,软骨细胞的活力逐渐降低。上述研究结果均以软骨细胞作为研究对象,尚未对软骨细胞的代数进行筛选。因此,基于实验研究的需要,本实验以3代内高活力表型良好的软骨细胞为实验基础,设置了0-20 μmol/L的星形孢菌素浓度梯度,而由于不能确定实验加药组的凋亡程度,因此采用H2O2作为一个诱导较强凋亡的阳性对照组,结果发现在0-10 μmol/L的浓度范围内,星形孢菌素对软骨细胞的凋亡作用并不显著,而超过10 μmol/L后,软骨细胞的凋亡作用与H2O2阳性对照比无显著差异。
本研究以3代内高活力表型良好的C57BL/6小鼠关节软骨细胞为主要研究对象,流式结果证明星形孢菌素可以诱导软骨细胞凋亡,同时利用AOEB法进一步验证,10 μmol/L星形孢菌素作用于软骨细胞24 h最适宜建立软骨细胞的凋亡模型,为骨关节炎药物的开发提供可参考的实验方法。
