艾司西酞普兰联合有氧运动对小鼠抑郁症的治疗作用
2021-02-10孙一鸣谷昱琛黄莹莹
孙一鸣,谷昱琛,黄莹莹,梁 心,鲁 明,刘 哲*
(1蚌埠医学院第一附属医院药剂科,蚌埠 233000;2蚌埠医学院药学院药理教研室;3南京医科大学基础医学院药理教研室;*通讯作者,E-mail:liuzhe@bbmc.edu.cn;#共同通讯作者,E-mail:lumingnjmu@sina.com)
抑郁症(major depressive disorder,MDD)是最常见的精神疾病,全球约3.5亿患者,已然成为了严重的公共卫生问题[1]。据WHO调查结果显示,自2004年起抑郁症已成为人类第三大顽症,预计至2030年抑郁症将成为影响人类生活的第一大精神疾病,仅中国抑郁症患者就有9 000万,终生患病率6.1%-9.5%,这个数字还在逐年增长,给家庭和社会带来严重的伤害及经济负担[2,3]。
已有研究表明,抑郁症是一类以星形胶质细胞丢失及功能异常为主要病理特征,并伴随神经炎症的神经精神类疾病[4,5]。抑郁症尸检结果显示,与正常人相比,抑郁症患者皮层、海马体积萎缩,多个脑区的肿瘤坏死因子-α(TNF-α)、白介素以及前列腺素(PGE2)等致炎因子水平明显增加[6]。抑郁症发病机制假说包括单胺类神经递质假说、神经营养因子假说、神经内分泌假说、免疫炎症假说[7,8],目前临床治疗主要基于单胺类神经递质假说,一线治疗药物选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitors,SSRIs)可诱导血清素转运体(serotonin transporter,SERT)内化,从而增加细胞间隙(Serogtonin,5-HT)浓度,达到缓解抑郁样症状的目的,但此类药物对三分之一的抑郁症患者效果较差[9]。临床治疗方案常建议患者联合有规律的有氧运动,可有效改善患者抑郁样症状,但是其治疗机制尚不明确[10]。本研究拟建立慢性温和不可预知应激模型(chronic mild stress,CMS),探究艾司西酞普兰与有氧运动结合对抑郁症小鼠星形胶质细胞丢失、促炎因子含量及氨基酸水平的调节作用,并探索艾司西酞普兰联合有氧运动对抑郁症发生发展的影响,为抗抑郁药物研发和临床治疗提供新的思路及实验依据。
1 材料与方法
1.1 实验动物与主要试剂

1.2 慢性温和不可预知应激抑郁模型的建立
采用3月龄雄性C57BL/6小鼠,适应实验环境2 d,适应糖水2 d,剔除不合格小鼠。随机分为空白对照组(Control,CON,n=7)、慢性温和不可预知温和应激模型组(chronic mild stress,CMS,n=7)、艾司西酞普兰组(ESCIT,n=7)、联合治疗组(艾司西酞普兰+转笼有氧运动2 h,ESCIT+AE,n=7)。连续CMS应激6周后进行相关行为学检测小鼠建模成功与否。从第7周开始艾司西酞普兰组给予腹腔注射ESCIT(5 mg/kg)、联合治疗组给予ESCIT(5 mg/kg)+AE 2 h治疗至第10周,随后再次检测小鼠抑郁样行为,每周均采用糖水偏好实验检测小鼠糖水偏好率。实验小鼠均单笼饲养,给予充足的饮用水及饲料(除非模型需求)。CON组小鼠正常给予进食、饮水,与模型组分开放置,避免任何可能的刺激。CMS抑郁模型[11]实验小鼠每天随机给予2-3种应激源,刺激10周,每天给予的应激源及应激时间不可雷同。CMS模型应激源如下:夹尾巴(3 min)、不定时噪音、昼夜颠倒(24 h)、冰水浴(2-3 min)、50 ml束缚管束缚(4-6 h)、湿笼(8 h)、45°斜笼(12 h)、禁水(12 h)、禁食(12 h)、闪灯(12 h)等。转笼有氧训练:采用宠物鼠转笼,直径8 cm,底座用固定架固定,转笼有氧运动30 min/次,4次/d。CON组和CMS组小鼠不做任何训练,自由活动。
1.3 行为学实验检测小鼠抑郁样行为
1.3.1 糖水偏好实验 小鼠笼内放置蒸馏水和1%蔗糖溶液各1管,观察8 h内各组小鼠对两种液体的饮用情况,在第4小时交换蒸馏水与糖水的位置,防止位置偏好,检测8 h后称量两管液体的质量。计算糖水消耗比例:蔗糖水消耗比例=蔗糖水消耗(g)/(蔗糖水消耗+纯水消耗)×100%。每周均采用糖水偏好实验(sucrose preference test,SPT)检测小鼠糖水偏好率。
1.3.2 强迫游泳实验 采用强迫游泳实验(forced swimming test,FST)评价小鼠抑郁样行为。具体操作为将烧杯(高30 cm,直径20 cm)中注入蒸馏水约4 L,水温为25 ℃。记录烧杯中小鼠的游泳状态,从将小鼠置于烧杯内开始记录,记录6 min的游泳行为,并统计最后4 min小鼠的不动时间。在第6周和第10周各进行一次强迫游泳实验,不动时间越短,抗抑郁作用越强。
1.3.3 悬尾实验 采用悬尾实验(tail suspension test,TST)评价小鼠抑郁样行为。将小鼠尾巴后三分之一固定于支架上,保持小鼠头部悬挂向下(距离台面15 cm)。记录小鼠6 min行为变化,统计实验小鼠后4 min的不动时间。在第6周和第10周各进行一次悬尾实验,不动时间越短,抗抑郁作用越强。
1.3.4 旷场实验 采用旷场实验(opening field test,OFT)评价小鼠抑郁样行为。将小鼠放置于箱内底面中心,计时6 min。通过计算给定时间内小鼠行走轨迹路线及去到活动中心的次数,评价实验小鼠在旷场环境中的自主探索行为与焦虑行为。在第6周和第10周各进行一次旷场实验,自主运动路线越长,抗抑郁及焦虑作用越强。
1.4 ELISA酶联反应检测小鼠外周血炎症因子IL-1β、IL-6、IL-10、TNF-α的含量
行为学检测完毕,每组7只实验小鼠分别眼球取外周血800 μl,4 ℃ 3 000g离心10 min,取外周血上清放入新的EP管,冻存于-80 ℃,备用。将样品与标准品稀释后分别加入相应的96孔板中,再加入生物素化抗体,37 ℃放置30 min,洗板5次。加入酶结合物工作液,37 ℃孵育30 min,洗板5次。每孔都加入显色液A液B液,各50 μl,37 ℃避光孵育15 min。加入终止液50 μl终止反应,450 nm波长处测量吸光度,根据吸光度算出标准曲线,再计算检测样品的浓度。
1.5 HPLC-ECD法检测小鼠海马组织氨基酸类递质的含量
采用HPLC-ECD法检测小鼠海马组织匀浆的氨基酸类递质含量。实验小鼠眼球取血后,每组取3只小鼠立即处死,迅速剥离大脑置于冰盒上并分离海马组织,放入EP管去皮称重,其中左侧海马组织按10 μl/mg组织加入匀浆液(0.1 mol/L高氯酸,0.1 mmol/L EDTA.2Na,DHBA 3.5×10-8mol/L),超声匀浆。4 ℃,20 000 r/min离心30 min,取上清定量分装后置于-70 ℃冰箱,备用。系统组成及参数设置如下:HPLC-ECD检测系统(Thermo Fisher Scientific,USA),Thermo UniMate 3000 Pump;流速0.2 ml/min;UniMate 3000 Autosampler,4 ℃,进样10 μl;ESA Coulochem Ⅲ Electrochemical Detector,5041检测池电压350 mV,Guard Cell电压360 mV,Rang 100 nA,Filter 5S;DIONEX Acclaim Rapid Separation Liquid Chromatography(RSLC) C18 2.2 μm,2.1 mm×100 mm;柱温38 ℃;Chromeleon 6.9色谱工作站采集与分析数据。流动相组成及配比:NaH2PO490 mmol/L、柠檬酸50 mmol/L、OSA 1.7 mmol/L、EDTA 50 μmol/L、乙腈5%。
1.6 免疫荧光检测小鼠海马脑区星形胶质细胞表达
采用免疫荧光染色检测小鼠海马脑区星形胶质细胞的阳性数。实验小鼠眼球取血后,每组取4只小鼠给予腹腔注射戊巴比妥钠(1%,45 mg/kg),麻醉效果满意后,自左心室灌注PBS,没有血色后,继续灌注4%多聚甲醛,直至小鼠四肢僵直。即刻取出全脑放入5 ml EP管4%多聚甲醛固定、过夜。20%和30%蔗糖溶液连续梯度脱水5-7 d。以OCT胶包埋,切片,每片30 μm,装入甘油 ∶PBS为1 ∶1的混匀液中,-20 ℃保存。挑出典型海马区的脑片,PBS漂洗3次,每次10 min,用含0.3% Triton X-100的0.01 mol/L PBS配制的5% BSA封闭脑片1 h,弃去封闭液,不用清洗脑片,直接加入小鼠源性anti-GFAP,由抗体稀释液配成,4 ℃过夜。复温1 h,PBS漂洗3次,每次5 min,加入PBS配制的红色荧光小鼠二抗,室温孵育1 h。PBS漂洗3次,每次5 min,采用含防淬灭剂的DAPI进行染核,封片。体视学显微镜(Axiovert LSM510,Carl Zeiss Co)下观察拍片计数。
1.7 体视学细胞计数检测小鼠海马脑区星形胶质细胞阳性数
免疫荧光阳性细胞计数采用体视学立体计数法(Stereo Investigator software,Microbrightfield,Williston,VT,USA)。根据小鼠脑图谱,在20倍的物镜下找到海马区并圈出海马区的目的区域,计数框为100 μm×100 μm。目的区域以外的阳性细胞不列入计数范围,采用Stereo Investigator 7.0软件统计分析计算阳性细胞总数。
1.8 免疫印迹(Western blotting,WB)检测小鼠海马脑区焦亡相关蛋白表达
右侧海马组织称重,按比例加入含蛋白酶抑制剂的RIPA裂解液,组织匀浆,16 000 r/min×15 min,4 ℃离心,吸取上清。取1 μl进行BCA蛋白定量(碧云天,上海),余下上清蛋白按照体积比加入1/4体积的5×Loading buffer,95 ℃金属浴,5 min,分装-20 ℃保存备用。上样后,300 mA恒流下电转,转至PVDF膜(Millipore,USA)。在10%脱脂奶粉里封闭1 h,结束后TBST漂洗3次,每次10 min,再加入TBST配制5% BSA的一抗,4 ℃孵育过夜。所用的一抗包括:鼠抗GFAP(1 ∶1 000),兔抗GSDMD(1 ∶1 000),鼠抗Caspase-1(1 ∶1 000),小鼠抗GAPDH(1 ∶1 000)。复温30 min,TBST漂洗10 min×3次。加入HRP标记的二抗:山羊抗小鼠-HRP(1 ∶2 000),室温孵育1 h,TBST漂洗10 min×3次,用Image Quant LAS 4000(GE)化学发光成像系统显色。
1.9 统计学分析

2 结果
2.1 ESCIT联合AE改善CMS小鼠抑郁样行为
与对照组相比,模型组小鼠糖水偏好率降低(P<0.01);与模型组相比,艾司西酞普兰组及联合治疗组小鼠糖水偏好率增加(P<0.05);与艾司西酞普兰组相比,联合治疗组小鼠糖水偏好率显示增加趋势,但差异无统计学意义(P>0.05,见图1)。与对照组相比,模型组小鼠TST不动时间、FST不动时间增加,差异有统计学意义(P<0.01);与模型组相比,艾司西酞普兰组及联合治疗组小鼠TST不动时间、FST不动时间减少,差异有统计学意义(P<0.05);与艾司西酞普兰组相比,联合治疗组小鼠TST不动时间、FST不动时间有减少趋势,差异无统计学意义(P>0.05,见图1)。与对照组相比,模型组小鼠旷场总运动路线减少(P<0.01);与模型组相比,艾司西酞普兰组及联合治疗组小鼠旷场总运动路线增加(P<0.05);与艾司西酞普兰组相比,联合治疗组小鼠旷场总运动路线增加,差异有统计学意义(P<0.05,见图1)。

与空白对照组相比,*P<0.05,**P<0.01,***P<0.001;与模型组相比,#P<0.05,##P<0.01;与艾司西酞普兰组相比,△P<0.05图1 艾司西酞普兰联合有氧运动改善CMS小鼠抑郁样行为Figure 1 ESCIT combined with AE improves depression-like behavior in CMS mice
2.2 ESCIT联合AE可降低CMS小鼠外周血促炎因子水平
ELISA结果表明,与对照组相比,模型组外周血清炎症因子IL-1β、IL-6、TNF-α浓度增加(P<0.01);与模型组相比,艾司西酞普兰组及联合治疗组外周血清促炎因子IL-1β、IL-6、TNF-α浓度降低(P<0.05);与艾司西酞普兰组相比,联合治疗组外周血清促炎因子IL-1β、IL-6、TNF-α浓度有降低趋势,差异无统计学意义(P>0.05,见图2)。四组间外周血清抑炎因子IL-10差异无统计学意义(P>0.05,见图2)。

与对照组相比,**P<0.01,***P<0.001;与模型组相比,#P<0.05,##P<0.01图2 艾司西酞普兰联合有氧运动降低CMS小鼠外周血促炎因子水平Figure 2 ESCIT combined with AE inhibits inflammatory factors in peripheral blood of CMS mice
2.3 ESCIT联合AE缓解CMS小鼠海马脑区星形胶质细胞焦亡
免疫荧光结果显示,与对照组相比,模型组小鼠海马脑区星形胶质细胞GFAP阳性细胞显著减少,差异有统计学意义(P<0.01);与模型组相比,艾司西酞普兰组及联合治疗组小鼠海马脑区星形胶质细胞GFAP阳性细胞增加(P<0.05);与艾司西酞普兰组相比,联合治疗组小鼠海马区星形胶质细胞GFAP阳性细胞略有增加,但差异无统计学意义(P>0.05,见图3)。此外Western blotting结果显示,CMS小鼠海马脑区GSDMD,Caspase-1成熟体表达显著增加,ESCIT联合AE可改善CMS小鼠海马区GSDMD,Caspase-1成熟体表达水平(见图3)。
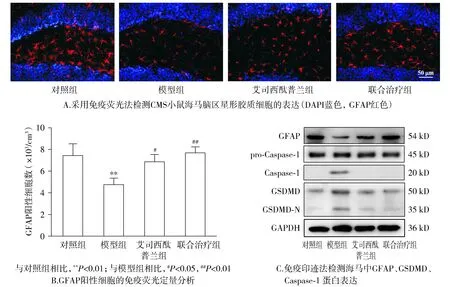
图3 艾司西酞普兰联合有氧运动缓解CMS小鼠海马脑区星形胶质细胞丢失Figure 3 ESCIT combined with AE increases the amount of astrocytes in the hippocampus of CMS mice
2.4 ESCIT联合AE改善CMS小鼠海马组织牛磺酸及γ-氨基丁酸水平
HPLC检测结果表明,与对照组相比,模型组小鼠海马脑区牛磺酸、γ-氨基丁酸含量增加,差异有统计学意义(P<0.001);与模型组相比,艾司西酞普兰组及联合治疗组小鼠牛磺酸、γ-氨基丁酸水平降低,差异有统计学意义(P<0.01);与艾司西酞普兰组相比,联合治疗组小鼠海马脑区牛磺酸、γ-氨基丁酸水平略降低,差异无统计学意义(P>0.05,见图4)。

与对照组组相比,***P<0.001;与模型组相比,###P<0.05图4 艾司西酞普兰联合有氧运动改善CMS小鼠海马组织牛磺酸及γ-氨基丁酸水平Figure 4 ESCIT combined with AE improves Tau and GABA levels in hippocampus of CMS mice
3 讨论
与正常人相比,抑郁症患者尸检结果显示额叶皮层、海马体积及质量显著减少,星形胶质细胞数量减少,其标记物GFAP和S100钙结合蛋白β(S100β)的mRNA水平和蛋白表达亦显著下调[12],其他神经系统疾病则是以神经元的异常为主。同时抑郁症患者多个脑区出现广泛的神经炎症反应,白介素(interleukin,IL)家族成员(IL-1,IL-6)、TNF-α和PGE2等致炎因子水平显著升高[13,14]。因此,抑郁症是一类以星形胶质细胞病理改变及功能障碍为主要特征,伴随神经炎症的神经精神类疾病。寻找理想的干预靶标,抑制星形胶质细胞丢失并恢复其正常功能,抑制炎症过度激活有望成为抑郁症治疗和药物研发的新方向和新策略。
基础研究也显示当机体受到外界过度刺激时,外周免疫细胞、单核细胞会过度释放炎症因子,而在炎性环境下血脑屏障的通透性显著增加,外周炎症因子则会透过血脑屏障进入脑内,促使脑内产生过度的炎性反应[15]。此外,外周炎症因子、趋化因子以及色氨酸代谢产物也会激活脑内胶质细胞,加剧神经炎性反应。炎症因子对单胺类神经递质代谢、谷氨酸代谢及神经毒性、突触可塑性、下丘脑-垂体-肾上腺轴(hypothalamic pituitary adrenal axis,HPA)的兴奋性均产生影响[16,17]。因此,试图通过抑制神经炎症的过度激活改善抑郁症状有一定理论基础。细胞焦亡(pyroptosis)是近年发现并被证实由Gasdermin家族蛋白介导的调节性细胞死亡形式,也是一种炎性细胞死亡形式。不同的蛋白酶或者颗粒酶介导了Gasdermin家族蛋白的剪切,使其释放N末端结构域,随后转运到细胞膜上形成焦亡小孔,由此引起细胞膜通透性改变、细胞肿胀和细胞膜破裂,释放胞内炎性物质[18,19],介导焦亡的发生发展。
世界卫生组织调查结果显示,抑郁症女性患者平均发病率远高于男性平均发病率,且女性抑郁症主要发生在围绝经期和月经周期的低雌激素阶段,目前各个医学领域也普遍认为雌激素与抑郁症密切相关,因此本研究为避免雌激素干扰实验结果,选用雄性小鼠建立CMS模型[20,21]。本研究结果表明,模型组旷场总路线相较于对照组显著缩短,给予艾司西酞普兰及有氧运动治疗至第10周,旷场总路线显著增多,说明艾司西酞普兰联合有氧运动可显著改善模型组小鼠焦虑抑郁样行为。与对照组相比,模型组小鼠促炎因子水平显著升高,海马脑区星形胶质细胞显著丢失,焦亡相关蛋白表达水平增加,给予艾司西酞普兰及有氧运动治疗至第10周,显著改善模型组小鼠促炎因子水平、焦亡相关蛋白表达。提示模型组小鼠外周血促炎因子水平增加以及海马脑区星形胶质细胞的丢失可能与星形胶质细胞焦亡相关,给予艾司西酞普兰及有氧运动治疗后缓解模型组小鼠外周炎症因子水平及海马脑区细胞焦亡。其中,艾司西酞普兰联合有氧运动治疗组与艾司西酞普兰单用组相比,TST、FST不动时间减少,外周血促炎因子降低,海马脑区GFAP表达增加、焦亡相关蛋白表达减少,但结果无统计学差异,分析其原因一可能与样本量较少有关,原因二可能与联合治疗组小鼠运动时间略短有关。牛磺酸是一类含硫氨基酸,可维持内环境稳态,具有神经营养和神经保护作用,可促进大脑发育,增强记忆[22,23]。本研究表明,模型组小鼠海马脑区牛磺酸水平显著增加,可能是应激作用下机体的代偿作用。在哺乳动物的中枢神经系统中γ-氨基丁酸是一种天然存在的非蛋白质氨基酸,也是一种抑制性的神经递质,具有镇静、抗焦虑、增强记忆以及改善睡眠的作用,对抑郁、失眠、自主神经失调等疾病均具有保护作用[24,25]。本研究中模型组小鼠海马脑区γ-氨基丁酸水平显著降低,小鼠抑郁样症状增加,也与报道相符,给予艾司西酞普兰及有氧运动治疗后,上述变化显著改善。艾司西酞普兰结合有氧运动可能通过调节牛磺酸及γ-氨基丁酸水平,减少神经毒性,促进神经再生,从而通过神经保护发挥抗抑郁作用,其机制需进一步探究。
综上所述,艾司西酞普兰联合有氧运动对抑郁小鼠焦虑行为的治疗效果优于艾司西酞普兰单独治疗组,其机制可能是通过抑制外周促炎因子水平及星形胶质细胞焦亡,调节体内氨基酸水平缓解神经炎症,该研究进一步充实了神经炎症假说,为下一步临床治疗提供基础实验依据。
