利用斑马鱼模型与代谢组学技术研究瓦他拉尼抑制血管生成的作用及其机制
2021-02-10吴晓敏陈善军刘拥军杨官娥韩利文
吴晓敏,董 榕,陈善军,刘拥军,杨官娥,韩利文*
(1山东第一医科大学,山东省医学科学院药学与制药科学学院药物分析教研室,济南 256200;2晋中市第二人民医院药剂科;3山西医科大学药学院中药教研室;*通讯作者,E-mail:hanliwen08@126.com;#共同通讯作者,E-mail:yangguane08@aliyun.com)
血管生成与肿瘤的发生发展密切相关。1971年Folkman首次提出“饿死”肿瘤疗法,该疗法主要通过阻断血管生成,抑制肿瘤营养、能量的供应等方式,最终实现“饿死”肿瘤的目的。抗血管生成是饥饿疗法最重要的作用方式,以肿瘤血管为靶点,抑制血管生成或破坏血管,阻断血管的营养通路[1]。瓦他拉尼(vatalanib)是由诺华和先灵公司共同开发的酪氨酸激酶小分子抑制剂,为血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)和血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)双靶点抑制剂,通过抑制血管生成而发挥抗癌作用,口服用于结肠癌、直肠癌、乳腺癌、脑肿瘤和肾癌的临床治疗。研究显示,瓦他拉尼直接作用于VEGF受体的ATP结合位点,此外,还可抑制上皮细胞的迁移和增殖[2,3]。近10年来,抗肿瘤靶向血管的药物不断涌现,但是在临床的综合疗效并未达到人们预期,提示对该类制剂作用机制的了解并不全面,有必要进行深入研究。
在肿瘤发生过程中,新生的血管与肿瘤组织伴行,无法独立研究。斑马鱼是目前理想的用于研究血管形成的整体实验动物模型,不受肿瘤组织干扰。本实验采用绿色荧光蛋白GFP标记血管内皮因子Ⅱ型受体的转基因斑马鱼品系,能够在荧光镜下清楚地观察到斑马鱼的血管形成过程[4-6]。斑马鱼的血管由内皮细胞芽生而产生新的微血管,直至形成血管网,可以从整体水平上观察血管自胚胎到成熟个体的完整发育过程,还可以从代谢物水平探讨影响血管生成的机制[7,8]。
代谢组学作为后基因时代的一种全新的组学技术,利用高分离效率、高灵敏度及极低检测限的仪器,以生物体内低分子量物质的动态规律变化来表征生物体的生理病理变化趋势,最终通过还原相关联事件,揭示生物体的病理生理变化趋势和机制[9-12]。本研究采用代谢组学技术探讨瓦他拉尼抑制斑马鱼血管生成引起的内源性小分子代谢物的变化,为深入了解瓦他拉尼抑制肿瘤的机制提供实验依据。
1 材料与方法
1.1 实验材料
1.1.1 转基因斑马鱼 Tg(VEGFR2:GFP)系转基因斑马鱼,山东省科学院生物研究所提供。
1.1.2 主要仪器与试剂 Agilent 7890A-5975C型气质联用仪、Scientz UW3100型组织细胞破碎仪、Eppendorf SC18型G低温台式离心机、Stuart SBH200D/3型氮吹型样品浓缩仪、奥林巴斯SZX16荧光显微镜。链霉蛋白酶Pronase E,活性≥7 000 U/g,由Solarbio公司提供。瓦他拉尼(1-(4-氯苯胺基)-4-(4-甲基吡啶基)-2,3-二氮杂萘琥珀酸盐),购自Sigma公司,含量为98.3%。
1.1.3 数据分析软件 Agilent GC-MSD ChemStation工作站、SIMCA-P 18.0、SPSS 25.0统计软件、XCMS、R分析软件。
1.2 实验方法

1.2.2 斑马鱼代谢物的提取 将斑马鱼胚胎转移至1.5 ml EP管中,纯净水洗涤3次,吸尽水分。加入磷酸盐缓冲液(phosphate buffered saline, PBS)130 μl提取,研珠破碎,超声10 min,4 000 r/min离心10 min,取上清液100 μl,加入400 μl乙腈,涡旋混合30 s,静置15 min;15 000 r/min,4 ℃离心5 min,取上清液400 μl备用。
1.2.3 斑马鱼代谢物的衍生化 将提取液400 μl用氮吹仪吹干,加入甲氧胺吡啶溶液(10 mg/ml)50 μl,于70 ℃恒温箱中反应1 h,加入BSTFA(含1%TMCS)50 μl,涡旋混合30 s,70 ℃水浴30 min,加入正庚烷150 μl,吸取上清液200 μl,用于GC-MS分析。
1.2.4 GC-MS分析 使用Agilent 7890A-5975C型气质联用仪对斑马鱼代谢物样本进行分析,程序升温条件:初始柱温70 ℃,保留5 min,以10 ℃/min升温至100 ℃,保留12 min,再以5 ℃/min升温至180 ℃,保留6 min,最后以5 ℃/min升温至300 ℃,保留5 min。
1.2.5 数据处理 数据预处理:将所要分析的GC-MS源数据导入GC/MSD ChemStation工作站,转换为CDF格式,之后导入XCMS软件中进行峰对齐。软件设置参数:full width at half-maximum: fwhm=4;S/N cutoff value: snthresh=10,max=20,group(bw=10),将软件所生成txt文件导入Excel软件中进行数据处理,得到一个包含丰度、保留时间、质核比的三维矩阵化合物数据表。
多元统计分析:将所得数据矩阵导入SIMCA-P 18.0软件建模,进行主成分(PCA)分析及偏最小二乘法-模式判别(PLS-DA)分析,观察斑马鱼的节间血管被抑制以及恢复后代谢轮廓的变化。然后通过S-Plot图远端离散数据点、变量权重(variable importance, VIP)>1、P<0.05、变量的CIJFJK值不跨越0等4个条件综合筛选组间差异相关的潜在生物标志物。
1.2.6 差异代谢物的鉴定 实验中为了更好地确认未知峰的化合物名称,采用标准品进行指认,以保证化合物确认的准确性。将标准品配置好后按照斑马鱼样本处理方法处理,使用气质联用仪对标准品混合物进行分析,将标准品的图谱同美国国家标准技术研究院(NIST)库进行数据比对,找出标准品的质谱碎片以及色谱图的保留时间。
2 结果
2.1 瓦他拉尼对斑马鱼节间血管生成的影响
结果显示随着发育时间的延长,斑马鱼节间血管的长度逐渐变长,因此,比较药物对斑马鱼血管的抑制作用只能通过和同一发育时间的对照组比较。当斑马鱼发育至24 hpf时,躯干部的体节间血管开始发育。加入瓦塔拉尼处理12 h后,斑马鱼的节间血管受到明显抑制。去除瓦塔拉尼药液后,继续在正常的培养水中孵育至72 hpf,斑马鱼的节间血管逐渐得到恢复(见图1)。

图1 瓦他拉尼处理后斑马鱼节间血管的随时间的生长情况Figure 1 Development of ISVs in zebrafish after vatalanib treatment
在所有实验组进行至72 hpf时,瓦他拉尼处理过的斑马鱼节间血管总长度明显缩短(见图2),与对照组的节间血管的长度相比差异有统计学意义(P<0.01)。先用瓦塔拉尼处理斑马鱼12 h然后移除药物培养至72 hpf,斑马鱼的节间血管长度与瓦塔拉尼组相比也体现了显著性差异(P<0.01),说明瓦塔拉尼抑制的血管得到了明显的恢复。
2.2 代谢组学分析
首先使用代谢组学PCA法对三组数据进行分析,发现瓦他拉尼组与对照组、恢复组在PCA分析中呈现离散的趋势,但恢复组与空白对照组不能完全区分。进一步通过PLS-DA法发现斑马鱼对照组、瓦他拉尼组与恢复组可以明显区分(见图3A)。通过7次模型交叉验证,发现模型Q2,R2的值符合要求,模型没有过拟合(见图3B)。从图3中看出瓦他拉尼组、对照组、恢复组有明显的离散趋势,并且R2X=0.832,R2Y=0.984,Q2Y=0.864,分别表示模型概括X矩阵的解释率为83.2%,模型的稳定性为98.4%,模型的预测性为86.4%。结果显示斑马鱼节间血管恢复组比较靠近对照组,且由对照组到瓦他拉尼组再到恢复组的夹角呈现锐角,显示了瓦他拉尼对血管生成的抑制、再转归的代谢轮廓变化特征。
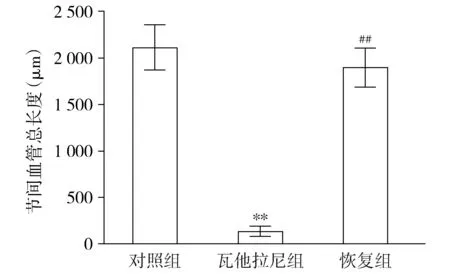
与对照组比,**P<0.01;与瓦他拉尼组比较,##P<0.01图2 瓦塔拉尼处理后斑马鱼至72 hpf节间血管的抑制及恢复情况Figure 2 Inhibition and recovery of ISVs in zebrafish at 72 hpf after vatalanib treatment
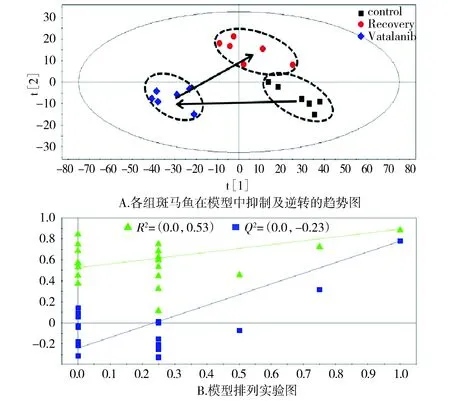
图3 PLS-DA模型分析结果Figure 3 Analytical results of PLS-DA model
2.3 差异代谢物分析
VIP值是PLS-DA监督性分析方法中评价变量贡献大小的常用方法,一般选择VIP>1的变量。本实验依据VIP值筛选到232个成分离子符合条件。图4A展示了前130个成分离子的VIP值,绿色变量表示其CIJFJK值跨越了0值,不符合实验予以进行剔除。
PLS-DA模型的Loading载荷图结果显示,大部分的样品成分离子集中在坐标轴原点附近,少数成分离子散落在离原点较远的位置,因此根据距离原点的距离,选取较远的167个成分离子作为潜在的生物标志物(见图4B)。
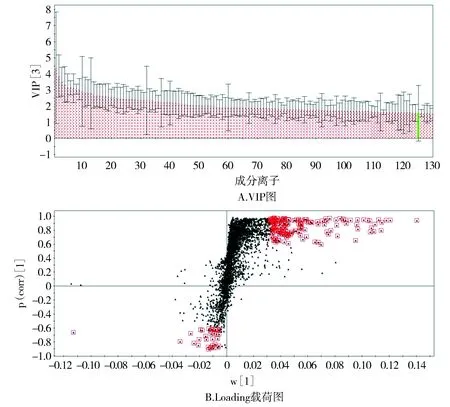
图4 斑马鱼样本差异代谢物的筛选结果Figure 4 Screening results of target metabolites in zebrafish samples
综合同时符合VIP值及远端离散点两个条件的成分离子,进行P值计算,根据P<0.05的条件,进一步筛选符合条件的成分离子。然后通过成分离子碎片与对照品比对、NIST数据库检索等方式,鉴定出对应的代谢物结构。本研究发现丙酮酸、缬氨酸、亮氨酸、异亮氨酸、甘油、磷酸、丝氨酸、脯氨酸、葡萄糖、天冬氨酸、苯丙氨酸、丙氨酸、酪氨酸、棕榈酸、硬脂酸、胆固醇16种代谢物同时与血管生成的抑制和恢复有关(见表1),推测这些代谢物可能为与血管生成相关的内源性生物标志物,这些代谢物涉及到糖酵解、氨基酸酸代谢、糖代谢、脂质代谢等多个生物学过程。
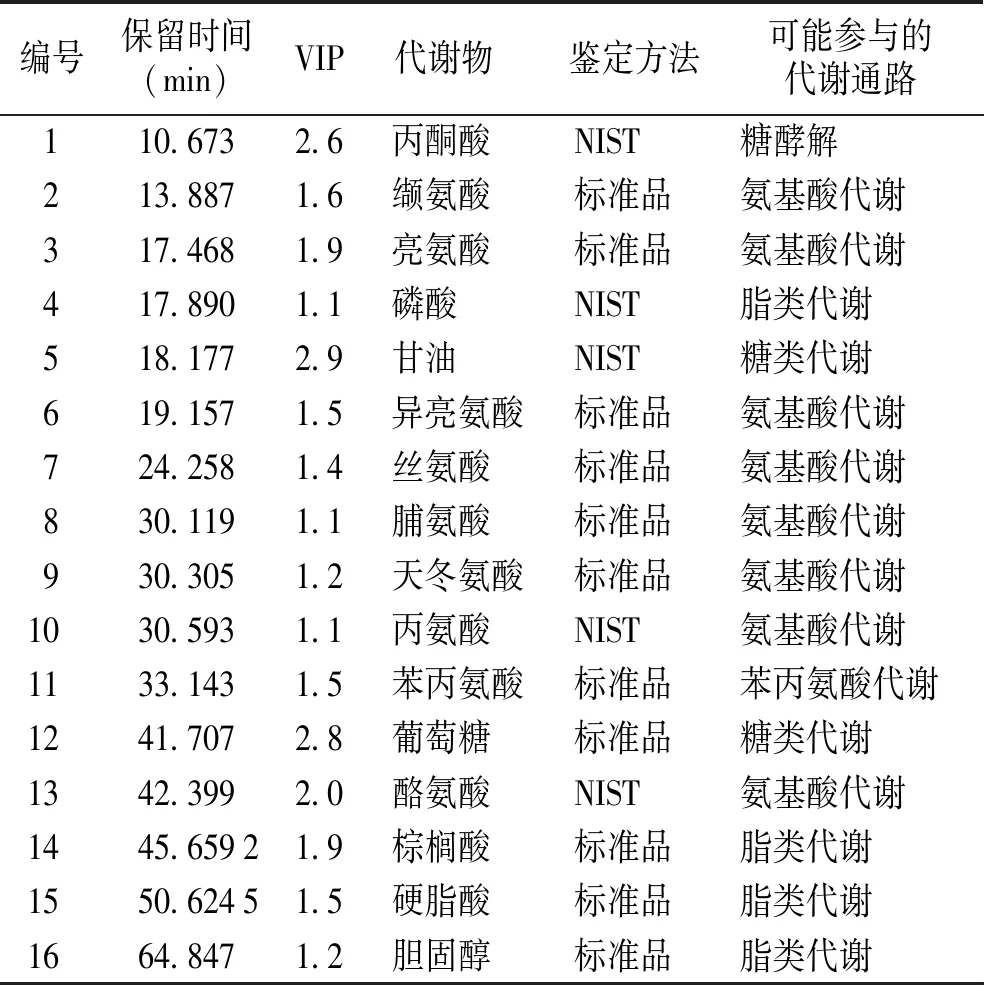
表1 斑马鱼血管生成可能相关的生物标志物Table 1 Possible biomarkers related to angiogenesis in zebrafish
3 讨论
瓦他拉尼通过抑制血管内皮生长因子受体(VEGFR),使肿瘤组织中的血管生成受到抑制,细胞缺少氧气及营养成分,从而抑制肿瘤的生长[13]。而VEGFR-2是血管内皮生长因子信号调节血管生成的主要受体。目前,关于瓦他拉尼抑制血管生成机制的报道相对较少。Neves等[14]研究发现NOXS和抗氧化酶是瓦他拉尼导致血管功能障碍的新靶点。韩利文等[15]研究发现瓦他拉尼抑制血管生成可能与缬氨酸-亮氨酸-异亮氨酸生物合成途径、苯丙氨酸-酪氨酸-色氨酸合成途径、苯丙氨酸代谢、甘氨酸-天冬氨酸-谷氨酰胺代谢、磷酸肌醇代谢途径有关。
本研究结果显示,瓦他拉尼抑制斑马鱼血管生成过程可能与糖酵解、脂类代谢、氨基酸代谢有关。葡萄糖、丙酮酸作为糖酵解的代谢产物,提示瓦他拉尼抑制斑马鱼血管生成可能与糖酵解代谢途径有关。血管生成受到阻碍后,营养和氧气无法供应周围组织的生长需要,周围组织处于低氧、缺血环境中。为了适应低氧微环境,血管区糖酵解增加。已有的研究证实,肿瘤细胞中也存在糖酵解作用,即所称的Warburg效应(Warburg effect)[16]。即肿瘤细胞获得ATP的方式发生明显改变,即使氧气供应充足,有氧氧化也会减弱,而糖酵解则增强。从肿瘤与血管生成的对应关系,该说法也暗示血管生成被抑制后会造成糖酵解作用增强[17]。
另外,棕榈酸、硬脂酸作为花生四烯酸合成的原料,硬脂酸、棕榈酸水平降低,提示斑马鱼体内血管生成被抑制可能与花生四烯酸有关。花生四烯酸是维持细胞膜结构和功能所必需,其在环氧酶和前列环素合成酶效用下,合成前列环素(PGI2),参与机体炎症反应[18]。赵敏等[19]研究大鼠血管损伤实验炎性机制研究表明,血管损伤与炎性状态具有相关性,血管生成障碍后,检测到体内炎症因子TNF-α和IL-6表达水平升高,暗示介导炎症的花生四烯酸含量升高,合成原料棕榈酸、硬脂酸含量降低。血管生成被抑制时,胆固醇含量下调。血管生成恢复后,胆固醇含量升高,提示血管生成作用与胆固醇相关。卢志顺等[20]利用人内皮静脉细胞研究胆固醇对血管损伤的作用,结果显示胆固醇可以增加血管内皮细胞膜的通透性,对细胞造成了损伤。因此,瓦他拉尼抑制斑马鱼血管生成可能与体内花生四烯酸、胆固醇的合成通路相关,与体内的脂代谢途径有关。

综上,采用斑马鱼模型研究血管生成作用具有明显优势。常规的动物模型肿瘤和血管生成是同时存在的,而斑马鱼的血管生成模型,能够把血管生成独立出来研究,无须考虑肿瘤等其他因素的干扰。本实验中采用血管自行恢复的方法,避免了药物恢复血管带来的体内内源性代谢物的变化,在一定程度上从内源性代谢网络角度揭示了瓦他拉尼抑制血管的分子机制,也为同类的靶向抗肿瘤药研发提供一定的借鉴意义。
致谢:特别感谢山东省科学院生物研究所为本研究提供斑马鱼资源及实验条件。
