代谢组学揭示水稻—稻瘿蚊互作的潜在生化标识物
2021-02-09陈灿张宗琼夏秀忠杨行海农保选张晓丽徐志健李丹婷郭辉冯锐
陈灿 张宗琼 夏秀忠 杨行海 农保选 张晓丽 徐志健 李丹婷 郭辉 冯锐


摘要:【目的】篩选稻瘿蚊(RGM)侵染下抗、感水稻材料差异代谢物,揭示水稻抗虫靶标化合物,为解析植物与昆虫互作关系及水稻害虫绿色防控提供理论依据。【方法】分别对抗RGM水稻材料GXM-001-2和易感RGM水稻材料TN1进行RGM接虫胁迫,接虫后48 h利用液相色谱—质谱联用仪(LC-MS)对RGM侵染及未侵染抗、感水稻材料的代谢物进行化学成分分析。【结果】RGM侵染下抗、感水稻材料的差异代谢物分析显示,LC-MS共检测到330种代谢物,其中155种为已知代谢物;被RGM侵染后,GXM-001-2中上调代谢物种类远少于其下调代谢物种类,也远少于TN1中的上调代谢物种类。RGM侵染下水稻潜在生化标识物种类分析表明,差异代谢物分为抗性特性(n=16)、易感特性(n=16)、侵染特性(n=7)和宿主特性(n=3)等4类。生化标识物及差异倍数分析表明,抗性特性物包括1-氨基环丙烷羧酸、3-磷酸甘油酸和二十烷酸等物质,其中6-甲基维生素D、谷氨酸、叶绿醇和酪氨酸等物质上调表达;易感特性物包括2-己酮酸、3-苯基乳酸和6-羟基己酸等物质,其中6-羟基己酸、葡萄糖和白皮杉醇等7种物质下调表达;侵染特性物包括γ-氨基丁酸、半乳糖酸和丙醇二酸等物质,其中腺嘌呤、尿苷、丙醇二酸和γ-氨基丁酸在抗、感材料中变化趋势一致;宿主特性物包括异亮氨酸、十六烷酸和环亮氨酸,前2种物质在GXM-001-2中显著高于TN1(P<0.05)。【结论】RGM侵染后从抗、感水稻材料中筛选到抗性特性物、易感特性物、侵染特性物和宿主特性物,其中脂肪酸及其衍生物(十六烷酸、二十烷酸、十四烷酸和β-羟基十四烷酸)、氨基酸(谷氨酸、酪氨酸、苯丙氨酸和γ-氨基丁酸)、酚类(阿魏酸)、萜类(叶绿醇)和胺类(乙酰苯胺、苄胺和乳酰胺)可能在植物抗虫防御反应中发挥重要作用,是RGM侵染水稻最重要的潜在生化标识物。
关键词:水稻;稻瘿蚊;代谢组;生化标识物;抗虫
中图分类号:S511 文献标志码: A 文章编号:2095-1191(2021)10-2662-09
Abstract:【Objective】 To detect differential levels of metabolites between rice gall midge (RGM)-resistant and -susceptible rice materials to provide a theoretical basis for analyzing rice-RGM interaction and assist in the development of green controls of RGM in rice. 【Method】 GXM-001-2 (high resistance) and TN1 (high susceptibility) were inoculated with RGM and liquid chromatography-mass spectrometry was employed to detect changes in metabolite levels after 48 h. 【Result】 330 metabolites were detected, of which 155 were known metabolites. TN1 displayed a much higher number of up-regulated metabolites after RGM infection than in GXM-001-2, where metabolites were largely down-regulated. The analysis of potential biochemical markers of rice infected by RGM showed that differentially regulated metabolites could be classified into four categories associated with resistance (n=16), susceptibility (n=16), infection (n=7) and host chara-cteristics (n=3). Biochemical markers and fold change analysis showed that the resistance category included 1-aminocyclopropanicarboxylic acid, 3-phosphoglyceric acid, eicosanoic acid, 6-methylvitamin D, glutamic acid, phyllol and tyrosine of which, the latter 4 were upregulated. Compounds associated with susceptibility included 2-hexketoic acid, 3-phenyllactic acid, 6-hydroxy hexanoic acid and other substances, of which 7 substances, including 6-hydroxy hexanoic acid, glucose and piceatannol, were downregulated. The characteristic compounds of infection included 4-aminobutyric acid, galactoic acid, propanedioic acid and adenine, uridine, propanedioic acid, and γ-aminobutyric acid showed similar up or down trends in GXM-001-2 and TN1. The host characteristic substances consisted of isoleucine, hexadecanoic acid and cycloleucine, with the former two substances at significantly higher levels in GXM-001-2 relative to TN1 (P<0.05). 【Conclusion】 Under rice RGM condition, 16, 16, 7 and 3 metabolites associated with resistance, susceptibility, infection and host characteristics, respectively, were selected. Of these, fatty acids and their derivatives (hexadecanoic acid, eicosanoic acid, tetradecanoic acid and β-hydroxytetradecanoic acid), amino acids (glutamic acid, tyrosine, phenylalanine and g-aminobutyric acid), phenolic acids (ferulic acid), terpenoids (phyllol) and amines (acetanilide, benzylamine and lactamide) are the most important potential biomarkers of RGM infection, which could play important roles in plant insect defense responses.
Key words: rice; Orseolia oryzae; metabolic group; biomarkers; insect resistant
Foundation item: Regional Scince Foundation Project of National Natural Science Foundation of China (31560385); Guangxi Science and Technology Project (Guike AB16380138, Guike AD18281067); Guangxi Natural Science Foundation (2018GXNSFAA138015)
0 引言
【研究意義】稻瘿蚊(Orseolia oryzae)(RGM)是一种为自身利益而专门操纵水稻生长、代谢和防御途径的昆虫,其以水稻植株顶端分生组织为食,并将易感宿主的分蘖转化为一种管状的虫瘿,称为“标葱”,导致水稻成穗失败,造成经济损失(Agarrwal et al., 2014)。有研究表明,植物某些代谢物质会对害虫产生特异性毒性或震慑作用,如酚类、萜类和生物碱等物质,利用此类物质研制新型害虫化学防控药剂,可限制或减少传统农药在农田的大量使用。稻瘿蚊在水稻上的侵害引发相容或不相容的相互作用,分别导致取食幼虫的生存或死亡。在不相容的相互作用中,植物化感物质/防御分子的产生,使得幼虫无法继续取食宿主,从而引发幼虫死亡(Sinha et al., 2015)。因此,揭示植物被昆虫侵染下的化学物质(生化标识物),对植物、植物昆虫互作及植物害虫防控研究均具有重要意义。【前人研究进展】植物被草食昆虫取食后会产生大量可变代谢物,包括积累抗毒素和释放挥发性信号,参与组成防御和诱导防御草食昆虫。近年来,代谢组学已成为化学生态学的一种补充方法,在探索环境—基因互作、突变体特征、表型、生化标识物鉴定和药物研发等方面发挥着重要作用(Razzaq et al., 2019)。关于利用代谢组筛选、鉴定与草食昆虫胁迫下植物抗性或易感相关的代谢物已有大量相关研究报道。Marti等(2013)利用代谢组学研究斜纹夜蛾诱导下玉米叶片和根的抗性和易感代谢产物,结果表明,叶片侵染导致1,3-苯并恶嗪-4-酮、磷脂、N-羟基肉桂酰胺、壬二酸和色氨酸显著增加;根侵染导致维管液和根分泌物中1,3-苯并恶嗪-4-酮增加。以上研究说明草食动物的攻击导致代谢产物的诱导,这些在叶子和根中的代谢产物对草食动物的抗性有截然不同的影响。Eloh等(2016)采用气相色谱—质谱联用仪(GC-MS)分析方法对根结线虫(RKN)侵染番茄的特征代谢产物和生化标识物进行鉴定,结果表明,在RKN刺激下,番茄叶片中β-丙氨酸、苯丙氨酸和二糖被诱导产生,而核糖、甘油、肉豆蔻酸和软脂酸则减少;番茄茎中代谢物核糖、蔗糖、果糖和葡萄糖上调,延胡索酸和甘氨酸下调。Undas等(2018)利用代谢组学技术鉴定抗啤酒花蚜虫抗性标记,结果表明,蚜虫饲养诱导所有啤酒花基因型代谢组的变化,特别是氧化化合物数量增加,表明该类物质可能是抗性机制的一部分,此外啤酒花香气和味道(倍半萜烯)可能在抵抗蚜虫中发挥作用。Papazian等(2019)研究发现,毛虫可诱导黑芥菜中三羧酸(TCAs)、硫代葡萄糖苷(GSLs)和苯丙酸(PPs)的积累,同时还诱导烯丙基-GSL(黑素苷)等防御化合物。在利用代谢组研究食草动物取食水稻代谢物方面也有相关报道。Agarrawl等(2014)利用基于代谢谱的GC-MS分析揭示水稻—瘿蚊相互作用中的生化标识物,从代谢物中筛选到4类生化标识物,分别是抗性特性(n=16)、易感特性(n=2)、侵染特性(n=6)和宿主特性(n=6)。Agarrawl等(2016)分析了籼稻品种RP2068-18-3-5被RGM侵染后的代谢组变化,结果显示,过敏反应中脂质过氧化代谢标识物壬二酸积累。Peng等(2016)对褐飞虱(BPH)侵染下水稻叶鞘代谢组进行分析,认为BPH侵染增强了易感材料TN1的脂肪酸氧化、乙醛酸循环、糖异生和γ-氨基丁酸分流,以及抗性材料YHY15的糖酵解和莽草酸途径。Liu等(2017)研究认为,二化螟取食水稻可激活水稻植株体内与防御相关的植物激素、转录因子、莽草素介导的次生代谢和萜类化合物相关的次生代谢,而抑制生长相关的次生代谢。Uawisetwathana等(2019)研究了感BPH品种和抗BPH品种在BPH侵害过程中不同的代谢响应模式,结果表明,BPH侵害抗虫品种1 d后,沙夫图甙(1.8倍)、异沙夫图甙(1.7倍)、野漆树甙(3.4倍)和芹菜素6-C-α-L-阿拉伯糖苷-8-C-β-L-阿拉伯糖苷(1.6倍)含量均显著增加。Wang等(2020a)研究结果表明,妊娠白背飞虱(WBPH)雌虫侵染水稻后,水稻中茉莉酸(JA)、茉莉酸—异亮氨酸(JA-Ile)和H2O2水平显著升高,乙烯水平显著降低;测试的12种酚酰胺(PAs)中的11种随后升高。【本研究切入点】目前,有关RGM诱导下水稻代谢物分析在国外仅有少量报道(Agarrwal et al., 2014, 2016),而国内鲜有报道。【拟解决的关键问题】利用液相色谱—质谱联用仪(LC-MS)对RGM侵染下抗、感水稻材料的代谢物进行化学成分分析, 通过差异化合物的筛选,揭示水稻抗虫靶标化合物,为解析植物与昆虫互作关系及水稻害虫绿色防控提供理论依据。
1 材料与方法
1. 1 试验材料
供试材料为对RGM表现不同抗性级别的2份水稻材料:易感材料(TN1)和抗性材料(GXM-001-2)。其中,TN1为苗期RGM鉴定的感虫对照,GXM-001-2为广西地方品种江潮后代分离株系,对RGM的抗性为高抗(郭辉等, 2017)(表1)。
1. 2 材料种植及处理
将供试种子浸种催芽后播种到已装好淤泥的40 cm×50 cm铝制托盘中,每份材料播6行,每行约20粒,每份材料各2盘,1盘接虫、1盘不接虫(对照)。水稻幼苗在温室生长2周后开始接虫,放入雌蚊(n=30)和雄蚊(n=12)成虫,然后喷雾保湿48 h(相对湿度>90%),以利于卵孵化和幼虫生长。接虫48 h后,剪取幼苗主茎(接近顶端分生组织)植物组织(约1 cm)进行解剖,观察幼虫是否已到达并开始觅食,然后开始取样,只取幼苗主茎(接近顶端分生组织)植物组织(约1 cm),每10株为1个重复;以未侵染植株相应部位组织为对照。剪取的组织立即冷冻在液氮中,于-80 ℃保存備用。GXM-001-2-0和TN1-0为未接虫材料,GXM-001-2-48和TN1-48为接虫48 h后材料(以下GXM-001-2-0和TN1-0分别命名为R0、S0;GXM-001-48和TN1-48分别命名为R48、S48)。
1. 3 稻株代谢物含量测定
代谢物提取:(1)在1000 μL含有内标(1000∶2)的提取液中加入50 mg样本(甲醇∶乙腈∶水=2∶2∶1,内标浓度2 mg/L),涡旋混匀30 s;(2)加入瓷珠,45 Hz研磨仪处理10 min,超声10 min;(3)-20 ℃静置1 h,12000 r/min(设置4 ℃)离心15 min;(4)吸出500 μL上清于EP管中,在真空浓缩器中干燥提取物;(5)加入160 μL提取液(乙腈∶水=1∶1)复溶,涡旋30 s,冰水浴超声10 min;(6)12000 r/min离心15 min,取120 μL上清于2 mL进样瓶,每个样本各取10 μL混合成质控样本上机检测。
质谱条件:质谱仪为沃特世Xevo G2-XS QTof。色谱柱为Acquity UPLC HSS T3 1.8 μm 2.1 mm×100 mm。在采集软件(MassLynx V4.2,Waters)控制下的MSe模式进行一级和二级质谱数据采集。在每个数据采集循环中,能同时对低碰撞能量及高碰撞能量进行双通道数据采集。低碰撞能量2 V,高碰撞能量区间为10~40 V,扫描频率为0.2 s/张质谱图。ESI离子源参数:毛细管电压2000 V(正离子模式)或-1500 V(负离子模式);锥孔电压30 V;离子源温度150 ℃;脱溶剂气温度500 ℃;反吹气流速50 L/h;脱溶剂气流速800 L/h。
1. 4 数据处理与分析
采用内标归一化处理,进行主成分分析(PCA)和正交偏最小二乘法—判别分析(OPLS-DA)。运用差异倍数(Fold change, FC)、t检验的P值和OPLS-DA模型的变量重要性投影(Variable importancein project,VIP)相结合的方法筛选差异代谢物,筛选的标准为FC>1、P<0.05和VIP>1。
2 结果与分析
2. 1 RGM侵染下抗、感水稻材料的差异代谢物分析
利用LC-MS对RGM侵染下的GXM-001-2和TN1进行代谢物分析,结果共检测到330种代谢物(部分样品总离子图见图1),其中155种为已知代谢物。在检测到的330种代谢物中,R48与R0的差异代谢物有153种,与R0相比,R48上调代谢物20种,下调代谢物133种;S48与S0的差异代谢物有143种,与S0相比,S48上调代谢物111种,下调代谢物32种。对于检测到的155种已知代谢物,R48与R0的差异代谢物有71种,与R0相比,R48上调代谢物8种,下调代谢物63种;S48与S0的差异代谢物有74种,与S0相比,S48上调代谢物55种,下调代谢物19种(表2)。
由表2可看出,被RGM侵染后,抗性材料上调代谢物种类远少于下调代谢物种类,而易感材料恰好相反,即上调代谢物种类远多于下调代谢物种类;同时,抗性材料上调代谢物种类远少于易感材料上调代谢物种类,说明易感材料需要上调更多的代谢物来应对害虫胁迫。
2. 2 RGM侵染下水稻潜在生化标识物种类
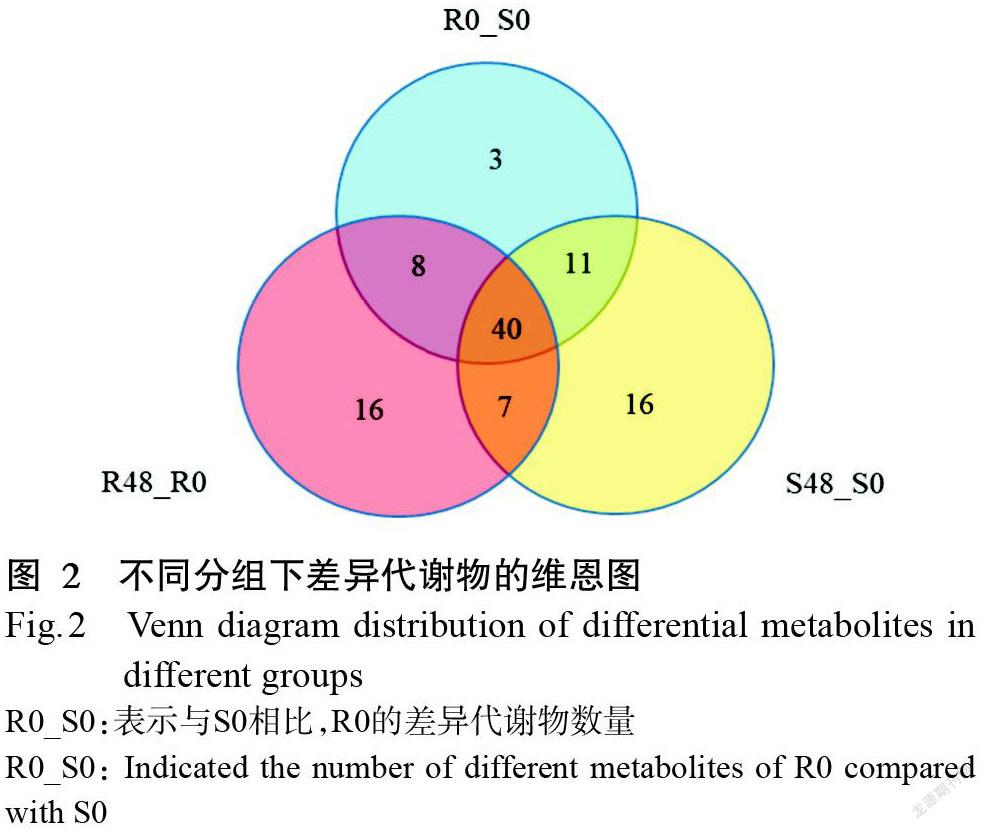
为便于后续分析,本研究仅对155种已知代谢物开展水稻—稻瘿蚊互作的潜在生化标识物筛选。从图2可看出,已知代谢物分为抗性特性(n=16)、易感特性(n=16)、侵染特性(n=7)和宿主特性(n=3)(n表示化合物种类数量);但在维恩图中还有3组类别(n=11、40、8)无法对特性进一步分类,因此,这3组类别不作为潜在的生化标识物进行分析。
2. 3 RGM侵染下水稻潜在生化标识物分析
抗性材料的16种代谢产物在未侵染和侵染组织间具有独特而显著的差异(P<0.05,下同),被分类为抗性特性。进一步分析16种抗性特性代谢物在抗性材料的侵染组织与未侵染组织间的差异倍数变化,结果(图3-A)显示,抗性特性物包括酸类(1-氨基环丙烷羧酸、3-磷酸甘油酸、羟基乙酸、谷氨酸、草氨酸、对苯二甲酸和酪氨酸);脂类(二十烷酸、β-羟基十四烷酸和十四烷酸);萜类(叶绿醇);糖类(果糖);酚类(阿魏酸);其他类(羟基脲、6-甲基维生素D和嘌呤核苷)。其中,除6-甲基维生素D、谷氨酸、叶绿醇和酪氨酸上调表达外,其他代谢物均下调表达,且大多数下调代谢物的log2FC值(>0.5)大于上调代谢物的log2FC值,说明这些下调代谢物在抗性材料中变化更剧烈。
易感材料的16种代谢物在未侵染和侵染组织间具有独特而显著的差异,被分类为易感特性。进一步分析16种易感特性代谢物在易感材料的侵染组织与未侵染组织间的差异倍数变化,结果(图3-B)显示,易感特性物包括酸类(2-己酮酸、3-苯基乳酸、6-羟基己酸、氨基氧乙酸、肌酸、L-高丝氨酸、苯丙氨酸、γ-内酯核糖酸、D-酒石酸和反式,反式-己二烯二酸);胺类(乙酰苯胺、苄胺和乳酰胺);糖类(葡萄糖);酚类(白皮杉醇);黄酮类(新橙皮苷)。其中,上调代谢物包括2-己酮酸、3-苯基乳酸、乙酰苯胺等9种;下调代谢物包括6-羟基己酸、葡萄糖和白皮杉醇等7种;除6-羟基己酸和葡萄糖外,其他下调代谢物的log2FC值(<0.5)低于大多数上调代谢物的log2FC值,说明上述上调代谢物在易感材料中变化更剧烈。
抗性和易感材料在侵染组织与未侵染组织间的7种代谢物水平显著不同,被分类为侵染特性。进一步分析7种侵染特性代谢物在抗、感材料的侵染组织与未侵染组织间的差异倍数变化,结果(图3-C)显示,侵染特性物包括酸类(γ-氨基丁酸、threo-β-羟基天冬氨酸和丙醇二酸);糖类(半乳糖酸);核酸类(5,6-二氢尿嘧啶、腺嘌呤和尿苷)。其中,腺嘌呤、尿苷、丙醇二酸和γ-氨基丁酸在侵染后的抗、感材料中变化趋势一致,前2种物质下调表达,后2种物质上调表达;其他侵染特性代谢物如5,6-二氢尿嘧啶、半乳糖酸和threo-β-羟基天冬氨酸在抗性材料中下调表达,而在易感材料中上调表达,说明这3类物质的表达差异很可能是抗、感材料对RGM防御调控的差异所引起。
抗性和易感材料在未侵染组织中代谢物存在组成性的差异,归为宿主特性。进一步分析3种宿主特性代谢物在抗、感材料的未侵染组织间的差异倍数变化,结果(图3-D)显示,宿主特性物包括异亮氨酸、十六烷酸和环亮氨酸,前2种物质在抗性材料中显著高于易感材料,而后1种物质在抗性材料中显著低于易感材料,这3种物质可能与水稻对RGM的组成防御有关。
3 讨论
植物受到害虫侵染后会引起一系列代谢物质变化。本研究发现,在RGM侵染48 h后,易感材料中的上调代谢物质(55种)远多于抗性材料(8种),与Peng等(2016)的研究结果一致,即BPH侵染24或48 h后,TN1(易感材料)上调化合物远多于YHY(抗性材料)。张佳松(2020)对粘虫取食下甘蔗叶片代谢物进行分析,结果表明,取食12和24 h后甘蔗叶片样品中上调的代谢物种数远多于下调的代谢物种数。Wang等(2020b)研究结果表明,明恢63水稻在稻纵卷叶螟侵染1、6、12和24 h后,上调的代谢物种数远多于下调的代谢物种数。以上结果与本研究认为易感材料中的上调代谢物质远多于下调代谢物质的结果相吻合,说明感虫植物需要上调更多的代谢物来防御虫害。
本研究从RGM侵染下的水稻材料中筛选到许多潜在生化标识物,主要包括酸类、糖类、酯类、萜类和胺类等。植物体内的氨基酸既是昆虫生长发育的营养物质来源,也是植物合成防御相关化合物的前体物质。在虫害胁迫后,会引起植物体内氨基酸含量的变化,一部分含量降低,减少植食性昆虫获取;一部分含量增加,促进防御物质合成。本研究发现,RGM侵染后,抗性材料中谷氨酸含量显著增加,与Subramanyam等(2015)研究黑森蝇幼虫(瘿蚊科昆虫)能诱导易感小麦的谷氨酸水平显著升高的结果一致。本研究还发现,RGM侵染后,易感材料中苯丙氨酸含量也显著增加,其他研究者也得到相同结果,如Agarrwal等(2014)研究认为,RGM等诱导抗、感水稻中苯丙氨酸含量上调;Eloh等(2016)研究认为,RKN能诱导番茄中苯丙氨酸含量上调;张佳松(2020)研究结果表明,粘虫取食甘蔗24 h后甘蔗叶片中苯丙氨酸含量显著上调。但本研究发现,RGM侵染后谷氨酸和酪氨酸仅在抗性材料中增加,苯丙氨酸仅在易感材料中增加,说明这些氨基酸在抗、感材料中参与了不同的代谢防御途径。
γ-氨基丁酸是一种重要的四碳非蛋白氨基酸代谢物,在植物对环境胁迫、病原体和昆虫攻击的反应过程中积累(Li et al., 2021)。有研究表明,拟南芥中的γ-氨基丁酸能被机械毛虫Mecworm和真实昆虫(Spodoptera littoralis)的食性伤害引起积累,这很可能代表了对昆虫食草动物的一种普遍的、直接的和系统的防御反应(Scholz et al., 2015)。Agarrwal等(2016)研究认为,寄主水稻RP使用过敏反应(HR)来限制对取食RGM的营养供应,同时积累γ-氨基丁酸,这些策略可能导致RGM死亡。γ-氨基丁酸可通过抑制昆虫神经元传递而对其进行伤害,同时调节被攻击的宿主细胞的超敏反应,这在宿主防御中起到至关重要的作用(Tarkowski et al., 2020)。本研究发现,在RGM侵染后,抗性材料中的γ-氨基丁酸也显著增加,与以上研究结果一致,说明γ-氨基丁酸在水稻对RGM侵染中可能起到重要的防御作用。
糖类是细胞提供能量的主要能源物质。冉伟(2018)研究结果表明,蚜虫为害6 d时,茶树中1-磷酸葡萄糖、6-磷酸葡萄糖和6-磷酸果糖等物质减少。本研究发现,受RGM侵染后葡萄糖(易感材料)和果糖(抗性材料)明显降低,与上述结果一致。本研究还发现,RGM侵染后,半乳糖酸在抗性材料中降低,而在易感材料中增加,说明抗性材料通过降低糖类含量以减少害虫取食,易感材料通过增加糖类含量以诱导害虫取食。有研究表明,感虫茶树在茶尺蠖为害后果糖含量显著上调,果糖作为昆虫真正的能量物质,刺激了茶尺蠖的取食(王伟伟, 2018);RKN会诱导番茄茎代谢物核糖、蔗糖、果糖和葡萄糖上调(Eloh et al., 2016),原因可能与植物自身对昆虫表现抗性或易感有关。
在植物体中,脂肪酸及其衍生物也是重要的能量物质,同时还是细胞膜脂的主要构成成分,在调控基础免疫、系统抗性及诱导抗性等方面具有重要作用(刘文献等, 2014;王利民等, 2020)。α-亚麻酸(LnA)能启动玉米幼苗对昆虫草食动物防御反应,不饱和脂肪酸水平的升高或存在使防御信号系统敏感,从而增强玉米在昆虫草食动物攻击时的防御反应(Li et al., 2016)。本研究鉴定到十六烷酸(宿主特性)、二十烷酸(抗性材料)、十四烷酸(抗性材料)及β-羟基十四烷酸(抗性材料)等差异代谢物,这些物质可能在维持细胞膜的稳定性及抗虫防御中起到一定作用。
酚类物质是植物对草食动物重要的防御化学物质。本研究鉴定到阿魏酸(抗性材料)、白皮杉醇(易感材料)和新橙皮苷(易感材料)等酚类物质。阿魏酸是苯丙烷类途径的中间产物,经过一系列的代谢反应,可生成木质素、黄酮类、生物碱和苯甲酸酯糖苷等次生代谢产物,其对昆虫具有一定的毒害与防御作用。韩宪琪等(2017)研究认为,阿魏酸含量与小麦对玉米象的抗性显著相关。Yang等(2017)研究指出,供试水稻品种阿魏酸含量与其对褐飞虱的抗性高度相关。陈锐等(2020)研究表明,阿魏酸是小麦抗麦红吸浆虫的主要次生物质,能诱导麦红吸浆虫幼虫谷胱甘肽转移酶、羧酸酯酶活性及相关基因的表达。以上研究结果说明,本研究鉴定到的阿魏酸可能在水稻对RGM的抗性中發挥了作用。受害虫侵染胁迫后的植物中阿魏酸含量会显著增加,如B型烟粉虱若虫为害下的烟草(张晓, 2015),苹果小吉丁虫侵染胁迫下的新疆野苹果(梅闯等, 2019),叶蝉取食为害后的感虫茶树(任倩倩, 2020)。本研究认为RGM侵染下抗虫植株中阿魏酸含量显著减少,与上述的结果存在差异,究其原因可能与害虫、寄主植物类型等不同有关。
Sano等(2011)采用體外清除1,1-二苯基-2-苦基肼(DPPH)自由基的方法证实西番莲种子中的白皮杉醇具有强大的抗氧化活性和显著的血管舒张作用。徐丹丹(2018)通过抑制孢子萌发和菌株接种试验证实白皮杉醇能显著降低葡萄果实灰霉病的发病率和发病程度。本研究结果表明,白皮杉醇含量在易感材料中显著下调,但其具体功能尚不清楚。赵小嫚(2019)研究结果表明,黄酮类物质在小绿叶蝉吸食后显著增加,其在茶树响应小绿叶蝉吸食的应激防御方面发挥重要作用。杨金睿和肖关丽(2021)研究结果表明,植物酚类化合物中的黄酮类具有多种作用,能清除自由基,具有抗氧化、抗菌、抗病毒等作用,还可抵御昆虫的危害。本研究结果表明,RGM侵染后,新橙皮苷含量在易感材料中显著上调,可能参与植物抗虫防御反应。
绿叶挥发物是由6个碳(C6)组成的化合物(包括醇、醛和酯),是一类重要的植物挥发物。其可击退或吸引草食动物及其天敌,也可诱导植物防御或增强植物对草食动物和病原体的防御,并对细菌和真菌有直接的毒性作用(Ameye et al., 2018)。叶绿醇(PYT)是一类绿叶挥发物,是长链不饱和无环醇中的一种二萜化合物。PYT能有效驱避WBPH成虫(王璐丰, 2017)、蚜虫(刘陈玮等, 2019)。Saad等(2020)研究表明,PYT对刚果锥虫具有一定的抑制活性,且在缓解宿主相关的细胞损伤方面具有很大的潜力,而贫血的缓解部分是通过抑制唾液酸酶介导。Fujimoto等(2021)研究认为,RKNs接种拟南芥根系可降低植株地上部分PYT含量,而能诱导根中PYT的积累,外源施PYT抑制根系RKN的渗透,但不表现出杀线虫活性。本研究结果表明,PYT含量在抗性材料中显著上调,说明其可能参与水稻对RGM的防御反应。PYT含量在害虫侵染后也会下调,如抗性材料被稻飞虱取食胁迫后,植株体内的PYT含量会减少(陈灿等, 2021)。
生物碱包括有机胺类、吡咯烷类和吡啶类等多种类型,会对昆虫产生毒性,在草食昆虫体内长期积累会影响其生长发育。Subramanyam等(2015)研究认为,被黑毛蝇幼虫攻击后,感虫小麦中多个参与多胺生物合成的基因转录丰度增加,导致游离多胺、腐胺、亚精胺和精胺水平升高。Alamgir等(2016)研究发现,PAs、对香豆酰腐胺和阿草酰腐胺在草食动物攻击水稻后显著上调;在生物测定中,与只吃糖的昆虫相比,饲喂含有对香豆酰腐胺或阿草酰腐胺的15%糖溶液的昆虫死亡率更高;认为PAs是一种快速发展的新型植物防御代谢物,对取食水稻和其他植物的草食动物起到阻止作用。Wang等(2020a)研究发现,WBPH雌虫侵染水稻后,11种PAs显著提高;生物测定表明,4种PAs(N-阿魏酰基腐胺、N-阿魏酰基胺、阿魏酰基胺和N1,N10-异阿魏酰基亚精胺)对新出现的雌成虫具有毒性。本研究认为在RGM侵染后,抗性材料中胺类物质显著上调,与上述研究结果一致,但本研究中这3种胺类物质(乙酰苯胺、苄胺和乳酰胺)是否对RGM产生毒害作用有待进一步生物测定。
4 结论
受RGM侵染后,从抗、感水稻材料中共筛选到16种抗性特性物、16种易感特性物、7种侵染特性物和3种宿主特性物,其中脂肪酸及其衍生物(十六烷酸、二十烷酸、十四烷酸和β-羟基十四烷酸)、氨基酸(谷氨酸、酪氨酸、苯丙氨酸和γ-氨基丁酸)、酚类(阿魏酸)、萜类(叶绿醇)和胺类(乙酰苯胺、苄胺和乳酰胺)可能在植物抗虫防御反应中发挥重要作用,是RGM侵染水稻最重要的潜在生化标识物。
参考文献:
陈灿,张晓丽,刘百龙,秦学毅,郭辉,冯锐. 2021. 稻飞虱诱导下水稻挥发物分析[J]. 南方农业学报, 52(1): 37-44. [Chen C,Zhang X L,Liu B L,Qin X Y,Guo H,Feng R. 2021. Rice volatile components induced by rice planthopper[J]. Journal of Southern Agriculture, 52(1): 37-44.] doi:10.3969/j.issn.2095-1191.2021.01.005.
陈锐,高贺,张国军,朱克岩,成卫宁. 2020. 小麦籽粒次生物质对麦红吸浆虫幼虫解毒酶活性及基因表达的影响[J]. 中国农业科学,53(20):4204-4214. [Chen R, Gao H, Zhang G J, Zhu K Y, Cheng W N. 2020. Effects of secon-dary metabolites in wheat kernels on activities of three detoxifying enzymes and related gene expression in Sitodiplosis mosellena[J]. Scientia Agricultura Sinica, 53(20):4204-4214.] doi:10.3864/j.issn.0578-1752.2020. 20.009.
郭辉,冯锐,陈灿,张晓丽,刘百龙,黄凤宽,邓国富,秦学毅. 2017. 水稻资源GXM-001-2对稻瘿蚊的抗性鉴定与遗传分析[J]. 植物遗传资源学报,18(1):56-60. [Guo H, Feng R, Chen C, Zhang X L, Liu B L, Huang F K, Deng G F, Qin X Y. 2017. Identification and genetic analysis of rice gall midge resistance in rice germplasm GXM-001-2[J]. Journal of Plant Genetic Resources,18(1):56-60.] doi:10.13430/j.cnki.jpgr.2017.01.007.
韩宪琪,李雪娇,冯淑娟,成卫宁,朱克岩. 2017. 小麦籽粒营养物质和次生物质含量与其对玉米象抗性的关系[J]. 植物保护学报,44(5):721-728. [Han X Q, Li X J, Feng S J, Cheng W N, Zhu K Y. 2017. Relationships between the contents of nutrients and secondary metabolites in wheat seeds and their resistance to Sitophilus zeamais (Coleoptera: Curculionidae)[J]. Acta Phytophy-lacica Sinica,44(5):721-728.] doi:10.13802/j.cnki.zwbhxb.2017.2016166.
刘陈玮,张凯鸽,薛欢欢,姜一凡,王海滨,房伟民,管志勇,陈发棣,陈素梅,郑丽. 2019. 北艾和辽东蒿抗蚜性及挥发物成分[J]. 生态学杂志,38(9):2683-2692. [Liu C W, Zhang K G, Xue H H, Jiang Y F, Wang H B, Fang W M, Guan Z Y, Chen F D, Chen S M, Zheng L. 2019. Aphid resistance and volatile organic compounds in Artemisia vulgaris and Artemisia verbenacea[J]. Chinese Journal of Ecology,38(9):2683-2692.] doi:10.13292/j.1000-4890.201909.035.
劉文献,刘志鹏,谢文刚,王彦荣. 2014. 脂肪酸及其衍生物对植物逆境胁迫的响应[J]. 草业科学,31(8):1556-1565. [Liu W X, Liu Z P, Xie W G, Wang Y R. 2014. Responses of fatty acid and its derivatives to stress in plants[J]. Pratacultural Science,31(8):1556-1565.] doi:10.11829\ j.issn.1001-0629.2013-0498.
梅闯,闫鹏,艾沙江·买买提,朱燕飞,马凯,韩立群,王继勋. 2019. 新疆野苹果次生代谢产物对虫害胁迫的响应[J]. 新疆农业科学,56(4):678-684. [Mei C, Yan P, Aisha-jiang M M T, Zhu Y F, Ma K, Han L Q, Wang J X. 2019. Response of secondary metabolites to insect stress in Xinjiang wild apple[J]. Xinjiang Agricultural Sciences,56(4):678-684.] doi:10.6048 /j.issn.1001-4330.2019. 04.010.
冉伟. 2018. 基于代谢组学的蚜虫为害降低茶树对茶尺蠖的抗性机制研究[D]. 北京:中国农业科学院. [Ran W. 2018. Metabolomics mechanisms underlying inhibition of infestatiion by Toxoptera aurantii on defense response of tea plants to Ectropis obliqua[D]. Beijing: Chinese Acade-my of Agricultural Sciences.]
任倩倩. 2020. 抗、感茶树品种对茶小绿叶蝉取食诱导的防御反应[D]. 福州:福建农林大学. [Ren Q Q. 2020. The defense strategies of resistant and susceptible tea cultivars in response to Empoasca onukii feeding[D]. Fuzhou: Fujian Agriculture and Forestry University.]
王利民,符真珠,高杰,董晓宇,张晶,袁欣,蒋卉,王慧娟,李艳敏,师曼,张和臣. 2020. 植物不饱和脂肪酸的生物合成及调控[J]. 基因组学与应用生物学,39(1):254-258. [Wang L M, Fu Z Z, Gao J, Dong X Y, Zhang J, Yuan X, Jiang H, Wang H J, Li Y M, Shi M, Zhang H C. 2020. Molecular mechanism of unsaturated fatty acids synthesis and regulation in plant[J]. Genomics and Applied Biology,39(1):254-258.] doi:10.13417/j.gab.039. 000254.
王璐丰. 2017. SRBSDV诱导水稻挥发物的变化及其对白背飞虱寄主选择行为的影响[D]. 长沙:湖南农业大学. [Wang L F. 2017. The change of volatiles from rice seedlings induced by SRBSDV and their effects on the host selection behavior of Sogatella furcifera[D]. Changsha:Hunan Agriculture University.]
王伟伟. 2018. 茶树对茶尺蠖的抗性评价及其抗性机制研究[D]. 武汉:华中农业大学. [Wang W W. 2018. Resistance evalua-tion and mechanism of Camellia sinensis response to Ec-tropis obliqua[D]. Wuhan: Huazhong Agricultural University.]
徐丹丹. 2018. 植物多酚对两种果实病害的抑制作用及其机理研究[D]. 北京:中国农业大学. [Xu D D. 2018. Effectiveness of plant phenolic compounds on the control of two fruit diseases and its action mechanism[D]. Beijing: China Agricultural University.]
杨金睿,肖关丽. 2021. 植物抗虫生理研究进展[J]. 中国农学通报,37(6):130-136. [Yang J R, Xiao G L. 2021. The insect-resistance physiology of plants: A review[J]. Chinese Agricultural Science Bulletin,37(6):130-136.]
张佳松. 2020. 甘蔗响应黏虫取食的代谢组学分析[D]. 福州:福建农林大学. [Zhang J S. 2020. The metabolomics analysis of sugarcane in response of Oriential armworm mythimna separate feeding[D]. Fuzhou: Fujian Agriculture and Forestry University.]
張晓. 2015. B型烟粉虱特异性诱导的烟草防御物质的筛选及其在防御烟蚜中的作用[D]. 泰安:山东农业大学. [Zhang X. 2015. The function of defensive substances in tobacco specifically induced by Bemisia tabaci biotype B against Myzus persicae[D]. Tai’an: Shandong Agricultural University.]
赵小嫚. 2019. 多组学技术探究茶树响应小绿叶蝉吸食的防御反应[D]. 福州:福建农林大学. [Zhao X M. 2019. The defense response of tea plants to green leafhopper infestation: A multi-omics study[D]. Fuzhou: Fujian Agriculture and Forestry University.]
Agarrwal R, Bentur J S, Nair S. 2014. Gas chromatography mass spectrometry based metabolic profiling reveals biomarkers involved in rice-gall midge interactions[J]. Journal of Integrative Plant Biology, 56(9):837-848. doi:10.1111/jipb.12244.
Agarrwal R, Padmakumari A P, Bentur J S, Nair S. 2016. Metabolic and transcriptomic changes induced in host during hypersensitive response mediated resistance in rice against the Asian rice gall midge[J]. Rice, 9(1):5. doi:10.1186/s12284-016-0077-6.
Alamgir K M, Hojo Y, Christeller J T, Fukumoto K, Isshiki R, Shinya T, Baldwin I T, Galis I. 2016. Systematic analysis of rice (Oryza sativa) metabolic responses to herbivory[J]. Plant Cell & Environment, 39(2):453-466. doi:10.1111/pce.12640.
Ameye M, Allmann S, Verwaeren J, Smagghe G, Haesaert G, Schuurink R C, Audenaert K. 2018. Green leaf volatile production by plants: A meta-analysis[J]. New Phytologist, 220(3):666-683. doi:10.1111/nph.14671.
Eloh K, Sasanelli N, Maxia A, Caboni P. 2016. Untargeted metabolomics of tomato plants after root-knot nematode infestation[J]. Journal of Agricultural & Food Chemistry, 64(29):5963-5968. doi:10.1021/acs.jafc.6b02181.
Fujimoto T, Abe H, Mizukubo T, Seo S. 2021. Phytol, a constituent of chlorophyll, induces root-knot nematode resistance in Arabidopsis via the ethylene signaling pathway[J]. Molecular Plant-Microbe Interactions,34(3):279- 285. doi:10.1094/MPMI-07-20-0186-R.
Li L, Dou N, Zhang H, Wu C X. 2021. The versatile GABA in plants[J]. Plant Signaling & Behavor, 16(3):1862565. doi:10.1080/15592324.2020.1862565.
Li T, Cofer T M, Engelberth M J, Engelberth J. 2016. Defense priming by non-jasmonate producing fatty acids in maize(Zea mays)[J]. Plant Signaling & Behavor,11(11):e1243635. doi:10.1080/15592324.2016.1243635.
Liu C X, Du B, Hao F H, Lei H H, Wan Q F, He G C, Wang Y L, Tang H R. 2017. Dynamic metabolic responses of brown planthoppers towards susceptible and resistant rice plants[J]. Plant Biotechnology Journal, 15(10):1346-1357. doi:10.1111/pbi.12721.
Marti G, Erb M, Boccard J, Glauser G, Doyen G R, Villard N, Robert C A, Turlings T C J, Rudaz S, Wolfender J L. 2013. Metabolomics reveals herbivore-induced metabolites of resistance and susceptibility in maize leaves and roots[J]. Plant Cell & Environment, 36(3):621-639. doi:10.1111/pce.12002.
Papazian S, Girdwood T, Wessels B A, Poelman E H, Dicke M, Moritz T, Albrectsen B R. 2019. Leaf metabolic signatures induced by real and simulated herbivory in black mustard (Brassica nigra)[J]. Metabolomics, 15(10):130. doi:10.1007/s11306-019-1592-4.
Peng L, Zhao Y, Wang H Y, Zhang J J, Song C P, Shangguan X X, Zhu L L, He G C. 2016. Comparative metabolo-mics of the interaction between rice and the brown planthopper[J]. Metabolomics, 12(8):1-15. doi:10.1007/s 11306-016-1077-7.
Razzaq A, Sadia B, Raza A, Hameed M K, Saleem F. 2019. Metabolomics: A way forward for crop improvement[J]. Metabolites, 9(12):303. doi:10.3390/metabo 9120303.
Saad S B, Ibrahim M A, Jatau I D, Shuaibu M N. 2020. The therapeutic potential of phytol towards Trypanosoma congolense infection and the inhibitory effects against trypanosomal sialidase[J]. Experimental Parasitology,216:107943. doi:10.1016/j.exppara.2020.107943.
Sano S, Sugiyama K, Ito T, Katano Y, Ishihata A. 2011. Identification of the strong vasorelaxing substance scirpusin B, a dimer of piceatannol, from passion fruit (Passiflora edulis) seeds[J]. Journal of Agricultural & Food Chemistry, 59(11):6209-6213. doi:10.1021/jf104 959t.
Scholz S S, Reichelt M, Mekonnen D W, Ludewig F, Mithöfer A. 2015. Insect herbivory-elicited gaba accumulation in plants is a wound-induced, direct, systemic, and jasmonate-independent defense response[J]. Front Plant Science, 22(6):1128. doi:10.3389/fpls.2015.01128.
Sinha D K, Atray I, Bentur J S, Nair S. 2015. Feeding on resistant rice leads to enhanced expression of defender against apoptotic cell death (OoDAD1) in the Asian rice gall midge[J]. BMC Plant Biology,15:235. doi:10.1186/s 12870-015-0618-y.
Subramanyam S, Sardesai N, Minocha S C, Zheng C, Shukle R H, Williams C E. 2015. Hessian fly larval feeding triggers enhanced polyamine levels in susceptible but not resistant wheat[J]. BMC Plant Biology,15:3. doi: 10.1186/s12870-014-0396-y.
Tarkowski Ł P, Signorelli S, Höfte M. 2020. γ-aminobutyric acid and related amino acids in plant immune responses:Emerging mechanisms of action[J]. Plant,Cell & Environment, 43(5): 1103-1116. doi:10.1111/pce.13734.
Uawisetwathana U, Chevallier O P, Xu Y, Kamolsukyeunyong W, Nookaew I, Somboon T, Toojinda T, Vanavi-chit A, Goodacre R, Elliott C T, Karoonuthaisiri N. 2019. Global metabolite profiles of rice brown planthopper-resistant traits reveal potential secondary metabolites for both constitutive and inducible defenses[J]. Metabolomics,15(12):151. doi:10.1007/s11306-019-1616-0.
Undas A K, Weihrauch F, Lutz A, van Tol R, Delatte T, Verstappen F, Bouwmeester H. 2018. The use of metabolomics to elucidate resistance markers against damson-hop aphid[J]. Journal of Chemical Ecology, 44(7-8):711-726. doi:10.1007/s10886-018-0980-y.
Wang W W, Yu Z X, Meng J P, Zhou P Y, Luo T, Zhang J, Wu J, Lou Y G. 2020a. Rice phenolamindes reduce the survival of female adults of the white-backed planthopper Sogatella furcifera[J]. Scientific Reports, 10(1):5778. doi:10.1038/s41598-020-62752-y.
Wang Y Q, Liu Q S, Du L X, Hallerman E M, Li Y H. 2020b. Transcriptomic and metabolomic responses of rice plants to Cnaphalocrocis medinalis caterpillar infestation[J]. Insects,11(10):705. doi:10.3390/insects11100705.
Yang J, Sun X Q, Yan S Y, Pan W J, Zhang M X, Cai Q N. 2017. Interaction of ferulic acid with glutathione s-transferase and carboxylesterase genes in the brown planthopper, Nilaparvata lugens[J]. Journal of Chemical Ecology, 43(7):693-702. doi:10.1007/s10886-017-0859-3.
(責任编辑 麻小燕)
