miR-106b-3p 和miR-214 在食管鳞癌组织中的表达及其与临床病理特征的关系
2021-02-08张文娟郭永泽程丽敏李学孔刘海涛石俊杰乔冠恩
张文娟,郭永泽,程丽敏,李学孔,刘海涛,董 魁,石俊杰,乔冠恩
(1.邯郸市第一医院消化科,河北 邯郸 056002;2.河北工程大学附属医院消化科,河北 邯郸 056002;3.邯郸市中心医院消化科,河北 邯郸 056000;4.魏县人民医院消化科,河北 魏县 056800;5.邯郸市第一医院胸外科,河北 邯郸 056002)
食管癌(esophageal carcinoma,EC)是常见的消化道恶性肿瘤,其中食管鳞癌(esophageal squamous cell carcinoma,ESCC)是EC 的主要病理类型,我国约90%左右EC 患者是ESCC。研究显示,在我国食管癌发病率居第5 位,死亡率居第4 位[1],且我国ESCC 存在临床治疗效果不佳、预后较差的特点[2]。目前针对食管癌治疗手段较多,主要包括手术、化疗及放疗,但总体治疗效果较差,患者5 年的生存率约为15%~25%[3]。积极寻找新的食管癌肿瘤标记物,有助于提高食管癌早期诊断,便于食管癌的及时治疗,但到目前为止,ESCC 确切的病因及分子调节机制尚未完全阐明。微小RNA(miRNAs)是一种内源性、结构及进化保守,长度约20 个核苷酸单链的非编码小分子RNA,可以通过抑制RNA 翻译或降解特异性靶mRNA 从而达到调控细胞分化、增殖、凋亡等生物学行为[4]。miRNAs 既可作为致癌分子也可作为抑癌分子,通过调控其靶基因的表达水平而对癌细胞的增殖、凋亡和转移等产生影响[5]。miR-106b-3p和miR-214 可在多种癌症中异常表达,但对其在ESCC 中的具体功能,目前鲜有报道。本研究采用反转录定量聚合酶链反应(RT-qPCR)技术检测ESCC组织和癌旁正常组织中miR-106b-3p 和miR-214表达水平,并结合临床病理资料,分析它们之间的关系,报道如下。
1 资料与方法
1.1 一般资料 选择2016 年10 月~2018 年8 月邯郸市第一医院确诊的行外科手术切除的60 例ESCC癌组织及对应的癌旁正常组织,其中男36 例,女24例,年龄42~76 岁,平均61.5 岁。ESCC 诊断均经过手术及病理证实,手术前均未接受化疗或放疗,术后有详细的回访记录,切除标本后迅速放进含有RNA保护液的试管中,并在10 min 内迅速冻存到-80 ℃冰箱中,用于后续总RNA 的提取。
1.2 主要试剂及仪器 Trizol 试剂及逆转录试剂盒购于美国Invitrogen 公司,PCR 试剂盒购于徳国Roche公司,引物由南京金斯瑞公司合成。紫外分光光度仪 为美国Beckman Coulter 公司生产,荧光定量PCR 仪7500HT 购自美国ABI 公司,电泳仪购自北京六一仪器厂。
1.3 方法
1.3.1 标本处理及总RNA 的提取 将保存在-80 ℃冰箱中的组织样本取出,放入有液氮的研钵中进行研磨,按100 mg 组织样本加1 ml 的Trizol 的比例添加Trizol 试剂,匀浆处理放置5 min。加入新的EP 管中,12,000 r/min 4 ℃离心10 min,上清移入新的EP管中。向上清液中加氯仿,震荡后放置3 min,4 ℃、12,000 r/min 离心15 min,收集上层水溶液。向水溶液中加异丙醇并充分混匀,放置30 min,4 ℃、12,000 r/min 离心15 min,收集沉淀。加入75%的乙醇洗涤,4 ℃、5000 r/min 离心5 min,去除上清液,保留沉淀。最后加20~30 μl RNase-Free dd H2O,充分溶解RNA。总RNA 经NanoDrop ND-2000 分光光度计测定浓度及纯度,并电泳检测RNA 完整性,质量合格后用DEPC 水溶解保存在-80 ℃,用于后续实验。
1.3.2 反转录反应 取2 μl RNA 入EP 管中,用DEPC 水加至11 μl,65 ℃放置5 min 后冰浴5 min 离心,加入5×Reaction buffer 4.0 μl、dNTPs 2.0 μl、Rnase Inhibitor1.0 μl、RT 酶1.0 μl,离心后42 ℃孵育60 min,70 ℃反应10 min 后立即取出冰浴冷却,合成cDNA,于-20 ℃保存。
1.3.3 实时荧光定量PCR 反应 合成cDNA 后,以Roche 公司的Fast Start Universal SYBR Green Master(Rox)荧光定量PCR 试剂盒来扩增目的基因,所有反应设立3 个复孔,采用20 μl 的反应体系,依次添 加SYBR Green Mix、cDNA、Forward Primer、Reverse Primer、ddH2O,通过1 个循环(95 ℃,3 min)的预变性,后40 个循环的变性(94 ℃,12 s)、退火及延伸(62 ℃,25 s),最后进行熔解曲线分析(62 ℃~95 ℃,0.5 ℃/cycles,5 s/次)。根据各个孔荧光信号达到阈值的循环数作为Ct 值,以U6 为内参,结果以ΔCt表示,ΔCt=Ct miRNA-Ct U6,表示组织中miR-106b-3p、miR-214 相对于内参基因U6 的表达水平,根据结果比较miR-106b-3p、miR-214 在癌组织及癌旁组织的差异,并分析其与性别、年龄、淋巴结有无转移及TNM 分期等临床病理特征的关系。
1.4 统计学方法 实验数据采用SPSS 22.0 统计软件分析,计量资料以()表示,两组间比较采用t检验,采用ROC 曲线分析miR-106b-3p 及miR-214对ESCC 诊断价值,P<0.05 表示差异有统计学意义。
2 结果
2.1 食管鳞癌组织和癌旁组织中miR-106b-3p、miR-214 表达情况 食管鳞癌组织中miR-106b-3p及miR-214 表达量分别为(0.78±0.13)及(0.91±0.19),癌旁正常组织中miR-l06b-3p、miR-214 表达量分别为(0.31±0.02)及(0.39±0.05),癌组织与癌旁正常组织组比较,差异有统计学意义(P<0.05)。
2.2 miR-106b-3p 及miR-214 的表达与ESCC 临床病理特征的关系 不同淋巴结转移情况、肿瘤TNM分期的ESCC 患者癌组织中miR-106b-3p、miR-214 的表达比较,差异有统计学意义(P<0.05),不同年龄、性别的ESCC 患者癌组织中miR-106b-3p、miR-214 的表达比较,差异无统计学意义(P>0.05),见表1。
2.3 miR-106b-3p 和miR-214 诊断 ESCC 的价值ROC 曲线显示,miR-106b-3p 诊断食管鳞癌的最佳临界值为0.49,AUC 为0.87,敏感性为87.50%,特异性为81.30%;miR-214 诊断食管鳞癌的最佳临界值为0.55,AUC 为0.84,敏感性为85.00%,特异性为87.50%,见图1。
3 讨论
miRNAs 是一类长度大小约为20~22 个核苷酸的非编码小RNA,能够通过其碱基序列区域与其相应靶目标mRNA 的3'-非翻译区(3'-untranslated region,3'-UTR)中的互补碱基序列进行完全或不完全的互补结合,在基因的转录后阶段调控其相应靶目标mRNA 的表达,参与了人体几乎所有的生物学调节途径。已证实miRNAs 在肿瘤的发生、进展及转移中发挥抑癌基因或促癌基因的作用[6]。在人类miRNAs 中,约50%左右的miRNAs 所在的基因组区域与癌症之间存在密切的联系。因此,癌组织中异常表达的miRNAs 对肿瘤的早期诊断、组织类型的分类、转移及预后等方面有着极其重要的价值[7]。
表1 miR-106b-3p、miR-214 表达与ESCC 临床病理特征的关系()
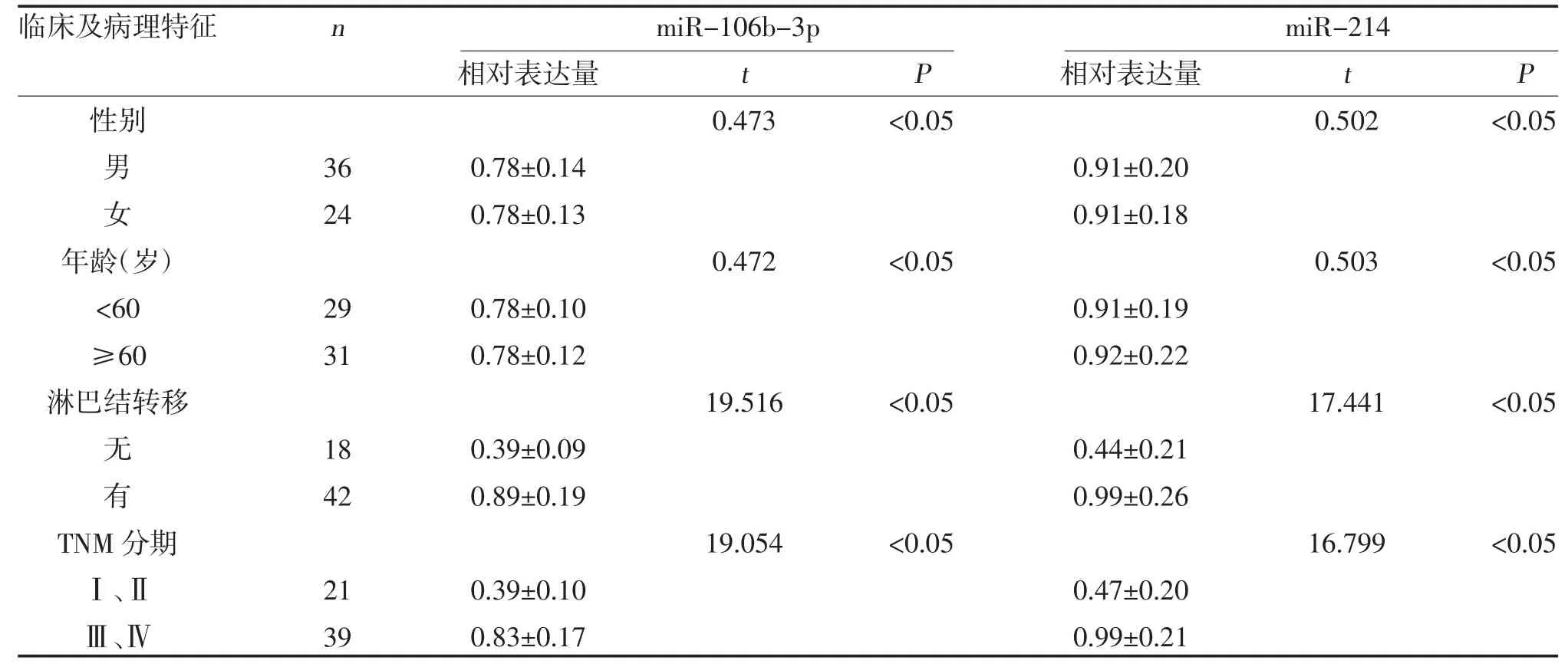
表1 miR-106b-3p、miR-214 表达与ESCC 临床病理特征的关系()

图1 miR-1O6b-3p 和miR-214 诊断ESCC 的ROC 曲线
miR-106b 是miR-106b-25 家族中的一员,位于人类7 号染色体且在编码基因MCM7 的第13 个内含子区域内,在多种肿瘤中异常高表达,具有调控肿瘤细胞迁移、侵袭、增殖等重要的功能。研究表明,miR-106b 在前列腺癌中高表达并且能够促进癌细胞增殖[8]。在肝癌组织中,高表达的miR-106b 能够促进E-Cadherin 等上皮标志物的上调且下调间质细胞标志物的表达,从而促进肝癌细胞增殖及侵袭[9]。在晚期乳腺癌患者中,miR-106b 表达升高,并与肿瘤进展相关,TGF-β 诱导的高水平的miR-106b 决定了TGF-β 在乳腺癌中的促肿瘤作用[10]。在ESCC 组织中miR-106b 的表达情况报道较多,但对于miR-106b在ESCC 中起促癌作用还是抑癌作用,结论不一。Okumura T 等[11]通过芯片技术检测了多种miRNAs的差异表达,确定了miR-574-3p 和miR-106b 的高表达与肿瘤无复发及良好的总生存率相关,其中miR-106b 被认为具有肿瘤抑制作用。另有研究显示,在ESCC 组织和细胞系中,miR-106b 表达上调,且在食管癌组织中,miR-106b 的表达与淋巴转移呈正相关,该研究认为miR-106b 有助于ESCC 的侵袭和转移,具有促癌作用,下调miR-106b 可能是预防肿瘤侵袭和转移的一种新策略[12]。肖长艳等[13]的研究结果显示,相对于癌旁组织,食管鳞状细胞癌肿瘤组织中miR-106b 的表达水平显著升高,其表达量与淋巴结转移、肿瘤分期及吸烟有相关性,并且miR-106b 表达水平较低的患者的生存率显著高于miR-106b 表达水平较高的患者,miR-106b 的表达量是食管鳞状细胞癌患者独立预后因子,可用作ESCC 的诊断及判断预后的生物标志物。但到目前为止,关于miR-106b-3p 在ESCC 中的表达尚未见报道。本研究发现,miR-106b-3p 在ESCC 癌组织中的表达高于其在癌旁组织中的表达,且随着患者TNM 分期増加及淋巴结转移而明显上调,其诊断ESCC 的敏感性为87.50%,特异性为81.30%,与研究报道的miR-106b情况类似[14],推断在整个ESCC 的发生发展过程中,miR-106b-3p 起着显著的促癌作用。
miR-214 在不同肿瘤中的表达水平不同,可作为癌基因或抑癌基因在肿瘤发生、发展、侵袭等过程中发挥作用[15],已被证实可作为乳腺癌、膀胱癌等多种癌症的特异性标志物而在临床中应用[16]。关于miR-214 在ESCC 中的表达,研究显示其在ESCC组织及细胞中的表达下降,认为miR-214 在ESCC中为抑癌基因[17]。本研究发现,ESCC 癌组织中miR-214 的表达水平高于癌旁正常组织,且miR-214 表达水平与ESCC 分期及淋巴结转移情况有关,ROC曲线分析显示其可作为区分ESCC 与正常者的分子标志物,因此,考虑miR-214 为致癌基因,在临床上可作为新的辅助诊断ESCC 的肿瘤标志物。
总之,miR-106b-3p 和miR-214 在食管鳞癌组织中表达上调,可作为致癌基因参与食管鳞癌的发生发展,且两者对诊断该病具有一定的价值。
