外源24-表油菜素内酯对茶树光合特性的影响
2021-02-06万绮雯杨妮李逸民韩妙华林士佳滕瑞敏庄静
万绮雯,杨妮,李逸民,韩妙华,林士佳,滕瑞敏,庄静
外源24-表油菜素内酯对茶树光合特性的影响
万绮雯,杨妮,李逸民,韩妙华,林士佳,滕瑞敏,庄静*
南京农业大学园艺学院 茶叶科学研究所,江苏 南京 210095
以中茶108为试验材料,研究喷施不同浓度(0.10、0.30、0.50 mg·L-1)24-表油菜素内酯(EBR)对茶树叶片叶绿素含量、气孔开度、光合气体交换参数及其相关基因表达的影响。结果表明,处理后第一天,叶面喷施0.10、0.30 mg·L-1EBR显著增加了茶树叶片叶绿素含量,与对照相比,分别增加了38.89%、22.22%。处理后第三天和第五天,0.10、0.30 mg·L-1EBR处理的茶树叶片气孔开度显著升高。处理后第一天和第五天,喷施EBR显著提高了茶树叶片的净光合速率。同时,EBR处理能显著上调BR合成酶基因、碳同化关键酶基因、叶绿素合成关键酶基因的表达。综上,外源EBR通过调控相关基因表达调节茶树叶片叶绿素含量、气孔开度,进而提高茶树叶片的光合作用能力。
茶树;24-表油菜素内酯;叶绿素;光合特性;基因表达
茶树[(L.) O. Kuntze]属山茶科山茶属,为灌木或乔木,作为常绿叶用植物,是我国南方地区的主要经济作物之一。茶叶中含有茶多酚、氨基酸、维生素等有益物质,通过采摘茶树叶片进行加工,控制其代谢过程,使之符合人们的需求。植物光合作用是一种基本的生理过程,它为初级代谢产物的合成提供底物和能量,而次级代谢产物又从初级代谢产物中获得[1]。因此茶树光合能力影响着茶叶的产量和品质。植物光合过程依赖于叶绿素,并在一定程度上反映于光合参数[2]。叶绿素a是光反应的中心色素分子,叶绿素b是捕光色素分子,光合色素含量的高低与光合功能密切相关[3]。气孔被植物表皮中成对的保卫细胞包围,调节植物与大气之间的气体交换,从而控制光合作用和蒸腾作用[4]。气孔的开放保证了H2O、CO2和O2在植物体内出入,是光合作用的通道[5]。
油菜素甾醇类物质(Brassinosteroids,BRs)是花粉中分离得到的生长促进物质,是区别于现有5种植物激素的第六大类激素。随着工业提取技术的不断发展,目前中国市场上常用的人工合成油菜素甾醇类产品主要有油菜素内酯、24-表油菜素内酯、28-高油菜素内酯和28-表油菜素内酯等,这些人工合成具有高活性的油菜素甾醇在蔬菜、瓜果和树木等各类经济作物上得到了相当广泛的应用[6]。研究表明,极低浓度的BRs处理就能使植物表现出显著的生理效应,如促进生长、促进种子萌发、提高光合作用、提高植物对逆境的抗性、提高作物产量和品质,调控农药降解等[7-11]。Fariduddin等[12]研究表明,BRs的应用可以增加黄瓜叶绿素含量,增强光系统Ⅱ的活性。高春娟[13]发现,低浓度的BRs能够通过增强Rubisco的活化和增加气孔开度,提高番茄光合作用CO2同化速率。
然而,关于施用24-表油菜素内酯(EBR)丰富茶树光合作用以及揭示其内在机制的研究鲜有报道。为此,本文以中茶108为材料,研究叶面喷施不同浓度EBR对茶苗叶绿素含量、气孔开度、光合气体交换参数的影响,并运用荧光定量PCR技术研究叶绿素、BR、碳同化相关基因在不同浓度EBR处理下的表达模式,旨在深入了解EBR对茶树光合作用的内在机制,为茶树优质、高效、安全生产栽培提供理论依据。
1 材料与方法
1.1 供试材料及试验设计
供试茶树品种为中茶108两年生扦插幼苗,其生长在昼夜温度为25/18℃,光照周期14 h、湿度(70±10)%、光强230 μmol·m-2·s-1的南京农业大学生长室内。选取植株健壮且长势良好一致的茶苗进行试验。
试验于2019年11月21日至28日进行。分别喷施质量浓度为0.10、0.30、0.50 mg·L-1的EBR于叶面,以喷施等量清水为对照。取上述茶树叶片用于叶绿素含量、叶片气孔开度、光合参数的测定;提取叶片RNA后反转录成cDNA,作为实时荧光定量模板。3次生物学重复。
1.2 测定项目及方法
1.2.1 叶绿素含量的测定
采用丙酮、无水乙醇、水三种液体的混合液浸提法测定叶绿素含量[14]。取茶苗顶部第二片叶,将其剪碎,取0.10 g放入10 mL混合液(丙酮∶无水乙醇∶水=4.5∶4.5∶1.0)中,置暗处浸提至叶片完全变白为止。以混合液为对照,用酶标仪(MD iD5)测定浸提液在645 nm和663 nm处的吸光值,最后计算叶绿素含量。
1.2.2 叶片气孔的测定
在取样期间,每个处理随机选取长势一致的3株茶苗,每株选取第三片叶,均匀涂抹指甲油,再用透明胶粘至载玻片上置于Olympus BX-53显微镜下观察气孔。在40倍物镜下选取视野内的9~15个气孔,测量其长度与宽度,最后计算气孔开度。气孔开度()=π·,其中,=1/2气孔长度,=1/2气孔宽度[15]。
1.2.3 光合参数的测定
使用便携式光合仪(Li-6400XT型)测定植株光合气体交换参数。选取茶树顶部以下的第二片功能叶,测定叶片的净光合速率(P)、气孔导度(G)、胞间CO2浓度(C)和蒸腾速率(T)等。测定条件控制为600 μmol·m-2·s-1光强、400 μmol·mol-1CO2含量、叶室温度(25±1)℃,相对湿度70%~80%。
1.2.4 相关基因表达量的测定

1.2.5 数据处理与统计分析
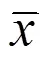

表1 RT- qPCR引物序列
2 结果与分析
2.1 不同浓度的EBR处理对茶树叶绿素含量的影响
如表2所示,处理后第一天,与对照相比,叶面喷施0.10、0.30 mg·L-1EBR显著增加了茶树叶片叶绿素含量,分别增加了38.89%、22.22%,而0.50 mg·L-1EBR处理无显著差异。处理后第三天,不同浓度EBR处理均显著增加叶绿素a、叶绿素b、叶绿素含量。处理后第五天,叶面喷施EBR可以提高茶树叶片叶绿素含量,但与对照相比,差异不明显。
2.2 不同浓度的EBR处理对茶树叶片气孔开度的影响
各浓度EBR处理能不同程度影响茶树叶片的气孔开度(图1)。如表3所示,处理后第一天,0.10 mg·L-1EBR处理能显著提高叶片的气孔开度,与对照相比,增加了8.26%,0.30、0.50 mg·L-1EBR处理与对照无显著差异;处理后第三天和第五天,0.10、0.30 mg·L-1EBR处理显著提高了茶树叶片的气孔开度,与对照相比,0.10 mg·L-1EBR处理分别增加了18.59%、21.29%,0.30 mg·L-1EBR处理分别增加了9.93%、12.80%,而0.50 mg·L-1EBR处理与对照相比无显著差异。以上表明0.10、0.30 mg·L-1EBR可以促进茶树叶片气孔开放。
2.3 不同浓度的EBR处理对茶树光合气体交换参数的影响
净光合速率(P)、气孔导度(G)、胞间CO2浓度(C)、蒸腾速率(T)是反映植物叶片光合作用最主要的指标。如图2所示,处理后第一天,0.10、0.30、0.50 mg·L-1EBR处理均能显著提高茶树叶片的P,与对照相比分别增加了1.85、1.23、0.85倍;各浓度EBR处理显著降低了茶树叶片的C;喷施不同浓度EBR还影响了茶树叶片的G和T,其中,0.50 mg·L-1EBR处理的G与对照相比无显著差异,T则显著下降,而0.10 mg·L-1和0.30 mg·L-1EBR处理表现出显著促进作用。处理后第三天,不同浓度EBR处理在不同程度影响了茶树叶片的P,0.10 mg·L-1EBR处理表现为显著促进作用,0.30 mg·L-1EBR处理则有显著抑制作用,0.50 mg·L-1EBR处理无显著变化;喷施0.10 mg·L-1EBR显著提高了茶树叶片的G和T,0.30 mg·L-1EBR处理无显著变化,0.50 mg·L-1EBR处理表现为显著抑制;此外,0.10、0.30 mg·L-1EBR处理对茶树叶片的C无显著影响,0.50 mg·L-1EBR处理表现为显著抑制。处理后第五天,0.10、0.30、0.50 mg·L-1EBR处理均能显著提高叶片的P,与对照相比分别增加了101.93%、80.32%、68.34%;C、G和T也受不同程度的影响,各处理均显著高于对照。

表2 不同浓度EBR对茶树叶片叶绿素含量的影响
注:同一列中不同小写字母表示在0.05水平有显著差异
Note: Different letters in the same column group mean significant difference at 0.05 level
2.4 不同浓度的EBR处理对茶树叶片相关基因表达量的影响
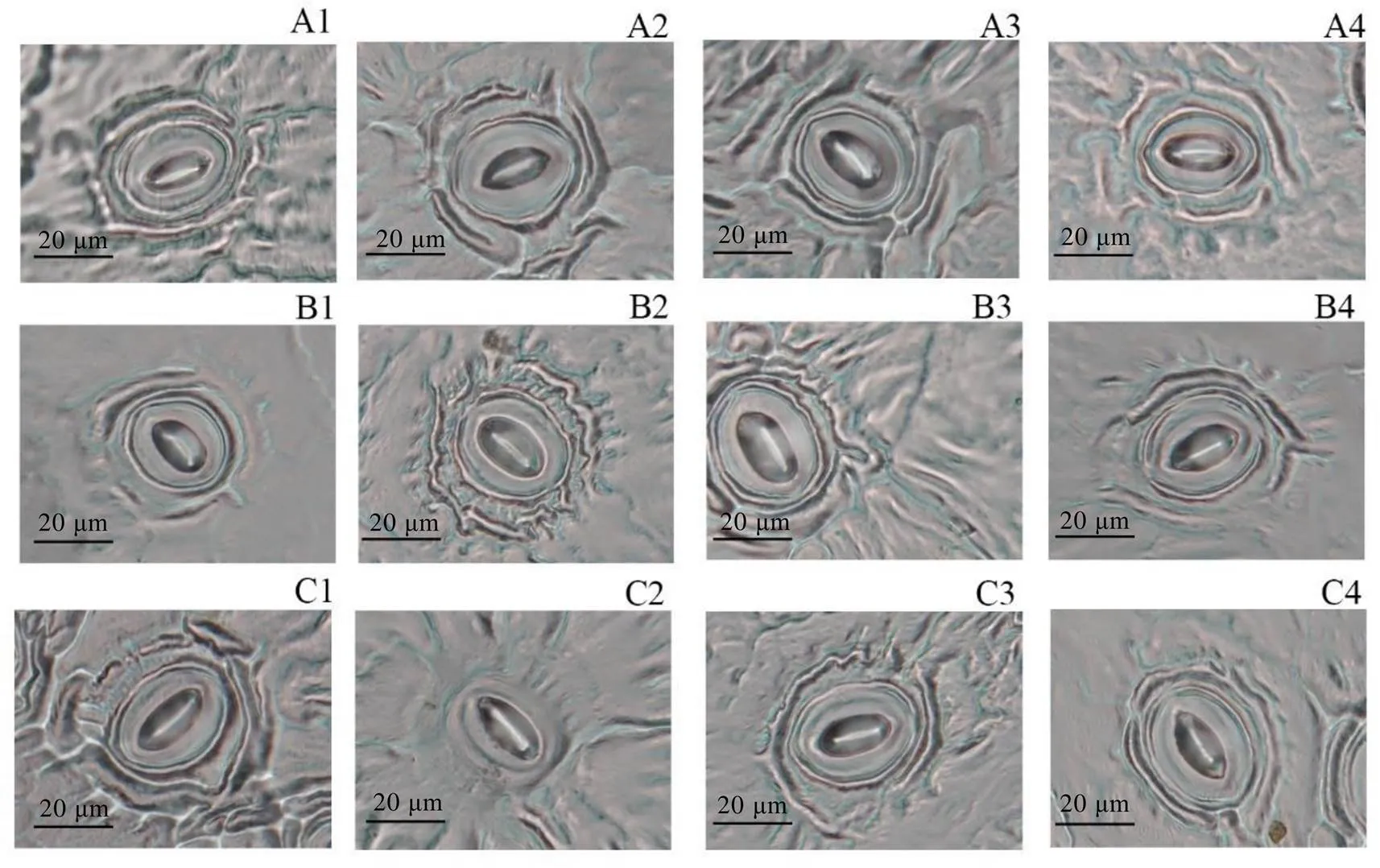
2.4.1 对茶树叶片碳同化关键酶基因表达量的影响
处理后第一天,叶面喷施0.30 mg·L-1EBR能显著上调核酮糖-1,5-二磷酸羧化/加氧酶大亚基(RbcL)、核酮糖-1,5-二磷酸羧化/加氧酶小亚基(RbcS)、核酮糖-5-磷酸激酶(PRK)、果糖-1,6-二磷酸酶(FBPase)、景天庚酮糖-1,7-二磷酸酯酶(SBPase)、核酮糖-1,5-二磷酸羧化/加氧活化酶(RCA)、果糖-1,6-二磷酸醛缩酶(Ald)、转酮醇酶(TK)编码基因的表达,以上调最为显著,与对照相比,增加了240.65%(图3)。而其他EBR处理也均能显著提高的相对表达量,且不同程度影响其他7个基因的表达。处理后第三天,0.10 mg·L-1和0.50 mg·L-1EBR处理均能提高以上茶树叶片8个碳同化关键酶基因的表达,而0.30 mg·L-1EBR处理对、、以及的表达水平无显著影响。处理后第五天,0.10 mg·L-1EBR能使、、、、、、的表达水平上调,以上调最为显著,与对照相比,增加了78.72%;0.30 mg·L-1EBR处理能显著提高、、、、和的表达量,和的表达水平略有下调,但无显著差异;在0.50 mg·L-1EBR处理下,、、、、、的表达量显著提高,的表达水平显著下降,而的表达水平无显著变化。
注:A、B、C分别表示处理后第一天、第三天、第五天。1:对照处理;2:0.10 mg·L-1 EBR处理;3:0.30 mg·L-1 EBR处理;4:0.50 mg·L-1 EBR处理

表3 不同浓度的EBR处理对茶树叶片气孔开度的影响
注:不同小写字母表示在0.05水平有显著差异
Note: Different letters mean significant difference at 0.05 level

注:不同小写字母表示在0.05水平有显著差异,下同
2.4.2 对茶树叶片油菜素内酯合成基因表达量的影响
处理后第一天,喷施0.10 mg·L-1EBR显著上调催化BRs合成途径中5-还原酶、C-23羟化酶、C-3氧化酶的编码基因、、的表达水平(图4),与对照相比,分别增加了27.71%、90.60%、48.11%,同时提高了BRs合成途径中C-22羟化酶编码基因的表达,但差异不显著;喷施0.30 mg·L-1EBR显著上调基因、表达,对的表达水平无显著影响,但显著降低的表达量;喷施0.50 mg·L-1EBR显著下调、的表达,对、的表达水平无显著影响。处理后第三天,喷施0.10、0.30 mg·L-1EBR显著提高了、的表达量,同时上调、的表达,但差异不显著;喷施0.50 mg·L-1EBR则显著上调除以外的3个BR合成酶基因的表达。处理后第五天,喷施0.10 mg·L-1EBR显著提高、的基因表达水平,对、无显著影响;喷施0.30 mg·L-1EBR显著上调、、、等4个油菜素内酯合成酶基因的表达;喷施0.50 mg·L-1EBR显著提高、、的表达量,对的表达量无显著影响。
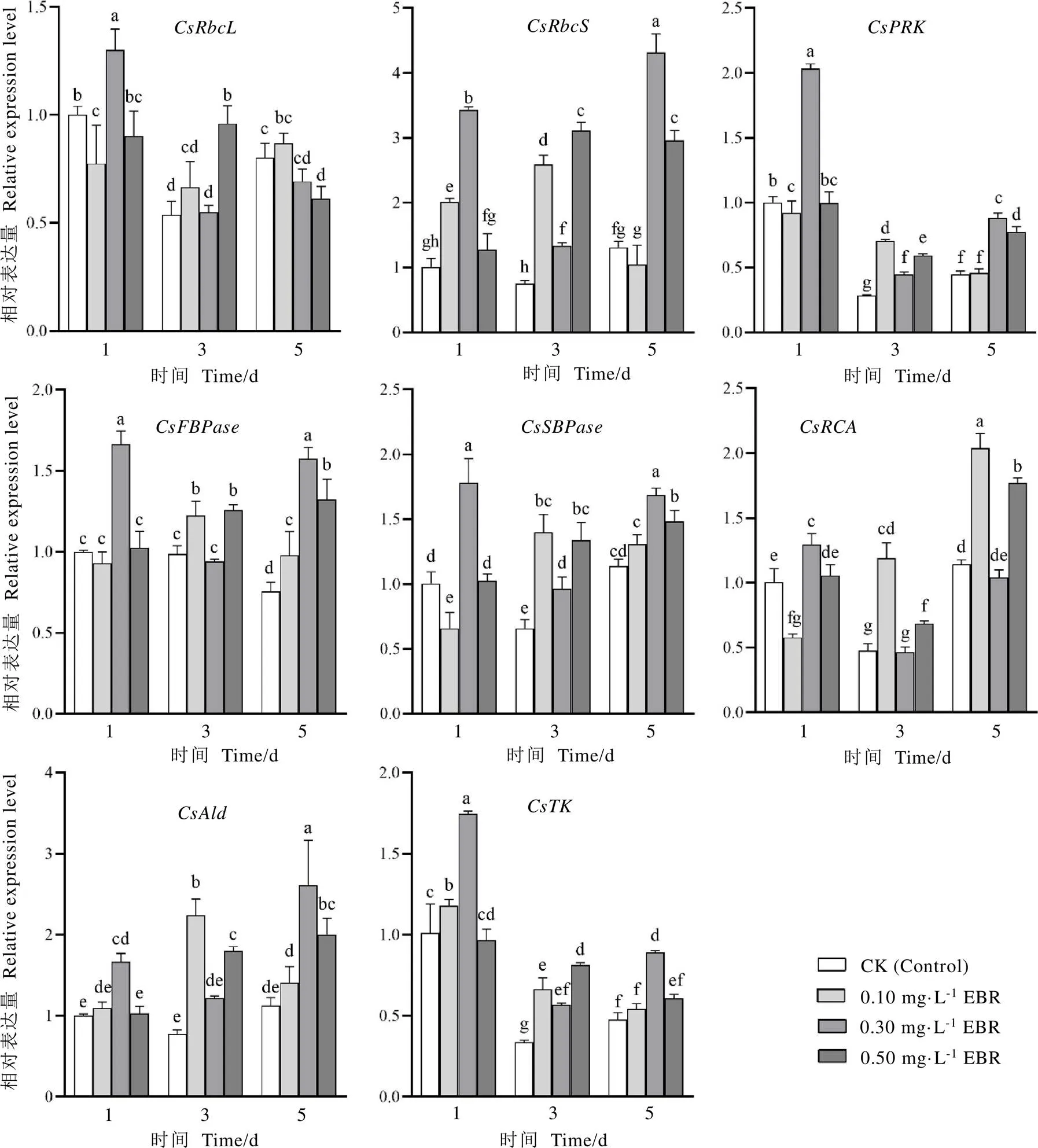
图3 不同浓度的EBR处理对茶树叶片碳同化相关酶基因相对表达量的影响

图4 不同浓度的EBR处理对茶树叶片油菜素内酯合成基因表达量的影响
2.4.3 对茶树叶片叶绿素合成基因表达量的影响
叶绿素的合成是一个由多酶参与的复杂过程,从-谷氨酰-tRNA到叶绿素a,叶绿素a再经叶绿素酸酯a加氧酶氧化形成叶绿素b,这一生物合成过程需要20多个步骤,由30多个基因编码的18种酶参与[21-23]。-谷氨酰-tRNA至原卟啉Ⅸ的合成是植物中叶绿素、血红素、细胞色素C等众多四吡咯物质合成的共同途径,该途径共涉及8种酶。本试验对参与该途径的6个酶基因进行表达分析。如图5所示,处理后第一天,0.10 mg·L-1EBR处理显著上调、的表达量,与对照相比,分别增加了27.91%、57.61%、31.52%;0.30 mg·L-1EBR处理显著提高、、、的表达水平,与对照相比,分别增加了72.57%、14.84%、30.70%、32.18%。处理后第三天,0.10、0.50 mg·L-1EBR处理显著上调除外的其余5个叶绿素合成基因表达水平;0.30 mg·L-1EBR处理显著上调的表达量。处理后第五天,0.30 mg·L-1EBR显著上调、、、、等6个叶绿素合成基因的表达量,0.10 mg·L-1EBR显著上调除基因外的其余5个叶绿素合成基因的表达量,0.50 mg·L-1EBR处理显著上调、、的表达量。综合分析,以0.10、0.30 mg·L-1EBR处理能更好提高茶树叶片叶绿素合成基因的表达量。
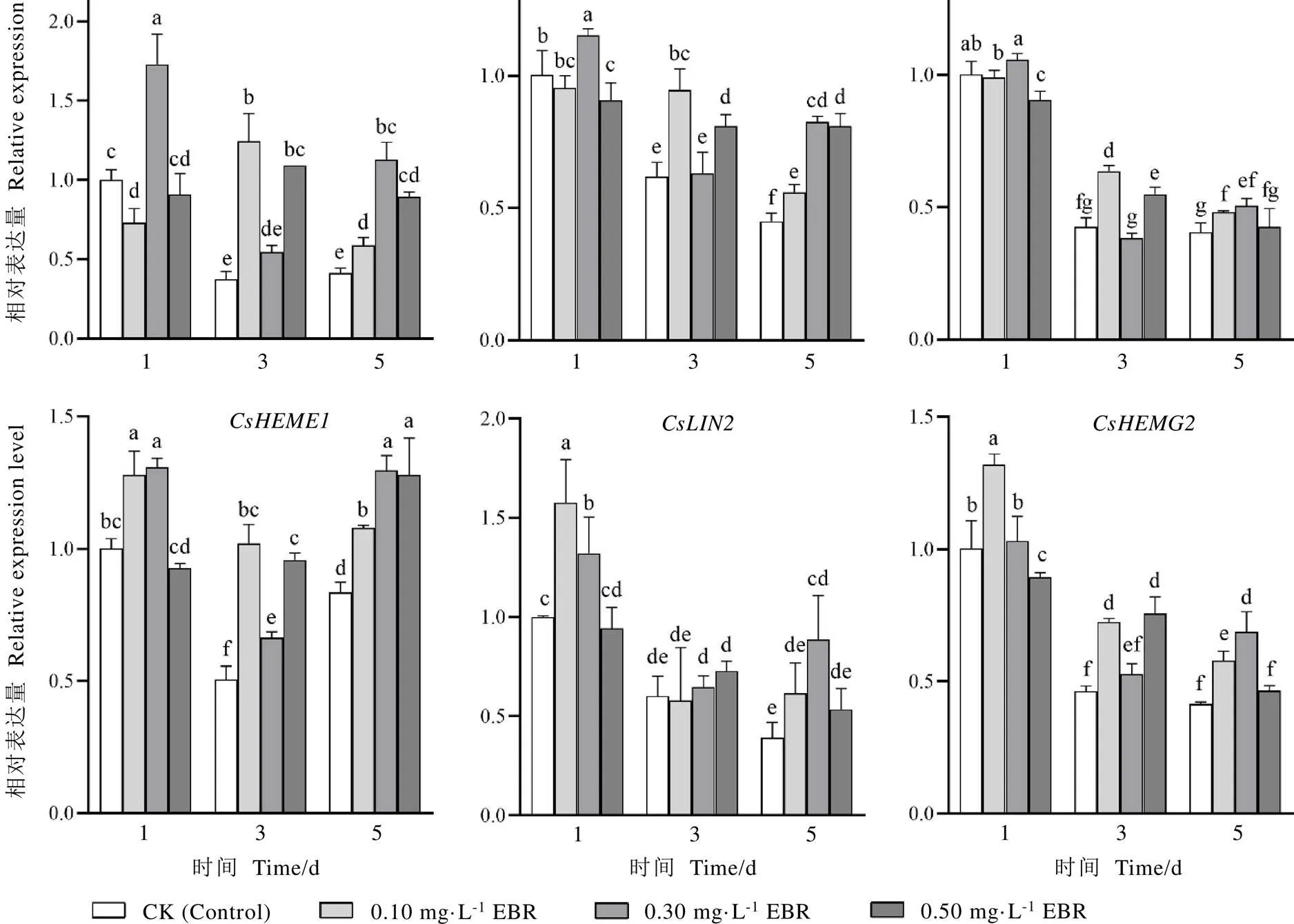
图5 不同浓度的EBR处理对茶树叶片叶绿素合成基因相对表达量的影响
3 讨论
叶绿素是植物光合作用中最主要的色素分子,参与光能吸收、传递、分配和转化等过程,其含量直接影响着光合速率[24]。李蒙等[25]研究表明0.10 mg·L-1EBR能显著提高番茄叶片叶绿素含量,而胡文海等[26]研究表明EBR处理对黄瓜叶片叶绿素含量无明显影响,说明EBR对叶绿素含量影响可能与植物种类、施用的EBR浓度和施用方式的差异有关。本文结果表明,各EBR处理均有提高茶树叶片叶绿素含量的效应,0.10、0.30 mg·L-1EBR处理效果较好。叶绿素的生物合成是一个由许多酶参与的复杂过程。植物中-氨基乙酰丙酸(ALA)的合成是四吡咯物质合成途径的限速步骤,决定了叶绿素合成途径的总流量,它是由谷氨酰-tRNA原酶(GluTR)和谷氨酸酯-1-半醛2,1氨基变位酶(GSA-AM)催化合成,其中由基因编码的GluTR对ALA的合成起关键作用[27]。将在黄化拟南芥与黄化烟草中过表达会增加其叶片中叶绿素的积累[28]。本试验中,各EBR处理均上调的表达,其中以0.10、0.30 mg·L-1EBR处理效果较为显著。、、、、分别是胆色素原脱氨酶、尿卟啉原Ⅲ合成酶、尿卟啉原Ⅲ脱羧酶、粪卟啉原Ⅲ氧化酶和原卟啉原氧化酶的编码基因,它们影响着叶绿素和血红素共同合成途径的分支点——原卟啉Ⅸ的合成。本试验结果表明,外源EBR可不同程度的提高这些基因的表达水平,这说明EBR可从转录水平上调控茶树叶片叶绿素合成酶,从而促进叶绿素合成。
气孔控制着植物与外界环境的气体和水分交换,对植物的光合作用和蒸腾作用十分重要。气孔导度是衡量气孔开度的一项重要指标,气孔导度越大,气孔开度越大[29],本试验结果与之相符。李翔[30]研究表明,番茄施用外源EBR后,气孔开度显著减小;然而本试验结果表明,叶面喷施0.10、0.30 mg·L-1EBR能显著提高叶片气孔开度,0.50 mg·L-1EBR处理则有出现抑制气孔开放的现象,这可能存在EBR高浓度促进气孔关闭,低浓度促进气孔开放的缘故[13]。
EBR可以促进许多植物的光合作用,并可通过调节气孔和非气孔因素来提高光合效率。岳健敏等[31]和李治鑫等[32]研究发现EBR能促进刺槐和茶树的光合作用。本试验中,处理后第一天和第五天,叶面喷施EBR能显著提高茶树叶片的P,其中以0.10 mg·L-1EBR处理最为明显;而处理后第三天,质量浓度为0.30、0.50 mg·L-1EBR两个处理并不能促进茶树叶片进行光合作用。这可能是由于BR对植物生长发育过程的影响取决于施用浓度,如低浓度BR促进甘蓝子叶生长,然而高浓度BR抑制其生长[33]。同时,处理后第三天,EBR处理的P、G和T表现出下降的趋势,这可能是由于植物内源激素水平、信息传递和植物生理反应调节的变化所致。当P和G降低,C减少时,P的降低主要是由于气孔限制;而C增加或不变时,则非气孔限制是光合作用下降的关键因素[34]。本试验中,处理后第一天,各EBR处理均能显著提高茶树叶片的P,显著降低茶树叶片的C,茶树叶片的G表现为显著提高或无显著影响。这表明处理后第一天,非气孔因素是喷施EBR促进茶树光合作用的主要原因。处理后第三天,0.10 mg·L-1EBR处理显著提高了茶树叶片的P、G,而C无明显变化,说明处理后第三天,非气孔因素是喷施EBR促进茶树光合作用的主要原因。处理后第五天,各EBR处理均能显著提高茶树的P、C和G,这表明处理后第五天,EBR处理对茶树光合效率的提高取决于气孔因素。此外,岳健敏等[31]研究发现,0.50 mg·L-1是木本植物刺槐的BRs最佳施用质量浓度,茶树同为木本植物,然而本研究结果表明0.10、0.30 mg·L-1EBR较0.50 mg·L-1EBR更能促进茶树叶片的光合作用,这可能与植物的种类、施用EBR的方式以及处理季节有关,其原因有待进一步探索。
Rubisco是植物叶片光合碳同化的双功能酶,它催化核酮糖-1,5-二磷酸(RuBP)的羧化反应和加氧反应,Rubisco大亚基由叶绿体基因编码,小亚基由核基因编码[35]。RCA促进且可以稳定Rubisco催化活性[36]。FBPase催化果糖-1,6-二磷酸水解,在卡尔文循环和糖异生途径中起关键调节作用[37]。Ald是卡尔文循环中固定CO2后第一个催化三碳化合物转化为六碳化合物的酶,处于第一个分支点上,是碳同化过程中重要的限速酶之一[38]。SBPase、PRK均参与RuBP的再生阶段[39]。TK活性降低,植物光合速率显著降低,芳香族氨基酸和苯丙氨酸代谢明显受抑[40]。本试验中,、、等8个碳同化关键酶基因在0.30 mg·L-1EBR处理后第一天显著上调,其余两个水平的EBR处理也在不同程度提高了这8个基因的表达,表明外源EBR可能从转录水平提高茶树叶片光合碳同化的转化过程。此外,各EBR处理的8个碳同化关键酶基因表达随时间变化趋势与P的变化趋势并不完全一致,这可能与后期的蛋白质翻译、修饰及环境因素有关。
BRs的生物合成途径受多种酶和相关基因的调控,和被认为是编码BR生物合成途径中限速反应酶的基因[41]。编码一种5还原酶,催化24-OH-4-en-3one生成24-OH-3-one[42]。研究发现,只有C-23位羟基化的BR中间体才能恢复ROT3缺陷表型,证明这个酶催化C-23位的羟基化步骤[43]。本试验中,油菜素内酯合成酶基因在EBR处理后的短期内表现出较高的表达水平,这可能是由于外源激素的应用能促进植物内源激素产生的缘故[44]。在油菜素甾醇稳态维持的调控网络中,信号转导下游的转录因子会抑制生物合成关键酶基因的表达,该调控方式被称为负反馈抑制,CPD受到该种机制的调节[45]。处理后第一天,叶面喷施0.50 mg·L-1EBR显著下调C的转录水平,这可能是植物自身为避免激素过度积累,采用负反馈调节机制下调激素合成基因的表达以保持正常的激素水平。
本研究表明外源喷施一定浓度的EBR可以上调茶树叶片叶绿素合成基因、碳同化代谢相关酶基因、BR合成关键酶基因的表达,提高叶绿素含量,调节气孔开度,促进茶树进行光合作用,但其在茶树生理调控过程中具体机理还待进一步探究。
[1] Verma N, Shukla S. Impact of various factors responsible for fluctuation in plant secondary metabolites [J]. Journal of Applied Research on Medicinal and Aromatic Plants, 2015, 2(4): 105-113.
[2] Stirbet A, Govindjee. On the relation between the Kautsky effect (chlorophyll a fluorescence induction) and photosystem Ⅱ: basics and applications of the OJIP fluorescence transient [J]. Journal of Photochemistry and Photobiology B: Biology, 2011, 104(1): 236-257.
[3] 杨志晓, 丁燕芳, 张小全, 等. 赤星病胁迫对不同抗性烟草品种光合作用和叶绿素荧光特性的影响[J]. 生态学报, 2015, 35(12): 4146-4154. Yang Z X, Ding Y F, Zhang X Q, et al. Impacts ofstress on characteristics of photosynthesis and chlorophyll fluorescence in two tobacco cultivars with different resistances [J]. Acta Ecologica Sinica, 2015, 35(12): 4146-4154.
[4] Shimazaki K, Doi M, Assmann S M, et al. Light regulation of stomatal movement [J]. Annual Review of Plant Biology, 2007, 58(1): 219-247.
[5] 曹刚. 不同LED光质对黄瓜和结球甘蓝苗期生长、光合特性及内源激素的影响[D]. 兰州: 甘肃农业大学, 2013. Cao G. Effects of different LED light qualities on cucumber and head cabbage seedling growth, photosynthetic characteristics and endogenous hormones [D]. Lanzhou: Gansu Agricultural University, 2013.
[6] 张子臻. 外源油菜素甾醇类化合物对甜菜产质量的影响[D]. 呼和浩特: 内蒙古农业大学, 2019. Zhang Z Z. Effect of exogenous brassinosteroids on yield and quality of sugar beet (L.) [D]. Hohhot: Inner Mongolia Agricultural University, 2019.
[7] 张爱敏, 周国顺, 付丽军, 等. 低温胁迫下油菜素内酯对黄瓜种子萌发及幼苗生长的影响[J]. 中国瓜菜, 2019, 32(12): 31-36. Zhang A M, Zhou G S, Fu L J, et al. Effects of brassinosteroids on seed germination and seedling growth of cucumber under low temperature stress [J]. China Cucurbits and Vegetables, 2019, 32(12): 31-36.
[8] Yu J Q, Huang L F, Hu W H, et al. A role for brassinosteroids in the regulation of photosynthesis in[J]. Journal of Experimental Botany, 2004, 55(399): 1135-1143.
[9] Dhaubhadel S, Browning K S, Gallie D R, et al. Brassinosteroid functions to protect the translational machinery and heat-shock protein synthesis following thermal stress [J]. Plant Journal, 2002, 29(6): 681-691.
[10] Babalik Z, Demirci T, Aşcı Ö A, et al. Brassinosteroids modify yield, quality, and antioxidant components in grapes (cv. Alphonse Lavallée) [J]. Journal of Plant Growth Regulation, 2020(39): 147-156.
[11] 汪季涛. 油菜素内酯调控番茄农药降解的生理与分子机制[D]. 杭州: 浙江大学, 2010. Wang J T. Physiological and molecular mechanisms of brassinosteroids-regulated pesticide degradation in tomato [D]. Hangzhou: Zhejiang University, 2010.
[12] Fariduddin Q, Yusuf M, Hayat S, et al. Effect of 28-homobrassinolide on antioxidant capacity and photosynthesis inplants exposed to different levels of copper [J]. Environmental and Experimental Botany, 2009, 66(3): 418-424.
[13] 高春娟. 油菜素内酯(BR)对番茄叶片气孔运动的影响及其调控机制[D]. 杭州: 浙江大学, 2012. Gao C J. Effect of brassinosteroid on stomatal movement and the regulation mechanism in tomato [D]. Hangzhou: Zhejiang University, 2012.
[14] 向芬, 李维, 刘红艳, 等. 茶树叶绿素测定方法的比较研究[J]. 茶叶通讯, 2016, 43(4): 37-40. Xiang F, Li W, Liu H Y, et al. Comparison methods of chlorophyll extraction in[J]. Journal of Tea Communication, 2016, 43(4): 37-40.
[15] 徐萍, 李进, 吕海英, 等. 干旱胁迫下水杨酸对银沙槐子叶表皮气孔开度的影响[J]. 植物生理学报, 2014, 50(4): 510-518. Xu P, Li J, Lv H Y, et al. Effect of salicylic acid on stomata aperture of epidermis incotyled under drought stress [J]. Plant Physiology Journal, 2014, 50(4): 510-518.
[16] Yu X L, Hu S, He C, et al. Chlorophyll metabolism in postharvest tea (L.) leaves: variations in color values, chlorophyll derivatives, and gene expression levels under different withering treatments [J]. Journal of Agricultural and Food Chemistry, 2019, 67(38): 10624-10636.
[17] 张东芝. 拟南芥油菜素内酯合成关键酶DWF4的功能研究[D]. 兰州: 兰州大学, 2018. Zhang D Z. Functional analyses of DWF4, a key enzyme in brassinosteroid biosynthesis pathway in[D]. Lanzhou: Lanzhou University, 2018.
[18] 李翔, 桑勤勤, 束胜, 等. 外源油菜素内酯对弱光下番茄幼苗光合碳同化关键酶及其基因的影响[J]. 园艺学报, 2016, 43(10): 2012-2020. Li X, Sang Q Q, Shu S, et al. Effects of epibrassinolide on the activities and gene expression of photosynthetic enzymes in tomato seedlings under low light [J]. Acta Horticulturae Sinica, 2016, 43(10): 2012-2020.
[19] Wu Z J, Tian C, Jiang Q, et al. Selection of suitable reference genes for qRT-PCR normalization during leaf development and hormonal stimuli in tea plant () [J]. Scientific Reports, 2016, 6(1): 19748. doi: 10.1038/srep19748.
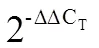
[21] Beale S I. Green genes gleaned [J]. Trends in Plant Science, 2005, 10(7): 309-312.
[22] Tanaka R, Kobayashi K, Masuda T. Tetrapyrrole metabolism in[J]. The Arabidopsis Book, 2011, 9(9): e0145. doi: 10.1199/tab.0145.
[23] Nagata N, Tanaka R, Satoh S, et al. Identification of a vinyl reductase gene for chlorophyll synthesis inand implications for the evolution of prochlorococcus species [J]. The Plant Cell, 2005, 17(1): 233-240.
[24] 王峰, 陈玉真, 王秀萍, 等. 不同品种茶树叶片功能性状及光合特性的比较[J]. 茶叶科学, 2016, 36(3): 285-292. Wang F, Chen Y Z, Wang X P, et al. Comparison of leaf functional and photosynthetic characteristics in different tea cultivars [J]. Journal of Tea Science, 2016, 36(3): 285-292.
[25] 李蒙, 束胜, 郭世荣, 等. 24-表油菜素内酯对樱桃番茄光合特性和果实品质的影响[J]. 西北植物学报, 2015, 35(1): 138-145. Li M, Shu S, Guo S R, et al. Effect of 24-brassinolides on photosynthetic characteristics and fruit quality of cherry tomato [J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(1): 138-145.
[26] 胡文海, 黄黎锋, 毛伟华, 等. 油菜素内酯对黄瓜苗期叶片光合机构调节作用的研究[J]. 园艺学报, 2006, 33(4): 762-766. Hu W H, Huang L F, Mao W H, et al. Role of brassinosteroids in the regulation of photosynthetic apparatus in cucumber leaves [J]. Acta Horticulturae Sinica, 2006, 33(4): 762-766.
[27] 王平荣, 张帆涛, 高家旭, 等. 高等植物叶绿素生物合成的研究进展[J]. 西北植物学报, 2009, 29(3): 629-636. Wang P R, Zhang F T, Gao J X, et al. An overview of chlorophyll biosynthesis in higher plants [J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(3): 629-636.
[28] Judith S, Botis H, Bernhard G. Overexpression ofencoding glutamyl-tRNA reductase [J]. Journal of Plant Physiology, 2011, 168(12): 1372-1379.
[29] 冯晓雪. 油菜素内酯对红地球葡萄生理生化特性和品质的影响[D]. 兰州: 甘肃农业大学, 2014.Feng X X. Effect of natural brassinolide on physiological, biochemical characteristics and fruit quality of red globe grape [D]. Lanzhou: Gansu Agricultural University, 2014.
[30] 李翔. 外源油菜素内酯对弱光胁迫下番茄幼苗生长及碳同化的影响[D]. 南京: 南京农业大学, 2016. Li X. The effects of growth and carbon assimilation process of tomato under low light stress by applying exogenous epibrassinolide [D]. Nanjing: Nanjing Agricultural University, 2016.
[31] 岳健敏, 张金池, 尤焱煌, 等. 油菜素内酯对盐胁迫刺槐苗光合作用及叶绿体超微结构的影响[J]. 西北农林科技大学学报(自然科学版), 2017, 45(10): 56-66. Yue J M, Zhang J C, You Y H, et al. Effects of brassinosteroids on photosynthesis and ultrastructure of chloroplasts inseedlings under salt stress [J]. Journal of Northwest A&F University (Natural Science Edition), 2017, 45(10): 56-66.
[32] 李治鑫, 李鑫, 范利超, 等. 外源油菜素内酯对茶树光合特性的影响[J]. 茶叶科学, 2015, 35(6): 543-550. Li Z X, Li X, Fan L C, et al. Effects of exogenous 24-epibrassinolide on the photosynthetic characteristics of tea plants () [J]. Journal of Tea Science, 2015, 35(6): 543-550.
[33] Çağ S, Gören-Sağlam N, Çıngıl-Barış Ç, et al. The effect of different concentration of epibrassinolide on chlorophyll, protein and anthocyanin content and peroxidase activity in excised red cabbage (L.) cotyledons [J]. Biotechnology & Biotechnological Equipment, 2007, 21(4): 422-425.
[34] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis [J]. Annual Review of Plant Biology, 1982, 33(1): 317-345.
[35] 毕焕改, 王美玲, 姜振升, 等. 亚适温弱光对黄瓜幼苗光合酶活性和基因表达的影响[J]. 应用生态学报, 2011, 22(11): 2894-2900. Bi H G, Wang M L, Jiang Z S, et al. Impacts of suboptimal temperature and low light intensity on the activities and gene expression of photosynthetic enzymes in cucumber seedling leaves [J]. Chinese Journal of Applied Ecology, 2011, 22(11): 2894-2900.
[36] Jiang D A, Lu Q, Weng X Y, et al. Regulation of rubisco carboxylation activity and photosynthetic rate by rubisco activase during leaf senescence in rice [J]. Journal of Zhejiang University Agriculture and Life Sciences, 2000, 26(2): 119-124.
[37] Raines C A. The Calvin cycle revisited [J]. Photosynthesis Research, 2003, 75(1): 1-10.
[38] Iwaki T, Wadano A, Yokota A, et al. Aldolase: an important enzyme in controlling the ribulose 1,5-bisphosphate regeneration rate in photosynthesis [J]. Plant and Cell Physiology, 1991, 32(7): 1083-1091.
[39] 何晓玲. 外源硒对NaCl胁迫下加工番茄幼苗光合碳同化的影响[D]. 石河子: 石河子大学, 2015. He X L. Effect of exogenous Se on photosynthetic carbon assimilation in tomato seedlings under NaCl stress [D]. Shihezi: Shihezi University, 2015.
[40] Henkes S, Sonnewald U, Badur R, et al. A small decrease of plastid transketolase activity in antisense tobacco transformants has dramatic effects on photosynthesis and phenylpropanoid metabolism [J]. The Plant Cell, 2001, 13(3): 535-551.
[41] 司建萍. 胡杨油菜素类固醇激素合成酶基因()和()在拟南芥生长发育中的作用[D]. 兰州: 兰州大学, 2016. Si J P. Functional analyses ofbrassinosteroid hormone biosynthesis enzyme genes() and() in the regulation of growth and development of[D]. Lanzhou: Lanzhou University, 2016.
[42] Noguchi T, Fujioka S, Takatsuto S, et al. Arabidopsisis defective in the conversion of (24)-24-methylcholest-4-en- 3-one to (24)-24-methyl-5α-cholestan-3-one in brassinosteroid biosynthesis [J]. Plant Physiology, 1999, 120(3): 833-839.
[43] Ohnishi T, Szatmari A M, Watanabe B, et al. C-23 hydroxylation byCYP90C1 and CYP90D1 reveals a novel shortcut in brassinosteroid biosynthesis [J]. The Plant Cell, 2006, 18(11): 3275-3288.
[44] Iqbal M, Ashraf M, Shafiq-ur-Rehman, et al. Does polyamine seed pretreatment modulate growth and levels of some plant growth regulators in hexaploidy wheat (L.) plants under salt stress? [J]. Botanical Studies, 2006, 47(3): 239-250.
[45] 孙超, 黎家. 油菜素甾醇类激素的生物合成、代谢及信号转导[J]. 植物生理学报, 2017, 53(3): 291-307. Sun C, Li J. Biosynthesis, catabolism, and signal transduction of brassinosteroids [J]. Plant Physiology Journal, 2017, 53(3): 291-307.
Effects of Exogenous 24-Epibrassinolide on Photosynthetic Characteristics of Tea Plants
WAN Qiwen, YANG Ni, LI Yimin, HAN Miaohua, LIN Shijia, TENG Ruimin, ZHUANG Jing*
Tea Science Research Institute, College of Horticulture, Nanjing Agricultural University, Nanjing 210095, China
With tea plant cultivar ‘Zhongcha 108’ as the test material, the effects of spraying EBR with different concentrations (0.10, 0.30, 0.50 mg·L-1) on the chlorophyll content, stomatal aperture, photosynthetic gas exchange parameters and related gene expression of tea leaves were studied. The results show that spraying 0.10 and 0.30 mg·L-1EBR on leaves significantly increased the chlorophyll content of tea leaves on the first day after treatment. Compared with the control condition, chlorophyll content increased by 38.89% and 22.22%, respectively. On the third and fifth days after treatment, the stomatal aperture of tea leaves treated with 0.10 and 0.30 mg·L-1EBR increased significantly. On the first and fifth days after treatment, spraying EBR significantly increased the net photosynthetic rate of tea leaves. At the same time, EBR treatment could significantly up-regulate the expressions of genes involved in BR biosynthesis, chlorophyll biosynthesis, and carbon assimilation. These results indicate that exogenous EBR increased the chlorophyll content and stomata aperture of tea leaves by regulating the expression of related genes, which ultimately promoted the photosynthetic rate of tea plants.
tea plant, 24-epibrassinolide, chlorophyll, photosynthetic characteristics, gene expression
S571.1
A
1000-369X(2021)01-058-13
2020-09-02
2020-10-28
江苏省农业科技自主创新资金项目(CX(20)3114)、国家自然科学基金(31870681)、江苏高校优势学科建设项目(PAPD)
万绮雯,女,硕士研究生,主要从事茶树分子生物学研究,2019804238@njau.edu.cn。*通信作者:zhuangjing@njau.edu.cn
(责任编辑:黄晨)
