CD34在肺腺癌浸润性病灶诊断中的意义
2021-02-06杨柳任兴昌吴丽娟杨文伟舒畅方敏
杨柳 任兴昌* 吴丽娟 杨文伟 舒畅 方敏
目前认为大多数肺腺癌是通过肺泡上皮腺瘤样不典型增生(AAH)发展成为微浸润腺癌,最终成为浸润性腺癌,因所处的时间阶段不同,其细胞形态与相关组织结构发生多样性变化,在病理诊断工作中,经常可以观察到一些组织结构非常复杂的现象与经典的原位腺癌诊断标准存在一定差别,给临床诊断带来困惑[1]。除了疾病本身发展的多样性,还包括手术中、制片过程中组织挤压等,冰冻切片后肺泡结构塌陷,肺泡内组织细胞增多等情况下,原位腺癌与贴壁型、腺泡型等,浸润性癌的形态重叠,难以准确辨认,需要借助免疫组化表达鉴别病变的性质和范围。本文探讨CD34在肺腺癌中判断是否有浸润性改变的应用价值。
1 资料与方法
1.1 临床材料 选择2015年1月至2019年12月本院肺腺癌标本患者100例,确诊为原发性非小细胞肺癌(NSCLC),包括穿刺标本9例及亚肺叶切除(肺段切除、楔形切除)91例。其中原位腺癌18例,微浸润性腺癌23例,贴壁为主型肺腺癌10例。其余均为浸润性肺腺癌,包含腺泡为主型腺癌21例,乳头为主型腺癌9例,微乳头为主型腺癌7例,实体为主型伴黏液产生腺癌12例。所有病理切片均采用苏木精-伊红(HE)染色,行免疫组化,包括CD34、CD31、F8、Ki67、P53、TTF-1、NapsinA。并回顾性分析病史,电话随访,复阅切片。
1.2 方法 收录的样本均使用浓度为10%福尔马林完成固定,规范取材,常规脱水、透明、经石蜡完成包埋,制成规格为4 μm厚连续切片并行HE染及免疫组化染色。免疫组化采用EnVision 两步法,深达自动免疫组化仪,选择CD34、CD31、P53抗体和相关试剂盒为福州迈新公司出品;F8、Ki67、TTF-1、NapsinA为北京中杉公司出品。PH9.0一抗修复抗原,二抗购于厦门通灵生物医药公司,采用葡萄串式多聚法生产的二抗检测试剂,将阳性切片及自身阳性作为阳性对照。使用PBS用于替代一抗视为阴性对照组。
1.3 判定方式 免疫组化切片由2位经验丰富的病理科医师阅片审核。CD34以清晰棕黄色颗粒着色在肺泡壁毛细血管内皮细胞胞膜、胞质均匀完整的勾勒出毛细血管网为完整表达,以毛细血管网缺乏连续性、消失为表达缺失;CD31为胞膜阳性,TTF-1、P53、Ki-67为核着色,天冬氨酸蛋白酶Napsin-A、F8阳性部位为胞质。
1.4 观察指标 免疫组化标记物CD34、CD31、F8、TTF-1、Napsin-A、ki-67、P53在肺腺癌中的表达情况、患者年龄、性别、吸烟史、淋巴结及远处转移、脉管癌栓、是否复发、死亡率。
1.5 统计学方法 采用SPSS 25.0统计学软件。计量资料用t检验,计数资料用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 常用血管内皮相关标记物对肺泡壁结构的显示情况及TTF-1、NapsinA对肺腺癌的免疫组化表达情况CD31、F8均不能勾勒出肺泡壁的结构;CD34于非肿瘤性肺泡及贴壁生长的原位腺癌区均能较好显示肺泡壁的网状结构(见图1)。原位腺癌及贴壁生长的腺癌中,肿瘤上皮细胞伴行肺泡壁结构呈现棕黄色均匀完整的表达肺泡壁毛细血管网结构,连续性好,清晰可见,在有组织细胞充填肺泡腔或肺泡纤维增厚显著的区域仍能容易判别肺泡壁结构的完整性;而在微浸润及浸润性癌中CD34呈现的肺泡壁毛细血管网不同程度表达消失,混乱,缺乏连续性,肺泡壁被肿瘤相关纤维组织增生破坏,血管少而稀疏(见图2、3)。两者CD34间质表达情况差异有统计学意义(P<0.01)。腺癌组织TTF-1与NapsinA总体表达率分别为100%和97.5%。
2.2 各类型肺腺癌中CD34、P53、Ki67的表达与临床病理特征的关系 CD34所标记诊断的早期腺癌及微浸润性腺癌的平均年龄低于浸润性腺癌(P<0.05)。腺癌总体性别女性大于男性(63% vs 37%)。浸润性癌吸烟率高于早期腺癌。淋巴结转移率、脉管癌栓,复发率和死亡率比较,浸润性腺癌明显高于早期腺癌(P<0.05)。见表1。
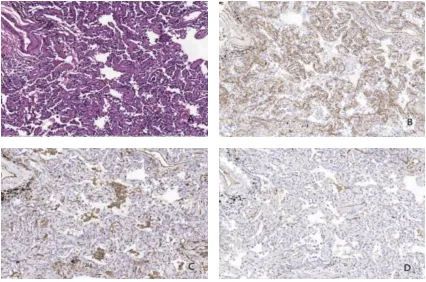
图1 A. 原位癌,HE染色(×10.0)。B. CD34标记肺泡壁毛细血管网完整,癌细胞局限在肺泡壁内。C. CD31血管及组织细胞阳性(×10.0)。D. F8(×10.0)

图2 A. HE染色 原位癌(×3.0)。B. CD34标记完整肺泡结构,证实癌细胞局限在肺泡壁内。C. HE染色 微浸润性癌(×3.0)。D. CD34在原位癌1区域肺泡结构呈阳性表达,在微浸润性2区域表达缺失。E. HE染色 浸润性癌(×3.0)。F. 浸润性癌CD34肺泡结构中断,缺失

图3 A. 乳头为主型腺癌,HE染色(×3.0);B. 对照乳头为主型腺癌CD34标记的毛细血管网大部分中断、消失(×3.0);C. 实性为主型伴黏液产生微浸润性癌,HE染色(×10.0);D.对照实性为主型伴黏液产生微浸润性癌CD34标记的毛细血管网绝大部分消失(×10.0);E. 腺泡为主型腺癌(×10.0),HE染色;F. 对照腺泡为主腺癌CD34标记的肺泡结构大部分消失。G. 微乳头为主型腺癌,HE染色(×3.0);G. 对照微乳头为主的腺癌CD34标记的毛细血管网部分中断,消失(×3.0)

表1 各类型肺腺癌中CD34、P53、Ki67的表达与临床病理特征的关系(%)
3 讨论
近年来,我国肺癌发生概率呈现出上升趋势。较多国家,腺癌已超过鳞状细胞癌成为最常见的组织学亚型[2]。根据肺癌患者所处的肿瘤分期差异,与患者病情及身体耐受情况所选的治疗方案有所不同,如化疗、手术、放疗及联合放化疗等,而患者的生存期也不同。大多数肺癌患者发现病患时已为晚期,失去手术治疗机会,预后差,死亡率高,而据统计原位腺癌和微浸润腺癌,患者手术后5年生存率为100%,手术切除范围小,患者生活质量高[3]。因此,肺癌早期诊断及系统化治疗方案对肺癌的治疗起重要效果。其能够增加肺癌患者的生存时间[4]。
从肺泡上皮腺瘤样不典型增生(AAH)发展成为微浸润腺癌,进而成为浸润性腺癌的演变过程中,因原位腺癌发生时间长短不一,不同区域肿瘤形态有明显差异,某些原位癌区域生长活跃,某些原位癌区域肺泡萎缩脱落,周围肺间质纤维组织增生,而造成原有肺泡组织结构多形,而形成的假浸润与肿瘤细胞推挤肺泡壁,使肺泡萎缩、塌陷进而肿瘤取代肺间隔纤维瘢痕的真浸润相鉴别[1]。虽然世界卫生组织与国际多学科肺腺癌分类已经对肺腺癌制定了完整的分类标准,但在临床工作中原位癌与微浸润性腺癌、及前者与腺泡为主型腺癌的鉴别诊断经常会受到阻碍,尤其是与腺泡为主型的肺腺癌的鉴别困难,有时形态学难以具体体现或在制片过程中组织受到挤压,及冰冻切片后剩余组织中,原位腺癌与浸润性癌的形态重叠也会给病理医师产生困惑。这时免疫组化指标CD34的染色结果,可以为评估肺泡结构提供额外的帮助。
CD34属于血管内皮标志物。因在发育及成熟的个体中,一切血管内皮细胞均体现出CD34高表达状态。因此,CD34通常被用于血管内皮细胞典型标志物。经免疫组化染色显现血管内皮,能够全面体现出肺腺癌肿瘤间质浸润情况与肿瘤生物学特点,但在临床病理诊断过程中,要排除肺纤维化等其他非肿瘤性导致肺泡结构破坏的情况。而同样作为血管内皮免疫组化标记物,CD31曾被认为是一种最为敏感的血管内皮标志物,但其在造血组织如血小板、巨噬细胞和淋巴细胞等炎性细胞中也可以表达[5],尤其在出血区域易着色,背景脏乱,及肺泡巨噬细胞丰富的病例时,CD31的染色结果可能会使人困惑[6]。F8是一种最早被运用到临床的血管内皮标志物[7],可以显现大、小血管,在血管肿瘤中其阳性表达率可达95%[8],但不能完整表达肺泡壁结构,尤其在组织挤压变形更不易辨认。经临床病理工作中发现,F8与CD31均不能较好显示肺泡间隔气体交换的毛细血管网,不能判断肺泡壁结构存在与否。多种器官基底型上皮细胞和肌上皮细胞标记物CK5/6和p63在外周气道上皮均有表达,但不表达于肺泡上皮细胞[9]。
研究证明,CD34通过显示肺泡壁毛细血管网完整或消失帮助判别肺腺癌是否有浸润是有临床意义的。病理医师遇到原位癌与腺泡型腺癌诊断困难,通过CD34诊断21例,原位癌与微浸润性腺癌诊断困难14例,其他病例HE染色与CD34的免疫组化表达诊断一致。在表达为浸润性腺癌的病例中淋巴结转移、脉管癌栓、复发率与死亡率明显高于早期腺癌(P<0.05)。TTF-1蛋白阳性颗粒定位于细胞核,Napsin-A阳性定位于胞质,在腺癌组织总体阳性率表达分别为100%和97.5%。Ki-67在浸润性腺癌的阳性率明显比早期腺癌的范围高,P53在浸润性腺癌的突变率比在腺癌的范围高(P<0.01)。表明CD34在判断肺腺癌是否有浸润的临床意义的准确性。综上所述,随着新版肺腺癌的推广,长期的临床实验表明,免疫组化标记CD34在临床早期肺癌与浸润性肺癌的鉴别诊断起到了重要的作用,成为临床早期肺癌有效的辅助诊断。
