砷胁迫对湿地植物香蒲生长的影响及其耐受性分析
2021-02-05杨桂英刘云根李梦莹
任 伟,杨桂英,刘云根,3,刘 雪,李梦莹,赵 蓉,王 妍,3**
(1. 西南林业大学 生态与环境学院,云南 昆明 650224;2. 长江三峡技术经济发展有限公司 北京 100038;3. 西南林业大学 水科学与工程中心,云南 昆明 650224)
砷和砷的化合物是具有危害性的环境污染物,严重威胁着人体健康[1]. 近年来,砷污染严重威胁着我国湖泊、河流和水库等地表水环境安全[2]. 鉴于湖泊湿地面域辽阔、水文条件复杂,采用物理、化学方法进行大面积治理尚难以实现[3],且易带来其他次生环境风险,使得植物修复成为目前备受关注的生态治理方法. 自Ma等[4]发现蜈蚣草(Pteris vittata)能超富集砷以来,已发现砷超富集植物20多种(包括变种)[5],如大叶井口边草(Pteris Cretica)[6]、傅氏凤尾厥(Pteris fauriei)及裸子蕨科的粉叶厥(Pityrogramma calomelanos)[7]等. 由于超富集植物普遍存在生长缓慢、生物量低、经济效益低等缺陷,导致重金属迁移总量相对不高[8],限制了其在植物修复工程中的应用推广. 在自然环境中存在一些对重金属耐性较强的植物,尽管其体内重金属含量不能达到超积累植物的量,但其重金属迁移总量仍较可观[9],如王爱云等[10]发现白花三叶草和高羊茅在治理铬污染土壤有一定的潜在应用价值,董萌等[4]发现蒌蒿对镉富集能力较强,这些植物对重金属污染的修复作用不可忽视.
砷的超富集植物多为陆生植物,水生植物中砷超富集种鲜有报道. 香蒲是多年生水生或沼生草本植物,多生于湖泊、沟渠、沼泽及河流缓流带,被公认为湿地植物中的优势品种[11-12],对环境胁迫耐性较强,但目前关于香蒲对砷胁迫的响应机制及耐受性还鲜见报道. 本研究采用室内模拟的方式,探析香蒲在不同浓度砷胁迫下的生长特性、生理反应以及其对砷的耐受性,以期为砷污染的河湖滨湿地保护和生态恢复提供科学依据.
1 材料与方法
1.1 供试植物与土壤供试植株取自昆明市海云绿化苗木有限公司苗木基地的当年生香蒲萌发苗,筛选高度一致(株高约35 cm),长势良好的植株作为供试植物. 供试土壤取自昆明市跑马山海拔1 900 m处的低洼地段,将土壤样品采回后自然阴干、锤碎、磨细后过4 mm筛备用,基本性质如表1.
1.2 试验设置本研究模拟湿地环境,通过添加Na2HAsO4·7H2O的方式设置土壤中As(以As5+计)质量比分别为0(CK)、50、100、150、200、600 mg·kg−16个处理,每个处理3个重复,具体方法如下.

表 1 供试土壤的基本性质Tab. 1 Physical and chemical properties of the tested soil
(1)使用黑色聚乙烯塑胶桶(高 32 cm,口径48 cm,底径 32 cm)作为湿地模拟装置,每桶装入10 kg干土和10 L纯净水,并按不同试验处理加入Na2HAsO4·7H2O,使土壤成粘稠状,充分混匀,自然放置平衡一周后用于试验.
(2)在湿地模拟装置中等间距栽种6株香蒲幼苗,并统一添加等量基肥(m(N)∶m(P2O5)∶m(K2O)为 16∶16∶16),于 45 d 后进行取样. 期间保持一致的水肥管理,土壤始终处于淹水状态. 选取植株第2~3层叶片(从上至下),每个处理采集6片叶磨碎混匀,进行各项生理指标的测定. 将收获的植株用 0.01 mol·L−1乙二胺四乙酸二钠(DETA)与蒸馏水洗净,用滤纸吸去外部水分,测定株高、根长、侧芽数. 分别采集植株地上部(新叶+枯叶)和地下部样品,在 105 ℃ 下杀青 30 min,70 ℃ 烘干至恒重,粉碎后用于测定砷质量比w(As).
1.3 样品分析与计算
1.3.1 植物生理指标测定 利用 SPAD-502 便携式叶绿素测定仪测定相对叶绿素含量(CCI);丙二醛(MDA)、还原型谷胱甘肽(GSH)含量采用北京索莱宝科技有限公司的试剂盒及Multiskan FC酶标仪测定,所有指标测定为3次重复.
1.3.2 样品中w(As)的测定 植物、土壤样品采用 HNO3-HClO4-H2SO4消解的方法(GB/T 5009.11—1996). 所有样品测定过程中均设置空白对照和重复,使用双道氢化物原子荧光光度计(AFS-810,北京吉天)测定其中w(As).
1.3.3 相关计算方法
(1)香蒲对土壤中砷的富集与转运系数,其计算公式为:


式中,wo为香蒲地上部砷质量比(mg·kg−1),wr为香蒲地下部砷质量比(mg·kg−1),wi为香蒲不同部位砷质量比(mg·kg−1),ws为试验土壤中砷质量比(mg·kg−1);香蒲不同部位包括地上部与地下部,其中地上部包括枯叶和新叶.
(2)香蒲对砷胁迫的耐受性综合评价方法,首先参考Metwally等[13]方法,将砷胁迫下香蒲各性状指标统一以耐性指数表示,耐性指数计算公式为:

式中,L为各处理组香蒲性状指标参数,Lck为对照组香蒲性状指标参数.
对各单项指标进行主成分分析,将原来多个彼此相关的指标转换成新的少数几个彼此独立的综合指标,主成分分析采用SPSS21. 0进行. 建立综合指标Zj方程[14],其计算公式为:

式中,Zj表示某w(As)第j个综合指标值,bij表示第j个综合指标第i个指标的载荷,xi表示w(As)第i个指标的标准化后的耐性指数.
采用隶属函数法对不同土壤w(As)胁迫下的香蒲进行综合评价,利用公式(5)计算耐砷综合评价D值,其计算公式为:
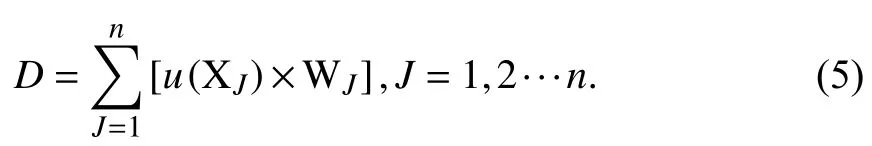
1.4 数据分析采用 Microsoft Office Excel 2010处理生长及生理指标测定值;应用SPSS 21. 0对数据进行相关分析(Pearson)和P=0.05水平下的方差分析(ANOVA);统计数据采用Origin 2018软件绘图.
2 结果与分析
2.1 砷胁迫对香蒲生长状况的影响由表2可知,随着供试土壤中w(As)的增加,香蒲的株高和根长在 0~ 150 mg·kg−1呈 上 升 趋 势 , 在 150 mg·kg−1附近达到峰值,分别达到106.57、38.42 cm,且与其它处理间差异显著(P<0.05). 大于150 mg·kg−1的砷胁迫下呈下降趋势,随着供试土壤中w(As)的增加,香蒲的地上部和地下部干重可能由于植株的个体差异存在波动,但整体都呈现出先升后降趋势,且150 mg·kg−1处理与其它处理间差异显著(P<0.05).土壤中w(As)达到 200 mg·kg−1时香蒲植株矮小,侧芽个数减少,根部生长受到抑制,须根明显减少,出现断根现象,枯叶随外源砷含量增加而增加,表现为强毒性.

表 2 砷胁迫对香蒲生长特性的影响Tab. 2 Effect of arsenic stress on the growth of Typha angustifolia
2.2 砷胁迫对香蒲生理特征的影响叶绿素含量是表现植物光合作用强弱的一个重要生理指标,直接标志着植物生长的能力[15]. 从图1(a)可以看出,随着土壤中w(As)的增加香蒲叶尖相对绿叶素含量亦呈现出先增加后减少的趋势. 叶尖、叶中的相对叶绿素含量均在 150 mg·kg−1砷处理下达到最高值,且与其它处理差异显著(P<0.05).
从图1(b)可以看出,随着供试土壤中w(As)增加,香蒲地上部与地下部MDA含量均表现出先升后降的趋势,且地上部MDA含量一直明显高于地下部. 当土壤中w(As)为 100 mg·kg−1时地下部 MDA含量最高,而地上部MDA含量在土壤中w(As)为200 mg·kg−1砷处理下最高. 地上与地下部 MDA 含量分别在土壤中w(As)达到 200、600 mg·kg−1时低于CK. 生物体的防御体系中,除了抗氧化酶参与酶性抗氧化系统外,还有谷胱甘肽(GSH)等非酶类抗氧化物质[16]. 由图 1(c)可知,随着供试土壤中w(As)增加,植物体内GSH 含量先升后降,地上部高于地下部;在土壤中w(As)大于 200 mg·kg−1砷胁迫下,GSH 含量开始下降. 如表 3 所示,通过 CCI、MDA含量和GSH含量相关性分析,表明叶尖相对叶绿素与地上部MDA含量之间呈显著负相关,地下部GSH含量与MDA含量之间呈极显著正相关.
2.3 砷在香蒲体内的积累与分布由图 2(a)可见,砷胁迫下香蒲体内不同部位砷的积累存在差异. 香蒲地上部与地下部砷含量随着土壤中w(As)的升高而不断增加,且各处理间差异显著(P<0.05). 当砷质量比为 600 mg·kg−1时,地上与地下部砷的质量比均达到最大,分别为 187.75、465.16 mg·kg−1.富集系数反映植物体对重金属的富集能力,而转运系数则反映重金属在植物体内的运输和分配情况[10].香蒲地上部、地下部对砷富集系数均值分别为0.21、0.63(表4),地下部富集系数是地上部2.5~4.5倍,植物地下部对砷的富集能力高于地上部. 随着土壤中w(As)的增加,香蒲的转运系数呈波动式上升,转运系数平均值为 0.26<1,在 600 mg·kg−1砷处理下达到峰值(0.40). 如图 2(b)所示,从植物地上部的新叶与老叶分析可知,香蒲新叶与枯叶砷含量随着土壤中w(As)的增加,总体呈增加趋势,且各处理间差异显著(P<0.05). 由表 4 可知,枯叶与新叶对砷的富集系数均值分别为0.60、0.05,枯叶富集系数达新叶38.7~4.1倍,两者对砷的富集水平差异较大.

图 1 砷胁迫对香蒲 CCI,MDA 含量,GSH 含量的影响Fig. 1 Effect of arsenic stress on relative chlorophyll content,MDA and GSH contents in Typha angustifolia
2.4 香蒲对砷胁迫的耐受性分析按照公式(3)进行耐性指数计算得出表5,进一步分析香蒲对砷的耐受性. 侧芽数在土壤中w(As)为 50 mg·kg−1处理下耐性指数最大,比对照增加了77.78%;但是香蒲株高、根长、地上部干重、地下部干重、叶尖CCI和叶中 CCI,在土壤中w(As)为 150 mg·kg−1砷胁迫下达到最大;而香蒲MDA与GSH耐受性指数大小却呈现波动式变化. 综合以上结果,不同土壤w(As)对各指标的影响不同,用不同单项指标的耐性指数来评价香蒲砷的耐受性,评价结果亦会不同. 这种现象说明香蒲对As的耐受性是一个复杂的综合性状,单个指标难以真正反映出植物砷的耐性,采用多指标综合评价,才更具有客观性和科学性. 如表6所示,研究采用主成分分析,将原11个单项指标转换为5个新的综合指标Z1、Z2、Z3、Z4和Z5,其积累贡献效率达到了91.89%,反映11个指标的信息.
利用隶属函数加权平均法,依据Z1~Z5综合指标的方差贡献率,根据公式(3)计算香蒲耐受性的综合评价值D值,D值为[0~1]闭区间的纯数,其反映了香蒲的综合耐受能力的大小,数值越大,表明耐As的能力越强,并根据D值对香蒲的砷耐受性排序. 参考CK的综合评价D值对其进行分级,如表 7 所示. 在土壤w(As)为 150 mg·kg−1时香蒲对砷的耐性综合评价D值大于0.5,对砷的耐受程度最高;100、50、200 mg·kg−1的D值在 0.35~0.5之间,香蒲表现出较强的耐受性;只有 600 mg·kg−1砷处理低于CK的D值0.35,对砷的耐受性表现为较弱的程度. 整体而言土壤中w(As)为0 ~200 mg·kg−1时,砷对香蒲生长具有促进作用,随着砷质量比的升高,砷对香蒲生长出现抑制作用.
3 讨论
砷不是植物的必需元素,但有研究发现,微量砷可以刺激植物的生长发育[17],合理的施用Ca3(AsO4)2会使小麦、大豆等得到有效增产[18]. 过量的砷在土壤中可危害植物的生长,引起植物在生物性状等方面的异常[19]. 本试验表明,随着土壤中w(As)增加,香蒲株高、根长、植株干重、侧芽数等指标均表现出先增后减的趋势(表2),砷胁迫对香蒲生长起到低促高抑的作用,这与砷超富集植物蜈蚣草相类似[4-6]. 研究表明,低浓度重金属会促进香蒲叶绿素形成,而高浓度则抑制其叶绿素的形成[15].本研究也表明在高浓度砷胁迫条件下,香蒲对光能的利用效率降低. 香蒲叶尖 CCI低于叶中(图 2(a)),可能由于砷被叶片吸收后多富集于维管束鞘和栅栏组织[20],通过叶脉转移至叶尖,促使叶绿素酶活性增强,增加叶绿素分解[21],光合作用下降,进而促使叶尖叶色变淡甚至出现黄化现象. MDA是反应组织细胞膜损伤程度的重要指标,胁迫环境中,植物细胞原生质膜中的活性物质可与不饱和脂肪酸发生过氧化作用产生的丙二醛交联[22],形成脂褐素,进而促使质膜系统受到伤害,干扰细胞的正常活动. 在同一时期MDA积累量低,表示植物抵逆性强[23];MDA积累量高,反之亦然. 本研究表明,一定浓度范围内香蒲MDA含量均随土壤中w(As)增加而表现出先上升后下降的趋势,但在高浓度砷胁迫下,MDA 含量却低于 CK(图 2(b)),表明高砷胁迫下细胞膜脂过氧化作用加剧,胞膜性系统难以维持平衡,香蒲地下先于地上部被打破平衡,可能是由于植物地下部最先受砷胁迫导致. GSH在维持机体氧化状态的平衡中起重要作用,是组织细胞抗氧化损伤的主要抗氧化物质,能够敏感并综合反应组织的氧化应激能力及受损程度. 本试验说明,适量砷胁迫下促使香蒲自我保护机制的启动,低砷刺激下GSH被诱导,促使GSH含量升高以减轻对植株的损伤,大于 200 mg·kg−1高砷胁迫下,形成过量的诱导已经超出叶片GSH的清除能力,并造成了叶片中抗氧化酶系统的紊乱[24],致使GSH含量开始下降,产生大量活性氧自由基植物细胞,使平衡遭到破坏,产生的活性氧自由基开始抑制抗氧化酶的活性,表现出酶活性下降[25]. 砷胁迫下香蒲体内地上部GSH含量高于地下部,亦说明砷对植物生长的影响机制复杂,砷胁迫对植物的不同组织器官具有不同的生物学效应. 严明理等[26]对铀对油菜幼苗生长和生理特征的影响研究发现植物组织
中MDA含量与绿素含量呈显著负相关. 在本研究中叶尖相对叶绿素含量与地上部MDA含量之间同样呈显著负相关(表3),主要原因是MDA为高活性的脂质过氧化物,可与脂类、核酸、糖类及蛋白质发生交联作用[27]而影响质膜和叶绿体片层膜的结构和功能,影响膜的流动性及其与酶的结合力. MDA含量可影响位于片层上的叶绿素含量[28],因此,在砷胁迫下,从植物叶绿素含量,即从香蒲叶尖颜色的变化,判断植株受砷胁迫的强弱程度,与韩东英等[29]在老芒麦和香根草的研究相符. 地下部GSH含量与MDA含量之间呈极显著正相关,可能是由于在AsA-GSH循环中,AsA是一种强抗氧化剂,在APX作用下氧化为MDA,GSH将MDA的歧化物还原成AsA,使H2O2分解为H2O[24],最终GSH含量影响MDA含量的高低.

表 3 砷胁迫下香蒲生理特性相关性分析Tab. 3 Correlation analysis of physiological characteristics of Typha angustifolia under arsenic stress
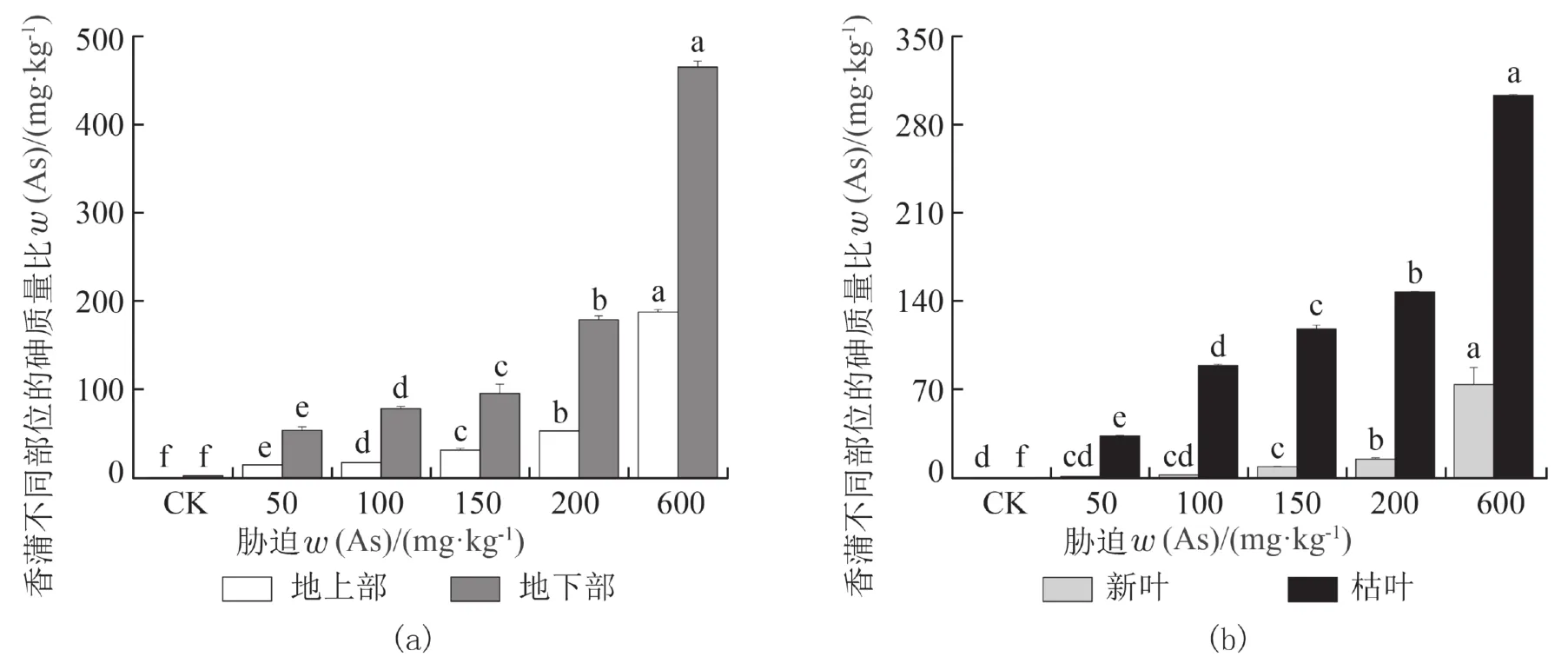
图 2 砷胁迫下香蒲不同部位的砷质量比Fig. 2 The content of arsenic in different parts of Typha angustifolia under arsenic stress
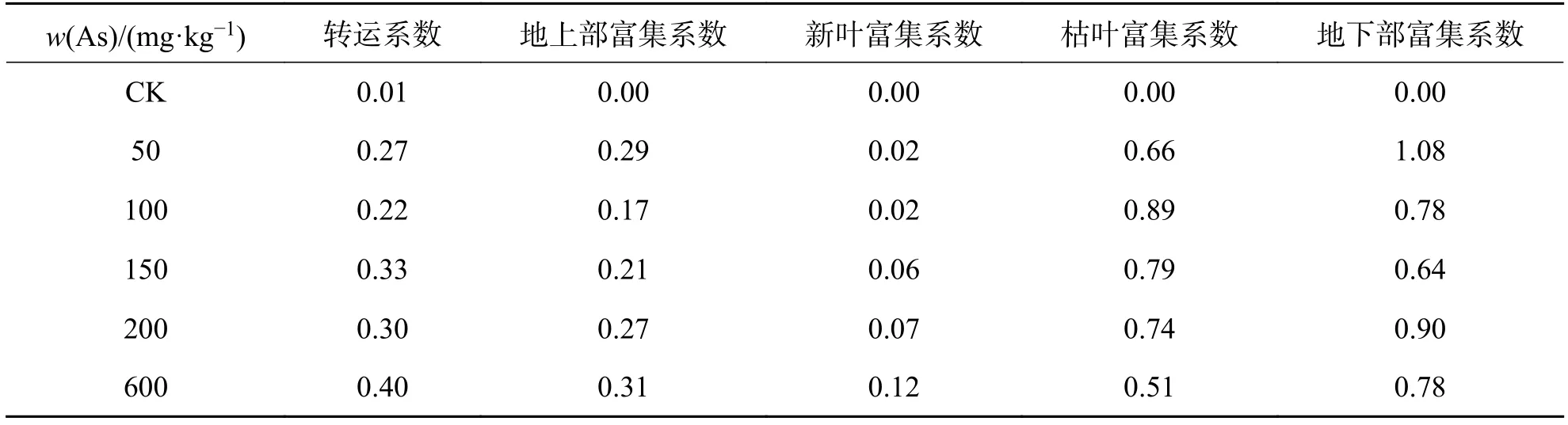
表 4 砷胁迫下香蒲对 As 的转运富集Tab. 4 The arsenic bioconcentration factor and transfer factor of Typha angustifolia under arsenic stress

表 5 砷胁迫下湿地植物香蒲各生物指标的耐性指数Tab. 5 Tolerance index of various biological indicators of Typha angustifolia under arsenic stress
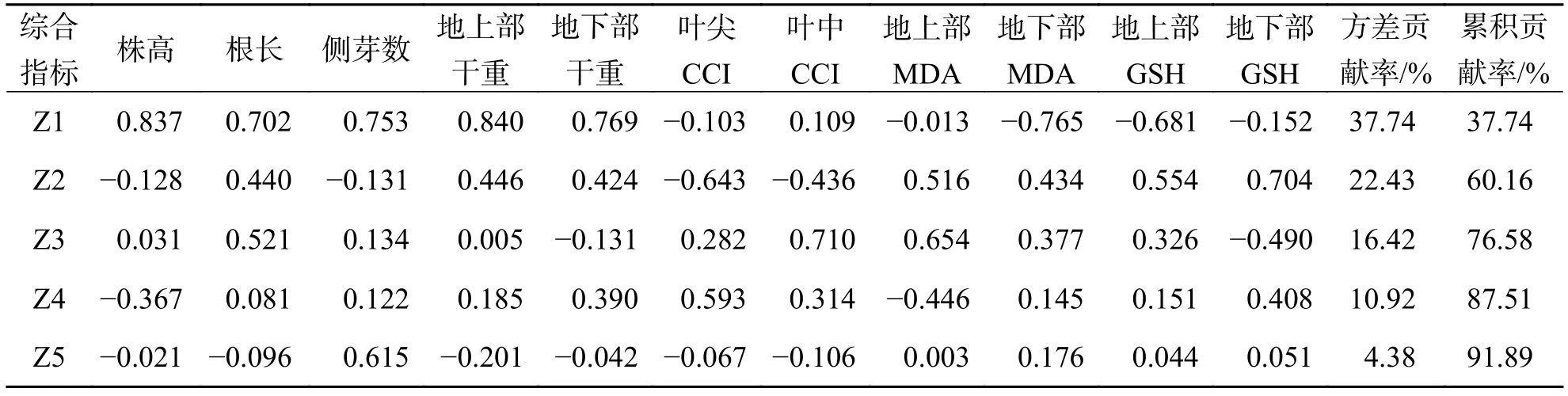
表 6 各综合指标的系数及贡献效率Tab. 6 The coefficient and contribution efficiency of each integrated indicators

表 7 砷胁迫下香蒲耐受性综合评价Tab. 7 Comprehensive evaluation of Typha angustifolia under arsenic stress
重金属积累能力的大小是修复植物选择的一个重要指标. 香蒲不同部位砷含量,随土壤中w(As)增加呈现剂量依赖效应,香蒲地上部砷积累浓度最大值 187.75 mg·kg−1低于 Baker等[30]提出的参考值(砷超积累植株地上部砷质量比必须在1 000 mg·kg−1以上),说明香蒲对砷具有一定的累积能力,并非超富集. 从整体来看无论土壤中w(As)增加低或高,香蒲不同部位对砷富集能力存在差异,其大小顺序为地下部>地上部,枯叶>新叶. 由此可见,香蒲通过地下部的吸收富集进而把砷阻隔在地下部,降低对植物地上部的危害度,香蒲将砷转移至枯老叶部以保护植株最具生命力的器官. 砷被植物根部吸收后不易向地上部分转运,在Bragato等[31]、Jesteban等[32]的研究中也出现了类似现象. 这种现象可能是由于香蒲吸收的砷大部分以难溶态形式积累在根部[33],与根部细胞壁中的配体发生包括离子交换、吸附、络合、沉淀和结晶在内的多种反应[34-35],形成重金属螯合物固定在液泡中,致使其向地上部分的转移不易发生,也可能是香蒲相对氧化的根际微环境,使其根表面形成铁膜,进而砷被强烈吸附在根部铁膜上的原因[36].
在砷污染的湖泊河流中,阳宗海和大屯海湖滨湿地底泥中砷的富集程度为 10~81 mg·kg−1[37]和160~780 mg·kg−1[38]. 有研究表明[39],我国水体表层底泥中 As质量比为 4.0~980.6 mg·kg−1. 从香蒲的综合耐受性评价来看,香蒲可在含砷低于150 mg·kg−1土壤中健康生长;高于 600 mg·kg−1土壤中,砷对香蒲的毒害效应显现,处于生长抑制状态. 结合上述砷污染河湖湿地底泥的砷污染程度,香蒲可在大部分砷污染河湖湿地底泥中生长,具有较强的耐受性,表明在砷污染河湖滨湿地及土壤治理中,香蒲具有一定的潜在应用价值.
4 结论
(1)砷胁迫对湿地植物香蒲表现出低促高抑的作用;香蒲体内叶绿素、MDA和GSH含量均呈先增加后降低的规律;且不同植物组织器官具有不同的生物学效应,地上部对砷胁迫相对敏感,地下部抗逆性强. 香蒲对砷的防御体系中,相关指标存在耦合关联性,通过香蒲叶尖颜色的变化,可以判断植株受砷胁迫的强弱程度.
(2)不同砷浓度胁迫下,其不同部位对砷的积累浓度存在差异,均反映出剂量依赖效应,高低顺序为:地下部>地上部,枯叶>新叶;且表现出不同的转运富集能力. 植株通过阻隔砷在地下部,以降低对地上部的毒害效应,砷被转移至老叶枯叶部以保护植株最具生命力的器官免受伤害.
(3)香蒲对不同浓度砷胁迫下的香蒲耐受性综合评价表明,香蒲对砷具有较强的耐受性.
