三七提取物大鼠体内3种皂苷成分测定方法建立及药代动力学研究
2021-02-05代秋琼刘红斌崔佳丽赵高琼周艺佳王京昆
代秋琼,刘红斌,崔佳丽,赵高琼,周艺佳,梅 晶,王京昆
(1. 云南中医药大学,云南 昆明 650500;2. 云南省药物研究所,云南 昆明 650111;3. 云南白药集团创新研发中心,云南 昆明 650111;4. 云南省中药和民族药新药创制企业重点实验室,云南 昆明 650111)
三七提取物为三七主根、三七剪口、三七大根、三七叶、三七花等多个药用部位混合提取后的浸膏加药用辅料而制成的拟申报临床的新药,其主药为三七. 三七味甘、微苦、性温、归肝、胃经,为五加 科 人 参 属 植 物 (Panax notoginseng(Burk) F.H.Chenion)的干燥根及根茎[1],又名参三七、田七、山漆、金不换等,是我国著名传统中药. 三七总皂苷是其主要成分,临床应用于心脑血管疾病以及免疫、老年痴呆、肿瘤等疾病[2-9]. 迄今为止,已从三七总皂苷(total saponins ofPanax notoginseng)中分离并鉴别出多种单体皂苷成分,如人参皂苷(Ginsenoside) Rb1、Rd、Re、Rg1和 Rg2,三七皂苷(Notoginsenoaide) R1、R2、R3和 R4等[10]. 这些成分均属于达玛烷型(Dammarane type)四环三萜皂苷,其中 Rg1、Rb1、R1为《中国药典(2015版)》第一部<三七>质量标准控制成分,故本研究选择Rg1、Rb1、R1作为检测指标成分,以血浆中Rg1、Rb1、R1的质量浓度表征三七提取物在大鼠体内的暴露量[1]. 因此,本试验针对三七提取物中的Rg1、Rb1和R1建立高专属性、高灵敏度的HPLC-MS/MS检测方法并对方法进行验证,同时研究了大鼠灌胃三七提取物后上述各活性成分的血浆药代动力学特征.
1 试验材料
1.1 仪器Agilent 1200SLHPLC(美国安捷伦科技有限公司);API3200 Q-Trap质谱仪(美国 AB公司);台式高速冷冻离心机 (Allegra 64 R,美国Beckman公司);XW-80A涡旋混合器(上海精科实业有限公司);MD200氮气吹扫仪(杭州奥盛仪器有限公司);96孔板固相萃取装置(美国Waters);eppendorf移液器(德国eppendorf公司);电子天平(DV215CD,上海OHAUS公司).
1.2 试药三七提取物(云南省药物研究所自制);人参皂苷 Rg1对照品(w=92.4%,批号:110703−201832,中国食品药品检定研究院);人参皂苷Rb1对照品(w=91.2%,批号:110704−201827,中国食品药品检定研究院);人参皂苷R1对照品(w=93.1%,批号:110745−201820,中国食品药品检定研究院);盐酸普萘洛尔(Pro)对照品(按C16H21NO2·HCl计,w=100%;批号:100783−201202,中国食品药品检定研究院);甲醇、甲酸为色谱纯,水为超纯水.
1.3 动物6 只 SPF 级 SD 大鼠,8~9 周龄,雌雄各半,(240±40) g,北京维通利华实验动物技术有限公司提供,动物生产许可证号:SCXK(京)2012−0001,研究通过云南省药物研究所实验动物福利伦理委员会(IACUC)审查通过.
2 方法
2.1 质谱及质谱条件
2.1.1 色 谱 条 件 色 谱 柱 : XBridge BEH C18Column(75 mm×φ4.6 mm,2.5 μm),Waters,USA;流动相A:甲醇,B:0.01%甲酸−水;梯度洗脱方式见表 1. 流速 500 μL·min−1,柱温 20 ℃;进样量 10 μL.
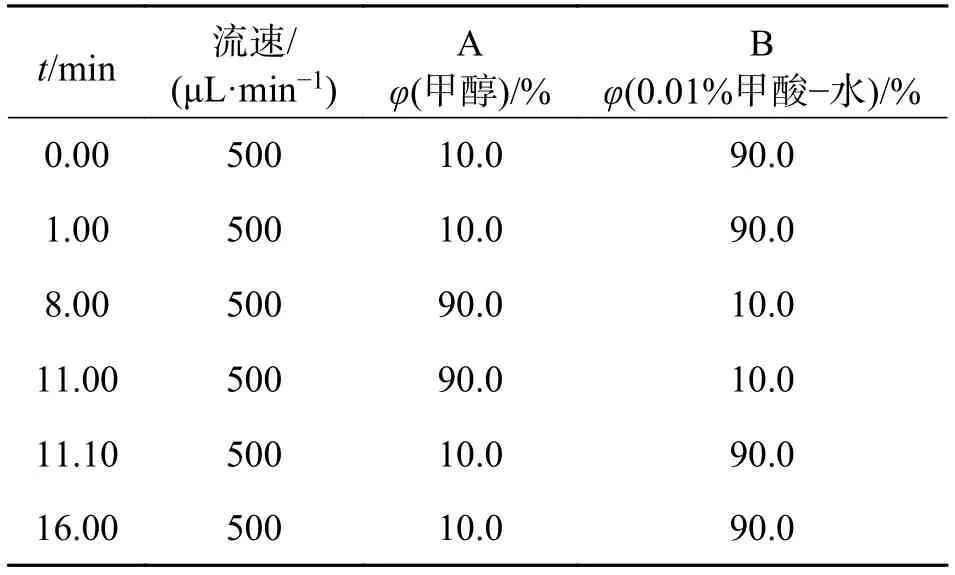
表 1 流动相梯度洗脱表Tab. 1 The gradient elution table of mobile phase
2.1.2 质谱条件 电喷雾离子源(ESI),采用正离子多反应监测(MRM)方式进行检测. 对质谱参数进行优化,优化后的质谱参数:气帘气(CUR)172.38 kPa, 喷 雾 电 压 (IS)5 500.00 V, 雾 化 温 度(TEM)650.0 ℃ , 雾 化 气 (GS1)413.7 kPa, 辅 助 气(GS2)413.7 kPa,碰撞气 (CAD)medium. 人参皂苷Rg1[M + Na]+m/z:823.40,定量/定性碎片离子m/z:203.20/643.60;人参皂苷 Rb1[M + Na]+m/z:1 131.50,定量/定性碎片离子m/z:365.10/789.20;三七皂苷R1[M + Na]+m/z:955.60,定量/定性碎片离子m/z:775.50/335.30; 盐 酸 普 萘 洛 尔 (Pro)[M + H]+m/z:260.20,定量/定性碎片离子m/z:155.10/183.10.
2.2 储备液和工作液的配制分别精密称取 Rg1、Rb1、R1化学对照品各2份,置于相应25 mL容量瓶中,加甲醇溶解并定容至刻度,摇匀,得Rg1、Rb1、R1质量浓度分别为0.667 4、0.613 4 mg·mL−1,0.539 2、0.513 9 mg·mL−1, 0.584 1、 0.563 0 mg·mL−1的 高 、低质量浓度标准储备液.
上述各化合物高质量浓度储备液用甲醇逐级稀释得Rg1、Rb1质量浓度范围分别为2.625~231.8 ng·mL−1、10.32~421.2 ng·mL−1的混合校正标准工作液,R1质量浓度范围为 6.500~265.5 ng·mL−1的校正标准工作液,备用. 各校正标准工作液用于制备标准曲线.
上述各化合物低质量浓度储备液用甲醇逐级稀释得 Rg1、Rb1质量浓度分别为 7.660、53.60、166.1 ng·mL−1,29.82、125.2、313.2 ng·mL−1的低、中、高质量浓度混合质控标准工作液,R1质量浓度为 19.02、79.85、199.6 ng·mL−1的低、中、高质量浓度质控标准工作液,备用. 质控标准工作液用于制备质控样品.
用甲醇为溶剂配制质量浓度为 320.0 ng·mL−1的盐酸普萘洛尔内标工作液,备用.
2.3 三七提取物给药制剂配制精密称定三七提取物 3.000 8 g 置于研钵中,将 20 mL 的 5% 羧甲基纤维素钠溶液少量多次加入并不断研磨,直至形成质量浓度为 0.15 g·mL−1均匀混悬液. 灌胃大鼠前,充分混匀以保证给药量准确.
2.4 三七提取物药代动力学实验与血样采集动物给药前禁食12 h以上、禁食期间自由饮水,给药后 4 h 统一喂饲. 每只动物按体重以 10 mL·kg−1的给药容积经口灌胃给予配制好的三七提取物给药制剂,使给药剂量为 1.5 g·kg−1. 分别于给药前及给药后 5、15、30 min,1、2、4、8、24、48 h眼底静脉丛取血 0.5 mL,3 000 r·min−1离心 15 min,分离血浆,−20 ℃下冻存、待测定.
2.5 血浆样品的处理方法Waters Oasis μElution HLB 固相萃取板以 300 μL甲醇、300 μL 超纯水顺序活化,备用.
检测Rg1、Rb1血浆样品时的处理方法:精密吸取 40 μL 大鼠含药血浆,涡旋混合 2 min,加入50 μL 1% 甲酸水溶液,涡旋混合 2 min,后完全转移至已活化固相萃取板中,依序分别加200 μL超纯水、200 μL 25% 甲醇淋洗,200 μL 甲醇洗脱,精密移取洗脱液 160 μL,加入 10 μL 内标工作液,涡旋混匀,15 000 r·min−1室温离心 10 min,取上清液进行HPLC-MS/MS分析检测.
检测R1血浆样品时的处理方法:精密吸取200 μL 大鼠含药血浆,其它同“检测 Rg1、Rb1血浆样品时的处理方法”(上一段).
2.6 数据统计采用 Analyst软件采集检测信号并拟合标准曲线,计算血浆样品测定值. 采用DAS 3.3.0 药代动力学程序计算AUC0−t、AUC0−∞、t1/2MRT、VZ/F、CLZ/F等主要药代参数,ρmax、tmax采用实测值,其它采用统计矩参数. 其中:AUC为药物质量浓度−时间曲线下面积,MRT为平均滞留时间,VZ/F为表观分布容积,CLZ/F为清除率,t1/2为半衰期,ρmax为达峰质量浓度,tmax为达峰时间. 采用Excel对方法学数据以及药代动力学数据进行计算与统计分析.
3 方法学验证与结果
3.1 特异性以2.1项下的检测条件分别进样空白血浆样品、空白血浆加标样品,测定,获得提取测定离子流图,见图1. 结果显示血浆中内源性物质不影响人参皂苷Rg1、人参皂苷Rb1、三七皂苷R1和盐酸普萘洛尔的检测,方法特异性良好.
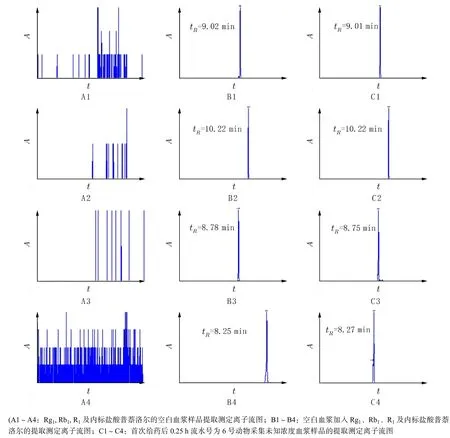
图 1 特异性考察图谱Fig. 1 Specificity MRM chromatograms
3.2 标准曲线及定量下限精密移取 10 μL 校正标准工作液至离心管中,常温氮气吹干,按血浆样品处理方法精密加入相应体积的大鼠空白血浆,涡旋混合2 min,得到不同质量浓度标准曲线样品,处理,测定. 以检测目标物峰面积(As)和内标峰面积(Ai)的比值为纵坐标Y,血药质量浓度为横坐标X,采用加权最小二乘法拟合(权重1/X2),标准曲线测定结果见表2.
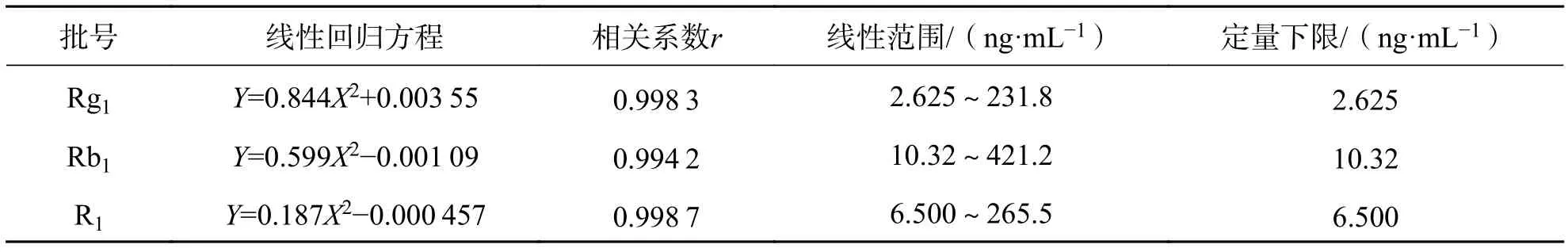
表 2 混合对照品中 Rg1、Rb1、R1 的标准曲线、线性范围及定量下限Tab. 2 Standard curves, linear ranges and lower quantitative limits of Rg1, Rb1, and R1 in mixed reference materials
3.3 精密度与准确度连续 3 d 处理 3 批定量下限、低、中、高4个质量浓度的血浆样品,每个质量浓度平行5份,测定结果见表3. 结果显示,精密度与准确度结果符合生物样品分析检测要求.
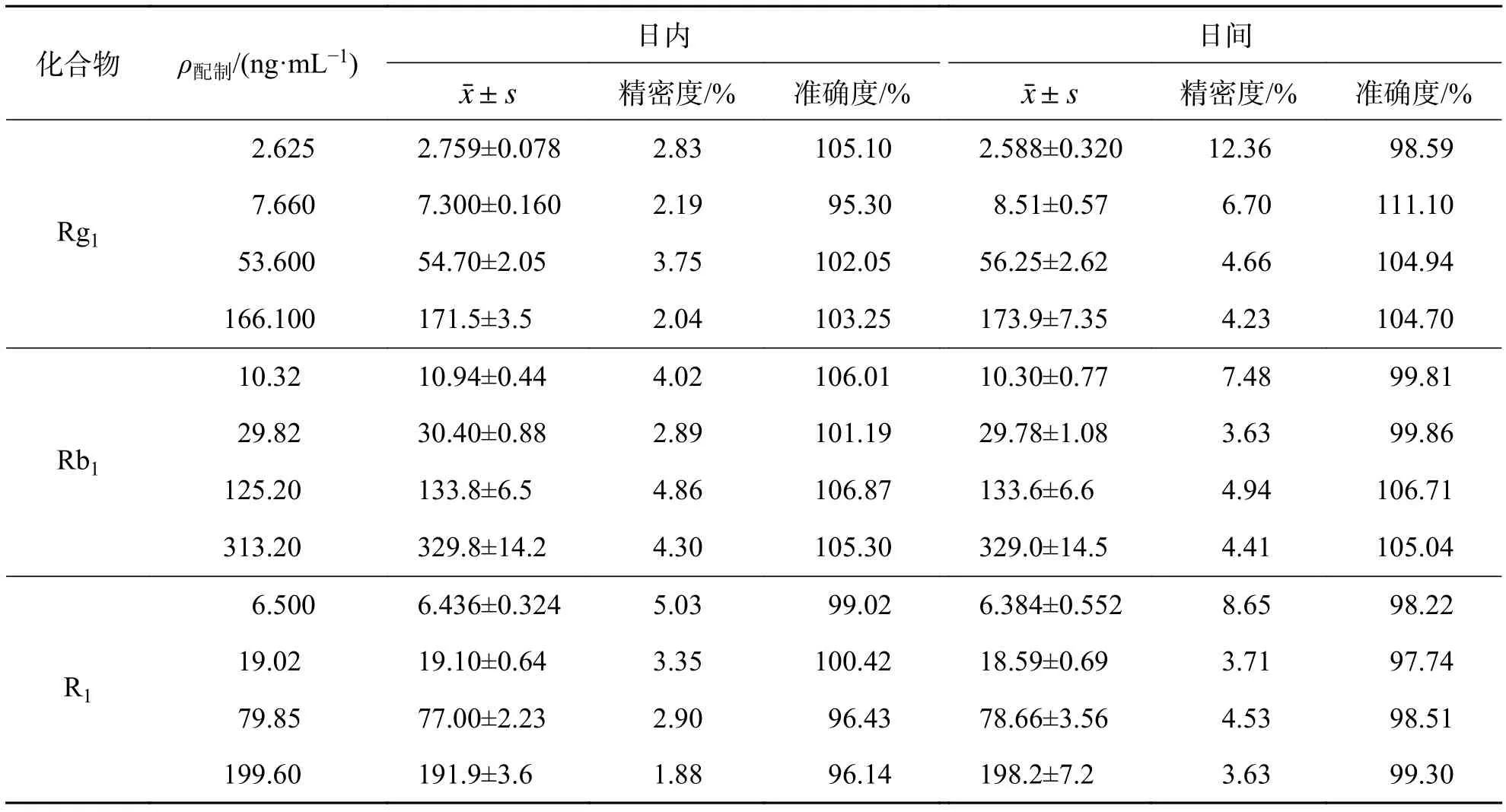
表 3 Rg1、Rb1、R1 在大鼠血浆中的精密度、准确度(n = 5)Tab. 3 Precision and accuracy of Rg1, Rb1 and R1 in beagle dogplasma (n = 5)
3.4 基质效应取来源于6个不同批次的大鼠空白血浆,提取空白基质,常温氮气吹干,低、中、高质量浓度质控标准工作液及内标溶液复溶、超声后取上清测定;随行测定复溶液,计算基质效应. 结果显示:Rg1、Rb1、R1低、中、高质量浓度归一化平均基质效应(91.58±15.59)%、(94.49±2.18)%、(82.75±4.74)%;说明基质对 Rg1、Rb1、R1的影响较小,且对各质量浓度影响程度一致,满足生物样品分析检测要求.
3.5 残留率以“线性最高质量浓度点样品−空白血浆样品”顺序交叉进样,计算空白血浆样品中残留峰面积与定量下限样品中峰面积比值评价残留率.结果显示Rg1、Rb1、R1残留率范围分别为7.97%~15.20%、0.53%~1.04%、0.60%~1.20%,均小于20%;内标盐酸普萘洛尔残留率范围0.04%~0.13%,小于5%;表明进样残留不影响样品的分析检测.
3.6 稳定性
3.6.1 标准储备液稳定性考察 处理、测定得到Rg1、Rb1、R1、盐酸普萘洛尔储备液于 2~8 ℃ 放置125 d后的峰面积与新鲜制备的标准溶液峰面积,计算两时间点相对偏差RE值分别为5.39%、2.87%、1.14%、0.59%,结果表明上述储备液于2~8 ℃ 至少可以放置 125 d.
3.6.2 质控样品稳定性考察 分别考察低、中、高质量浓度血浆质控样品于室温放置1 d,−10~−35 ℃ 放置 72 d 及 72 d 内冻结—融化循环 5 次的稳定性,结果显示上述每一考察条件下,相对标准偏差RSD均小于15%. 表明血浆质控样品在上述考察条件下存放稳定.
3.7 药代动力学实验结果采用本文所建立的检测方法,对血浆样品进行检测. 血浆中Rg1、Rb1和R1的平均药时曲线见图2,体内主要药动学参数见表4.
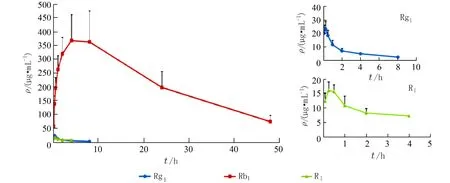
图 2 人参皂苷 Rg1、Rb1 和三七皂苷 R1 的平均药时曲线图Fig. 2 Average drug time curve of ginsenoside Rg1, Rb1 and notoginsenoside R1

表 4 SD大鼠单次经口灌胃三七提取物后血浆中人参皂苷Rb1、Rg1和三七皂苷R1的药代动力学参数Tab. 4 Pharmacokinetic parameters of ginsenoside Rg1, Rb1 and notoginsenoside R1 in plasma of SD rats after single oral administration of Notoginseng extract
4 讨论
本实验对血浆样品前处理进行考察,首先采用了沉淀法、固相萃取法对血浆样品进行考察[11-12],结果表明沉淀法的基质效应强、回收率低不能满足生物样品检测要求. 固相萃取法处理后所得血浆样品,用HPLC-MS/MS方法检测后结果可知,受血浆内源性物质的干扰较小,其残留率、回收率及精密度、准确度,均能达到生物样品检测要求,可为三七提取物的药代动力学研究以及临床用药和临床评价提供可借鉴的方法工具.
大鼠经口单次灌胃三七提取物1 500 mg/kg后,从获得的药代参数结果来看,平均AUC0-t、ρmax、t1/2、MRT0-t的数值大小,Rb1>> Rg1> R1,平均Tmax的数值大小,Rb1>> R1> Rg1;Rg1、R1 在大鼠体内具有相似的药代特征,吸收快、消除快;Rb1具有与Rg1、R1完全不同的药代特征,吸收慢、消除慢;在大鼠体内Rb1血浆暴露占绝对优势,血浆暴露量最大,AUC0-t分别为 Rg1、R1的 204、400倍,ρmax分别为 Rg1、R1的 16、24倍;从 Rg1、Rb1和R1的表观分布容积来看,Rb1可能主要分布于血浆中,Rg1、R1可能主要分布于组织和体液中,需要后续更深入的组织分布研究来进一步验证.
