ECE1过表达通过eNOS/NO通路促进Ang Ⅱ诱导的体外培养大鼠心肌细胞肥大和凋亡*
2021-02-05樊琼玲张雪莲张石蕾由淑萍
樊琼玲, 张雪莲, 杨 菲, 刘 涛, 赵 军, 张石蕾, 由淑萍△
(新疆医科大学 1护理学院,2公共卫生学院,3新疆维吾尔自治区药研所,新疆乌鲁木齐830011)
心脏肥大(cardiac hypertrophy)是心脏长期处于压力超负荷下的一种常见的适应性反应,其持续进展会导致心力衰竭[1-3]。研究表明,在心脏肥大的动物及细胞模型中,心肌细胞凋亡水平升高,增殖减少[3-4]。内皮素转换酶 1(endothelin-converting enzyme 1,ECE1)是血管收缩肽内皮素1(endothlin 1,ET-1)生成的限速酶,是ECE 家族的主要成员,在肺、心脏、血管内皮组织等重要器官均有表达,主要存在于细胞质中,对于调节ET-1 的生成和多种信号通路具有重要意义[5-6]。ET-1 与血管舒张物质一氧化氮(nitric oxide,NO)相互协调,共同控制血管的舒缩[7-8]。本课题组前期在压力超负荷大鼠心脏肥大模型中观察到ECE1基因甲基化水平降低和磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)/内皮型一氧化氮合酶(endothelial nitric oxide synthesis,eNOS)通路抑制[9-10]。但ECE1 在心脏肥大发生过程中与eNOS/NO信号通路的作用及具体机制仍不清楚。本研究旨在探讨过表达ECE1 对血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)诱导的体外培养大鼠H9C2 心肌细胞肥大和凋亡水平的影响及其机制。
材 料 和 方 法
1 细胞和实验主要材料
H9C2 大鼠心肌细胞株购自武汉普诺赛生命科技有限公司。ECE-1 过表达质粒(pEX-3-ECE1)和空载质粒(pEX-3-NC)购自上海吉玛有限公司;Ang Ⅱ购自APExBIO;DMEM 培养液、磷酸盐缓冲液(phosphate-buffered saline,PBS)、胎牛血清、胰蛋白酶和双抗溶液购自BI;Lipofectamine 2000 转染试剂购自Invitrogen;4×上样缓冲液和NO 含量检测试剂盒购自Solarbio;彩虹蛋白Marker 和BCA 蛋白检测试剂盒购自Thermo;FITC 偶联的Annexin-Ⅴ凋亡检测试剂盒购自BD Biosciences Pharmingen;快速质粒小量抽提试剂盒购自天根生化科技(北京)有限公司;兔抗p-eNOS 和 β-actin 单克隆抗体购自 Bioss;兔抗 Bax 单克隆抗体购自Cell Signaling Technology;兔抗Bcl-2单克隆抗体购自Proteintech。基因扩增仪和Western blot相关实验仪器购自Bio-Rad;FluorChem E 凝胶成像仪购自ProteinSimple。
2 方法
2.1 细胞培养及分组 H9C2 心肌细胞用含10%胎牛血清和1%双抗的DMEM 培养液,于37℃、5% CO2的细胞培养箱中培养,当细胞生长密度至90%后以0.25% 胰酶消化,按 1∶2 或 1∶3 传代,以含 10% 二甲基亚砜的胎牛血清冻存细胞。选取生长良好的H9C2 细胞,随机分为空白对照(control)组、Ang Ⅱ组、Ang Ⅱ+ECE1 过表达(Ang Ⅱ+ECE1)组和 AngⅡ+阴性对照(Ang Ⅱ+NC)组。后两组先转染pEX-3-ECE1或pEX-3-NC后进行Ang Ⅱ刺激。
2.2 细胞转染 转染前1 d,用胰酶消化细胞,计数后接种于6 孔板中,以DMEM 培养液稀释质粒pEX-3-ECE1 及pEX-3-NC,与转染试剂Lipofectamine 2000充分混合后,静置20 min,于37℃培养箱中孵育5 h后,弃去原培养液更换为含10%胎牛血清的培养液培养48 h。
2.3 RT-qPCR 检测 mRNA 表达水平 以 Trizol 法提取H9C2 心肌细胞的总RNA 后纯化,用紫外分光光度计检测RNA 纯度,要求A260/A280>1.8。反转录RNA为cDNA,取 2 μL 产物进行扩增,20 μL 反应体系,扩增条件为:95℃ 30 s;95℃ 3 s,60℃ 30 s,40 个循环;95℃ 15 s,60℃ 60 s。实验重复 3 次,以 2-ΔΔCt法分析ECE1、ANP 和BNP mRNA 的相对表达水平。ECE1 的上游引物序列为5′-TCATCGGCTCACTCTCCAACTCC-3′,下 游 引 物 序 列 为 5′-CCTTCTTCCACCTGTGTTCTCTGC-3′;ANP 的上游引物序列为5′-GAGAGCGGACTAGGCTGCAA-3′,下游引物序列为 5′-TCAGTGGCAAlGCGACCAA-3′;BNP 的上游引物序列为 5′-CGGATTGGCGCAGTCAGTCG-3′,下游引物序列为 5′-AGAGCCGCAGGCAGAGTCAG-3′;内参照β-actin 的上游引物序列为5′-TGTCACCAACTGGGAGGATA-3′,下游引物序列为 5′-GGGGTGTTGAAGGTCTCAAA-3′。
2.4 CCK-8 法检测细胞活力 将各组细胞接种于96 孔板,每孔5×103个细胞+100 μL 培养液,在37℃、5% CO2培养箱中培养24 h 后,每孔加入CCK-8 溶液10 μL,37℃孵育2 h,在酶标仪中检测450 nm处的吸光度(A450值)。细胞活力(%)=(实验孔A450值-空白孔A450值)/(对照孔A450值-空白孔A450值)×100%。
2.5 流式细胞术检测细胞凋亡 PBS 清洗细胞2次后,加入胰酶消化细胞,离心后计数,将细胞接种于6孔板,每孔 5×106个,培养 24 h 后收集细胞;用 PBS 洗涤,加入300 μL 结合缓冲液重悬细胞,再加入5 μL Annexin V-FITC 后混匀,室温下避光15 min;上机前5 min 加入 5 μL 碘化丙啶及 200 μL 结合缓冲液,流式细胞术分析心肌细胞的凋亡水平。
2.6 Western blot 法检测蛋白表达水平 预冷的PBS 清洗细胞 2 次后,加入 100 μL RIPA 裂解液和 1 μL蛋白酶抑制剂(或1 μL蛋白磷酸酶抑制剂),每隔5 min 吹打一次细胞,30 min 后用细胞刮刀刮下细胞,收集细胞后以12 879×g离心20 min后,用移液器吸取上清。BCA 法测定蛋白浓度后,取30 μg 样品,加入上样缓冲液,在100℃下热变性5 min,10%SDSPAGE 分离蛋白后,电转至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜,5%脱脂牛奶封闭2 h。将PVDF 膜加入Ⅰ抗中,4℃孵育过夜,TBST 溶液洗3次,每次5 min;加入Ⅱ抗,室温孵育1 h,TBST溶液洗3 次,每次10 min。在FluorChem E 凝胶成像仪上拍照并分析条带灰度值,每个条带重复测量3 次,计算目的蛋白相对表达量。
2.7 硝酸还原酶法检测NO 含量 根据NO 含量检测试剂盒说明书检测H9C2 细胞培养液中的NO 含量。试剂混匀后,4℃静置15 min,以对照管调零,用1 mL 玻璃比色皿测定各组波长550 nm 处的吸光度(A550值),根据所得标准曲线计算NO含量。
3 统计学处理
采用SPSS 25.0 软件进行统计分析。结果以均数±标准差(mean±SD)表示。多组间数据比较采用单因素方差分析,组间多重比较采用LSD 法。以P<0.05为差异有统计学意义。
结 果
1 转染后H9C2 心肌细胞中ECE1 的mRNA 及蛋白表达水平的变化
RT-qPCR 和Western blot 实验结果显示,与空白对照组相比,Ang Ⅱ组ECE1的mRNA和蛋白表达水平显著增加(P<0.05);与Ang Ⅱ组相比,Ang Ⅱ+ECE1 过表达组ECE1 的mRNA 和蛋白表达水平进一步增加(P<0.05),见图1。
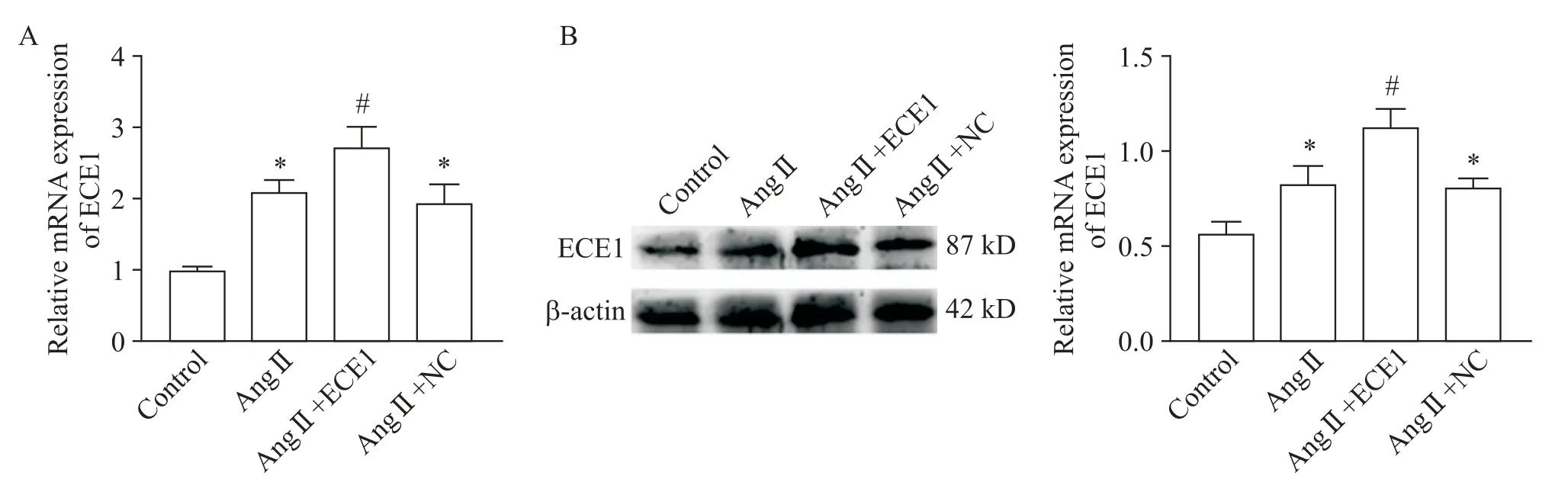
Figure 1.The expression of ECE1 in H9C2 cells after transfection.A:the mRNA expression level of ECE1;B:the protein expression level of ECE1.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs Ang Ⅱ group.图1 转染后ECE1的mRNA及蛋白表达水平
2 过表达ECE1对Ang Ⅱ诱导的H9C2心肌细胞中心脏肥大因子ANP和BNP mRNA表达的影响
RT-qPCR 结果显示,与空白对照组相比,Ang Ⅱ组ANP和BNP的mRNA表达水平显著升高(P<0.05);与Ang Ⅱ组相比,Ang Ⅱ+ECE1过表达组ANP和BNP的mRNA表达水平进一步升高(P<0.05),见图2。
3 过表达ECE1对Ang Ⅱ诱导的H9C2心肌细胞活力影响
CCK-8 实验结果显示,与空白对照组相比,AngⅡ组H9C2细胞活力显著下降(P<0.05);与Ang Ⅱ组相比,Ang Ⅱ+ECE1 过表达组的细胞活力进一步下降(P<0.05),见图3。

Figure 2.The effect of ECE1 over-expression on the mRNA expression of cardiac hypertrophy factors ANP and BNP in Ang Ⅱ-induced H9C2 cells.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs Ang Ⅱ group.图2 过表达ECE1 对Ang Ⅱ诱导的H9C2 心肌细胞中心脏肥大因子ANP和BNP mRNA表达的影响
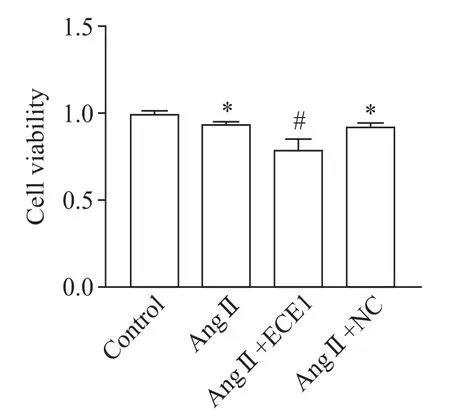
Figure 3.The effect of ECE1 over-expression on the viability of Ang Ⅱ -induced H9C2 cells.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs Ang Ⅱ group.图3 过表达ECE1对Ang Ⅱ诱导的H9C2细胞活力的影响
4 过表达ECE1对Ang Ⅱ诱导的H9C2心肌细胞凋亡水平的影响
流式细胞术结果显示,与空白对照组相比,AngⅡ组H9C2细胞凋亡率显著升高(P<0.05);与Ang Ⅱ组相比,Ang Ⅱ+ECE1 过表达组的细胞凋亡率进一步升高(P<0.05),见图4。
5 过表达ECE1 对凋亡相关蛋白Bax 和Bcl-2 表达的影响
Western blot 实验结果显示,与空白对照组相比,Ang Ⅱ组促凋亡蛋白Bax 表达水平显著升高,抗凋亡蛋白Bcl-2 表达水平显著下降(P<0.05);与AngⅡ组相比,Ang Ⅱ+ECE1 过表达组Bax 蛋白表达水平显著升高,Bcl-2 蛋白表达水平显著下降(P<0.05),见图5。

Figure 4.The effect of ECE1 over-expression on the apoptosis level of Ang Ⅱ-induced H9C2 cells.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs Ang Ⅱ group.图4 过表达ECE1对Ang Ⅱ诱导的H9C2心肌细胞凋亡水平的影响
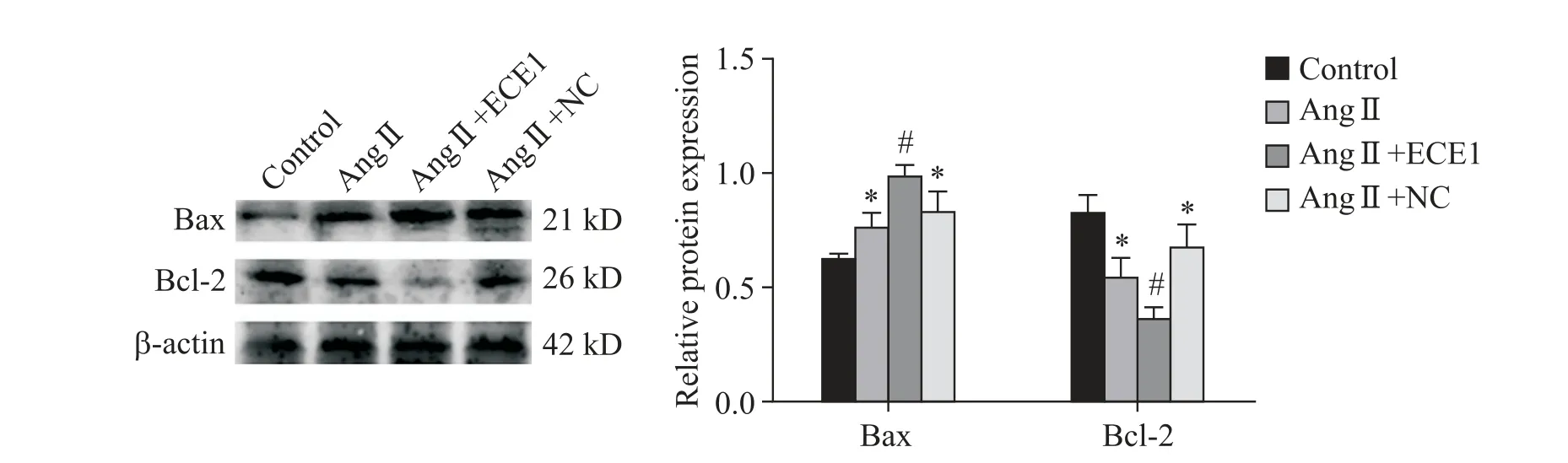
Figure 5.The effect of ECE1 over-expression on apoptosis proteins of Ang Ⅱ-induced H9C2 cells.A:the Western blot pictures of Bax and Bcl-2.B:the relative protein expressions of Bax and Bcl-2.Mean±SD.n=3.*P<0.05 vs control group;#P<0.05 vs Ang Ⅱgroup group.图5 过表达ECE1对Ang Ⅱ诱导的H9C2心肌细胞中凋亡蛋白Bax和Bcl-2的影响
6 过表达ECE1对eNOS蛋白及NO水平的影响
Western blot实验结果显示,各组eNOS蛋白表达水平无显著差异(P>0.05),见图6A。与空白对照组相比,Ang Ⅱ组p-eNOS 蛋白水平显著降低(P<0.05);与 Ang Ⅱ组相比,Ang Ⅱ+ECE1 过表达组 peNOS 蛋白水平进一步降低(P<0.05),见图6A。NO含量检测显示,与空白对照组相比,Ang Ⅱ组的NO含量显著降低(P<0.05);与Ang Ⅱ组相比,Ang Ⅱ+ECE1 过表达组的NO 含量进一步降低(P<0.05),见图6B。
讨 论
心脏肥大是高血压、冠心病等心血管疾病的独立危险因素[11-12],但其病理生理机制尚未阐明。ET-1是一种强大的血管收缩肽,已被证明是心脏肥大过程中的重要参与因子[13]。作为ET-1 生成最后一步反应的关键酶,ECE1 在调节ET-1 生成与心脏肥大的发展过程中发挥重要作用。有研究证实,ECE1在Ang Ⅱ诱导的心脏肥大过程中表达显著增加,ECE1下调可显著抑制Ang Ⅱ诱导的心脏肥大[14]。在本研究中,我们观察到过表达ECE1会显著促进Ang Ⅱ诱导的体外培养H9C2 心肌细胞中心脏肥大因子ANP和BNP 的mRNA 表达,并显著降低心肌细胞活力,证明ECE1与Ang Ⅱ诱导的心肌细胞肥大有密切关系。
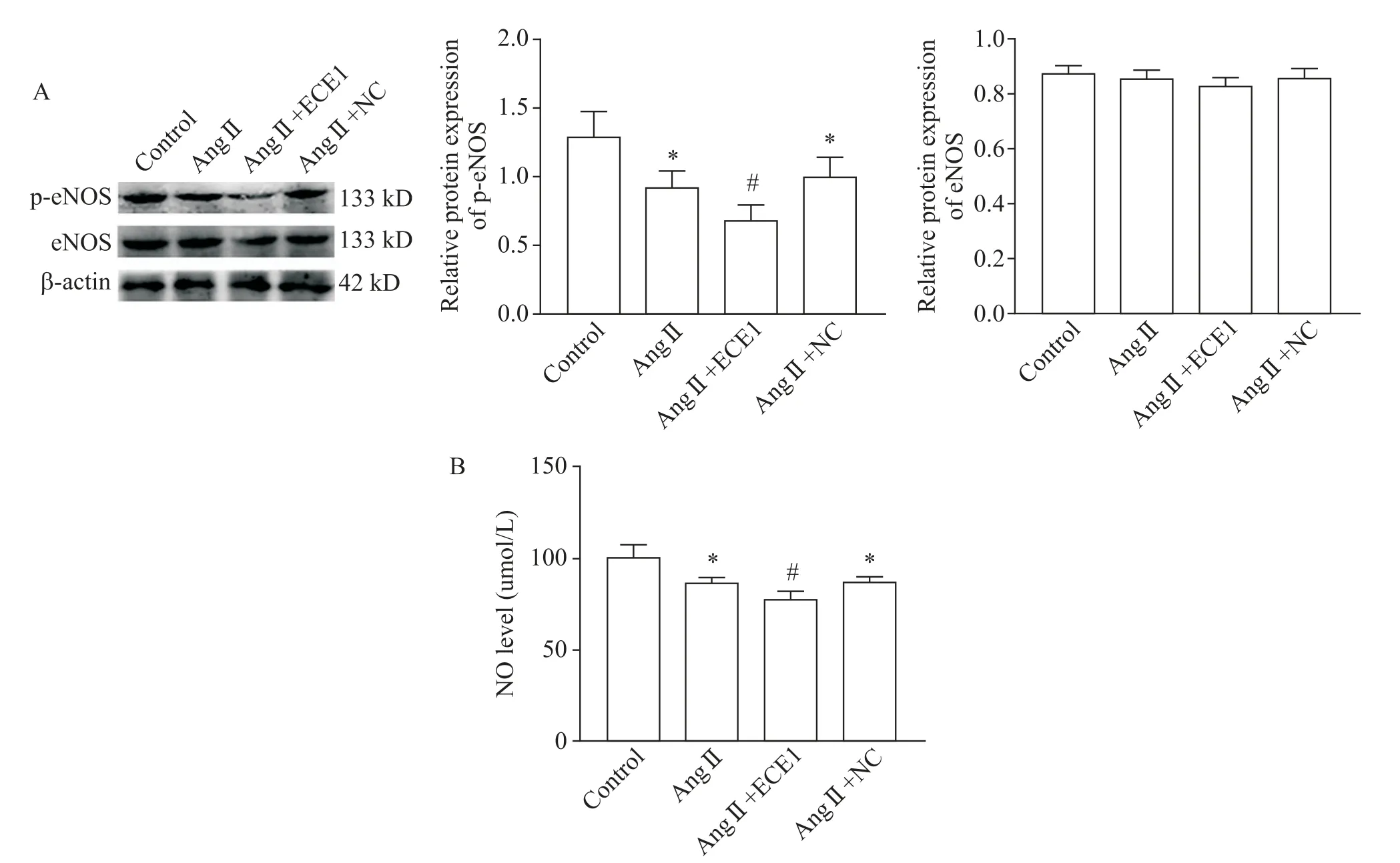
Figure 6.The effect of ECE1 over-expression on eNOS/NO signaling pathway.A:the protein expression levels of p-eNOS and eNOS detected by Western blot;B:the NO level.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs Ang Ⅱ group.图6 过表达ECE-1对eNOS/NO信号通路的影响
NO 与ET-1 是在血液循环中的一对血管舒张因子和收缩因子,在调节血管活动和血压中起到了重要作用[7,15]。研究表明,ET-1 可以通过 PI3K 途径、钙离子依赖途径及Rho kinase 途径等调控eNOS/NO通路,以调节 NO 的生成[16]。在肺内皮细胞中 NO 生成的一个重要途径是内皮素B 型受体介导的eNOS的激活[17]。我们在前期动物实验中检测到ECE1 在压力超负荷大鼠左室心肌组织中表达升高,且伴随eNOS/NO 通路的激活[10]。因此,本研究通过Western blot和硝酸还原法检测Ang Ⅱ诱导的H9C2心肌细胞中eNOS/NO信号通路的水平,并且通过ECE1过表达观察其是否对eNOS/NO 信号通路有影响。实验结果显示,心肌细胞中eNOS 总蛋白水平没有显著差异,但p-eNOS 蛋白水平及NO 含量在Ang Ⅱ的诱导下显著升高,且过表达ECE1 可进一步提高p-eNOS 蛋白水平及 NO 含量,表明 ECE1 可能通过 eNOS/NO 通路调节Ang Ⅱ诱导的H9C2心肌细胞肥大。
心肌细胞凋亡水平上升和增殖受阻是多种心血管疾病的重要病理过程,压力超负荷下的心肌细胞易发生凋亡和坏死[18]。已有研究证实,在阿霉素诱导的心肌病中,eNOS途径的激活可以介导心肌细胞凋亡下降[19]。Hoffmann 等[20]的研究表明,eNOS敲除在内皮细胞中显示出显著增强的凋亡诱导作用。为证实ECE1是否可以通过调控eNOS途径而对心肌细胞的凋亡产生作用,我们通过流式细胞术检测了ECE1 过表达后的凋亡水平及相关凋亡蛋白表达。实验结果显示,过表达ECE1后Ang Ⅱ诱导的心肌细胞凋亡率及Bax 表达水平显著上升,而Bcl-2 表达水平显著降低。这表明ECE1 可能通过抑制eNOS/NO信号通路调节H9C2心肌细胞凋亡。
综上所述,本研究显示,过表达ECE1 可降低Ang Ⅱ诱导的体外培养H9C2 心肌细胞活力,促进心肌细胞肥大和凋亡,其机制可能与过表达ECE1 后eNOS/NO信号通路的抑制有关。
