自噬标志物LC3的节律表达破坏参与β1-AA诱导的H9c2大鼠心肌细胞死亡*
2021-02-05贾微微李朋佳陆洁蓓王晓晖
贾微微, 宁 娜, 孙 聪, 李朋佳, 陆洁蓓, 张 晟,原 媛 , 王 丽 ,3, 王晓晖 ,3△
(山西医科大学基础医学院 1病理教研室,2形态学实验室,3基础医学研究中心,山西太原030001)
心功能不全是多种心脏疾病的终末阶段,是重要的全球公共健康问题,但发病机制尚未完全阐明[1]。研究表明,在40%~60%心功能不全患者血清中可检测到针对自身β1-肾上腺素受体(β1-adrenergic receptor,β1-AR)产生的自身抗体(β1-AR autoantibodies,β1-AA)[2]。β1-AA 可以持续激活 β1-AR 导致心肌细胞死亡,从而参与心功能不全的发生发展[3]。然而,β1-AA引起心肌细胞死亡的机制尚不明确。
自噬是一种细胞自主的防御机制,可将细胞质内的一些物质运输到溶酶体内进行消化降解[4]。自噬被认为是细胞死亡和存活之间的交汇点,可以保护心肌细胞免于凋亡和其他重大伤害[5]。早在1970年,Pfeifei[6]在电镜下就观察到小鼠心肌、视网膜和胰腺等多种组织细胞中存在自噬体数量的节律性波动。自噬标志蛋白微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)的表达水平在小鼠肝脏中也呈现出显著的震荡节律[7-8]。
特异性敲除小鼠心肌自噬相关基因ATG5可以使自噬的节律丧失,诱导心功能下降[9],提示自噬震荡节律的异常可以影响心肌细胞。然而,β1-AA 对心肌细胞自噬标志物LC3 的节律表达是否有影响及其对心肌细胞死亡的作用目前尚不清楚。因此,本研究用β1-AR 细胞外第二环(the second extracellular loop of β1-AR,β1-AR-ECII)抗原肽段主动免疫大鼠,再将从大鼠血清中提纯的β1-AA作用于H9c2大鼠心肌细胞,观察LC3 的节律性表达,探究自噬节律的破坏是否参与β1-AA 诱导的心肌细胞死亡,以期为β1-AA阳性心功能不全患者的治疗提供实验参考资料。
材 料 和 方 法
1 材料
1.1 动物及细胞 清洁级8 周龄雄性Sprague-Dawley(SD)大鼠12只,体质量180~200 g,由山西医科大学动物中心[许可证号:SCXK(晋)2015-0001]提供。H9c2细胞系由中国科学院上海细胞库提供。
1.2 主要试剂 β1-AR-ECII 抗原肽段(吉尔生化上海有限公司);抗LC3 抗体和抗Per2 抗体(Abcam);抗GAPDH 抗体、辣根过氧化酶标记的山羊抗小鼠IgG 和辣根过氧化酶标记的山羊抗兔IgG(中杉金桥公司);RNAiso Plus、PrimeScript RT Master Mix 和SYBR Premix Ex TaqTMII(TaKaRa);胎牛血清(中乔新舟公司);Cell Counting Kit-8(CCK-8;Dojindo);地塞米松(索莱宝科技有限公司);慢病毒(lentivirus,LV)-shPer2 和LV-NC(中国汉恒生物科技有限公司)。
1.3 主要仪器 Heracell 150i CO2恒温细胞培养箱(Thermo Scientific);酶联免疫检测仪(SoftMax);LR56495 低温高速离心机(Thermo Fisher);PCR 扩增仪(Stratagene);热循环仪(MJ Research);垂直电泳仪和半干转转膜仪(BIO-RAD);BioSpectrum 810 凝胶成像系统(UVP)。
2 实验方法
2.1 建立主动免疫大鼠模型 参照文献进行大鼠主动免疫[10],诱导其血清中产生β1-AA,具体实验设计见图1A。选取12 只8 周龄雄性SD 大鼠按随机数字表法分为免疫组(β1-AR 组)和对照(control)组,每组6 只。使用Na2CO3溶液溶解β1-AR-ECII 抗原肽段,按1∶1的比例与完全弗氏佐剂乳化混匀后,于SD大鼠背部皮下多点注射法进行首次免疫(0.4 μg/g),随后将已稀释的β1-AR-ECII 抗原肽段与不完全弗氏佐剂1∶1乳化,采用单点背部皮下注射,每隔2周加强免疫 1 次,共免疫 8 周;control 组用等量 Na2CO3溶液替代抗原溶液,实验方案同免疫组。随后从血清中检测并提纯β1-AA。
2.2 链霉抗生物素蛋白(streptavidin,SA)-酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测β1-AA 使用β1-AR-ECII 抗原肽段(10 mg/L)包被空白ELISA 板,加入磷酸盐缓冲液、待测血清、生物素标记的Ⅱ抗和辣根过氧化物酶标记的SA,且以上各步骤均在37℃水浴1 h;底物显色30 min;最后检测405 nm 处吸光度(A),计算P/N 值判定结果。P/N=(标本A值-空白对照A值)/(阴性对照A值-空白对照A值),P/N≥2.1 定为抗体阳性,P/N≤1.5定为抗体阴性。
2.3 纯化β1-AA 冰箱取出层析柱放置室温30 min,三蒸水冲洗保存在柱子中的乙醇,用结合缓冲液冲洗柱子,使用含有β1-AA 的血清滤过柱子并用洗脱缓冲液冲洗柱子,使β1-AA 随同洗脱缓冲液一起滴到EP管中。
2.4 细胞培养及处理 培养H9c2 细胞至汇合度达80%左右时用终浓度0.1 μmol/L[11]的地塞米松溶液同步化处理3 h,同步化结束时间记为CT0。细胞随机分为 4 组:control 组(1 μmol/L 阴性 IgG 处理细胞)、β1-AA组(1 μmol/L β1-AA处理细胞)、LV-NC组(LV-NC 感染细胞,MOI=30)和 LV-shPer2 组(LV-shPer2 感染细胞,MOI=30)。各组细胞分别在同步化并给药诱导之后于不同时点(CT0、CT4、CT8、CT12、CT16和CT20)收样,用于后续研究。
2.5 通过慢病毒感染敲减Per2基因 参照文献[12],采用慢病毒感染H9c2 细胞以敲减Per2基因,进而得到LC3 节律异常的细胞。由上海汉恒生物科技有限公司协助构建含shPer2 质粒同时带有GFP 的慢病毒。采取1/2小体积感染法:前一日进行细胞计数和传代,次日细胞换液后加入1/2 体积培养基,根据最佳MOI加入适宜体积的慢病毒,感染4 h后加入另外1/2 体积新鲜培养基,12~16 h 后将含病毒的培养基换为普通完全培养液。
2.6 Western blot 实验 采用Western blot 法检测各时点LC3 和Per2 蛋白的表达。同2.4 处理后于各时点收集细胞,BCA法测蛋白浓度,定量的蛋白经SDSPAGE分离后,转至PVDF膜,奶粉室温封闭2 h,相应抗体4℃孵育过夜,TBST 洗膜后加入相应Ⅱ抗室温孵育2 h。利用凝胶成像系统曝光,使用ImageJ 软件对图像进行灰度分析。
2.7 real-time PCR 实验 采用 real-time PCR 检测Per2 mRNA 表达和各时点LC3 mRNA 表达。将各组细胞处理,充分裂解后收集细胞,提取总RNA 并反转录为cDNA,使用SYBR Green 试剂盒扩增cDNA 产物。引物设计如下:LC3 的上游引物序列为5′-AGCTCTGAAGGCAACAGCAACA-3′,下游引物序列为 5′-GCTCCATGCAGGTAGCAGGAA-3′;GAPDH 的上游引物序列为5′-GGCACAGTCAAGGCTGAGAATG-3′,下游引物序列为 5′-ATGGTGGTGAAGACGCCAGTA-3′;Per2 的上游引物序列为 5′-AGCAACACCACCTTTCACAA-3′,下 游引 物序 列为 5′-CGTAGGCTTAGACCACCATC-3′。所有结果用control组 CT0 时 GAPDH 的表达进行标化,采用 2-ΔΔCt法进行相对定量。
2.8 CCK-8 法检测细胞活力 将密度为每孔(2~3)×104的细胞悬液接种于96 孔板,待细胞贴壁后更换培养基并对各组细胞进行加药处理;药物作用24 h 后每孔加入CCK-8 溶液10 μL,混匀后继续孵育1.5 h;最后检测450 nm 处A值,对各组A值进行处理分析得到其相较于control 组细胞的相对活力。计算公式为:细胞相对活力(%)=(实验组A值-空白对照组A值)/(阴性对照组A值-空白对照组A值)×100%。
3 统计学处理
实验数据采用SPSS 16.0 软件进行分析,以均数±标准误(mean±SEM)表示。两组间比较采用两独立样本t检验;多组间比较采用单因素方差分析,多重比较采用LSD法。检验水准α=0.05。
采用R 统计软件包2.10.0 版进行JTK_CYCLE算法[13-15]来识别数据的循环变量,以查看24 h 节律。JTK_CYCLE 算法是一种可以从微阵列数据中检测循环记录的非参数测试程序,提供每个循环记录的基于置换的P值(校正的P值),其所需的置信区间为95%。
结 果
1 主动免疫大鼠血清中β1-AA的A值显著升高
SA-ELISA 结果显示,与 control 组(0.65±0.02)相比,β1-AR 组大鼠血清中 β1-AA 的A值(2.47±0.07)显著升高(P<0.05),进一步采用亲和层析法提纯β1-AA,用于后续细胞实验,见图1。
2 β1-AA显著降低H9c2细胞活力
CCK-8 结果显示,与 control 组相比,1 μmol/L 的β1-AA 作用于H9c2心肌细胞24 h后细胞活力显著下降(P<0.05),见图2。
3 β1-AA破坏H9c2细胞LC3的节律表达
real-time PCR 及 Western blot 结果显示,control组LC3 mRNA 和蛋白表达水平均在CT8~CT12 时升高,CT12 以后开始下降;经β1-AA 处理后,LC3 的表达高峰前移至CT8,见图3。
使用JTK_CYCLE 算法对所得数据进行分析,可得到 control 组 LC3 的 JTK_CYCLEP值小于 0.05,经β1-AA 处理后,LC3 的 JTK_CYCLEP值大于 0.05,见表1。
4 β1-AA破坏H9c2细胞Per2蛋白的节律表达
Western blot 结果显 示 ,control 组 Per2 蛋白在CT8 和 CT16 时表达较高,其中以 CT16 时最高;经 β1-AA 处理后,Per2 蛋白的生成高峰前移至CT12,见图4。
使用JTK_CYCLE 算法对所得数据进行分析,结果表明 control 组 Per2 蛋白的 JTK_CYCLEP值小于0.05,经β1-AA 处理后,JTK_CYCLEP值大于0.05,见表1。
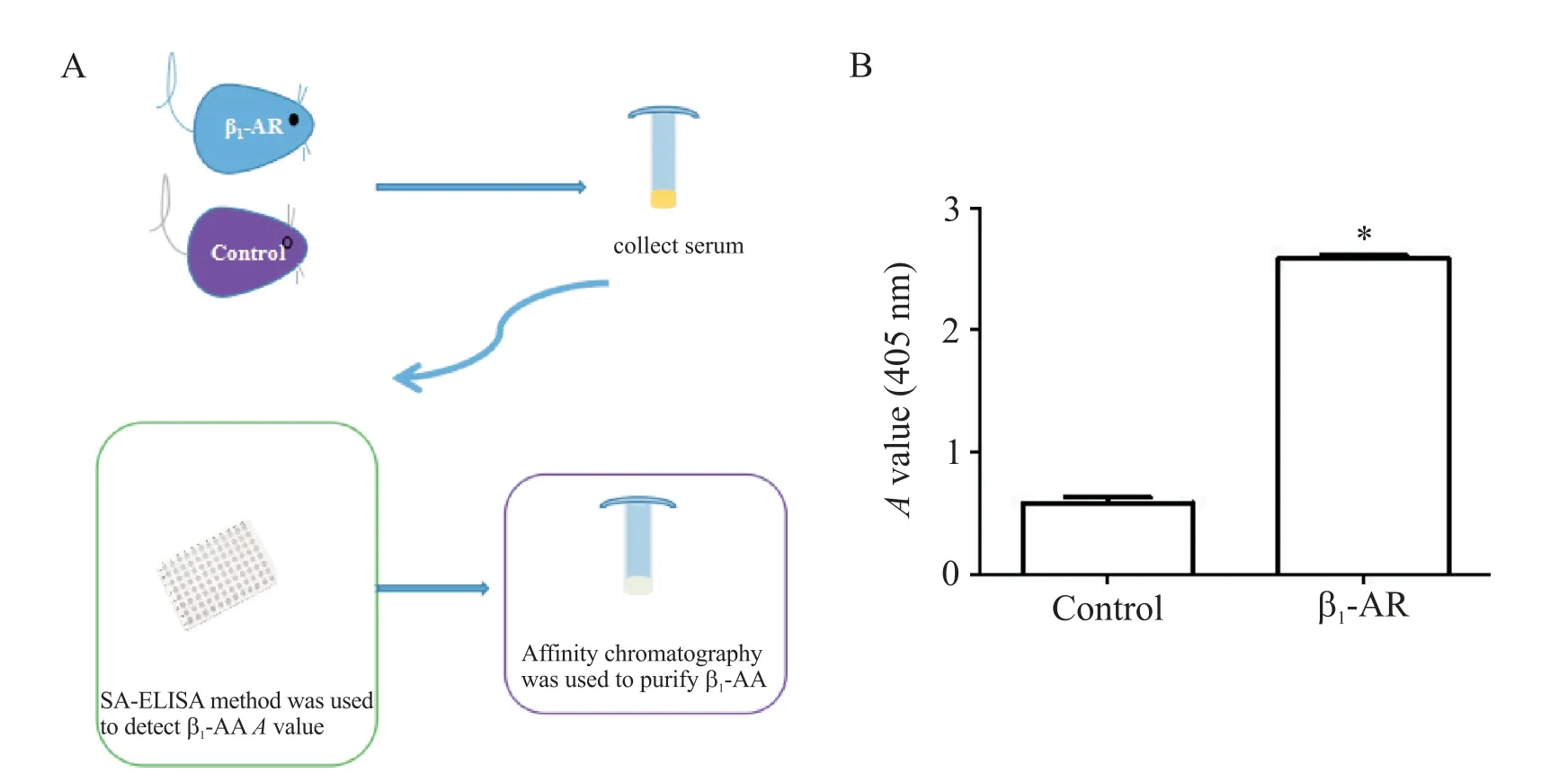
Figure 1.Detection and purification of β1-AA from rat serum.A:diagram of detection and purification of β1-AA;B:serum β1-AA level in control group and β1-AR active immunization group was determined by SA-ELISA.Mean±SEM. n=6. *P<0.05 vs control group.图1 β1-AR主动免疫后检测及提纯β1-AA

Figure 2.β1-AA decreased the viability of H9c2 cells.Mean±SEM. n=6. *P<0.05 vs control group.图2 β1-AA显著降低H9c2细胞活力
5 敲减Per2 基因破坏H9c2 细胞LC3 节律表达后细胞活力显著降低
5.1 慢病毒感染成功敲减H9c2 细胞的Per2基因采用LV-shPer2感染H9c2细胞,MOI=30时荧光强度较高且与MOI=50 时差异不大(图5A),故选定MOI为30用于后续实验。随后检测病毒对目的基因Per2的敲减效果,结果显示,与LV-NC 感染的H9c2 细胞(3.69±0.26)相比 ,LV-shPer2 感 染 使 H9c2 细胞Per2 mRNA 表达水平(1.98±0.37)显著降低(P<0.05),见图5B;Per2 蛋白表达也显著降低(1.22±0.25vs0.56±0.09,P<0.05),见图5C。
5.2 慢病毒感染敲减Per2基因破坏H9c2 细胞LC3的节律表达 Western blot 结果显示,LV-NC 组LC3节律表达与control 组类似,且JTK_CYCLE 算法分析的P值 小 于 0.05,而 LV-shPer2 组 LC3 的 JTK_CYCLEP值大于0.05,见图6及表1。
5.3 LC3 节律表达破坏可引起H9c2 细胞活力下降 CCK-8 结果显示,LV-NC 组 H9c2 细胞活力(96.90%±6.42%)与 control 组(97.50%±1.43%)相比无显著差异,而破坏LC3 节律表达后,细胞活力显著下降(37.95%±3.76%,P<0.05),见图7。
讨 论
本研究观察到,β1-AA 可以诱导H9c2 心肌细胞自噬标志物LC3 的节律表达破坏。研究表明,自噬节律表达受生物钟基因调控,于是本研究采用LV-shPer2 敲减生物钟基因Per2以破坏细胞自噬标志物LC3 的节律表达,观察到心肌细胞活力显著下降,提示自噬标志物LC3 的节律表达破坏促进β1-AA 诱导的H9c2心肌细胞死亡。
β1-AA 是一种针对β1-AR-ECII 产生的自身抗体[16],可以持续激活β1-AR导致心肌细胞死亡[3]。β1-AA可以通过结合β1-AR的构象表位而影响受体的构象和下游cAMP 信号传导,进而诱导MCP-1 蛋白产生,引起心肌细胞死亡[17]。β1-AA 还可以通过诱导CD4+T 细胞增加,导致心肌细胞凋亡和心力衰竭[18]。本研究也观察到β1-AA作用H9c2心肌细胞24 h可显著降低心肌细胞活力,与之前的研究一致。
我们前期研究结果表明,β1-AA 可显著抑制心肌细胞自噬功能,继而导致线粒体膜电位下降,参与心功能不全的发生发展[19]。自噬在生理过程中起着“管家”的作用,可以清除长寿、错误折叠的蛋白质和受损的细胞器,参与细胞生长和衰老的调节[20]。已有研究表明,细胞自噬存在节律性震荡[21];早在1970年就观察到大鼠某些组织自噬空泡的丰度在一日中具有节律性波动[6];另有研究表明,LC3-II 蛋白表达在小鼠肝脏、骨骼肌及肾脏中也具有节律性[22]。LC3作为自噬的分子标记物位于细胞质中,自噬发生时LC3-I 与磷脂酰乙醇胺共价结合,形成LC3-II 并定位于自噬体膜上参与自噬小体的形成[23]。在本研究中,我们重点关注自噬标志物LC3 的节律表达情况。为了对相关蛋白在24 h 的节律变化进行分析,我们采用的是公认的昼夜节律震荡性分析软件JTK_CYCLE[24-25]。JTK_CYCLE 是一种新颖的非参数统计算法,采用R 语言来识别样本的循环变量。而且本研究以H9c2 大鼠心肌细胞系为研究对象,细胞系的节律不会被环境变化所加强,所以节律性震荡较低,但是经过与其他算法相比较,JTK_CYCLE 算法能很好识别这些数据中的循环转录本。而且JTK_CYCLE算法对于24 h内的样本数据较其他算法相比具有更高的特异性和准确性[13-15]。我们的结果显示,control组LC3 的表达确实存在显著节律性震荡,LC3 在CT8~CT12时升高,CT12开始下降,提示在主观白天LC3 的生成处于较低状态,心肌细胞产生的衰老、损伤的蛋白质会出现累积,主观夜间LC3 的生成增多,自噬开始发挥吞噬降解衰老损伤的蛋白质及细胞器的作用,维持心肌细胞的正常状态。由此可见,自噬节律的正常运转对于心肌细胞稳态的维持至关重要。而给予β1-AA 处理后LC3 生成的最高点由CT12提前至CT8,JTK_CYCLE 算法分析得出其节律性震荡被破坏。这提示β1-AA可以引起H9c2心肌细胞自噬标志物LC3的节律表达破坏。
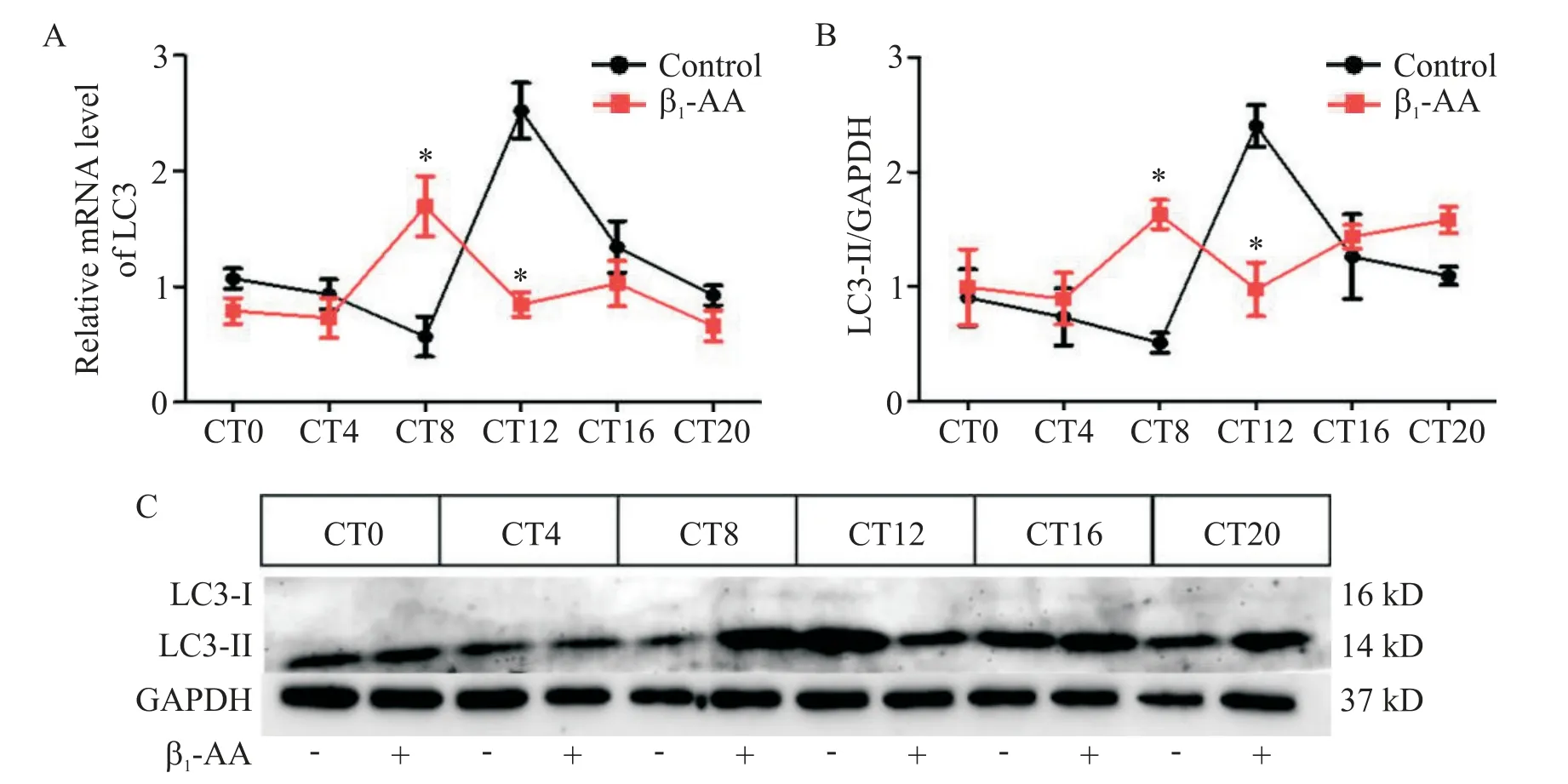
Figure 3.Autophagy marker LC3 rhythm was disrupted in H9c2 cardiomyocytes by β1-AA.The samples were collected every 4 h within 24 h.A:real-time PCR demonstrated that the LC3 mRNA rhythmic expression in the H9c2 cardiomyocytes was disrupted by β1-AA(1 μmol/L);B,C:Western blot showed that the LC3 protein rhythmic expression in the H9c2 cardiomyocytes was disrupted by β1-AA(1 μmol/L).Mean±SEM. n=6.*P<0.05 vs control group.图3 β1-AA破坏H9c2心肌细胞自噬标志物LC3的节律表达
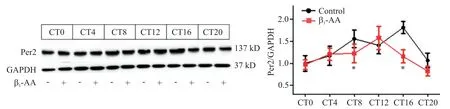
Figure 4.The rhythmic expression of Per2 protein in H9c2 cardiomyocytes was disrupted by β1-AA(1 μmol/L).The samples were collected every 4 h within 24 h.Mean±SEM. n=6.*P<0.05 vs control group.图4 β1-AA破坏H9c2心肌细胞Per2蛋白的节律表达
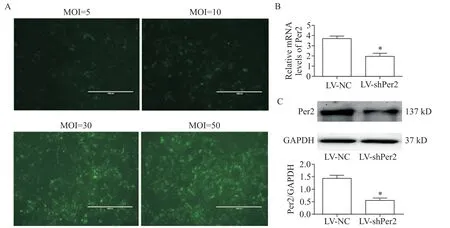
Figure 5.H9c2 cells were infected with LV-shPer2 to knock down the expression of Per2.A:GFP fluorescence images with MOI of 5,10,30 and 50(scale=1 mm);B:real-time PCR showed that the mRNA expression of Per2 was reduced by LV-shPer2(MOI=30)in the H9c2 cardiomyocytes;C:Western blot showed that the protein expression of Per2 was reduced by LV-shPer2(MOI=30)in the H9c2 cardiomyocytes.Mean±SEM. n=6.*P<0.05 vs LV-NC group.图5 LV-shPer2感染H9c2心肌细胞敲减Per2的表达

Figure 6.The expression of LC3 rhythm was disrupted after LV-shPer2 infection.The samples were collected every 4 h within 24 h.A:real-time PCR demonstrated that the LC3 mRNA rhythmic expression in the H9c2 cardiomyocytes was disrupted by LV-shPer2(MOI=30);B,C:Western blot showed that the LC3 protein rhythmic expression in the H9c2 cardiomyocytes was disrupted by LV-shPer2(MOI=30)Mean±SEM. n=6.*P<0.05 vs LV-NC group.图6 LV-shPer2敲减Per2使心肌细胞自噬标志物LC3节律破坏
研究表明,人类清醒时,饥饿增加胰岛素水平,进而激活心脏mTOR 信号通路,导致自噬节律异常,从而发生心功能不全[9,26]。FoxO3 诱导心肌细胞中几种自噬相关基因节律性异常表达,导致心肌细胞变小,心功能下降[27]。这些研究表明,自噬节律异常可能会对心肌细胞和心功能产生影响。因此,我们需要进一步探究β1-AA诱导的H9c2心肌细胞自噬标志物LC3的节律表达破坏是否参与其细胞死亡。
自噬的震荡节律受生物钟调控[28]。生物昼夜节律是地球上所有生物体以太阳作为参考点将生物周期调整为近似24 h 的震荡节律。转录-翻译反馈环路(transcriptional translation feedback loop,TTFL)是目前公认的节律维持机制[29]。其中,β-AR活化能够显著改变 Per2 蛋白和 mRNA 的节律性表达[30],即 β-AR 的激活会引起生物钟基因Per2的变化。而且本研究也观察到,H9c2心肌细胞control组的Per2蛋白通过JTK_CYCLE 算法分析表现出显著的昼夜节律性震荡,其表达量于CT8 和CT16 时相对较高,其中以CT16 时最高;而β1-AA 能够显著破坏 Per2 蛋白的昼夜节律性震荡,使其生成最高峰前移至CT12。有研究表明,成纤维细胞Per2基因沉默后,LC3蛋白表达显著下降,节律也出现显著异常[31]。因此,本研究使用LV-shPer2 感染H9c2 心肌细胞,降低Per2表达,进而破坏自噬标志物LC3 的节律表达,结果细胞活力出现显著下降,表明β1-AA 诱导的H9c2 心肌细胞自噬标志物LC3 的节律表达破坏了参与其细胞死亡。

表1 JTK_CYCLE 算法分析LC3 mRNA、LC3 蛋白和Per2蛋白表达的昼夜节律参数Table 1.The circadian parameters of LC3 mRNA,LC3 protein and Per2 protein using JTK_CYCLE algorithm analysis

Figure 7.The viability of H9c2 cardiomyocytes was reduced after the rhythm of LC3 was destroyed by LV-shPer2.Mean±SEM. n=6.*P<0.05 vs control group;#P<0.05 vs LV-NC group.图7 LV-shPer2 敲减Per2 基因使心肌细胞LC3 节律表达破坏后心肌细胞的活力显著降低
综上所述,β1-AA 可引起H9c2 心肌细胞自噬标志物LC3 的节律表达破坏和细胞活力降低;敲减生物钟基因来破坏H9c2 心肌细胞LC3 节律表达后,细胞活力显著下降。由此可见,自噬标志物LC3 节律表达的破坏在β1-AA 诱导的心肌细胞死亡过程中发挥重要作用;早期合理调控自噬标志物LC3 的节律表达有望成为β1-AA 阳性心功能不全患者的治疗策略。
