三株牛支原体的致病性比较
2021-02-05刘重阳黄海碧范文霞乌吉斯古楞张彦婷陈学飞刘玉梅宋庆庆关平原
刘重阳,黄海碧,范文霞,乌吉斯古楞,张彦婷,陈学飞,纪 燕,刘玉梅,宋庆庆,关平原
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2.金宇保灵生物药品有限公司,兽用疫苗国家工程实验室,内蒙古呼和浩特 010020)
牛支原体(Mycoplasma bovis,M.bovis)没有细胞壁,归属柔膜体纲,主要引起牛的呼吸系统疾病[1]。引起牛呼吸道疾病的支原体主要有丝状支原体丝状亚种(牛肺疫)、牛支原体、解脲支原体、殊异支原体等[2]。自2008 年我国第一次从肺脏分离到牛支原体后,全国部分地区陆续发现牛支原体肺炎情况[3]。牛支原体发病一般与应激因素有关,常见的因素为运输应激导致发病[4]。牛支原体病呈全球流行,对全球养牛业造成极大的损失[5]。牛群感染牛支原体后很难将其根除,主要原因是隐性感染牛的存在,其带菌、排菌时间可长达数月甚至数年[6]。牛支原体主要经呼吸道传播,近距离接触更容易传播[7],也可通过交配、哺乳传播[8]。慢性型牛支原体病一般不表现症状,急性的则会出现咳嗽、分泌物增多,病变也一般表现在肺部和胸腔,肺部可能有化脓灶或干酪样坏死灶[9]。牛感染牛支原体后还可继发其他细菌及病毒感染[10-11]。目前普通抗生素几乎无法治疗牛支原体感染,所以疫苗在预防牛支原体病上至关重要。到目前为止,只有美国有两种商品化疫苗,但其保护力有限而且副作用较大。本试验通过比较3 株牛支原体的致病性,筛选出其中毒力较强的菌株,以便为后续致病性研究使用的动物模型建立评价标准,也可为国内疫苗的研制提供菌株资源。
1 材料与方法
1.1 菌株
牛支原体HS2019、HSZ2019、HSS2019,由金宇保灵生物有限公司病原分离平台分离、鉴定和保存,连续传代至10 代,选取第10 代进行试验,其中HSS2019 株来自牛乳,HS2019 株和HSZ2019株均来自病变肺脏。
1.2 试验 动物
本地3 月龄肉牛11 头。试验牛的鼻拭子经特异性PCR 检测均为阴性。动物试验在金宇保灵生物有限公司负压试验动物房进行。
1.3 牛支原体PCR 引物
参考申之义等[12]报道的牛支原体特异性荧光定量PCR 上下游引物及探针,用于确定试验牛不同脏器以及肺脏不同分叶牛支原体载菌量。参照肖淦文等[13]的方法合成特异性M.bovis引物对牛鼻拭子样品进行检测,确定其体外排毒情况。具体见表1。

表1 引物信息
1.4 牛支原体生长曲线测定
从传代培养开始,每6 h 检测1 次,总计测定时长为126 h。取样并稀释至10-6,吸取10 μL 加入固体培养基中,37 ℃恒温培养箱放置培养,显微镜下观察结果并记录绘制曲线。
1.5 动物试验
1.5.1 试验分组 将11 头本地肉牛随机分为4 个组:3 个攻毒组(每组3 头)和1 个对照组(2 头)。连续3 d 气管加滴鼻攻毒(气管10 mL、滴鼻5 mL),每天1 次。菌液滴度为1×109CFU/mL。对照组同样方法使用等体积的支原体培养液。
1.5.2 临床观察 观察牛的精神食欲状况、攻毒前后眼鼻分泌物情况、是否咳嗽以及呼吸频率。
1.5.3 体温检测 攻毒前后,每天早晨进食前进行直肠体温测量并记录
1.5.4 鼻拭子采集 在攻毒前采集1 次,攻毒后连续采集10 d,进行牛支原体PCR 检测。步骤为:鼻拭子管中加入2 mL PBS 充分振荡,用移液器吸取管中液体,通过0.45 μL 滤器过滤,使用康宁生命科学(吴江)有限公司的AxyPrep DNA 小量试剂盒提取核酸。PCR 反应体系为:Premix 10 μL、uvrc-F 1 μL、uvrc-R 1 μL、无酶水 3 μL。PCR 反应条件为:94 ℃预变性5 min;94 ℃变性 45 s,55 ℃退火1 min,72 ℃延伸 1 min,共30 个循环;72 ℃最后延伸10 min。
1.5.5 病理变化观察 感染后15 d,将所有牛解剖,观察脏器病理变化并进行评分记录,评分标准(表2)参考文献[14]。
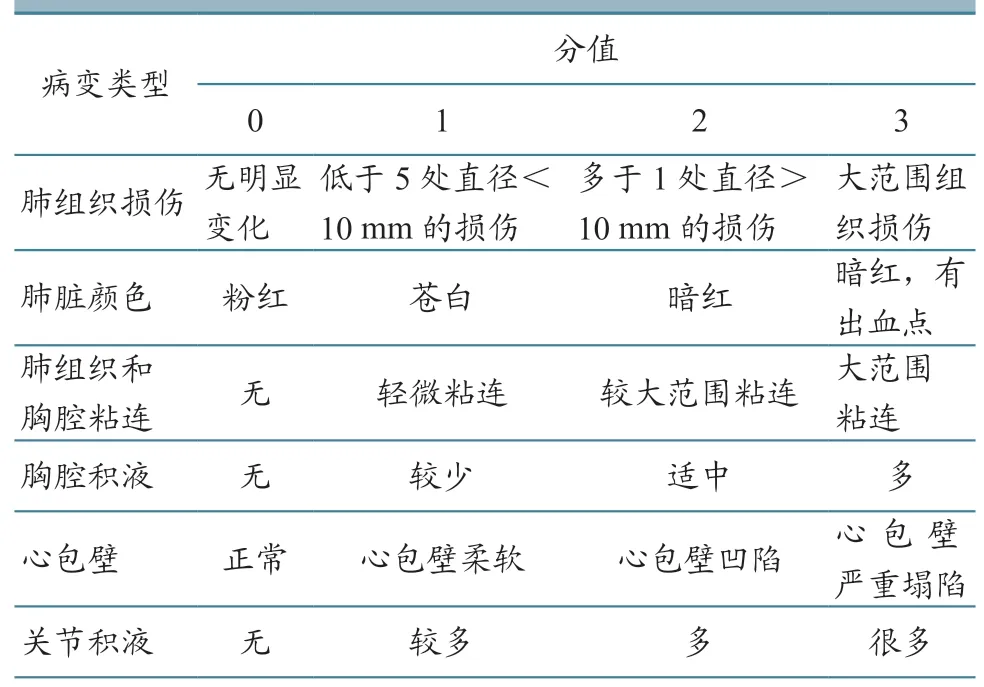
表2 病理评分表
1.5.6 病理组织学观察 将采集的肺组织和气管组织浸泡到10%福尔马林溶液中固定,石蜡包埋,切片,HE 染色,在显微镜下观察病理组织学变化。
1.5.7 脏器荧光定量PCR 测定 取相同质量的牛脏器组织(喉、气管、肺脏、颌下淋巴、肺门淋巴、肩前淋巴、肠淋巴、腹股沟淋巴、心、肝、脾、肾)加入PBS 缓冲液,在高通量组织研磨器研磨,离心取上清,使用AxyPrep DNA 小量试剂盒进行提取DNA,进行荧光定量PCR。PCR 体系为:Premix 12.5 μL,上下游引物各0.6 μL 以及探针0.6 μL、ddH2O 8.7 μL、模板2 μL。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火和延伸30 s,40 个循环;60 ℃收集荧光。将携带牛支原体基因的克隆质粒作为标准品,梯度稀释为108~101copies/2 μL;将其作为模板进行荧光定量PCR,建立检测牛支原体的标准曲线,之后观察结果。
1.5.8 肺脏不同分叶荧光定量PCR 测定 与1.2.6方法相同,对肺脏不同分叶的载菌量进行测定。
2 结果与分析
2.1 生长曲线测定
以牛支原体常用的传代比例1:10 进行培养。测定结果显示:0~24 h 为牛支原体HSS2019ZH 株的调整期和对数生长期,24 h 达到菌量峰值,后持续到42 h 菌量开始下降进入衰亡期;HS2019 株0~36 h 为调整期和对数生长期,36 h 达到高峰,后持续到42 h 菌量开始下降进入衰亡期;HSZ2019株0~36 h 为调整期和对数生长期,36 h 达到高峰,后持续到48 h 菌量开始下降进入衰亡期(图1)。

图1 3 株牛支原体生长曲线
2.2 临床症状观察
攻毒前,各组试验牛均未出现咳嗽以及分泌物增多等症状。而在攻毒后,3 组试验牛均出现不同程度咳嗽,其中:HSZ2019 毒株攻毒牛第2 天部分出现鼻腔黏液增多、流鼻涕症状,第4 天全部出现呼吸频率加快和咳嗽症状;HS2019 毒株攻毒牛症状最为严重,在攻毒后第2 天就全部出现眼角分泌物、咳嗽等症状;HSS2019 毒株攻毒牛部分在第4 天出现咳嗽,并有少量牛出现眼部分泌物增多;对照组肉眼未见临床症状。
2.3 体温检测
对照组体温波动在正常范围内;而攻毒牛组体温在攻毒后1~3 d 体温有1 ℃左右的波动,然后逐渐恢复正常(图2)。
2.4 鼻腔排菌检测
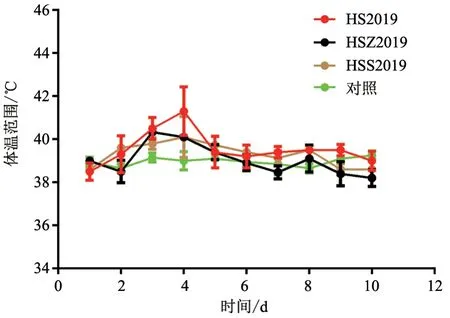
图2 平均体温变化
对鼻拭子进行特异性PCR 检测,攻毒前均未检测到支原体,攻毒后每头牛均检出支原体,但通过PCR 检测发现,大多数牛鼻腔不是连续排菌而是间歇性排菌。对照组未检出阳性,HS2019株阳性检出率为56.4%,HSS2019 株为35.9%,HSZ2019 株为41.0%。
2.5 病理评分
根据病理评分标准,对各毒株组的牛进行分值累加并求平均数,结果HSZ2019株平均分为7分,HS2019 株为10.3 分,HSS2019 株为9 分,而对照组无病理变化,为0 分。试验牛病理图片见图3,计分结果见表3。

图3 试验牛的病理解剖结果
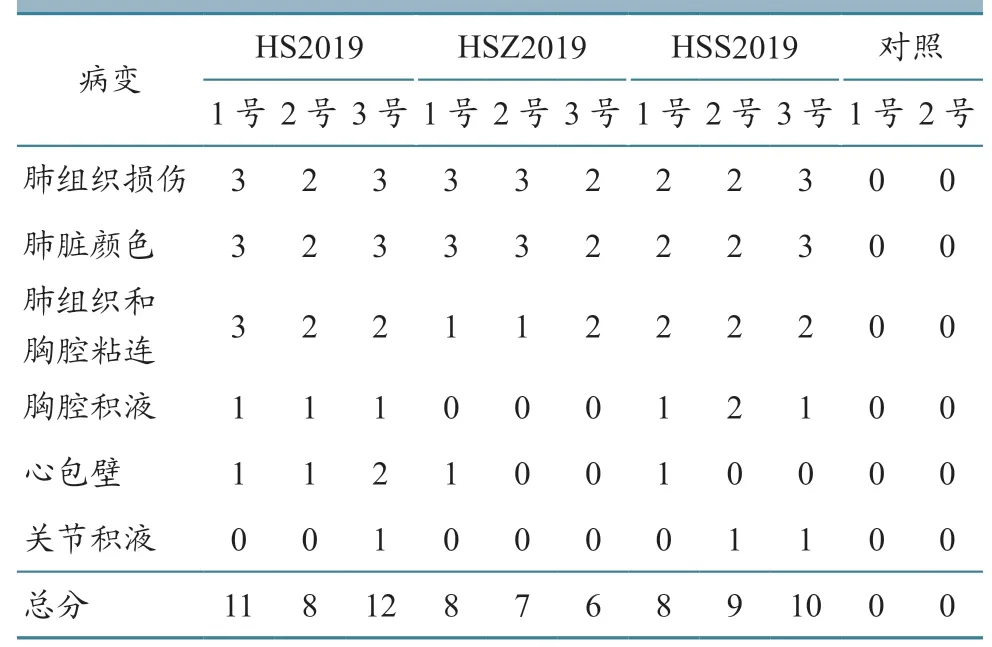
表3 试验动物病理变化打分情况
2.6 病理组织观察
通过显微镜观察发现,HS2019 株引起的病变最为严重,其次是HSS2019 株,HSZ2019 株最轻微。HS2019 株:数个肺小叶有严重的间质性肺炎,多数肺小叶可见明显出血,小血管及细支气管淋巴细胞性周围炎,多数肺泡腔、细支气管可见巨噬细胞大量增生,有散在的中性粒细胞,有的肺泡腔、细支气管腔中可见淋巴细胞增生(图4-A1);HSS2019 株:各肺小叶血管周围、气管周围结缔组织增生,局部有肺小叶淋巴滤泡,细支气管周围明显,较大细支气管黏膜固有层、淋巴细胞和组织细胞增生(图4-A2);HSZ2019 株:黏膜上皮完整,上皮细胞间以及黏膜下层中性粒细胞散在浸润,少量的巨噬细胞腔内可见吞噬的红细胞(图4-A3);对照组肺小叶,肺泡完整均一,肺泡间隔较细,未观察到病变(图4-A4)。
2.7 各脏器荧光定量PCR 测定
肝脏、脾脏、肾脏、肠淋巴中均未检测到支原体,而肺脏、气管和喉头中,3 株牛支原体均有检出,其中肺脏的拷贝数最高,具体为HSZ20119株8.75×101、HS2019 株4.60×102、HSS2019 株7.45×101,而阴性对照均无扩增。HSZ2019 株在颌下淋巴、肺门淋巴、肩前淋巴、心脏中未检出,HSS2019 株在肩前淋巴、腹股沟淋巴、心脏中未检出,HS2019 株在颌下淋巴中未检出。由图5 可见HS2019 株的器官分布较其他2 株更为广泛。
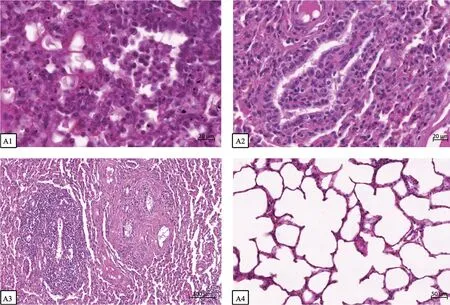
图4 试验牛肺部组织切片观察结果
2.8 肺脏各分叶荧光定量PCR 测定
从3 株牛支原体动物回归试验的肺脏荧光定量PCR 来看,心叶与副叶载菌量较其他分叶高,其中HS2019 株在肺脏各分叶的平均菌量最高,其他2 株均较低,阴性对照均无扩增(图6)。

图5 各毒株在不同器官中的平均Q-PCR 分布
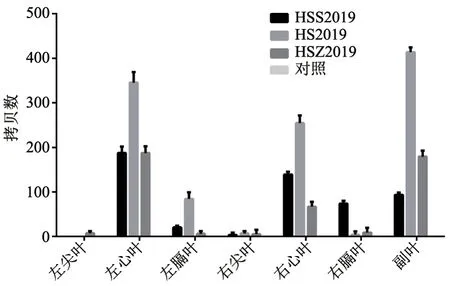
图6 各毒株在肺脏各叶的平均分布
3 讨论
支原体在动植物以及人体中广泛存在,现已确定的支原体已有200 多种,其中在牛体内的就有20 多种。牛支原体的致病性研究较为缓慢,其原因可能是牛支原体具有严格的宿主性,导致缺少动物试验模型。
本次试验对试验牛使用气管加滴鼻的方式进行攻毒,在攻毒后几天内,攻毒试验组牛均有症状产生,前3 d 体温出现不同程度的升高,之后体温趋于正常。通过鼻拭子检测体外排菌发现,牛支原体一般为间歇性排菌,这与文献[15]报道相似。之后通过采集病变脏器进行PCR 发现牛支原体为阳性,说明此次动物模型成功建立。3 株牛支原体中的HSS2019 株为从牛乳中分离,通过CFU 测定生长曲线发现,HSS2019 株比其他2 株牛支原体对数生长期短,高峰期持续较。推测这是可能因为牛乳中的支原体生长较快,但缺少数据支持,需要继续开展深入研究。HSS2019 株试验组的病理解剖发现肺叶之间粘连,肺脏表面有片状出血,病理切片发现有淋巴细胞及组织细胞增生,出现炎症现象。HSZ2019 株和HS2019 株均来自病牛肺脏,2 株支原体的生长周期基本相同,但HSZ2019 株试验组解剖病变不明显,病理切片也只出现少量的中性粒细胞和巨噬细胞。在这3 株牛支原体中,HS2019株引起的病变最为明显,3 头试验牛的肺脏均出现了部分肉变及干酪样坏死灶,在病理切片中也出现严重的间质性肺炎。从试验牛的病理变化上看,本试验虽未做致病性相关试验,但验证了牛支原体的黏附蛋白可黏附气管黏膜,从而造成机械损伤,导致牛间质性肺炎。
之后采集试验牛的不同器官进行牛支原体荧光定量PCR 发现,牛支原体主要侵害肺脏和气管,这为治疗以及预防牛支原体疾病提供了帮助。从不同菌株的分布结果看,HS2019 株毒力较其他2 株强。为了验证HS2019 株毒力较强,又对肺脏不同分叶进行定量PCR,发现HS2019 在肺脏分叶中分布更广,因此基本确定HS2019 株毒力较强。而在HS2019 株平均定量中发现,副叶明显高于其他叶,推测副叶可能在牛支原体感染肺脏后最先受侵害,这为下一步牛支原体感染研究奠定了基础。
4 结论
致病性比较发现,HS2019、HSZ2019、HSS2019 这3 株支原体均有致病性,其中HS2019株致病性较其他2 株强,因此HS2019 株可以作为疫苗制备的候选菌株。本次动物模型的建立为今后牛支原体致病性研究及预防提供了技术支持。
