益生菌对慢性乙型肝炎患者肠道菌群的影响
2021-02-05郝双影
朱 泽,郝双影
1.诸暨市中医医院急诊科,浙江 诸暨 311800; 2.浙江中医药大学; 3.河南理工大学
肝病,特别是慢性乙型肝炎(chronic hepatitis B, CHB),是我国严重的公共卫生问题。CHB患者可能发生肝硬化(liver cirrhosis,LC),它是一种死亡率高的恶性肝病,常伴有胃肠道出血、营养不良等复杂问题,乙肝病毒(hepatitis B virus,HBV)是导致CHB的主要病原体[1-2]。据统计,全球范围内每年有超过80万人死于终末期肝病或肝癌[3]。
HBV在体内的分布是全身性的,它发生在血液、汗液、胃液、唾液、胆汁、胃液、尿液、肠液等其他体液中[4]。不同体液中HBV浓度不同,感染情况不同,其中,血液中HBV颗粒浓度最高,且感染最严重。肝脏和肠道有共同的胚胎起源,因此,它们的结构和功能是内在联系在一起的,形成了一个“内脏-肝脏轴”[5]。一些肠道细菌和肠道菌群代谢产物可能在一定情况下会到达肝脏,激活肝脏组织中的TLR/NLR炎性因子的分泌,导致肝脏发生炎症。大量研究证实,益生菌可以被用来辅助治疗许多损伤胃肠道的疾病,如腹泻、炎症性肠病、结肠癌、幽门螺杆菌感染、胃肠过敏、乳糖不耐受等[6]。但鲜有研究讨论益生菌对肝脏的影响。HBV及其在肠道中的代谢产物有可能到达肝脏,导致肝脏炎症,并可能影响肝脏的损伤程度。可见,肠道免疫保护机制的研究具有一定的复杂性和必要性。因此,本文主要探讨肠道菌群在CHB患者中的免疫作用。
1 资料与方法
1.1 一般资料
1.1.1 纳入标准:(1)研究对象的年龄为≥18岁;(2)出现阳性的时间在半年以上,谷丙转氨酶为正常上限的2倍以内;本研究之前的1周内无消化道出血现象,大便隐血为阴性;(3)影像学检查提示未出现肝硬化状况;(4)本研究之前1个月内未服用损害肝脏的药物;(5)通过实验室检测,排除携带有A型肝炎病毒、C型肝炎病毒、E型肝炎病毒、巨细胞病毒、柯萨奇病毒、爱泼斯坦-巴尔病毒感染等患者;(6)临床资料完整;获得患者的家属知情并同意。
1.1.2 排除标准:(1)年龄<18岁;(2)参照既往诊断和治疗的病例,在本研究之前的1个月内曾服用抗生素、抗病毒药物或干扰素的患者;(3)伴有其他肝病、炎症、自身免疫病、肺病、心脏病等病史的患者。
1.1.3 医学伦理学问题:根据机构评审委员会指导方针,获得内部评审委员会的批准,告知患者及其家属,并签署知情同意书。
1.2 研究对象的分组选取诸暨市中医医院2015年1月至2016年1月收治的CHB患者及健康体检者共99例作为研究对象,分为健康体检组33名,CHB组33例,益生菌组33例。健康体检组:男18名,女15名,年龄(46.38±7.19)岁(39~72岁);CHB组:男19例,女14例,年龄(52.39±10.42)岁(30~69岁);益生菌组:男23例,女10例,年龄(40.27±7.50)岁(24~73岁),服用双歧杆菌/乳杆菌/嗜热链球菌三联活菌片(1.59,2次/d),疗程均为2周,末次用药后3 d内采样。
1.3 研究方法
1.3.1 血清的采集:患者确诊为CHB,治疗前采集患者的血样和粪便标本。粪便样本统一为早上采集。样本收集后搅拌均匀,将400 mg样本分装至2支EP管内(200 mg/管),并存储于-80 ℃冰箱。此外,抽取各组患者的空腹肘静脉血5 ml,在室温下静置30 min,通过4 ℃,1 000g离心15 min后收集血清,装于无菌的采血管(含0.2%抗凝血剂)中,并存储于-20 ℃冰箱内,用于后续检测研究。
1.3.2 各组粪便样本中肠道细菌的检测:获取各组研究对象的粪便样本,混合之后装于无菌的0.85% NaCl溶液中,浓度为0.1 g/ml,搅拌均匀至悬浮状态。将粪便样品按照梯度浓度进行一系列稀释,并涂在琼脂上,对乳酸菌、拟杆菌、双歧杆菌、葡萄球菌、肠杆菌科、肠球菌/链球菌、产生H2S的细菌分别给予匹配的琼脂培养基。于37 ℃厌氧培养箱内培养拟杆菌、双歧杆菌、乳酸菌;对葡萄球菌、肠球菌/链球菌、肠杆菌科细菌、产生H2S的细菌放置于37 ℃需氧培养箱内培养,孵育24~48 h后进行菌落计数。
1.3.3 各组粪便样本中IgA的含量测定:获取各组研究对象的粪便样本,均匀混合后检测IgA水平。将收集的粪便样本悬浮于PBS溶液[1.9 mmol/L NaH2PO4、8.1 mmol/L Na2HPO4、154 mmol/L NaCl (pH 7.2)]中,加入质量浓度为10 g/L胎牛血清(Sigma Chemical Co.,美国),最终浓度为0.1 g/ml(w/v),搅拌均匀至悬浮。取上清液,10 000g离心10 min,采用酶联免疫吸附测定法(ELISA法)测定上清液中IgA的总含量。
1.3.4 各组粪便样本中常见的肠道真菌种类分析:收集各组研究对象的粪便样本,混匀之后用马铃薯葡萄糖培养基[含氯霉素卡那霉素(BD公司,美国)]培养于30 ℃培养箱,培养3~7 d。培养之后收集1 ml混合样本溶于0.9%的无菌生理盐水中,浓度维持在(1~5)×106CFU/ml,使用Vitek酵母生化卡(YBC)(bioMerieux公司,法国)进行菌株的形态学测试。各组研究对象排便后1 h内将收集的200 mg粪便样本冻存于-80 ℃冰箱,使用QIAamp DNA Mini Kit(Qiagen公司,德国)从粪便样本和真菌沉淀物中提取DNA,并使用细胞裂解液清洗1次,再离心沉淀,装于离心管内备用于后续检测。
1.3.5 实时荧光定量PCR法测定mRNA相关基因表达:提取菌群RNA(Solarbio,R1200),并进行逆转录(Solarbio,RP1100)获得cDNA。利用DNA Opticon 2装置(Bio-Rad Laboratories),结合Option Monitor软件(3.0版),对粪便样本中6种常见真菌进行实时定量PCR(Q-PCR)检测(种属特异性引物见表1)。通过调整引物浓度、退火条件、延伸温度、放大周期等,得到最佳反应体系和反应参数。20 μl放大反应体系,加入1 μl模板DNA、10 μl SYBR预混Taq酶(包含MgCl2、氯化钾、Tris-HCl、核苷酸、Taq DNA聚合酶)。反应过程如下:1个循环,在95 ℃预变性5 min之后,进行40次变性,周期为30 s,温度为95 ℃,退火30 s,扩增30 s,并且最后一个扩增步骤持续5 min。为了避免出现引物二聚体、假引物或二级结构的干扰,每个周期在适当温度下延长10 s后再做荧光检测,扩增之后通过对溶解曲线分析,缓慢将聚合酶链反应混合物的温度从75 ℃加热到95 ℃,严格按照试剂盒说明书进行操作。
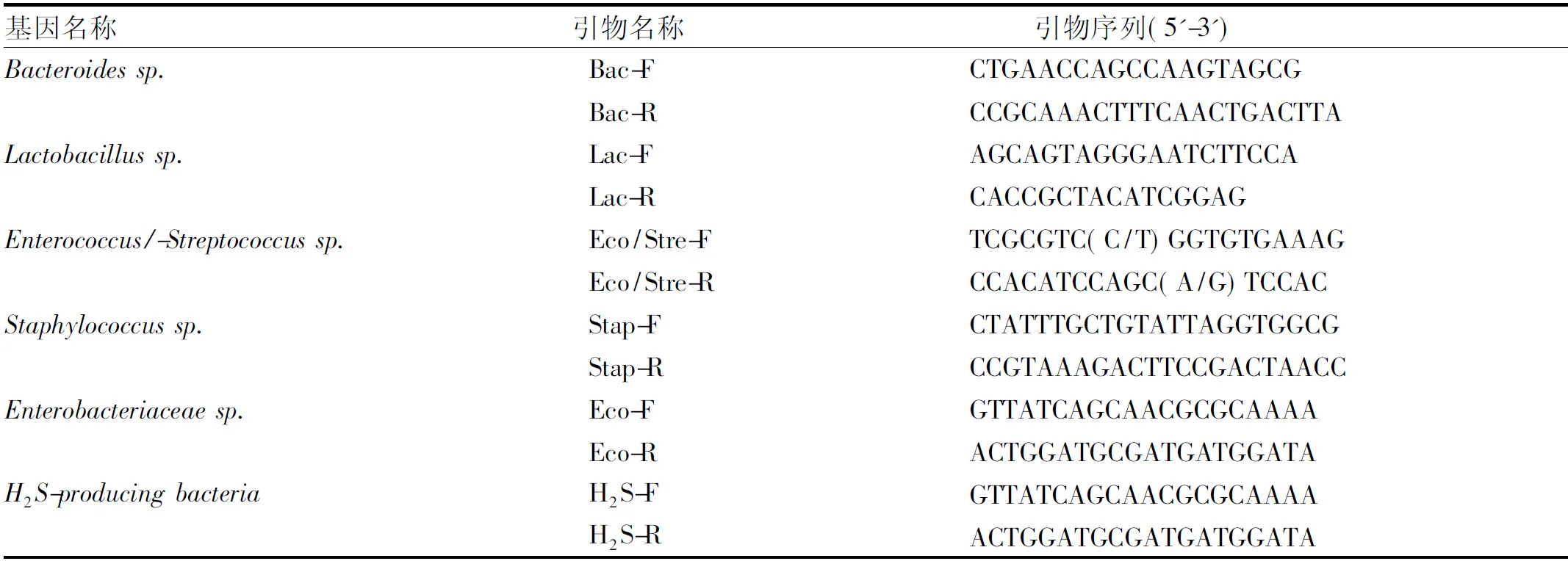
表1 肠道菌群实时定量PCR检测种属特异性引物Tab 1 Primers of intestinal flora detected by real-time quantitative PCR
1.3.6 体液免疫指标的测定:对所有研究对象各取肘静脉血3 ml,在外周血样本中加入2 ml的肝素-抗凝血剂后使用流式细胞仪(Beckman Coulter公司,美国Coulter Epics XL型)和速率散射免疫透射比浊法测定各组外周血样本中血球免疫球蛋白IgA、IgM、IgG,以及补体C3的免疫参数,进而了解体液免疫情况,此过程严格按照各指标含量及水平的检测试剂盒说明书进行检测操作。
1.3.7 T淋巴细胞免疫亚群指标的测定:对所有研究对象各取肘静脉血3 ml,在外周血样本中加入2 ml的肝素—抗凝血剂进行T淋巴细胞亚群检测,采用流式细胞仪测定其中细胞免疫指标,并使用美国Dade-Behring公司BN 100型自动特定蛋白分析仪,采用CD4+-PE和CD8+-APC试剂盒分别检测CD4+、CD8+、NK细胞、B细胞的含量。
1.3.8 TNF-γ和IL-4基因蛋白含量的测定:对各组外周血样本进行4 ℃,1 000g离心15 min,离心后取血清。严格按照BCA试剂盒说明书测定TNF-γ和IL-4的总蛋白含量。并使用TNF-γ和IL-4 ELISA检测试剂盒(合肥博美生物科技有限公司)检测TNF-γ和IL-4的蛋白水平。
2 结果
2.1 各组研究对象的临床资料对所有的入选研究对象的姓名、年龄、病程等情况进行记录,各组研究对象的临床资料之间差异无统计学意义(P>0.05,见表2)。

表2 各组研究对象的临床资料Tab 2 The clinical data of subjects in each group
2.2 肠道中细菌的活菌数检测如表3所示,CHB组与益生菌组相比,乳酸菌(Lactobacillus)、拟杆菌(Bacteroidessp.)、肠球菌(Enterococcus)、链球菌(Streptococcus)、肠杆菌科(Enterobacteriaceae)的活菌数差异有统计学意义(P<0.05);可能由于产生乳酸或细菌素等抗菌物质的影响。益生菌组中H2S-producing细菌的活菌数(5.46±2.00)明显少于CHB组(6.02±0.21),差异有统计学意义(P<0.05)。
表3 各组研究对象肠道中细菌的测定结果Tab 3 Detection results of intestinal bacterias in each group
2.3 粪便样本中IgA的含量测定由表4可知,益生菌组研究对象的粪便样本中的IgA水平显著高于CHB组(P<0.01)。口服益生菌可能会增强肠道的免疫功能,乳酸菌通过多种等免疫调节因子促进黏液产物的产生,进而促进IgA的分泌。
2.4 实时荧光定量PCR法测定mRNA相关基因表达如图1所示,健康体检组、CHB组、益生菌组肠道白色念珠菌(C.albicans)、近平滑念珠菌(C.parapsilosis)、热带念珠菌(C.tropicalis)、光滑念珠菌(C.glabrata)、克柔氏念珠菌(C.krusei)、酿酒酵母菌(S.cerevisiae)的表达情况,通过PCR法检测发现,从粪便样本中观察到CHB组内真菌种类最多的是C.albicans、S.cerevisiae、C.parapsilosis、C.krusei。并通过对3组粪便样本中6种真菌的含量检测比较,发现3组之间6种真菌的目标DNA拷贝数差异有显著统计学意义(P<0.01)。
表4 各组研究对象粪便样本中IgA的含量测定结果Tab 4 Determination of IgA content in fecal samples of each

图1 实时荧光定量PCR法测定mRNA相关基因表达Fig 1 mRNA related gene expressions detected by real time fluorescent quantitative PCR
2.5 体液免疫的指标水平测定结果结果如表5所示,与健康体检组比较,CHB组血清中血球免疫球蛋白IgG水平明显降低(P<0.05);血球免疫球蛋白IgA和补体C3的水平显著升高(P<0.05),而IgM水平无变化,差异无统计学意义(P>0.05)。
2.6 细胞免疫指标的测定结果采用流式细胞仪测定各组研究对象外周血样本中的细胞免疫相关指标,所有研究对象外周血中CD4+细胞百分率与健康体检组比较,发现CHB组中的T淋巴细胞含量显著低于健康体检组,差异有统计学意义(P<0.05);CHB组CD8+细胞百分率显著高于健康体检组,差异有统计学意义(P<0.05);与健康体检组比较,CHB组外周血样本中的NK细胞和B细胞含量均明显下降(P<0.01),结果如图2、表6所示。
2.7 各组外周血中TNF-γ及IL-4水平的比较CHB组的TNF-γ表达水平较健康体检组和益生菌组明显降低,差异均有统计学意义(P<0.05);与CHB组相比,健康体检组和益生菌组IL-4的表达水平均显著下降,差异均有统计学意义(P<0.05)(见图3)。通过计算TNF-γ与IL-4浓度之比发现,CHB组和益生菌组的TNF-γ/IL-4之比显著下降,同时,与CHB组相比,益生菌组上升趋势显著(见表7)。
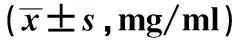
表5 各组研究对象体液免疫指标的水平测定结果 Tab 5 The levels of humoral immune indexes in each group

图2 各组研究对象细胞免疫指标流式细胞结果Fig 2 Flow cytometry results of cellular immune indexes

表6 各组研究对象细胞免疫指标的水平测定结果Tab 6 The levels of cellular immune indexes in each group

图3 各组研究对象体液免疫表达水平Fig 3 The expression levels of humoral immunity

表7 各组研究对象TNF-γ及IL-4水平的比较Tab 7 Comparison of TNF-γ and IL-4 in each group
3 讨论
人体胃肠道中含有多种细菌,它们的功能之一是保持微生物屏障,抵御潜在病原体,并帮助调节人体的免疫功能,肠道菌群的组成及其变化在肝病的发生发展中起着重要的作用[7]。肠道内有大量的细菌,是诱导分泌免疫抑制细胞因子与调节性T细胞的主要场所,肠道菌群在人体营养、免疫学、病理过程中发挥着重要作用,肠道菌群有助于对抗感染和肿瘤[8]。益生菌主要调节一些难消化的碳水化合物,如菊糖、半乳糖、果糖,它们能促进肠道菌群中有益细菌的生长和活性,它的免疫调节作用可以通过增加共生菌的数量来调节肠道免疫功能和肠道屏障功能[9]。
本研究结果表明,与正常人群相比,CHB患者肠道菌群、外周血、粪便中免疫因子发生改变,最终导致肠道及肝脏中的免疫微环境发生紊乱,而益生菌能在一定程度上调节肠道菌群的组成,从而改善这种紊乱。肠道菌群主要类型包括乳酸菌和双歧杆菌,而细菌的主要功能是对已存在的和潜在的病原体保持微生物屏障功能,并发挥调节免疫反应、肠道运动、肠壁通透性功能[10]。Azvolinsky团队[11]的研究表明,菌群生长在胃肠道受多种因素的影响,包括饮食、腔内pH值、细菌粘附、黏液分泌、细菌拮抗。这些因素中任何一个发生改变均可能影响支持肠道菌群生长的环境,从而改变维持肠道内稳态的微生物数量,导致能量生产和热量提取过度,进而出现新陈代谢和肥胖等负面影响,从而导致肝病的发生。肝病患者的肠道功能紊乱是众所周知的[12-13],细菌肽聚糖、微生物产物、代谢副产物易位已被认为能够加重慢性肝病患者的临床病程。有报道称,CHB患者中双歧杆菌和乳酸菌的含量水平下降,而肠杆菌科、肠球菌、白色念珠菌的含量水平明显升高[14-16]。TLRs在慢性肝病中的关键作用表明,通过胃肠道的微生物易位增加和肝脏对微生物产物的识别是影响肝脏病理的重要组成部分。TLR4表达可以激活枯氏细胞受脂多糖(LPS)与蛋白CD14因素启动的炎症反应,并影响有丝分裂原、应激活化蛋白激酶、p38、干扰素调节因子3、Jun-N-terminal激酶、核转录因子κB(NF-κB)等细胞因子的表达[17]。该信号通路是引起多种肝脏疾病如肝癌、肝硬化、纤维化、病毒性肝炎、脂肪肝等病理发生过程的基础。肝脏疾病模型中TLR4表达水平升高而其他TLRs,如TLR2,可能会促进调节反应。Liang等[18]研究益生菌作用后酒精性肝病(ALD)模型小鼠内毒素和TNF-α表达水平降低,但增加了紧密连接蛋白(TJ)的表达水平,出现阻塞进而减少细胞旁路的肠道通透性。IL-6可以通过刺激IgA抗体的产生来增强肠道免疫反应,表明益生菌具有调节肠道菌群变化,肠道通透性以及免疫和炎症反应的潜在能力,可用于治疗肝病。Mücke等[19]研究发现,CHB患者肠道细菌生长改变。此外,已有研究[20]表明,在人类中,双歧杆菌、梭状芽胞杆菌、乳酸菌、肠杆菌科的活菌数随年龄增加而改变。产生H2S的肠道细菌包括沙门氏菌、志贺氏杆菌、柠檬酸杆菌,它们均与各种慢性疾病有关,包括炎症性肠病和结直肠癌。此外,热杀灭的嗜酸乳杆菌LB菌株可以抑制肠道侵袭性病原体对人体肠道Caco-2细胞的粘附[11]。
综上所述,人类肠道菌群对肝脏免疫稳态不可缺少,因为它们产生维生素,保持微生物屏障,抵御潜在病原体,并帮助调节人体的免疫反应,保持黏膜完整性,促进调节免疫反应。
