蔗糖输入对凡纳滨对虾养殖系统真核微生物群落的影响
2021-02-04鲍方剑王思鹏黄晓林张德民张化俊
鲍方剑 黄 雷 陈 伟 王思鹏 陈 琛 黄晓林 张德民 张化俊
(1.宁波大学海洋学院,宁波 315211;2.浙江省海洋水产养殖研究所,温州 325005)
随着对虾养殖业高速发展,高密度集约化的养殖模式逐渐成为当前市场的主流趋势。为了维持高密度对虾养殖生产系统中的水质而进行的大面积水体交换,极易向养殖体系中引入病原导致对虾患病[1,2]。因此,对虾高密度养殖体系中亟需一种能有效管控水体水质,减少外界环境水体输入的技术策略。生物絮团技术(Biofloc Technology)是一项环境友好型的水产养殖新技术,该技术通过向水体中输入额外的碳源,促进异养细菌、硝化菌、真菌、藻类和原生动物等的生长和聚集,通过代谢活动进行有效的水质管控。同时,这些异养微生物及其分泌物,可依附于绿藻、丝状真菌等[3],在恒定的曝气、搅拌及外源碳输入条件下,在水体中保持高度悬浮状态,进一步形成生物絮团[4],提高水体中氮的吸收与转化[5]。
生物絮团可以降低水体中过剩的营养物质,有机物以及病原体,从而最大限度地减少养殖污水进入外围水域环境,实现更高的经济和环境效益。此外,生物絮团可作为凡纳滨对虾的日粮[6],絮团中的多种微生物以聚合的形式为对虾提供蛋白质、脂类、氨基酸和脂肪酸等营养物质,并促进对虾的免疫因子的表达[7],从而提高对虾的成活率[8]。同时,生物絮团可以抑制哈维氏弧菌的群体感应能力[9],从而降低其对对虾的致病风险。生物絮团对水质也具有显著的调控效果,研究发现水体输入碳源可以显著降低其亚硝酸盐、氨氮、硝酸盐和化学需氧量水平[10];而且,输入不同组分的碳源也会影响絮团形成的种类,进而影响絮团对水质的净化效率[11]。同时,对生物絮团浓度的管控可以显著提高对虾的生长速度,饲料转换率和总生物量的产量[12]。当前,生物絮团技术已经展示出在水产养殖领域的重要应用潜力,但是对其形成的真核微生物过程及与水体真核微生物的互作特征研究仍然较为匮乏。基于此,本文研究在外源碳氮输入条件下,对虾养殖系统生物絮团形成过程中的水体真核微生物与絮团真核微生物的组成及群落结构,揭示在该养殖模式下养殖系统中微生物之间的相互作用,从而明确碳源输入对生物絮团形成的影响机制,为外源碳氮输入促进生物絮团形成提供理论支持和应用基础。
1 材料与方法
1.1 实验设计及样品采集
本研究在浙江温州的浙江水产养殖研究所永兴基地(120°50′24″E,27°51′36″N)进行。实验时,在600 L的小型对虾养殖生态实验体系中输入400 L的消毒海水,养殖系统配备增氧、排换水装置。实验饲料购于浙江省澳华饲料有限公司,粗蛋白含量为42%,碳、氮元素比值约为6。碳源为白色粉末状蔗糖,纯度为99%。设置三组实验,通过调节蔗糖添加量维持输入物的C/N比分别为10(CN10)和15(CN15);对照组不添加蔗糖即初始C/N为6(CK);每组设置6个重复。在每个实验体系中投放210尾(500尾/m3)凡纳滨对虾,使用相同的日常管理措施进行对虾养殖。
在第0、第11和第28天采集水体微生物;在形成稳定的生物絮团后(第28天),采生物絮团,分析其真核微生物群落组成。
水体微生物每个实验桶采2 L水样,混匀。先用100 μm纱绢预过滤,再经0.2 μm的聚碳酸酯膜(Millipore)过滤,收集微生物,置-20 ℃保存,用干冰运送回实验室-80℃保存。利用Power Soil®DNA 提取试剂盒(MOBIO)试剂盒提取总DNA,用NanoDrop ND1000 核酸测(NanoDrop Technologies,Wilmington,DE,USA)定仪测定 DNA 浓度和纯度,并进行后续测序分析。
絮团微生物每个实验桶采集2 L水样,利用100 μm纱绢过滤,收集纱绢上生物絮团过滤物,放入灭菌的1.5 mL EP管中,置-80℃保存。用Qiagen公司的DNA提取试剂盒提DNA,用 NanoDrop ND1000 核酸测定仪测定 DNA 浓度和纯度,并进行后续测序分析。
1.2 水体理化指标测定
使用YSIQS600便携式水质检测仪(YSI,USA)每日测定各实验体系的温度、pH、溶解氧和盐度。铵态氮、亚硝态氮、硝态氮、活性磷、叶绿素a和化学需氧量的分析方法均参照《海洋监测规范》(GB 17378-2007)和《海洋调查规范》(GB 12763-2007)的标准规范进行测定。
1.3 MiSeq测序及数据处理
针对真核微生物18S rRNA基因的V4可变区,利用引物3NDF:5′-GGCAAGTCTGGTGC CAG-3′和V4eukR2R:5′-ACGGTATCTRATCRTCTTCG-3′[13]进行扩增。采用20 μL PCR反应系统,扩增条件为:95℃预变性3min;95℃变性30s,55℃退火30s,72℃延伸45s,共27个循环;72℃延伸10min,每个反应3个平行。扩增产物经TaKaRa 的纯化试剂盒(Takara Purification Kit,TaKaRa,Japan)纯化后,将三个PCR产物混合并通过Quant-It Pico Green试剂盒(Invitrogen,Carlsbad,CA)定量。将样品PCR产物以等摩尔量混合,利用TruSeq DNA样品制备试剂盒(San Diego,CA,USA)构建文库,送于上海美吉生物医药科技有限公司进行Illumina MiSeq测序。
通过QIIME v.1.9.0平台(Quantitative insights into microbial ecology,http://qiime.org/)对下机测序数据进行样品分装、去嵌合体和质量筛选[14];利用SILVA 132数据库将相似性大于97%的序列归为同一个分类操作单元(OTU),以每个OTU中丰度最高的作为代表序列,在SILVA132数据库中比对确定其所属类群;去除未鉴定序列,保留后生动物(Metazoa)的OTU,得到的样本的序列数为7028—64041。
1.4 统计分析
将每个样品中的序列标准化为最小测序深度7020。在门水平(相对丰度大于 0.1%)分析每个样品的群落组成。通过Bray-Curtis距离测量β-多样性,并通过非度量多维尺度分析(NMDS)展示输入碳源情况下真核微生物的演替规律。基于Bray-Curtis距离的相似性分析(ANOSIM)分析各组真核微生物群落的相似性。应用冗余分析(RDA)和Mantel分析来评估环境因素对群落变异的贡献度。使用SPSS计算40种最丰富的OTU和环境因子的Spearman相关性,筛选得到相关性系数ρ值大于0.6的OTUs,并通过R中的“pheatmap”包绘制热图[15]。基于Bray-Curtis距离对水体和絮团样品进行平均聚类并绘制聚类树,使用 “stats”包[16]和“ggplot2”[17]包进行计算绘图。利用R包的“psych”包[18]计算水体与絮团微生物群落间相互作用相关性系数,对水体和絮团中浮游真核微生物丰度大于0.1%的OTU进行相关性分析。筛选得到相关性系数ρ值大于0.6,显著性P值小于0.05的相关性OTUs,用“gephi”[19]绘制无向性微生物互作网络图,并进行加权随机模块化网络分析。
2 结果
2.1 水体真核微生物群落组成
水体真核微生物在不同组别中存在显著差异(图1)。第0天,水体中主要门类为不等鞭毛类(Heterokonta,55.4%)、纤毛虫(Ciliophora,32.5%)、眼虫门(Euglenozoa,6.1%)和绿藻门(Chlorophyta,4.7%)。第11天时,CK组中绿藻门相对丰度高达47.7%,较第0天提高了近10倍;而不等鞭毛类的相对丰度则降低到2%;而CN10组绿藻门比例相比第0天水体有升高,与CK组水体相对丰度接近;同时,检测到之前未出现的脊索动物(Chordata),平均相对丰度为26.3%;CN15组的绿藻门低于CK组,相对丰度为仅为6.0%;三个实验中的不等鞭毛类相对丰度接近,均为2.1%。第28天,CK组的绿藻门较第11天的相对丰度有显著升高,达到了80.4%;同时首次检测到轮虫门(Rotifera),平均相对丰度为11.3%。CN10组中绿藻门比例比CK组低4倍;轮虫门的相对丰度为CK组的两倍;腹毛动物门(Gastrotricha)比例增长为12.8%;CN15组中绿藻门相对丰度为40.8%,为相对丰度最高的类群;轮虫门的相对丰度为35.8%。

图1 养殖系统中真核微生物群落组成(门水平,相对丰度大于 0.1%)Fig.1 Microeukaryotic community compositions in aquaculture system at phylum level(relative abundance of >0.1%)
2.2 水体真核微生物群落结构演替及影响因素
NMDS分析(图2)发现,在第11天,三个处理组的水体真核微生物群落具有差异,其中CK与CN15组差异显著(表1);第28天时,CK组与CN15组沿NMDS2轴分离;ANOSIM分析发现(表1),CK与CN15有显著差异。
RDA分析(图3A—C)及Mantel分析(表2)发现,28d时,溶氧、亚硝态氮、活性磷与蔗糖输入对真核微生物群落结构变异有显著影响。在微生物群落组成方面,真核微生物群落受到DO(P<0.05)的影响最为显著,OTU5193(绿藻门,ρ=0.77)、OTU1634(轮虫,ρ=0.78)和OTU6373(绿藻门,ρ=0.93)的相对丰度受DO影响最为显著;输入碳源与OTU1634(轮虫,ρ=0.80)、OTU3672(轮虫,ρ=0.75)、OTU131(纤毛虫,ρ=0.73)和OTU7049(网黏菌纲Labyrinthulomycetes,ρ=0.74)的相对丰度正相关,与OTU6373(绿藻门,ρ=-0.70)的相对丰度负相关。
2.3 絮团真核微生物群落结构
在第28天时,絮团中各组的优势真核微生物类群均为绿藻门(图4A),平均占比91.4%。NMDS分析发现CN10组与CN15组沿NMDS1轴分离(图4B)。基于Bray-Curtis 距离的聚类分析(图4C)发现,来源于水体和絮团的微生物群落可显著聚为两类;同时,经ANOSIM分析发现絮团和水体真核微生物群落差异显著(表3)。
2.4 水体与絮团真核微生物群落互作特征
微生物互作的Co-occurance网络是由955个边连接的198个节点组成的非随机网络(SES=3.7447),其中有173个边是水体真核微生物与絮团真核微生物的相互作用。绿藻有62个节点(絮团27个,水体35个),水体与絮团相互作用的边有114条;不等鞭毛类有22个节点(絮团7个,水体15个),水体与絮团相互作用的边有56条;轮虫有23个节点(絮团5个,水体18个),水体与絮团相互作用的边有28条;纤毛虫有23个节点(絮团3个,水体20个),水体与絮团相互作用的边有22条。

图2 基于Bray-Curtis距离的非度量多维尺度分析真核浮游生物群落结构Fig.2 Nonmetric multidimensional scaling(NMDS)analysis of microeukaryotic community structure based on Bray-Curtis distance
互作网络由5个主要模块组成(图5B)。模块1(Module I)主要由轮虫、绿藻、腹毛动物门组成,且多数OTUs在CK有更高的丰度(图5C)。模块2(Model II)主要为水体中的轮虫、纤毛虫、子囊菌门(Ascomycota)、不等鞭毛类与絮团中的轮虫、绿藻、不等鞭毛类的相互作用,且多数OTUs主要分布在CN10与CN15组,如水体中轮虫丰度是CK组的近8倍与12倍,且CN15组中的纤毛虫与子囊菌门有较高丰度;在絮团中,CN10与CN15的绿藻丰度分别是CK的近3倍和2倍。模块3(Model III)不包含絮团OTUs,主要是水体中纤毛虫、轮虫等的相互作用。模块4(Model IV)与模块5(Model V)主要为水体中的不等鞭毛类、纤毛虫、轮虫与絮团中的绿藻的相互作用。CK组中的绿藻与轮虫在絮团与水体中处于相同的模块;实验组中绿藻与絮团中绿藻处在相同的模块,轮虫、纤毛虫和线虫(Nematoda)处在相同的模块。

表1 相似性分析不同时间段不同处理组真核微生物群落差异Tab.1 Similarity analysis of microeukaryotic community in different treatment groups at day 11 and day 28
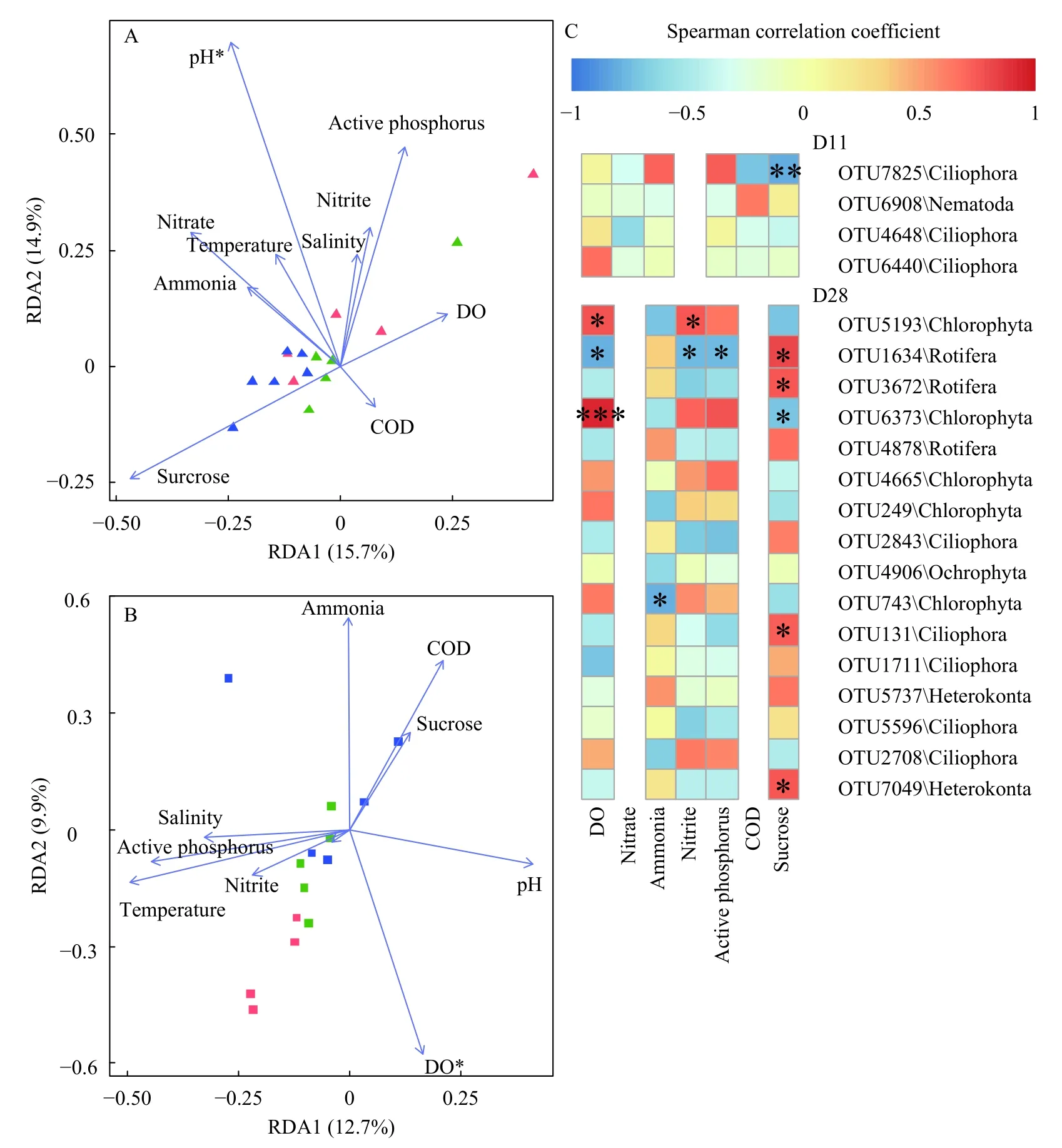
图3 冗余分析真核微生物群落结构与环境因子的关系Fig.3 Redundancy analysis(RDA)of the relationship between microeukaryotic community and environmental variables
3 讨论
3.1 蔗糖输入对水体和絮团真核微生物群落组成的影响
绿藻是构成水体和絮团微生物群落的重要组成部分,在整个实验过程中都有较高丰度,且不同组别差异较大。绿藻的丰度主要受氮磷营养盐和溶解氧的影响[20],对照组的氮、磷、溶解氧含量高于实验组,可能有利于绿藻的生长。绿藻在絮凝作用下可组成絮团骨架,有利于细菌和原生动物等的附着,从而形成生物絮团[21]。此外,绿藻可以吸收水体中的氨、磷,进而改善水质,并降低水体透明度,避免对虾的相互残食[22]。但当浮游藻类过度生长,易引起水体环境剧烈变化,从而导致水质恶化[23],造成养殖水体生态系统崩溃。
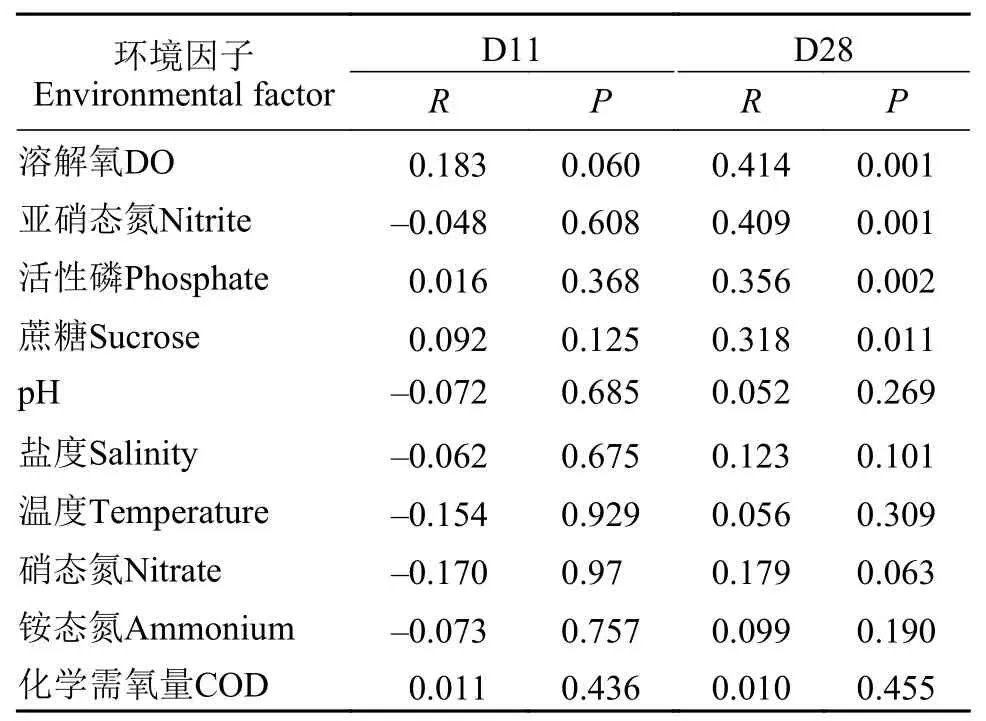
表2 Mantel分析环境因子与真核微生物群落的相关性Tab.2 Mantel tests analysis the correlation between environmental factors and eukaryotic microbial communities
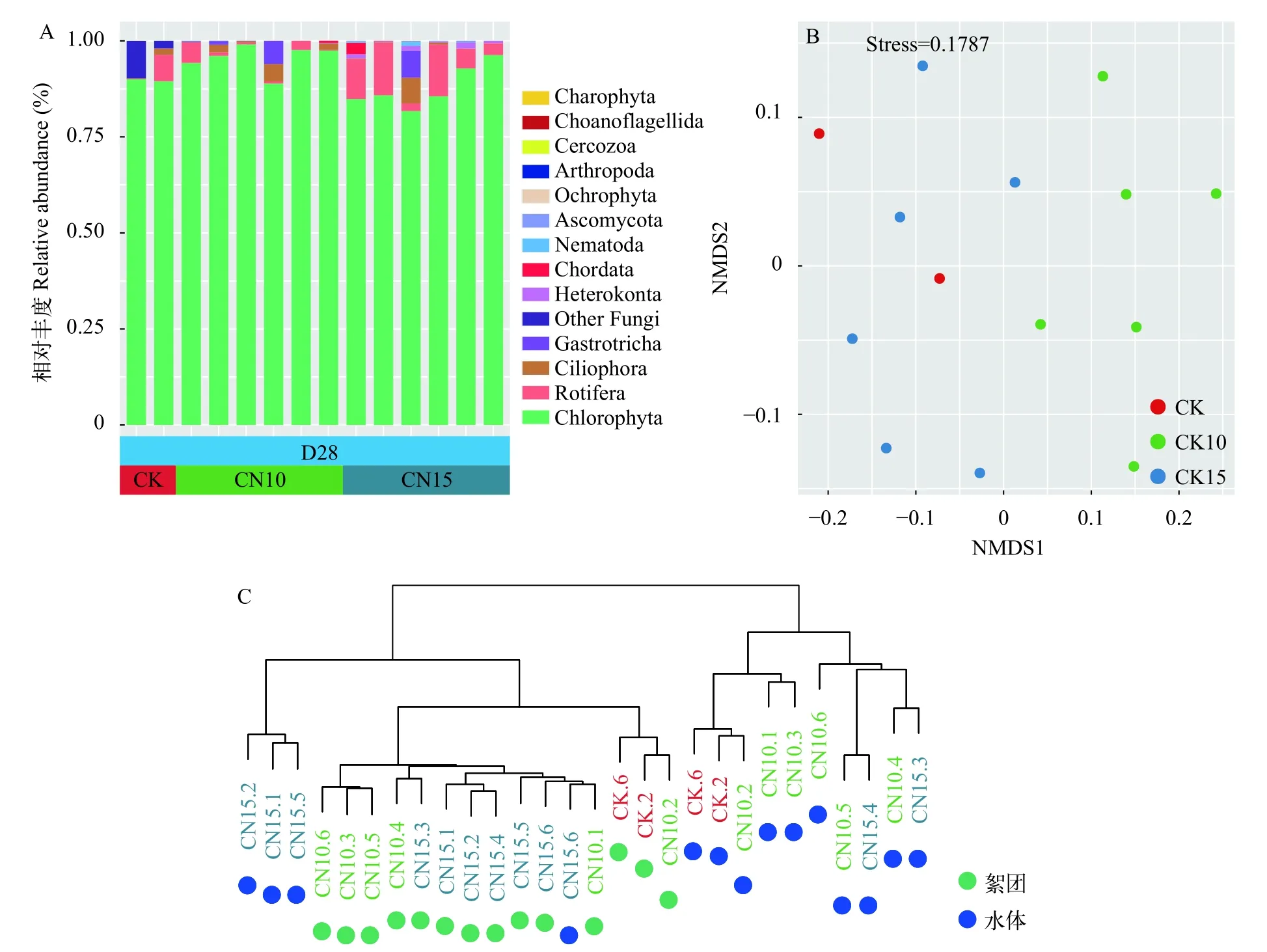
图4 絮团真核微生物组成及群落结构Fig.4 Microeukaryotic community composition and structure in biofloc
在第11天时,实验组与对照组中纤毛虫和绿藻的相对丰度有较大差异,纤毛虫在蔗糖输入组具有更高的丰度。研究发现,纤毛虫的丰度与氮和磷含量显著负相关[24],蔗糖的输入使微生物代谢速率加快,提高了氮磷去除效率,从而使纤毛虫在碳源输入组中具有较高丰度。 此外,在养殖生态系统中,纤毛虫能够刺激菌落的形成与黏附,促进其摄取营养物质[25];同时,纤毛虫对于浮游植物具有摄食作用,被认为是铵(“再生氮”)的重要来源,可以满足初级生产者对氮的需要[26]。
在第28天时,对照组中绿藻丰度较高,而碳源输入组中轮虫、腹毛动物门和子囊菌门具有更高的丰度。该阶段,养殖系统中有机质含量增高,微生物絮团增多,为轮虫的生长和增殖提供了有利的条件;同时,轮虫是对虾幼虫的重要食物来源[27]。子囊菌门可以降解水体中较难利用的颗粒及溶解腐殖质,随后将其作为碳源和氮源输入到食物网中,并改善水质[28]。可见,输入蔗糖能显著改变真核微生物群落组成,对微生物絮团的形成和养殖系统的稳定具有重要作用。
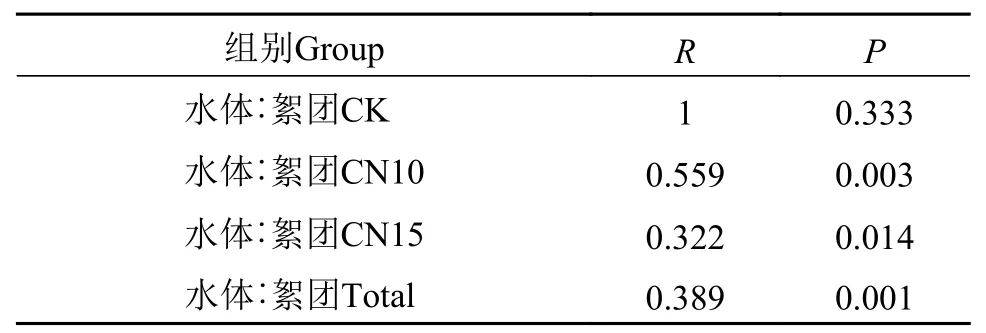
表3 相似性分析水体与絮团真核微生物群落结构差异Tab.3 Analysis of similarity(ANOSIM)of microeukaryotic community in water and biofloc
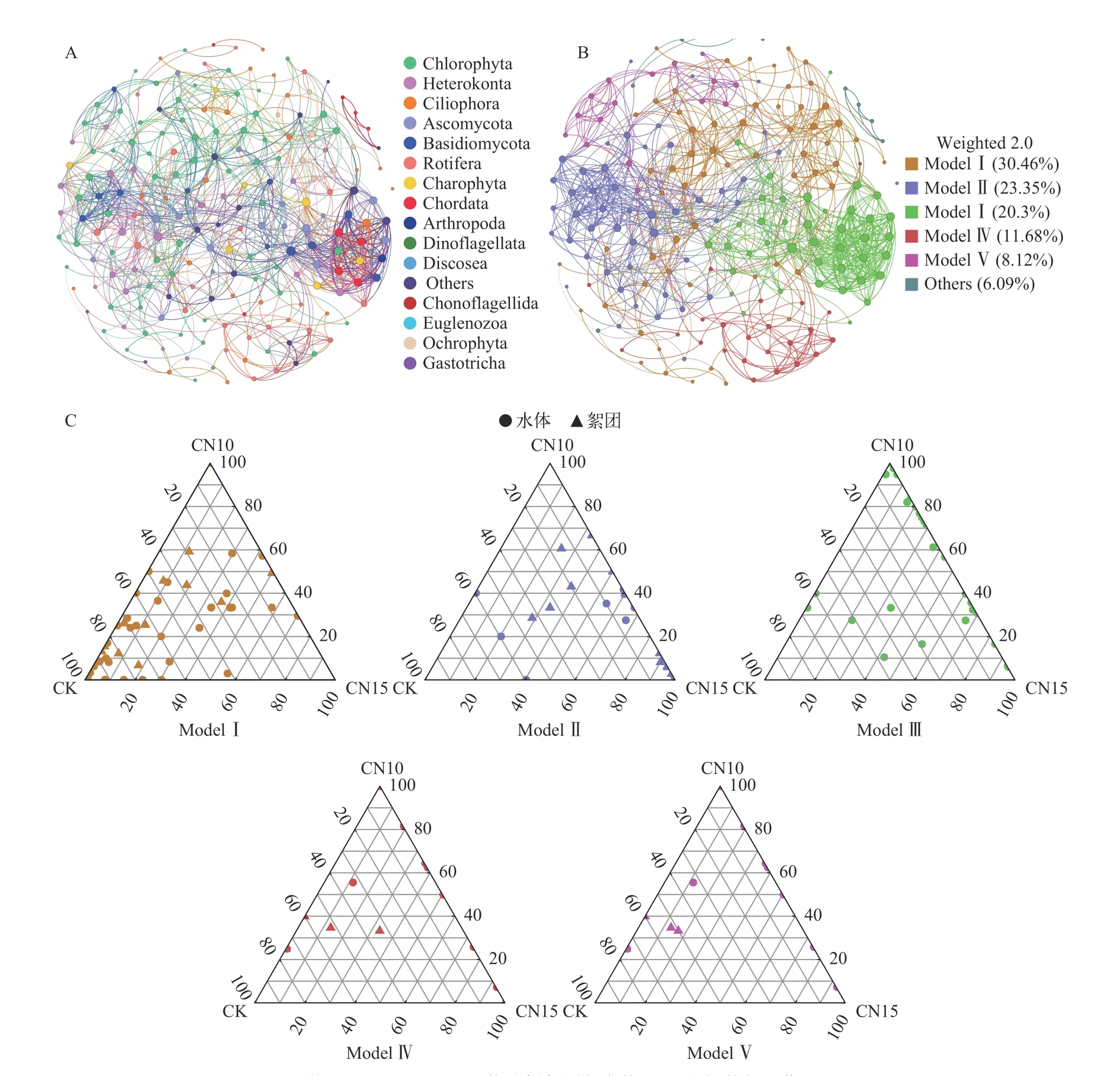
图5 Co-occurrance网络分析絮团与水体OTUs之间的相互作用Fig.5 Co-occurrence network among OTUs in water and biofloc based on correlation analysis
3.2 蔗糖输入条件下真核微生物群落结构变异的驱动因素
当前,针对水体与絮团微生物群落的研究主要集中在原核微生物[29],对真核微生物群落结构的研究还较为缺乏;然而,真核微生物群落结构在维持养殖系统水质以及保障对虾正常生长发育上的作用不容忽视。在实验过程中,对照组与CN15组的群落组成差异不断加大,而CN10组介于二者之间,与两个组均没有显著差异。海水的细菌在碳氮比大于10时会保持较高生长水平较高,然而高碳氮比条件下细菌的过度繁殖会显著影响水质[30]和絮团的形成[31],进而影响水体和絮团的真核微生物群落结构。
冗余分析和Mantel分析发现,水体溶氧、亚硝态氮、磷酸盐和碳源的输入对水体真核微生物群落演替具有显著影响。溶氧能显著影响浮游植物的光合作用和呼吸作用,对细菌和真核微生物群落结构具有显著影响[32—34]。氮、磷是浮游植物生长的必需元素,是构成浮游植物细胞的重要物质基础;磷常常作为限制性元素影响浮游植物的生长[35,36]。此外,溶氧和亚硝态氮能显著影响绿藻和轮虫的丰度,如轮虫丰度常与溶氧负相关,与亚硝态氮正相关[37—39]。蔗糖输入组中磷酸盐含量高于对照组,这与Luis等[40]的结果类似,可能是由于微藻和其他固磷细菌的共同作用导致[41],进而抑制了绿藻的生长,降低了其在蔗糖输入组中的比例。因此,碳氮输入对养殖水体水质具有一定影响,并进而影响微生物群落结构和组成。
3.3 水体与絮团真核微生物群落互作特征
在实验第28天时,绿藻、轮虫、纤毛虫与不等鞭毛类在水体与絮团具有较强的互作关系。在水体中碳氮比升高时,轮虫和纤毛虫在水体和絮团中的比例同时升高;而在低碳氮比组,真菌(Fungi)中的Zoopagales和壶菌门(Chytridiomycota)相互作用更加密切(图5A)。壶菌门中的根囊壶菌目主要分布在对照组中;根囊壶菌目可寄生微藻和无脊椎动物[42],对对虾的生长具有潜在危害作用。
在本研究中絮团中占据优势的原生动物为纤毛虫,后生动物中占据优势的为轮虫的单巢纲(Monogononta),这与Azim等[4]的研究结果不同,可能是由于不同水体对于絮团的微生物组成有一定的塑造作用。絮团真核微生物群落间的相互作用要强于絮团与水体真核微生物的相互作用(图5C)。蔗糖输入组的轮虫在水体和絮团中与对照组均无显著差异;但随着碳氮比的增加,轮虫的比例也相应升高。同时,水体与絮团中的轮虫或具有一定的动态交换能力(图5C),可在一定程度上弥补对方数量上不足。碳源输入会增加不等鞭毛类在水体与絮团中的相互作用,特别是网黏菌纲在絮团中的比例;此外,网黏菌纲的作用与根囊壶菌目类似,在有机质降解中起着重要作用[43,44]。可见,在水体和絮团中有着复杂的微生物互作关系,其中絮团微生物内部互作更为密切,且碳源输入对微生物互作具有一定的影响。
4 结论与展望
综上,向对虾养殖体系中输入碳源,能够改变真核微生物群落组成,提高纤毛虫、轮虫在水体的丰度,抑制绿藻过度生长,对微生物絮团形成和养殖微生物系统的稳定具有重要意义。增加输入的碳氮比例会进一步影响水体和微生物的群落变化,且溶氧、亚硝态氮、活性磷对群落演替都有显著影响,如输入碳源可增加不等鞭毛类、纤毛虫和轮虫在水体和絮团中的相互作用,对养殖体系中藻类的过度繁具有一定的抑制作用,并提高对虾对蛋白摄入。然而,当前研究并未就蔗糖输入条件下的真核微生物与原核微生物之间的相互关系进行进一步研究,因而无法对碳、磷、氮的流向进行深入探讨。同时,高通量测序在后生动物等多细胞生物相对丰度测定方面存在一定偏差,后续研究中会使用显微计数的方式准确测定后生动物丰度。此外,后续研究可关注输入蔗糖条件下的对虾营养结构和免疫酶活变化,为生物絮团技术应用于凡纳滨对虾养殖提供理论支持和技术指导。
