虹鳟spindlin基因克隆及不同倍性的表达分析
2021-02-04史秀兰黄天晴徐革锋邹作宇刘晨斌王炳谦
史秀兰 黄天晴 徐革锋 邹作宇 谷 伟 程 琳 刘晨斌 王炳谦
(1.上海海洋大学,上海 201306;2.中国水产科学研究院黑龙江水产研究所,哈尔滨 150076;3.哈尔滨市农业科学院,哈尔滨 150028)
卵母细胞成熟是胚胎发育的开端。成熟期可以进一步分为两个方面,即细胞质成熟和细胞核成熟,其中核成熟包括在减数分裂过程中,染色体的联会,重组和分离[1,2]。spindlin(Spin)基因在前期的研究中被证明是减数分裂纺锤体相关的母体效应因子,且从卵母细胞到早期胚胎发育的过渡期间,在细胞周期调节中发挥作用[3]。作为丰富的母体转录物,在小鼠(Mus musculus)[4]、鸡(Gallus gallus)[5]和银鲫(Carassius auratus gibelio)[6]等不同物种的研究中发现,spindlin基因的转录和翻译结果表现出很大差异。在小鼠卵母细胞的减数分裂期间,spindlin部分定位于减数分裂纺锤体[7],而鸡在整个有丝分裂期间都停留在染色体上,推断spindlin可能在间期细胞核中发挥作用,并在有丝分裂期间作为载体转移到染色体上。蛋白质磷酸化和去磷酸化可调控细胞周期进程[8],有研究表明,Spin家族蛋白在细胞周期中以剂量依赖性方式被磷酸化,在核内发挥重要功能,并且在减数分裂进程中与纺锤体相关[9],在人(Homo sapiens)[10]、小鼠和鸡的Spin蛋白家族中,蛋白激酶C(PKC)磷酸化和酪氨酸磷酸化这两个潜在位点和RNA结合基序RNP-1是完全保守的,RNA结合蛋白调节母体转录物的及时翻译和定位[11]。
通过人工诱导,精子入卵时,使停滞在第二次减数分裂中期的卵子重新启动,此时利用理化手段抑制第二极体的排出,即制得三倍体雌性虹鳟[12]。在生产过程中,三倍体雌性虹鳟生长速度快、肉质鲜嫩[13]和养殖死亡率小的优势是二倍体虹鳟不可比拟的,并且逐渐受到市场的亲睐。但是三倍体虹鳟性腺败育的深层机理方面的研究并不详尽。了解性腺败育的机制是育种的关键,人工诱导的三倍体虹鳟恰成为研究多倍体鱼类性腺发育的良好模型。在前期的研究中发现,三倍体雌性虹鳟在8月龄以后,卵母细胞成熟开始受阻,不能正常产生配子。当发育到10月龄后,完整的卵母细胞结构几乎不存在,由于卵母细胞结构发育异常,染色质集中在核中央或偏于一侧,即发生破裂或坏死等败育现象[14,15]。spindlin基因在脊椎动物如银鲫、青鳉(Oryzias latipes)[16]和青黑斑河豚(Tetraodon nigroviridis)[17]等进行过相关研究,但在虹鳟的研究中尚未见报道。为深层探究在卵母细胞败育过程中减数分裂机制中的差异表现,本研究选取240—330 dpf发育时期,采用基因克隆得到spindlin基因cDNA序列,分析了spindlin基因在虹鳟各组织的表达情况,并且比较了spindlin基因在不同发育阶段二倍体与三倍体雌性虹鳟卵巢中的表达差异状况。利用免疫组化方法,观察在不同发育时期,Spin蛋白在二倍体与三倍体的卵巢组织中表达的动态变化。研究结果为进一步探讨多倍体鱼类性腺发育过程中减数分裂受阻提供参考。
1 材料与方法
1.1 实验动物与样品保存
二倍体和三倍体雌性虹鳟取自黑龙江水产研究所渤海冷水性鱼试验站,在平均水温为 9℃的养殖缸中饲养,自240—330 dpf期间,每30d取样1次,共采取全雌二倍体虹鳟48尾,三倍体雌性虹鳟36尾。其中采取3尾二倍体虹鳟的肾、肝、鳃、肌、肠、脾、卵巢、心和眼组织,采取体积大小为3 mm×3 mm;另取二倍体与三倍体虹鳟各6尾的卵巢组织,将所得组织均置于RNA保护液中,并放入-80℃冰箱保存备用。同时采取二倍体与三倍体虹鳟各3尾的卵巢组织,采取卵巢组织时,保持其形态完好度,即前部的扁三棱状与后部线状拖尾,并展平置于4%多聚甲醛,常温备用。
1.2 总RNA提取与cDNA合成
利用Simply P Total RNA Extraction Kit试剂盒(BioFlux,中国)提取总RNA,通过1%琼脂糖凝胶电泳以及紫外分光光度计检验 RNA 的完整度,同时使用ScanDrop 核酸分析仪(Analytik Jena,德国)测量 RNA 浓度和纯度,即吸光度值A260/280在1.8—2.0可以留作备用。按照Bio RT高灵敏cDNA第一链合成试剂盒(BOER,中国)说明书合成cDNA,其反应体系为5 μL Hybrid mix,0.5 μL Enzyme mix,根据所测得的RNA浓度添加模板量(1 pg—2 μg),加入Nuclease-free water补至10 μL。反应程序为37℃,20min;98℃,5min。获得的cDNA置于-20℃保存。
1.3 spindlin基因cDNA克隆
在NCBI公共数据库中检索到与虹鳟同源性较高的物种spindlin基因的序列信息,根据高度保守区域设计引物,引物spindlinF2/R2用于该基因的核心片段克隆,其5′UTR由设计的引物spindlinF1/R1获得,引物spindlinF3/R3用于克隆3′UTR,使用Primer 5.0软件设计特异性引物(表1),引物在苏州泓迅生物科技股份有限公司合成。核心片段的PCR扩增体系为10 μL,反应体系为5 μL 2×Taqmixture、0.5 μL Forward primer+Reverse primer、1 μL cDNA、3.5 μL Nuclease-free water。反应程序设置为94℃预变性2min;94℃变性30s;59℃退火30s;72℃延伸30s;30个循环;72℃延伸5 min。根据SMARTer®RACE 5′/3′ Kit Components说明书的方法和步骤进行3′UTR和5′ UTR的RACE扩增,PCR产物经1%琼脂糖凝胶电泳,根据Biospin Gel Extraction Kit(Bio-Flux公司)纯化目的片段,PMD18-T载体连接,转入DH5α感受态细胞,LB培养基(含氨苄)挑取圆形亮白色单菌落送公司完成测序。

表1 虹鳟spindlin基因序列扩增引物信息Tab.1 The primers used for spindlin amplification
1.4 虹鳟spindlin基因序列生物信息学分析
利用DNAMAN软件拼接克隆片段,得到spind-lin基因完整cDNA,采用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/)进行基因开放阅读框预测,用Blast在线程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi)分析基因与其他物种的同源性。使用DNAMAN6.0软件对序列进行翻译及与其他物种同一蛋白的氨基酸序列多重比对。蛋白质基本物理化学参数分析和结构使用在线网站(https://web.expasy.org/protparam/)进行分析,构建氨基酸系统进化树用MEGA 7.0软件的邻接法(Neighbor-joining,NJ)发育树构建工具,进行1000 次自展检验(Bootstrap)评估进化树分支可信度。
1.5 实时荧光定量PCR
以各时期采取的二倍体和三倍体雌性虹鳟的肾、肝、鳃、肌、肠等组织和卵巢的cDNA 作为实时荧光定量(RT-PCR)的模板,根据已经克隆出的虹鳟spindlin基因序列,以β-actin作为内参基因,使用Primer 5.0软件设计特异性引物(表1),在苏州泓迅生物科技股份有限公司合成。反应体系采用Roche公司(瑞士)的SYBR Green Master 10 μL体系,SYBR Green 5 μL,上下游引物共 0.4 μL,cDNA模板0.5 μL,加ddH2O至10 μL。利用 BIO-RAD CFX96 TOUCH荧光定量仪的 2-ΔΔCt法检测spindlin基因在各组织以及不同时期卵巢的相对表达量。反应设置程序为95℃,10min;95℃,10s;60℃,30s;共计40个循环,熔解曲线从 65℃上升到95℃,每秒增加0.5℃。
1.6 Western blot
将采取的二倍体和三倍体雌性虹鳟各时期卵巢组织剪切成细小碎块并匀浆,按照每100 mg组织加入1 mL RIPA裂解液(Beyotime,中国)和10 μL PMSF(Beyotime,中国),在冰上使其充分裂解。12000 r/min离心5min 后,取上清放入新的EP管。按照1﹕5加入蛋白上样缓冲液,煮沸10min,即获得各时期卵巢蛋白,保存于-20℃待用。将各时期蛋白样品进行 SDS-PAGE 凝胶电泳,根据蛋白marker,切下含有目的条带的下层分离胶,采用 PVDF膜进行转膜。转膜时需定流 I=200 mA,时间为50min。然后在5%的脱脂乳中封闭2h。用 PBST洗膜,共3次,每次10min。以Spin的抗兔多克隆抗体为一抗(Immunoway,美国),按1﹕1000比例稀释在4℃过夜孵育,之后用 PBST 洗膜三次。使用辣根过氧化物酶标记的(HRP)二抗(抗兔IgG,Immunoway,美国)用孵育液1﹕2000倍稀释,37℃孵育2h,之后利用 PBST洗膜3次。使用 1 mL ECL 超敏发光液(500 μL A+500 μL B)滴到膜上进行显影,利用化学发光凝胶成像系统(BIO-RAD公司)进行曝光和拍照。
1.7 利用免疫组织化学方法进行切片观察
采取各时期二倍体与三倍体雌性虹鳟卵巢组织,置于4%多聚甲醛中固定48h,然后从50%、70%、80%、85%、90%、95%和100%的乙醇依次进行梯度脱水,二甲苯透明,置于硬软蜡中包埋后,以5 μm厚度切片制成石蜡切片,后进行脱蜡,在室温环境下,将切片避光浸入3%过氧化氢(蒸馏水稀释)10min,以灭活内源性过氧化氢酶,使用EDTA溶液进行抗原修复,在85℃下浸泡2min,在60℃下浸泡4min。以Spin抗兔多克隆抗体为一抗(Immunoway,美国),按1﹕200比例稀释在4℃过夜孵育,后用酶标山羊抗兔IgG聚合物(中杉金桥公司)为二抗进行孵育,DAB显色,苏木素复染,最后用中性树胶封片,使用OLYMPUS CX41的正置光学显微镜在物镜40×和目镜10×镜头下观察,利用IC Capture 2.2软件获取图片。
1.8 数据分析与统计
使用SPSS 17软件进行单因素方差分析(One-Way ANOVA)和Duncan检验进行数据处理,利用Origin 2017软件对统计结果进行作图,P<0.01表示具有极显著差异性,P<0.05表示具有显著差异性。
2 结果
2.1 虹鳟spindlin序列分析与多序列比对
本研究通过克隆得到虹鳟spindlin基因cDNA全长4529 bp,获得GenBank登录号:MN378564,其中3′UTR长3662 bp,5′UTR长141 bp,开放阅读框(ORF)长726 bp,编码241个氨基酸。通过对其编码的蛋白质进行分析,虹鳟Spin蛋白质的相对分子量为28.3 kD,理论等电点值为5.94,不稳定指数为43.08,此蛋白为不稳定蛋白。
采用Ensembl和NCBI数据库对spindlin全长cDNA 序列进行分析,得到虹鳟spindlin基因的结构图(图1)。通过比对发现虹鳟spindlin位于虹鳟第28号染色体,基因全长约13.5 kb,由7个外显子和6个内含子组成。利用ExPASy在线分析工具,预测结果显示该基因无信号肽,无跨膜螺旋区,对虹鳟spindlin基因的磷酸化位点进行预测,结果表明,含有丝氨酸(Ser)磷酸化位点13个[unsp(6/14/15/19/21/22/24/25/27/28)、DNAPK(66)、PKA(90)、PKC(224)],苏氨酸(Thr)磷酸化位点7个[PKC(51/56/150/205)、unsp(96/193)、PKG(212)],络氨酸磷酸化位点4个[unsp(2/72/166/203)],Ser-6的得分最高为0.997。
利用BLAST 在线分析软件对虹鳟Spin氨基酸与其他物种Spin氨基酸进行同源性比对,在硬骨鱼类中,虹鳟与银大马哈鱼(Oncorhynchus kisutch)同源最高,为99.59%,与银鲫(Carassius auratus)、鲤(Cyprinus carpio)和斑马鱼(Danio rerio)相比分别为87.11%、92.12%和91.7%。与哺乳动物和两栖动物相比,与鸡(Gallus gallus)、小鼠(Mus musculus)、人(Homo sapiens)和兔(Oryctolagus cuniculus)的同源性分别为65.26%、65.05%、61.18%和59.76%。与两栖动物非洲爪蟾(Xenopus laevis)的同源性为60.16%。
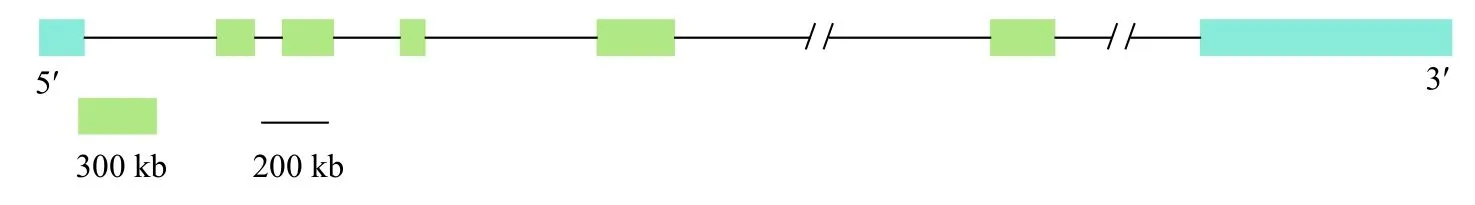
图1 虹鳟 spindlin 基因结构图Fig.1 Rainbow trout spindlin gene structure map
2.2 Spin系统进化树分析
利用贝叶斯分析的方法对21个物种的氨基酸序列进行进化分析,系统发育进化树显示,主要分为两大支,硬骨鱼类与哺乳动物类。从分支长度来看,虹鳟与大马哈鱼亲缘关系最近,其次就是红点鲑(Salvelinus alpinus),聚为一支。与鸡的亲缘关系最远。其他鱼类亲缘关系介于两者之间(图2)。
2.3 虹鳟spindlin基因在mRNA水平的表达模式
Spindlin基因在二倍体雌性虹鳟的卵巢、肾、肝、脾、肌、鳃、心、眼、肠和鳍等组织中均有表达。且spindlin基因在卵巢组织中的表达与其他各组织差异极显著(P<0.01),明显高于其他各组织的表达。在其他组织如肾、肝、脾、肌肉、鳃、眼、肠和鳍之间相对表达量差异不显著(P>0.05),但在心脏和鳍中的表达,与其他组织有显著性差异(P<0.05,图3A)。
通过分析spindlin基因在卵巢组织中不同发育阶段不同倍性的相对表达量,可得出以下结论,在240—300 dpf发育阶段,与三倍体雌性虹鳟不同发育时期卵巢相比,二倍体雌性虹鳟中spindlin基因的相对表达量显著的下降,在300—330 dpf阶段,表达量有回升,但恢复不到240 dpf的表达量水平。且在240、270和330 dpf阶段之间差异不显著(P>0.05)。在240—330 dpf发育阶段,与二倍体雌性虹鳟不同发育时期卵巢相比,三倍体雌性虹鳟中spindlin基因的相对表达量显著的上升,240 dpf与270 dpf、300 dpf和330 dpf存在极显著差异(P<0.01),270、300和330 dpf之间差异不显著(P>0.05)。在同一发育阶段中,spindlin基因在二倍体雌性虹鳟卵巢中的表达量较三倍体雌性虹鳟相对较高,且均存在极显著差异(P<0.01,图3B)。
2.4 二倍体与三倍体虹鳟卵巢组织学观察结果分析
在240—330 dpf阶段时,二倍体虹鳟卵母细胞体积逐渐增大,核仁的数量也在增多,在卵母细胞膜的边缘出现零散的滤泡细胞(Follicle cell,Fc),外排的核仁形成类核周体(Nuage,Nc),胞质与核膜之间出现透明层,随后,卵母细胞继续变大,透明层消失。与二倍体虹鳟不同,三倍体虹鳟在240—330 dpf发育阶段卵巢发育异常,卵原细胞包囊化,形成卵原细胞簇,通常由4—6个卵原细胞外被一层膜包裹。通过Spin蛋白在卵巢组织中的表达和定位分析,可以得到如下结论,在240—330 dpf发育阶段,二倍体雌性虹鳟(图4A)与三倍体虹鳟(图4B)的卵巢组织中均有特异性表达条带,从其深浅变化结果与实时荧光定量结果基本一致。对于二倍体虹鳟卵巢,在240 dpf,阳性信号主要集中在细胞核内,且阳性信号最强(图5a),在270 dpf时,信号在核内减弱,向胞质扩散(图5b),在300 dpf时期,核内信号持续降低,到达最低点,胞质信号逐渐增强(图5c),而330 dpf时,核内信号回复,但仍比240 dpf时弱(图5d)。这与卵母细胞发育轨迹是相同的。对于三倍体虹鳟卵巢,由于主要存在败育的卵母细胞和卵原细胞簇,在240—330 dpf阶段,在卵原细胞中表达,且信号逐渐加强,在卵原细胞簇间隙的滤泡细胞有较弱的信号。
3 讨论
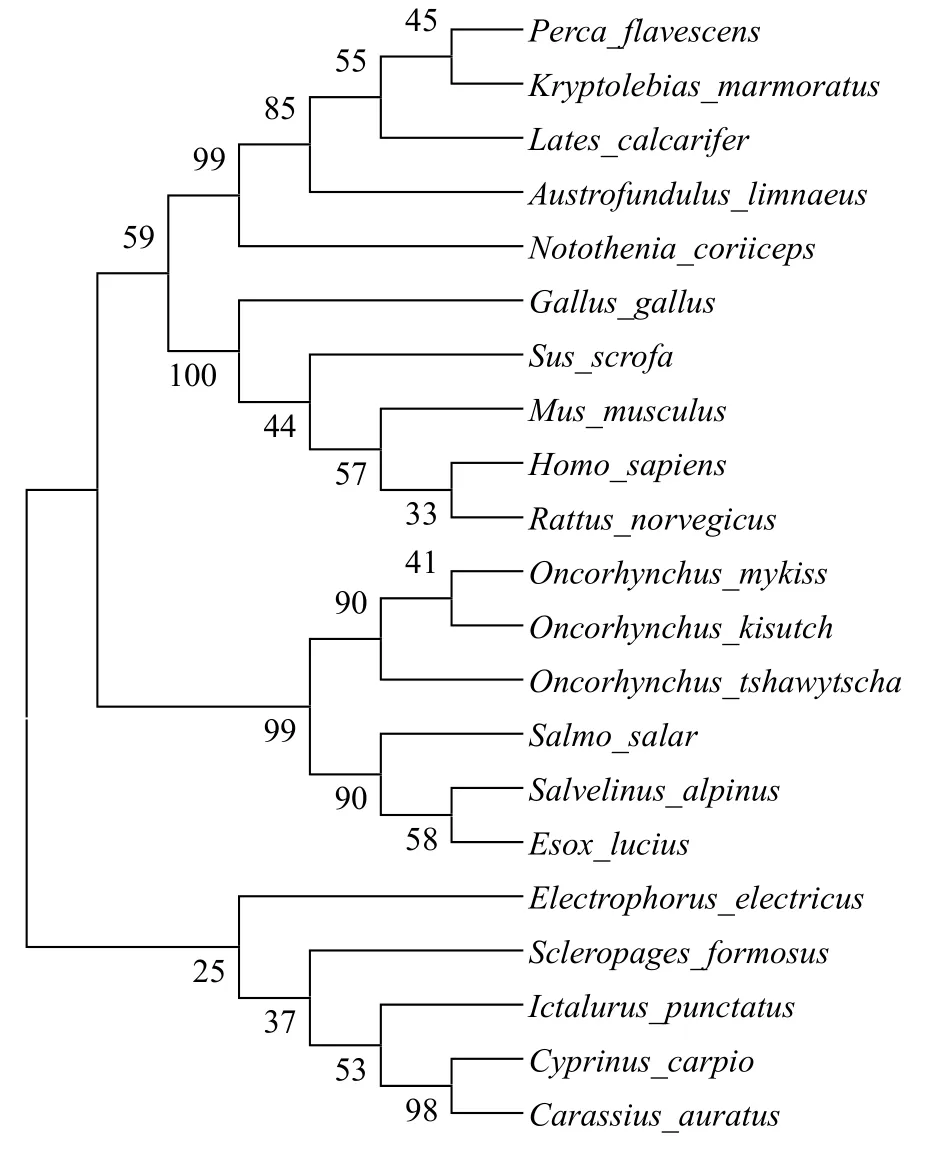
图2 Spin氨基酸序列NJ系统进化树Fig.2 The Neighbor-Joining Phylogenetic tree for amino acid sequences of Spin

图3 spindlin基因实时定量表达情况Fig.3 Real-time quantitative expression of spindlin genes

图4 Spin蛋白在虹鳟二倍体与三倍体卵巢组织中不同发育时期表达情况Fig.4 Spin protein expression in different developmental stages in the diploid and triploid ovarian tissues of rainbow trout
本研究克隆得到了虹鳟spindlin基因cDNA序列全长,编码由245个氨基酸组成的蛋白质,预测分析不存在信号肽,且无跨膜螺旋区,由于蛋白质磷酸化和去磷酸化对细胞周期的调控是有重要作用的,在分析该基因可能存在的磷酸位点可知,丝氨酸和苏氨酸的位点最多,且丝氨酸得分最高,在之前的研究中证明,Spin蛋白质是MAP激酶途径中的底物,它在丝氨酸或苏氨酸残基上的磷酸化是必不可少的,它与主轴相互作用发挥功能,说明可能通过磷酸化spindlin来进行减数分裂细胞周期的调控[18—20]。小鼠的spindlin基因转录在未受精和受精后2细胞期到4细胞期可以被检测到,到8细胞以后未见有表达。在鸡中,在早期胚胎中chSpin-W和chSpin-Z都被转录,chSpin-Z在成年鸡的各种组织中表达,而chSpin-W在卵巢颗粒和睾丸细胞中有显著表达。在银鲫中,其转录产物可以从成熟卵到囊胚胚胎中检测到,但其含量从2细胞期降低,在原肠胚阶段后的阶段中无法被检测到[21]。在这次研究中,在成鱼虹鳟各组织中均有表达,但在卵巢表达量最高,说明spindlin基因在卵母细胞成熟过程持续发挥作用,并不是只在胚胎早期有调控功能。在240—330 dpf发育阶段,spindlin基因在二倍体雌性虹鳟卵巢组织表达量无显著性差异,在三倍体虹鳟卵巢组织呈现低水平表达且为上升趋势,由于鱼类卵母细胞在成熟阶段,先停滞在减数第一次分裂的G2期末,即生发泡(Germinal vesicle,GV)期,随后,在促黄体激素作用下,再次恢复减数分裂,完成卵母细胞成熟[22]。值得注意的是卵母细胞完成从第一次减数分裂双线期向中期的转变时,会发生核膜破裂,皮层区细胞骨架的重排和减数分裂纺锤体的组装等事件。由于三倍体虹鳟存在第三套染色体,在减数分裂偶线期,即同源染色体联会发生紊乱,使得减数分裂不能正常进行,无法排出成熟配子,导致不具备受精能力。三倍体虹鳟的spindlin基因低表达恰好证实了这一观点。在三倍体虹鳟发育后期阶段,性腺败育形成的卵原细胞簇,会进行再分化形成类生精细胞囊,此时与卵原细胞簇并存,且类生精细胞囊成为性腺结构的主要组成成分,卵巢呈现类雄性化,由于不能正常产生精子,最终会出现大量败育的精子细胞[23],在此阶段可能是spindlin基因表达上升的原因,但这一推测仍需进一步验证。

图5 Spin蛋白在虹鳟二倍体与三倍体卵巢组织中不同发育时期表达分布状况Fig.5 Distribution of Spin protein in different gonadal stages of diploid and triploid female rainbow trout
关于Spin蛋白在核仁中的定位,在免疫组化结果显示,Spin蛋白质表达模式符合特定的亚细胞定位,并且与特定功能一致[24]。核仁是在卵母细胞和胚胎发育重要的细胞器,并且在卵子发生过程中发生广泛的形态学变化[25,26]。密集的核仁定位意味着spindlin可能是组成调控卵母细胞生长过程的重要因子,且可以作为追踪核仁形态变化和功能作用的标志物。显示的数量众多的核仁可能与虹鳟卵母细胞发育有关。
根据前人研究发现,在240—330 dpf发育阶段,spindlin基因在二倍体雌性虹鳟与三倍体虹鳟卵巢组织中的表达量呈现的趋势同细胞自噬调控通路mTOR(Mammalian target of rapamycin)受体基因TOR1变化趋势一致[27],有研究表明,细胞自噬在三倍体雌性虹鳟性腺败育过程中起重要作用,由于mTOR通路在三倍体雌性虹鳟卵巢发育的过程中受阻,细胞自噬水平增加,使得细胞内相关基因转录翻译发生紊乱,甚至缺失。关于spindlin基因是否与这一通路有关还未见报道,但在人类研究中,已表征了两个Spin蛋白同系物(Spin-1和Spin-2),揭示了其与抗凋亡和肿瘤发生有关[28],这为进一步探讨spindlin基因功能提供了有力的证据。三倍体虹鳟性腺败育的发生机制还需进一步探讨。
