粟粒型肺癌的肿瘤微环境及其与EGFR-TKI疗效的关系
2021-02-04叶美凤苏珊岑文昌张言斌
叶美凤 苏珊 岑文昌 张言斌
1广州医科大学(广州511436);2广州市胸科医院(广州501595)
粟粒型肺癌是一种特殊类型的肺癌,主要表现为影像学上大量弥漫的、微小的(≤3 mm)的肺小结节,多为非小细胞肺癌(non-small cell lung cancer,NSCLC)血行转移形成[1]。文献报道,绝大多数粟粒型肺癌为肺腺癌,且表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变率高达70% ~86%[2-3]。近年来,EGFR 酪氨酸激酶抑制剂(EGFR-tyrosine kinase inhibitor,EGFRTKI)在指南中被推荐为EGFR 突变的晚期NSCLC患者的首选一线治疗。既往临床研究显示,接受EGFR-TKIs 治疗的EGFR 敏感突变NSCLC 患者,中位无疾病进展时间(progression-free survival time,PFS)达到8 ~13个月,与传统的一线化疗4 ~6个月的中位PFS 相比,TKIs 展现出了极大的优势[4-5]。有少数研究发现,粟粒型肺腺癌患者一线接受EGFR-TKI 治疗的PFS 大约在4 ~8 个月[3,6],预后明显比非粟粒型肺癌差。但是,粟粒型肺癌患者接受靶向治疗效果不佳的内在原因仍需进一步的研究。
肿瘤微环境是肿瘤细胞生存的内环境,不仅包括肿瘤细胞本身,还有其周围的成纤维细胞、免疫和炎性细胞、胶质细胞等各种细胞,以及细胞间质、微血管等[7]。程序性死亡分子配体1(programmed death ligand 1,PD-L1),在多种肿瘤细胞中表达,与其受体程序性死亡分子PD-1(programmed death 1)结合可抑制肿瘤免疫效应[8]。TENG 等[9]根据PD-L1 的表达和肿瘤浸润淋巴细胞(tumorinfiltrating lymphocytes,TIL)的状态,将肿瘤微环境分成四种免疫表型,其中I 型肿瘤微环境中PD-L1高表达且存在大量CD8+TILs,因此被认为是免疫炎症型的肿瘤微环境,对以PD1/PD-L1 通路为靶点的免疫治疗响应。近年来有研究发现,肿瘤微环境可能还参与了靶向治疗的耐药。MASSI 等[10]发现,黑色素瘤微环境中的免疫抑制成分在BRAF 抑制剂反应改善中发挥重要作用。在肺癌中,MATSUMOTO 等[11]发现,微环境的免疫表型与EGFRTKI 疗效密切相关。前期研究也证实,PD-L1 的表达阳性与EGFR-TKI 耐药有关[12]。而既往研究发现,粟粒型肺癌患者,EGFR 突变几率较高,且接受靶向治疗效果不佳,这其中是否也有免疫因素的参与,目前尚不清楚。
因此,本回顾性研究通过免疫组化方法检测粟粒型肺癌患者PD-L1 和CD8 的表达,拟明确粟粒型肺癌患者肿瘤微环境免疫表型的特点,并进一步探索其是否影响EGFR-TKI 的疗效,为免疫因素参与靶向治疗的耐药提供新的理论依据。
1 对象与方法
1.1 研究对象回顾性收集2017 年3 月至2019 年3 月广州市胸科医院收治的147 例EGFR 突变并接受EGFR-TKI 治疗的IV 期NSCLC 患者。根据影像学是否表现为大量弥漫性的、微小的(≤3 mm)的肺小结节,将患者分为粟粒型肺癌组(A 组,49 例)和非粟粒型肺癌组(B 组,98 例)。纳入标准:(1)经组织病理学确诊为NSCLC;(2)病理学分期为Ⅳ期;(3)具有EGFR 基因突变;(4)组织标本足够行免疫组织化学检测;(5)病理确诊后曾接受采用EGFR-TKI 治疗。排除标准:(1)取得组织标本前曾接受过抗肿瘤治疗;(2)合并其他肿瘤或严重疾病者。从医院电子数据中收集患者性别、年龄、吸烟史、临床分期、EGFR 突变类型等临床基线特征。该研究已得到广州市胸科医院评审和伦理委员会批准,所有患者在参加本研究前均已获得知情同意。
1.2 结果评估所有患者在接受EGFR-TKI 治疗期间每3 个月进行一次胸部CT 检查随访。根据实体肿瘤反应评估标准(RECIST)1.1 版确定治疗反应和疾病进展的定义。无进展生存期(progression-free survival,PFS)被定义为从接受EGFR-TKI治疗开始到疾病进展或死亡的时间。在最后一次随访中,如果没有疾病进展(PFS),则对患者进行审查。
1.3 免疫组化染色所有肿瘤标本均为患者首诊时通过活检获得。采用免疫组化法检测肿瘤组织中PD-L1(22C3,Dako,Carpinteria,CA)及淋巴细胞CD8(C8/144B,上海基因科技有限公司,中国)的表达。所有的IHC 分析都由两名经验丰富且不知患者临床信息的病理学家进行评估。PD-L1 表达采用3 级分级系统定义:≥50%为强阳性,1% ~49%为弱阳性,<1%为阴性表达。CD8 阳性的标准为表达CD8 的淋巴细胞在肿瘤间质中所占的比例,<10%为阴性,≥10%为阳性。
1.4 治疗方法粟粒型肺癌组患者均接受过EGFR-TKI治疗,其中一线治疗40例(81.63%),二线治疗9 例(18.37%)。接受EGFR-TKI 一线治疗的药物包括吉非替尼(13 例,32.5%)、埃克替尼(15 例,37.5%)、厄洛替尼(7 例,17.5%)和阿法替尼(5 例12.5%),二线治疗包括吉非替尼(6 例,66.67%)、厄洛替尼(2例,22.22%)和阿法替尼(1例11.11%)。非粟粒型肺癌组患者均接受一线EGFR-TKI 治疗,包括吉非替尼(41 例,41.84%)、埃克替尼(35 例,35.71%)、厄洛替尼(13 例,13.27%)和阿法替尼(9 例9.18%)。
1.5 统计学方法采用SPSS 22.0进行统计学分析及GraphPad Prism 8.0 绘图。采用χ2检验评估粟粒型肺癌和非粟粒型肺癌患者间PD-L1 和CD8 表达以及治疗反应的差异。采用χ2检验比较不同PD-L1表达患者的治疗反应。采用Kaplan-Meier 法进行生存分析,并进行Log-rank 检验。采用Cox 回归方法分析PFS 的预后因素。采用Logistic 回归分析方法分析粟粒型肺癌的相关因素。检验水准α=0.05。
2 结果
2.1 入组患者的基线特征本研究共纳入147 例EGFR 突变的NSCLC 患者,其中粟粒型肺癌组(A组)患者49 例,非粟粒型肺癌组(B 组)患者98 例。A组患者的中位年龄58岁,范围为25 ~82岁。B患者的中位年龄63 岁,范围为33 ~83 岁。A 组患者病理类型均为腺癌,B 组有96 例腺癌(98.0%),2例鳞癌(2.0%)。所有患者在接受治疗前进行基因检测。A组中1例患者治疗前检测到合并T790M 突变,B 组1 例患者合并T790M 突变,2 例PI3K 复制,1 例HER2 扩增,1 例ALK+突变,1 例ROS1 突变。所有患者的基线临床资料平衡,两组患者之间的年龄、性别、吸烟情况等基线特征差异均无统计学意义(均P>0.05),但两组的EGFR 突变分型差异有统计学意义(P<0.05)。见表1。
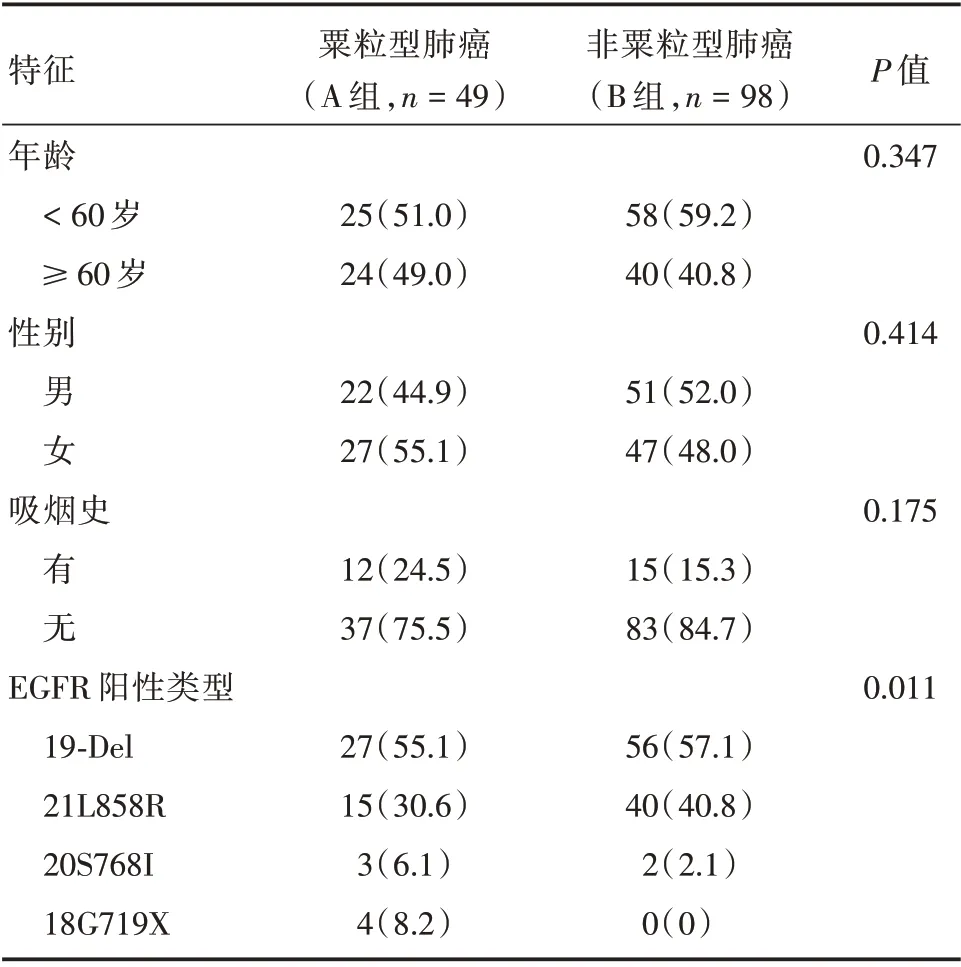
表1 两组患者的临床病理基线特征Tab.1 Clinicopathological baseline characteristics of patients in both groups例(%)
2.2 肿瘤微环境中PD-L1 的表达及其对EGFRTKI 疗效的影响A 组和B 组患者PD-L1 表达的阳性率分别为40.82%(20/49)和24.49%(24/98),二者差异有统计学意义(P= 0.042)。A 组PD-L1阳性患者的中位PFS 为5.1 个月,明显短于阴性患者的9.4 个月(P= 0.009)。B 组PD-L1 阳性和阴性患者的中位PFS 分别为7.0 和11.0 个月,二者之间差异有统计学意义(P=0.024),见图1。
2.3 肿瘤微环境的免疫分型及其与EGFR-TKI疗效的关系既往文献报道[10],根据PD-L1 和CD8的表达状态,将肿瘤微环境分为4 种类型:Ⅰ型(PD-L1+/CD8+,适应性免疫抵抗)、Ⅱ型(PD-L1-/CD8-,免疫忽视)、Ⅲ型(PD-L1+/CD8-,内源性诱导)和Ⅳ型(PD-L1-/CD8+,免疫耐受)。A 组Ⅰ型免疫微环境的患者有12 例,占比24.49%,B 组有10 例,占比10.20%,二者之间差异有统计学意义(P=0.022)见图2。A 组中I 型免疫微环境患者的中位PFS 为5.7 个月,其他型(Ⅱ/Ⅲ/Ⅳ型)患者的中位PFS 为7.4 个月,二者之间差异有统计学意义(P=0.024);B 组Ⅰ型微环境患者的中位PFS 为6.0 个月,其他型(Ⅱ/Ⅲ/Ⅳ型)患者的中位PFS 为11.0 个月,二者之间差异有统计学意义(P= 0.027),见图3、4。
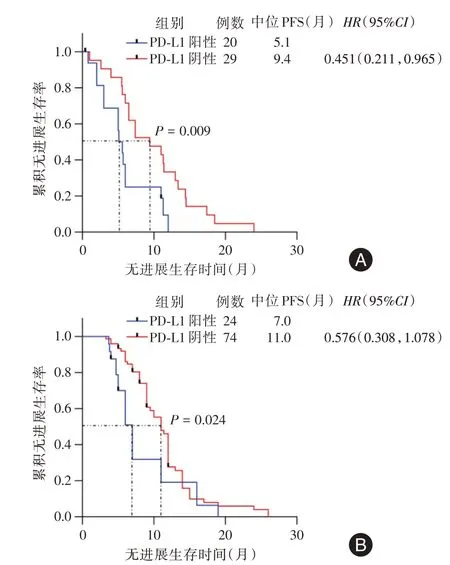
图1 肿瘤微环境中PD-L1 表达阳性和阴性患者的无进展生存曲线Fig.1 Progression-free survival curves of patients with positive and negative PD-L1 expressionin tumor microenvironment
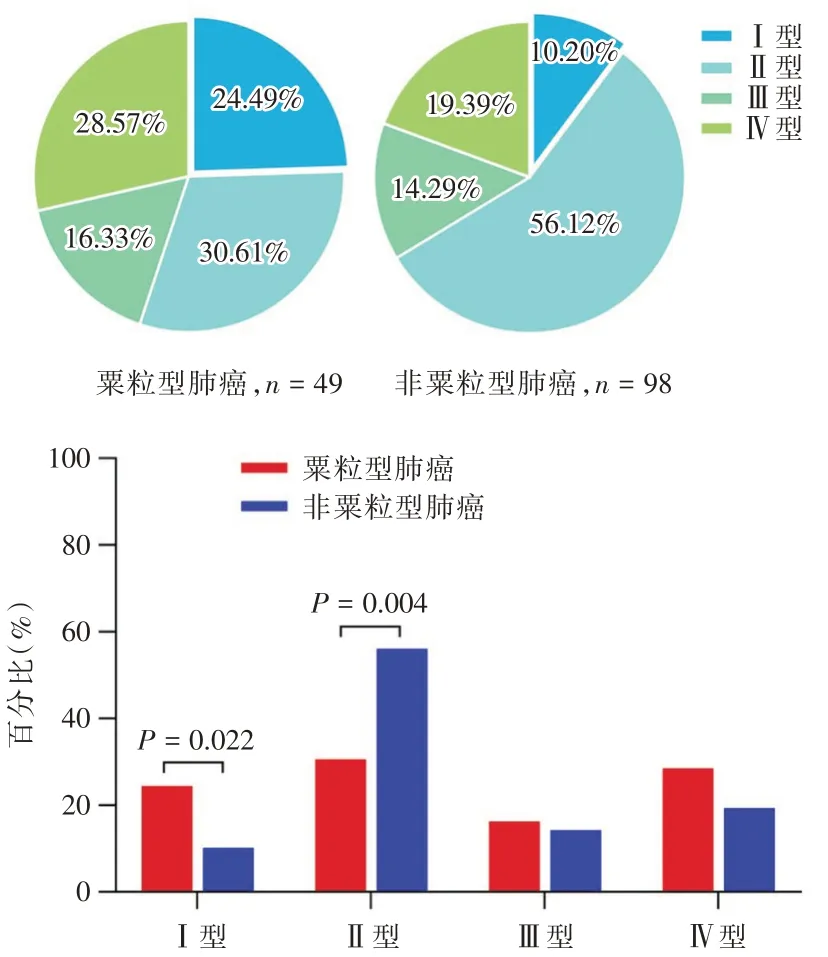
图2 粟粒型肺癌组和非粟粒型肺癌组患者的肿瘤微环境免疫表型比较Fig.2 Comparison of tumor microenvironmental immunophenotypes between miliary and non-miliary lung cancer group
3 讨论
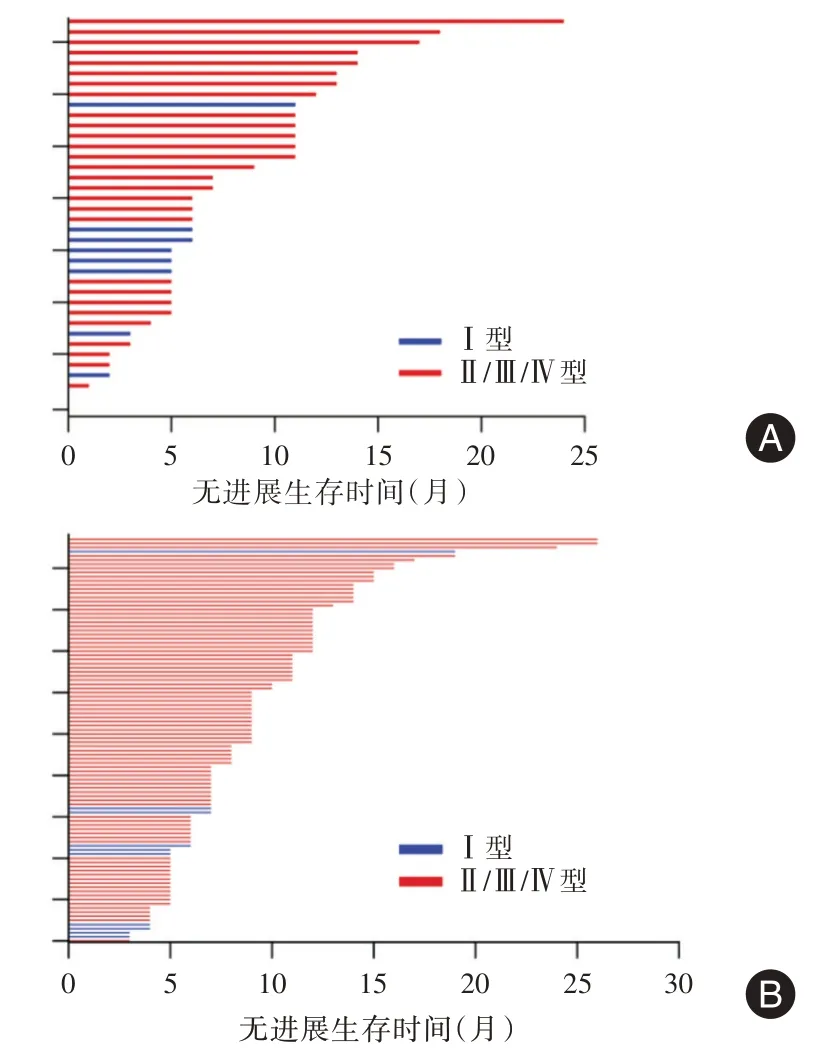
图3 肿瘤微环境免疫表型与EGFR-TKI 疗效的关系Fig.3 The relationship between tumor microenvironmental immunophenotype and the efficacy of EGFR-TKI
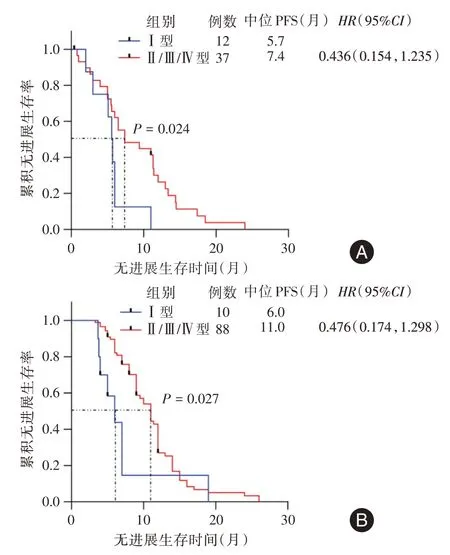
图4 肿瘤微环境免疫表型不同患者的无进展生存曲线Fig.4 Progression-free survival curves of patients with different tumor microenvironmental immunophenotypes
粟粒型肺癌患者是一类特殊的肺癌人群,有研究显示,其EGFR 突变率较高,接近80%左右[2]。部分研究报道,这类型肺癌患者接受EGFR-TKI治疗的疗效可能不佳[2,6],但影响其疗效的因素尚未明确。T790M 突变、C-MET 扩增以及组织学类型转化是目前已知最常见的EGFR-TKI 的耐药机制[13-14],少数研究提出,肿瘤免疫微环境可能也参与了EGFR-TKI 的耐药[11-12,15]。本研究通过大样本量的回顾性分析,首次探讨了粟粒型肺癌患者的免疫微环境及其与EGFR-TKI 疗效的关系。本研究发现,粟粒型肺癌的PD-L1 呈高表达状态,“炎症型”免疫微环境的比例较高,且呈炎症型免疫微环境的患者接受EGFR-TKI 治疗的疗效较其他类型的免疫微环境差,提示炎症型免疫微环境可能是粟粒型肺癌患者靶向治疗疗效差的原因,且该部分患者可能从免疫治疗中获益。
有研究显示,EGFR 信号可通过激活ERK、AKT-mTOR、STAT3 通路上调PD-L1 的表达[16-17]。但免疫表型与EGFR 状态的关系尚未完全清楚。MATSUMOTO 等[11]和LIU 等[18]的研究发现,EGFR阳性NSCLC 患者Ⅰ型免疫微环境分别占13.5%和5%,均为四种免疫表型中最低的。与以往的研究结果相似,本研究中非粟粒型肺癌患者亦为Ⅰ型免疫表型最少(10.2%),然而粟粒型肺癌患者达到24.49%,显著高于非粟粒型肺癌患者。目前粟粒型肺癌呈炎症型免疫微环境的原因尚不明确,可能与肺癌的血行转移或PD-L1 表达的动态变化相关,仍需进一步研究来阐明。
越来越多的证据表明,免疫因素与EGFR-TKI的耐药密切相关[12,19]。ZHANG 等[20]在动物实验中发现PD-L1 可能通过激活TGF-β/Smad 通路诱导上皮间质转化(EMT),从而促进EGFR-TKI 的原发耐药。目前多个研究发现NSCLC 患者EGFRTKI 疗效不佳与PD-L1 的阳性表达相关。本研究发现PD-L1 阳性表达的肺癌患者PFS 显著缩短,与既往研究结果一致。
LIU 等[18]通过大样本量的研究分析了EGFR突变或ALK 重排患者的PD-L1 表达和CD8+TILs 的状态之间的相关性,发现联合CD8+TILs 比单独的PD-L1 表达更能预测肺腺癌患者的预后。TENG等[9]基于PD-L1 的表达与CD8+TILs 的状态将肿瘤微环境分为四种免疫表型。MATSUMOTO 等[11]分析了四种不同肿瘤微环境免疫表型与EGFR-TKI疗效的相关性,结果提示,Ⅰ型肿瘤微环境的PFS在四种类型中最短。前期研究也发现[12],EGFRTKI 原发性耐药患者的PD-L1/CD8 双阳性表达比例较高,因此推测PD-L1 和CD8+TILs 表达可能与EGFR-TKI 耐药相关。本研究纳入了晚期EGFR 突变且接受EGFR-TKI 治疗的49 例粟粒型肺癌和98 例非粟粒型肺癌患者进行分析,发现两组患者中呈Ⅰ型肿瘤微环境的患者PFS 均短于其他类型的患者,进一步验证了Ⅰ型肿瘤微环境参与了EGFR-TKI 的耐药。本研究进一步对比了粟粒型肺癌与非粟粒型肺癌免疫微环境的差异,结果显示,粟粒型肺癌患者呈Ⅰ型肿瘤微环境的比例显著高于非粟粒型肺癌患者(24.49%vs. 10.20%,P=0.022)。因此推测免疫微环境可能是影响粟粒型肺癌接受EGFR-TKI 治疗疗效的重要因素,且这类患者出现EGFR-TKI 耐药后可能受益于免疫治疗。但是粟粒型肺癌、免疫微环境与EGFR-TKI 耐药之间相互作用的具体机制仍需要进一步的基础研究来探索和验证。
本研究仍存在一些局限性。一方面,本研究为回顾性的单中心研究设计,可能存在选择偏倚。另一方面,本研究未对EGFR-TKI 耐药后的粟粒型肺癌患者进行下一代基因测序,因此,难以明确是否存在其他未知的潜在的耐药机制影响了EGFR-TKI 的疗效,也无法从免疫信号通路方面,深入研究免疫因素影响EGFR-TKI 耐药的分子机制。
综上所述,本研究表明炎症型免疫微环境可能是影响粟粒型肺癌患者EGFR-TKI 的疗效不佳的原因之一。因此,免疫治疗或是粟粒型肺癌EGFR-TKI 耐药后的可选择的治疗策略。
