SIRT1基因多态性对血糖控制不佳的2型糖尿病患者接受利拉鲁肽联合二甲双胍治疗效果的影响
2021-02-04高红红任丽君马豪莉王利侯会娟司马盼盼谢骅宋瑞捧
高红红 任丽君 马豪莉 王利 侯会娟 司马盼盼 谢骅 宋瑞捧
河南省直第三人民医院内分泌科(郑州450002)
2 型糖尿病(T2DM)是一种以胰腺β细胞功能减退为特征的进行性疾病,同时伴随胰岛素抵抗,最终导致血糖控制失败[1]。对于既往口服抗糖尿病药物(OAD)血糖控制不佳的2 型糖尿病患者,LEAD-2、LEAD-4 研究结果表明采用利拉鲁肽联合二甲双胍方案治疗,可以显著降低患者餐后血糖(FPG)和糖化血红蛋白(HbA1c)[2-3]。
单核苷酸多态性(SNP)是人类遗传变异的主要类型。全基因组关联研究已鉴定出400 多种单核苷酸多态性与2 型糖尿病和/或严重合并症如心血管疾病、高血压、视网膜病变、肾病和糖尿病足等相关[4]。比如最近研究发现,SCN5A 基因多态性与糖尿病心脏病变患者左室功能间具有相关性[5]。
沉默信息调节因子2 相关酶1(SIRT1)基因是酵母沉默信息调节因子2(Sir2)的同源基因,Rs12778366 单核苷酸多态性位点位于第10 号染色体(10q21.3)SIRT1 转录起始位点上游1.3 kb 处,编码烟酰胺腺嘌呤二核苷酸(NAD+)-依赖性去乙酰化酶蛋白[6]。该蛋白与胰腺发育、胰岛细胞分化和胰岛素合成相关,并参与肝脏代谢和糖异生的调节[7-8]。在多种疾病中发现了SIRT1 水平失调,如2 型糖尿病、糖尿病足、乳腺癌及急性冠脉综合征等[9]。研究发现,Rs12778366 的C 等位基因携带者的糖耐量升高,且Rs12778366 单核苷酸多态性(SNP)的C 等位基因不仅与2 型糖尿病风险呈正相关,而且与2 型糖尿病以及糖尿病足易感性之间具有相关性[9-11]。SIRT1 基因Rs12778366位点对利拉鲁肽联合二甲双胍治疗既往血糖控制不佳的2 型糖尿病疗效尚未明确。因此本研究目的是探讨SIRT1 基因多态性对血糖控制不佳的2 型糖尿病患者接受利拉鲁肽联合二甲双胍治疗临床疗效的影响,以期为糖尿病治疗提供一定的临床依据。
1 资料与方法
1.1 研究对象本研究为回顾性分析,纳入2016年5 月至2019 年5 月在河南省直第三人民医院内分泌科接受2 型糖尿病治疗的血糖控制不佳患者为研究对象。入组标准:(1)年龄≥18 周岁;(2)诊断为2 型糖尿病;(3)单用二甲双胍或磺脲类药物最大可耐受剂量治疗后仍然控制不佳患者(使用二甲双胍、格列美脲等磺脲类药物至少90 d);(4)患者空腹血糖(FPG)≥7.0 mmol/L 或餐后2 小时血糖(2 h PG)≥11.1 mmol/L,糖化血红蛋白(HbA1c)7.0% ~11.0%。排除标准:(1)有严重胃肠道疾病(如炎性肠病或胃轻瘫)患者;(2)胰岛素水平严重减低的2 型糖尿病患者(例如体重急剧减轻、血糖控制不佳,尤其是存在酮症的患者);(3)有甲状腺髓样癌既往史或家族史患者以及2 型多发性内分泌肿瘤综合症患者。最终符合入排标准病例组患者216 例。本研究通过医院伦理委员会批准,每个入组患者或其家属签署知情同意书。
1.2 治疗方法所有入组的2 型糖尿病患者均采用利拉鲁肽联合二甲双胍方案进行糖尿病治疗,治疗26周后评价患者的疗效,治疗期间记录不良反应情况进行安全性评价。用法用量:利拉鲁肽(诺和诺德(中国)制药有限公司,国药准字J20160037,规格为3 mL:18 mg)皮下注射,初始剂量每天0.6 mg/次,1 周后剂量增加至1.2 mg 或1.8 mg(根据患者血糖和尿糖调整用量,最大剂量不超过1.8 mg/d)。盐酸二甲双胍缓释片,进食时或餐后口服,每次1 g,每天2 次。
1.3 DNA 提取及基因分型抽取患者外周静脉血5 mL,使用全血DNA 提取试剂盒从全血中提取DNA,-20 ℃保存备用。在Applied Biosystems 7900上按照TaqMan®试剂盒C_1340370_10 说明书对SIRT1 多态性基因Rs12778366 进行分型。
1.4 实时荧光定量聚合酶链反应(qPCR)检测SIRT1 mRNA表达收集患者新鲜外周血,获取新鲜外周血单核细胞标本(PBMC)。用Trizol从PBMC中提取总RNA,逆转录后在Applied Biosystems 7900上使用SYBR 进行qPCR 评估SIRT1 mRNA 的相对表达。GAPDH 作为内参。采用2-△△Ct进行相对定量分析,试验重复3 次。
1.5 统计学方法采用SPSS 25.0 进行统计分析。采用哈迪温伯格平衡(HWE)检验SIRT1 多态性的基因型分布。在基线临床资料当中,离散型变量和Rs12778366 位点不同基因型的分布采用χ2检验,当数据较少时用Fisher 精确检验。连续型变量和Rs12778366 位点不同基因型的分析用均数±标准差表示,组间比较采用t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 入组患者基线临床资料本研究共纳入216例既往血糖控制不佳的2 型糖尿病患者,基线资料见表1。患者年龄范围32 ~65 岁,中位年龄48 岁,其中女99 例(45.83%),男117 例(54.17%)。体质量指数(BMI)为(28.23 ±1.40)kg/m2,空腹血糖(FPG)水平(11.1 ± 0.8)mmol/L,餐后2 h 血糖(2 h PG)为(14.5 ± 1.3)mmol/L,糖化血红蛋白水平为(9.3±0.6)%。
Rs12778366位点的基因分型结果:TT型155例(71.76%),TC型56例(25.93%),CC型5例(2.31%),最小等位基因频率为0.153,三种基因型分布频率符合哈迪温伯格平衡(P=0.983)。由于CC 型的患者数较少,在后期分析中将TC 和CC 基因型患者合并。Rs12778366 位点不同基因型患者基线临床资料基本平衡,差异无统计学意义(P>0.05)。
2.2 利拉鲁肽联合二甲双胍治疗血糖控制不佳的2 型糖尿病患者的临床疗效及Rs12778366 不同基因型对治疗效果的影响治疗26 周后对216 例患者进行疗效评价。患者空腹血糖(FPG)、餐后2 h血糖(2 h PG)、体重指数(BMI)及糖化血红蛋白(HbA1c)分别为:(5.5±0.6)mmol/L、(9.5±1.2)mmol/L、(26.3 ± 0.8)kg/m2、(7.2 ± 0.3)%,与治疗前相比均明显下降,且差异均有统计学意义(P<0.05)。治疗后不同基因型的患者各指标与治疗前相比均明显下降,且差异有统计学意义(P<0.05)。治疗后TC/CC 基因型患者的BMI、FPG、2 h PG 和HbA1c 指标与TT 基因型患者相比,各指标下降更为明显,且差异有统计学意义(P<0.05),见表2。
表1 病例组的基线临床资料Tab.1 Baseline clinical characteristics of case group±s
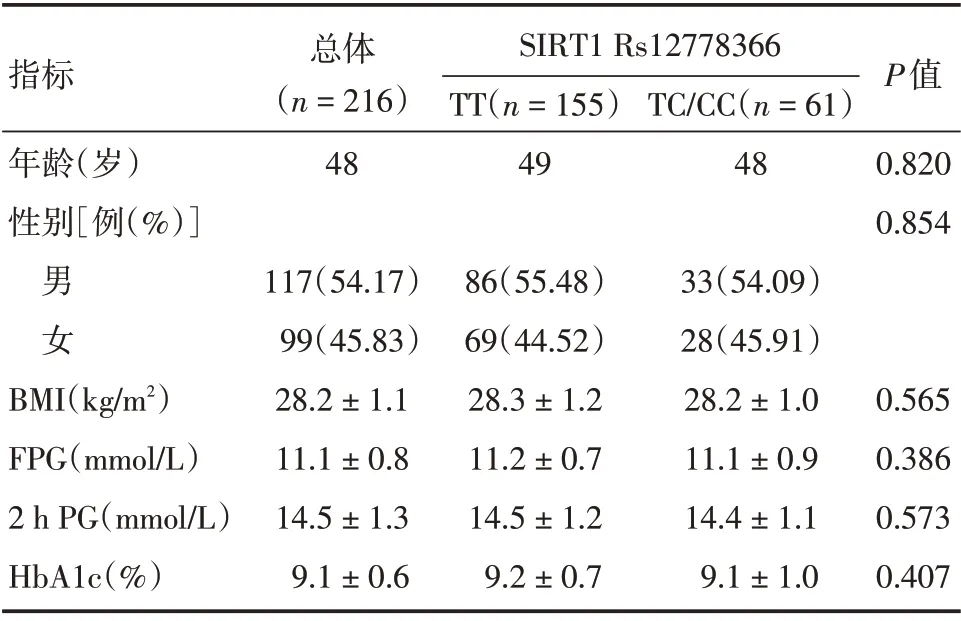
表1 病例组的基线临床资料Tab.1 Baseline clinical characteristics of case group±s
注:BMI,体质量指数;FPG,空腹血糖;2 h PG,餐后2 h 血糖;HbA1c,糖化血红蛋白
指标年龄(岁)性别[例(%)]男女BMI(kg/m2)FPG(mmol/L)2 h PG(mmol/L)HbA1c(%)总体(n=216)48 117(54.17)99(45.83)28.2±1.1 11.1±0.8 14.5±1.3 9.1±0.6 SIRT1 Rs12778366 TT(n=155)49 86(55.48)69(44.52)28.3±1.2 11.2±0.7 14.5±1.2 9.2±0.7 TC/CC(n=61)48 33(54.09)28(45.91)28.2±1.0 11.1±0.9 14.4±1.1 9.1±1.0 P值0.820 0.854 0.565 0.386 0.573 0.407
表2 Rs12778366 不同基因型对治疗效果的影响Tab.2 The influence of Rs12778366 genotypes on the therapeutic effect±s
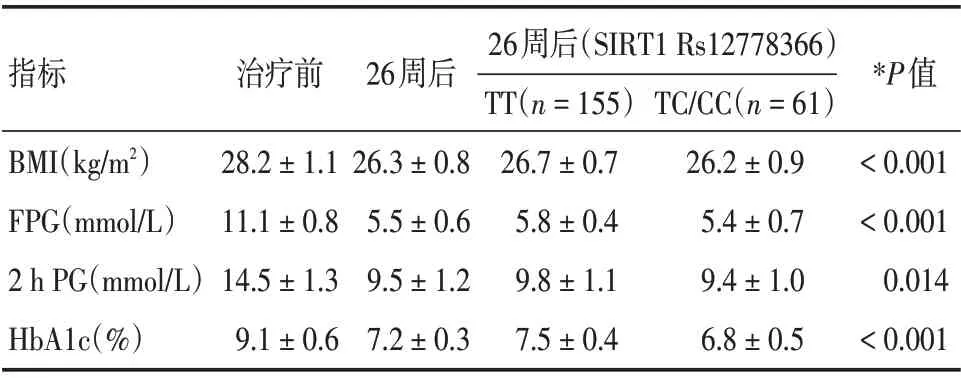
表2 Rs12778366 不同基因型对治疗效果的影响Tab.2 The influence of Rs12778366 genotypes on the therapeutic effect±s
注:*P,26 周后TT 基因携带者与TC/CC 基因携带者各指标之间比较
指标BMI(kg/m2)FPG(mmol/L)2 h PG(mmol/L)HbA1c(%)治疗前28.2±1.1 11.1±0.8 14.5±1.3 9.1±0.6 26周后26.3±0.8 5.5±0.6 9.5±1.2 7.2±0.3 26周后(SIRT1 Rs12778366)TT(n=155)26.7±0.7 5.8±0.4 9.8±1.1 7.5±0.4 TC/CC(n=61)26.2±0.9 5.4±0.7 9.4±1.0 6.8±0.5*P值<0.001<0.001 0.014<0.001
2.3 SIRT1 基因多态性位点对SIRT1 基因mRNA表达的影响提取患者PBMC(由于PBMC 标本比较难获取,标本数少于样本数)总RNA,测定各基因型SIRT1 mRNA 的表达情况。最终提取145 例,TT 型104 例,TC 型36 例,CC 型5 例,三种基因型分布频率符合哈迪温伯格平衡(P=0.400)。CC 型患者数相对较少,因此将其与TC 型患者合并分析。结果如图1 所示,TC/CC 型患者的mRNA 表达水平相对于TT 型患者明显较高,差异有统计学意义(P<0.001)。
2.4 SIRT1 基因多态性位点不同基因型患者的不良反应情况采用利拉鲁肽联合二甲双胍治疗时,不良反应主要有恶心(23.6%)、腹泻(13.9%)、呕吐(7.4%)、头痛(4.6%),在整个治疗过程中仅有2 例患者发生了低血糖事件。SIRT1 Rs12778366位点不同基因型各不良反应发生率差异无统计学意义(P>0.05),见表3。
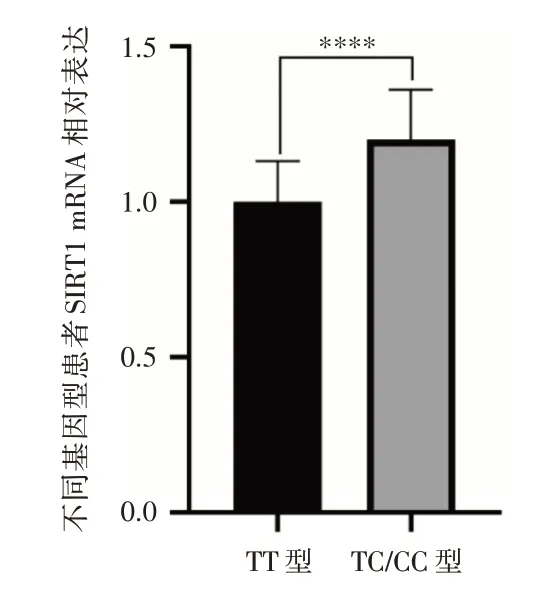
图1 不同基因型患者外周血单核细胞中SIRT1 基因mRNA 相对表达情况Fig.1 Relative expression of SIRT1mRNA in peripheral blood mononuclear cells of patients with different genotypes
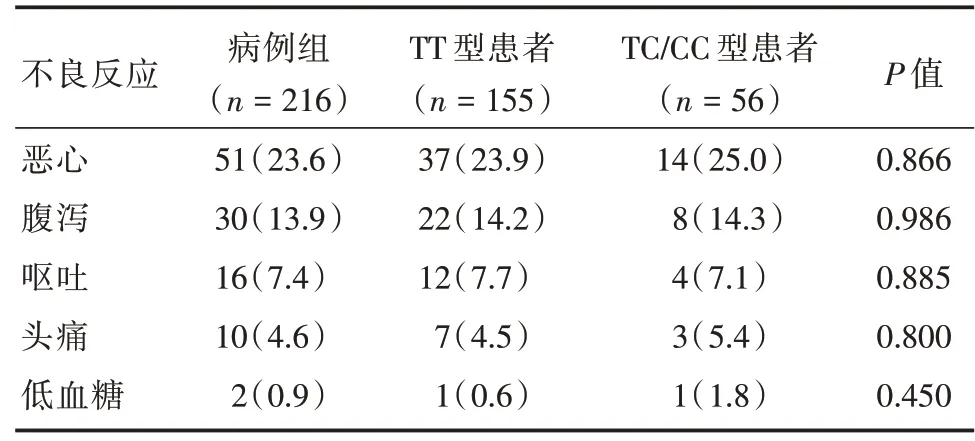
表3 各基因型患者不良反应的发生率比较Tab.3 Comparison of adverse reactions among patients with different genotypes例(%)
3 讨论
二甲双胍可以降低糖尿病的相关并发症和死亡风险[12],但是对于部分患者血糖控制作用有限,因此对于血糖控制不佳的2 型糖尿病患者临床上可以采用利拉鲁肽与二甲双胍或磺脲类药物联合应用。利拉鲁肽通过直接激活胰岛β细胞上的相关肽,促进胰岛素的分泌和合成,延长患者胃排空时间,控制患者食欲,抑制胰高血糖素分泌,作用于p-AMPKα/NOX2/JNK1/2 信号通路抑制β-细胞凋亡等机制来降低血糖水平[13]。除此之外,利拉鲁肽在对2 型糖尿病患者进行治疗过程中可以作用于线粒体ATP-钾等离子通道,减轻血管损伤,对抗动脉粥样硬化,对心血管起保护作用,而且不易引起低血糖,还能降低患者体质量[14]。
Sirtuins 是Sir2 的同源物,哺乳动物拥有7 个Sirtuins(SIRT 1-7),不同的成员具有不同的功能,其中研究最多的是SIRT1[15]。SIRT1 通过对各种靶标如FOXO(叉头转录因子)、PPARγ(过氧化物酶体增殖物激活受体γ)、AMPK(AMP 激活蛋白激酶)、p53 等的调控参与到许多慢性疾病中[16]。SIRT1 具有8 个基因多态性位点,其中Rs12778366位点与垂体腺瘤的复发性、侵袭性及活动性有关[17],且Rs12778366 增加IL-6 相关的患者病死率,TC/CC携带者的病死率高于TT 携带者[18]。除此之外,研究还发现Rs12778366 位点与胰岛素抵抗及炎症等相关[9]。许多研究表明,基因多态性对糖尿病药物治疗的有效性有着比较重要的影响作用。因此本研究目的是探索SIRT1 基因多态性对于血糖控制不佳的2 型糖尿病患者采用利拉鲁肽联合二甲双胍治疗的临床疗效的影响。
本研究共纳入216例既往血糖控制不佳的2型糖尿病患者接受利拉鲁肽联合二甲双胍进行治疗,对SIRT1 基因Rs12778366 不同基因型与患者疗效进行关联性分析。研究发现,在接受利拉鲁肽联合二甲双胍治疗26 周后,各项指标与治疗前相比,各基因组均明显下降,且差异有统计学意义。其中发现,TC/CC 型的患者HbA1c、FPG、BMI、2 h PG 指标与TT 型的患者相比,各项指标下降的更为明显,且差异有统计学意义。也就是说携带C 等位基因的TC/CC 基因型的患者与TT 型患者相比具有更好的控制血糖的疗效。这与FIGARSKA等[10]的研究一致,Rs12778366 C 等位基因携带者葡萄糖耐量更高。研究还发现Rs12778366 TT型患者具有更高的糖尿病风险,且会影响SIRT1 mRNA的表达水平[19]。本研究对145 例患者PBMC 标本SIRT1 基因mRNA 表达水平分析发现,TC/CC 型患者SIRT1 mRNA 表达水平要显著高于TT 型患者。研究表明SIRT1 缺乏症小鼠的活性氧产生增加,mTORC2 信号传导受损而导致胰岛素抵抗[6]。因此推测C 等位基因可能对糖尿病患者具有一定的保护作用,且SIRT1 基因Rs12778366 位点可能通过影响SIRT1 基因mRNA 的表达,从而改变胰岛素抵抗的状态,随着代谢增加减轻患者体质量,从而影响利拉鲁肽联合二甲双胍对既往血糖控制不佳的2 型糖尿病患者的临床疗效。
安全性方面,与利拉鲁肽和二甲双胍之前报道一致,未出现新的不良事件。恶心呕吐及腹泻大部分为轻中度,且呈剂量依赖性。大部分最初出现恶心呕吐症状患者在继续治疗的情况下,这些症状的发生频率和严重程度均有所降低,呈一过性,未出现恶心呕吐导致治疗停止。本研究发现,SIRT1 Rs12778366 位点不同基因型患者之间不良反应差异无统计学意义。
在过去15 年间,科学家发现了数百种与2 型糖尿病相关的基因组位点和变异体以及潜在的生物标志物,从而更深入地了解2 型糖尿病病理生理特征[15]。STIR1 进一步的研究发现大脑中SIRT1 与肥胖、2 型糖尿病及昼夜节律是同步的,且SIRT1 是糖尿病引起心肌缺血再灌注(MI/R)损伤的关键调节剂,SIRT1 的过表达可以通过调节糖尿病条件下的一氧化氮合成酶活性来抑制氧化减少MI/R 损伤[20-21]。SIRT1 因此有望成为糖尿病新型治疗靶标。本研究对2 型糖尿病患者的基因型进行分析,发现SIRT1 Rs12778366 位点可能直接或间接与2 型糖尿病的遗传易感性相关,而且还可能通过影响SIRT1 mRNA 的表达影响利拉鲁肽和二甲双胍对既往血糖控制不佳2 型糖尿病患者临床疗效。本研究只纳入了本院接受治疗的患者,大多是本地居住居民,遗传学特征单一,且样本量偏小,后期未进行长期患者随访,试验结果可能存在一定局限性,但为进一步研究STIR1 Rs12778366 多态性位点对2 型糖尿病治疗的临床效果的影响提供基础,为未来STIR1 成为糖尿病新型治疗靶点提供一定的理论依据。
