回回甘松饮对糖尿病肾病大鼠miR-192及TGF-β1/Smads的调控作用
2021-02-04袁玲李嘉欣鲁玉梅南一
袁玲 李嘉欣 鲁玉梅 南一,3
宁夏医科大学1药学院药理学与毒理学系,2中医学院中医内科学系(银川750004);3回医药现代化教育部重点实验室(银川750004)
糖尿病肾病(diabetic nephropathy,DN)是临床常见的慢性肾功能衰竭的主要原因,近半数DN 患者最终进展为终末期肾病[1]。肾功能受损后,随着尿白蛋白排泄增加,肾小球细胞外基质(extracellular matrix,ECM)堆积,肾小球硬化及肾小管纤维化逐步加重[2]。临床上以控制血糖和血压为主要治疗手段,但治疗效果并不理想[3]。近年来,中医药在DN 的防治中起到了很好的辅助及有效的治疗作用[4-5],利用现代药理学的研究手段和方法可进一步阐明中医药的药理作用机制。而微小RNA(microRNA,miRNA)的发现为DN 的分子机制研究提供了新的切入点[6]。多项临床研究通过分析白蛋白/肌酐比率、肾小球滤过率及微量白蛋白,证实miR-192 可以反映DN 的发病机制[7],并在DN 进展过程中可作为生物标志物[8]。miR-192 可能是肾脏病理改变过程中TGF-β1/Smads 信号传导通路的重要下游介质[9],通过其特异性靶点直接与DN 病变联系[10]。有学者通过在体及离体实验均发现某些与补肾功效相关的中药可通过TGF-β1/Smad/miR-192 信号通路抑制系膜细胞过度增殖,减少肾脏ECM 堆积,改善肾纤维化的病理变化[11-12],也有研究发现通过调控miR-192 可有效的治疗糖尿病肾病[13]。
回回甘松饮(Hui-hui Gan-song Yin,HGY,国家发明专利:ZL201310205739.1),以“香药”为用药特色,药物组成方面选用甘松、木香、藿香等芳香化浊的香药。前期研究已发现在HGY 干预后,DN 大鼠的血糖、血脂、肾功能及肾脏的病理等指标较DN 模型组均有显著改善[14-15],HGY 含药血清对高糖诱导的肾小球系膜细胞的活力和细胞周期均有影响,可通过调控TGF-β1/Smads 信号通路干预高糖诱导的肾小球系膜细胞[16],通过调控LncRNAPVT1 信号通路干预肾足细胞[17],并可通过调控miR-21 改善自发性2 型糖尿病ZDF 大鼠早中期肾纤维化的损伤程度[18]。故本研究利用互联网miRNA 软件(TargetScan、miRanda 和PICTar 等)在线服务站点,通过预测作用靶基因,并结合NCBI检索、综合分析,研究HGY 对早期DN 大鼠miR-192 及相关信号通路的调控作用,以为临床防治DN 提供参考。
1 材料与方法
1.1 实验动物清洁级健康雄性Sprague-Dawley(SD)大鼠50只,8 ~10周龄,体质量(200±20)g,由北京大学医学部实验动物科学部提供,SD 大鼠动物许可证编号为SCXK(京)2011-0012。本次实验所使用的SD 大鼠以及实验环境均符合《实验动物管理条例》(国家科学技术委员会)要求。实验期间,大鼠自由饮水摄食。动物饲养区域温度设置为22 ~23 ℃,室内相对湿度为55%~60%,空气流通。
1.2 药品与主要试剂回回甘松饮的药物组成是按照已授权的国家发明专利(批准文号为ZL201310205739.1)的配方和比例,包括甘松、藿香、茴香、丁香、木香、红花、大黄、枸杞、人参、肉苁蓉、菟丝子、松蕈、芦荟,比例为10∶15∶12∶9∶6∶3∶5∶10∶5∶8∶15∶10∶5,中药饮片由宁夏医科大学附属中医医院制剂室经水煎、过滤、浓缩后分别制成生药浓度为0.5 g/mL 及1 g/mL 浓缩药液。格列喹酮片(30 mg/片,国药准字:H10940258,北京万辉双鹤药业有限责任公司,产品批号为1120536)溶于蒸馏水后,制成格列喹酮浓度为1 mg/mL 的混悬液。链脲佐菌素(Streptozotocin,STZ,美国Sigma 公司,货号S0130);枸橼酸(北京化学试剂公司);枸橼酸三钠(北京化学试剂公司);定量PCR 及miRNA引物(北京阅微基因技术有限公司);KAPA SYBR FAST qPCR Master Mix(2X)试剂盒(美国KAPA Biosystems 公司,货号KK4601);TIANScript RT 试剂盒(天根生物科技有限公司,货号KR104-02);TGF-β1 抗体(美国Abcam 公司,货号ab92486);Smad3 抗体(美国Abcam 公司,货号ab28379);Smad7 抗体(美国Epitomics 公司,货号3894-1);SIP1 抗体(美国Santa 公司,货号sc-48789);GAPDH 抗体(美国Abcam 公司,货号ab9485);Rnase 抑制剂(美国Invitrogen 公司,货号AM2694)。
1.3 主要仪器XP205 分析天平(瑞士Mettler Toledo 公司);TS-2000A 多用脱色摇床(江苏其林贝尔仪器制造有限公司);电泳仪(美国Bio-Rad 公司);Fresco17 低温冷冻离心机(美国Thermo Scientific 公司);NAS-99 微量分光光度计(美国ACTGene 公司);MultiSkan3 酶标仪(美国Thermo Scientific 公司);7900HT Fast 实时荧光定量PCR 仪(美国ABI 公司)。
1.4 模型制备以普通大鼠维持饲料(碳水化合物60%、蛋白质22%、脂肪4%)喂养,1 周后,选取50 只健康状况良好的大鼠,作为实验研究对象。随机将其中的10 只大鼠作为空白对照组(NC),用普通大鼠维持饲料继续喂养,其余40 只大鼠给予含糖44.4%、脂类22.3%、蛋白质18.6%的高糖高脂饲料喂养。4周后,禁食12 h,将上述40只大鼠腹腔注射STZ(55 mg/kg),NC 组的10只大鼠腹腔注射等量枸椽酸钠缓冲液。DM 造模成功标志为:STZ注射72 h 后,连续两次随机血糖值≥16.7 mmol/L。DM 大鼠以高糖高脂饲料继续喂养6 周,当随机血糖≥16.7 mmol/L、尿糖+++以上、尿量为DM 造模前150%以上、MAU >400 μg/24 h、肾脏出现MogensenⅢ期病理改变时,说明早期DN 大鼠造模成功。
1.5 动物分组将早期DN 造模成功的大鼠随机分为4 组:DN 模型组(DN)、HGY 高剂量组(DN+HH,10 g/kg)、HGY 低剂量组(DN+HL,5 g/kg)及格列喹酮组(DN+Gli,10 mg/kg),每组10 只大鼠。各给药组的给药量按照大鼠与人体表面积系数进行换算(相当于人用药剂量的6 ~10 倍),并以等体积(10 mL/kg)的蒸馏水分别灌胃给予NC 组和DN 组,每日1次,连续灌胃8周,均以普通饲料喂养大鼠。
1.6 检测方法
1.6.1 Western blot 法检测大鼠TGF-β1、Smad3、Smad7及SIP1蛋白的表达将肾皮质均质化,研磨后加入蛋白裂解液,4 ℃、12 000 r/min 离心15 min。吸收蛋白质溶液,并使用考马斯亮蓝(1∶4)定量检测组织中TGF-β1、Smad3、Smad7 和SIP1 蛋白含量。将含有30 μg 蛋白的样品在12%SDS-聚丙烯酰胺凝胶上分离并电转移到PVDF 膜上。转膜后,37 ℃封闭2 h。与特异性抗体在4 ℃孵育过夜,与辣根过氧化物酶标记二抗IgG(1∶1 000)进行反应,显影后,定量分析该条带。
1.6.2 实时荧光定量PCR(Quantitative Real-time PCR,qPCR)检测大鼠miR-192的表达及TGF-β1、Smad3、Smad7、Zeb2 mRNA 的表达使用Trizol试剂(Invitrogen,USA)分离来自肾脏的总RNA。使用逆转录系统(Thermo Scientific,Lithuania)将RNA 用于第一链cDNA 合成。使用热循环仪(ABI system,USA)通过以下步骤进行PCR 扩增:在94 ℃变性2 min,然后在94 ℃变性30 s,退火30 s 并在72 ℃下保持1 min,延伸30 个循环。循环结束后,在72 ℃再延伸10 min 后结束PCR,通过2-ΔΔCt方法计算mRNA 相对表达量。引物序列设计见表1。

表1 引物设计Tab.1 PCR-primer design
1.7 统计学方法统计学数据处理采用SPSS 18.0软件比较分析,数据以均数±标准差的方式表示,采用单因素方差分析(one-way ANOVA)的方法,进行多组间数据比较,P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠肾组织TGF-β1、Smad3、Smad7、SIP1蛋白表达采用Western blot 方法检测各组大鼠肾组织发现:与NC 组相比,DN 组大鼠TGF-β1 和Smad3 蛋白表达明显增加(P<0.01),而Smad7 和SIP1 蛋白表达明显减少(P<0.01);与DN 组相比,给予HGY 及格列喹酮干预后,大鼠TGF-β1 水平显著下降(P<0.01),Smad7 和SIP1 蛋白表达水平显著升高(P<0.01 或0.05),HGY 与格列喹酮组结果趋势相近,见图1。
2.2 各组大鼠肾组织miR-192 及Zeb2、TGF-β1、Smad3、Smad7mRNA 表达与NC 组相比,DN 组大鼠肾组织中miR-192、TGF-β1 mRNA 及Smad3 mRNA 的表达显著增加(P<0.01),而Zeb2 mRNA和Smad7 mRNA的表达显著减少(P<0.01)。与DN组相比,进行HGY 和格列喹酮干预后,大鼠Zeb2和Smad7 mRNA 的表达水平显著上升(P<0.01),miR-192 及TGF-β1、Smad3 mRNA 的表达水平明显下降(P<0.05),HGY 与格列喹酮对照组作用趋势相近,见图2。
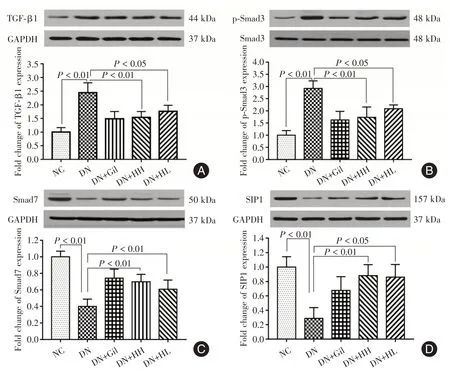
图1 各组大鼠肾组织TGF-β1、Smad3、Smad7、SIP1 蛋白的表达Fig.1 Expression of TGF-1,Smad3,Smad7 and SIP1 proteins in renal tissues of rats in each group
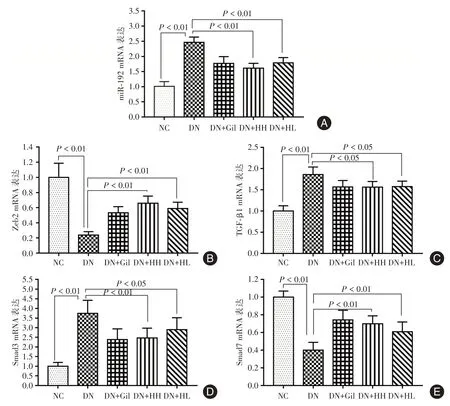
图2 各组大鼠肾组织miR-192、Zeb2mRNA、TGF-β1mRNA、Smad3mRNA、Smad7mRNA 表达Fig.2 Expressions of mir-192,Zeb2mRNA,TGF-1mRNA,Smad3mRNA and Smad7mRNA in renal tissues of rats in each group
3 讨论
DN 的病因非常复杂,其发病机制尚未完全阐明,本研究以高糖高脂高热量饮食诱发大鼠胰岛素抵抗,通过注射大剂量的STZ,一次性破坏胰岛功能,复制DM 模型,再继续喂以高糖高脂高热量饮食,导致肾脏并发症出现,其发病过程和特征与人类DN 相似。
在DN 发病过程中,肾组织中ECM 的关键调节因子TGF-β1 的含量会明显增加[19],它既可以刺激和增加ECM 蛋白的合成[20],还可以减少ECM 的降解[21]。二聚体形式的TGF-β1 具有生物活性,且表现最为活跃[22]。Smads 蛋白在TGF-β受体下游,是其重要的信号转导因子。在DN 发生过程中[23]:Smad2或Smad3磷酸化后发挥正性调节作用,Smad7在TGF-β1/Smads 信号通路中主要发挥着负性调控作用,Smad3 的磷酸化作用可以被Smad7 所抑制。Smad 相互作用蛋白1(Smad interacting Protein l,SIP1),其基因名称为Zeb2,它可以和Smad1、Smad5、Smad3、Smad2 及Smad7 结合,并发生相互作用,它也是TGF-β家族成员的基因转录抑制因子[24]。
本研究发现在HGY干预后,DN大鼠肾脏TGFβ1的表达受到抑制,Smad3的表达降低,Smad7的表达升高。如前所述,调控TGF-β1/Smads 信号通路可有效的抑制或减少ECM 的堆积,这就不难解释在早期动物实验研究中的结果[14]:HGY 可以一定程度上延缓和减轻DN 大鼠早期出现的肾小球肥大,肾小球基底膜增厚,肾小囊腔变窄,系膜区增宽,系膜基质弥漫性增生等肾脏病理改变。我们在前期离体实验研究中发现[25]:HGY 含药血清可以干预调控高糖诱导的肾系膜细胞中纤维连接蛋白及Ⅰ型、Ⅳ型胶原蛋白表达水平,这些蛋白是ECM 的主要成分,因而本研究结果与前期离体实验研究结果是一致的。
miRNA 的发现为研究DN 的分子机制提供了新的切入点。KATO 等[26]人最早研究发现,miRNA-192 在肾小球系膜细胞中表达,对肾小球系膜细胞起到至关重要的作用。miR-192 是在高糖诱导的肾小球系膜细胞中最早被发现且表达量最多的miRNA 之一。对靶序列综合分析后发现:Zeb2 是miR-192 预测的靶基因[27]。更有趣的是,SIP1 又是Zeb2 在蛋白水平的表达形式,所以SIP1 是miR-192的一个靶标,miR-192 负调节Zeb2,Zeb2 正调节SIP1。miR-192 可通过其特异性靶点直接与DN 病变联系,显示了双重作用,即:可能通过“TGF-β1/Smad 信号通路”(ECM 堆积)和“TGF-β1/CTGF 信号通路”(E-cadherin 堆积)两条信号通路来延缓2型DN 的进展,保护肾功能[28]。
HGY 干预后,SIP1 表达增多,而SIP1 是作用于Smads 之间的蛋白,Smads 蛋白反向抑制TGF-β1 表达,这样就形成了一个以SIP1 为核心因子的调控网络。本研究发现,HGY 干预后,miR-192 表达降低,Zeb2 表达升高,并对TGF-β1/Smads 信号通路发挥了重要的调控作用,推测可能与miR-192 与靶基因Zeb2 结合相关,通过SIP1 蛋白有效介导TGFβ1/Smads 信号通路,发挥保护肾脏的作用,HGY 的这种药理机制与改善和治疗DN 的一些药物具有相似之处[29]。HGY 的药物组成多为含有挥发油成分的香药,这种治疗方法曾在几千年前的《黄帝内经·素问》奇病论关于消渴(糖尿病)的治疗中提出过,但在近代并不多见。所以本研究的发现,不仅可以为临床改善和治疗DN 提供合理有效的药物,而且为深入研究中医药理论有关糖尿病的治法“治之以兰,除陈气也”开拓思路,提供研究基础。
尽管本研究结果可以合理解释HGY 前期的药理作用,但本研究所采用的动物模型属于化学药物损伤方法,相对于疾病本身存在着局限性。故在充分论证本研究结果基础上,我们有理由在后续的研究中应用自发性DM 模型,如:Zucker 大鼠、GK 大鼠等进一步验证HGY 的药效及药理机制,并合理借鉴KATO 等[30]的研究方法,进一步论证HGY的药理作用。
