慢性阻塞性肺疾病急性加重合并下肢深静脉血栓的临床特征及危险因素
2021-02-03岳晓艳李凤杰蒋志锋朱娅楠
岳晓艳 李凤杰 蒋志锋 朱娅楠
(首都医科大学附属北京潞河医院急诊科,北京 100069)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是以气流受限为特征,反复急性发作,发病率、病死率均较高的一种肺部疾病。慢性阻塞性肺疾病急性加重(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)多因感染诱发,长期慢性缺氧、血管内皮损伤、炎性介质释放、血液黏稠、体循环瘀血等特点,致使AECOPD患者发生静脉血栓栓塞症(venous thromboembolism,VTE)的风险增加了2.5倍[1], 发生肺栓塞(pulmonary embolism,PE)的风险增加了1倍,已成为肺栓塞的独立危险因素,导致病死率明显升高[2-4]。如果能够通过分析AECOPD患者下肢深静脉血栓(deep venous thrombosis,DVT)的危险因素进行早期诊断及治疗,将会减少AECOPD患者的并发症及病死率[5]。因此,本研究入选了51例AECOPD患者进行前瞻性病例对照研究,统计分析AECOPD合并下肢深静脉血栓的临床特征及危险因素。
1 对象与方法
1.1 研究对象与分组
连续收集2018年10月至2019年4月首都医科大学附属北京潞河医院急诊病房收治的AECOPD患者51例,其中男性29例,女性22例,平均年龄(76.7±8.5)岁。AECOPD的诊断标准以2018年GOLD指南为依据[6],下肢深静脉血栓的诊断标准以2017版中华医学会外科学分会《深静脉血栓形成的诊断和治疗指南(第三版)》[7]为依据,并均由血管多普勒超声诊断明确。排除标准:既往肿瘤病史患者;拒绝参与本研究的患者;存在精神疾患不能遵嘱完善相关检查的患者;根据《急性肺栓塞诊断与治疗中国专家共识2015》[8]诊断或疑似诊断肺栓塞的患者。
根据患者入院后下肢深静脉彩色多普勒超声回报有无血栓的结果,将患者分为血栓组和非血栓组。其中血栓组共10例,其中,男性3例,女性7例,平均年龄(79.9±6.5)岁,包括股浅静脉合并大隐静脉血栓1例,小腿肌间静脉血栓9例(其中单纯小腿肌间静脉血栓6例,小腿肌间静脉血栓合并胫后静脉血栓1例,小腿肌间静脉血栓合并腘静脉血栓2例)。非血栓组共41例,其中,男性26例,女性15例,平均年龄(75.9±8.8)岁。
1.2 方法
1) 基本资料:收集患者的基本信息,包括性别、年龄、住院时间、卧床时间、既往史、吸烟史、饮酒史及有无长期抗血小板治疗等。
2) 临床特征:入院初始平均动脉压、心律失常、下肢水肿、生活能力评分。
3) 实验室检查:入院首次血白细胞、红细胞压积、血色素、血小板,血肌酐,国际标准化比值(international normalized ratio, INR),纤维蛋白原,D-二聚体,B型利钠肽(B-type natriuretic peptide, BNP),pH值,动脉血氧分压,动脉血二氧化碳分压,白细胞介素-6(interleukin-6,IL-6),白细胞介素-8(interleukin-8,IL-8),C反应蛋白(C-reactive protein, CRP),肿瘤坏死因子(tumor necrosis factor,TNF)等。
4) 辅助检查:心脏射血分数(ejection fraction,EF)、肺动脉高压、下肢深静脉彩色多普勒超声等。
1.3 统计学方法
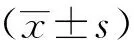
2 结果
2.1 基本资料及临床特征的单因素分析
血栓组和非血栓组患者在性别构成、年龄、COPD病史时间、住院时间、吸烟史、饮酒史、长期抗血小板治疗、生活能力评分、心率、心律失常、心力衰竭(如BNP≥400,则考虑存在心力衰竭)等方面比较,差异均无统计学意义(P>0.05)。血栓组平均动脉压明显高于非血栓组,血栓组合并下肢水肿及肺动脉高压的发生率明显多于非血栓组,差异均具有统计学意义(P<0.05),详见表1。由于入组患者入院前卧床时间均<3 d,故在卧床时间方面两组可考虑无差异。
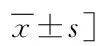
表1 两组临床特征及辅助检查结果的比较Tab.1 Comparison of clinical features and auxiliary examination results between the two groups [n(%),
2.2 实验室检查及辅助检查结果
两组患者的血白细胞、红细胞压积、血红蛋白、血小板、血肌酐、INR、纤维蛋白原(fibrinogen,FIB)、pH值、动脉血氧分压、动脉血二氧化碳分压、IL-6、IL-8、CRP、TNF等差异均无统计学意义(P>0.05)。血栓组D-二聚体明显高于非血栓组,差异具有统计学意义(P<0.05)。详见表2。
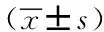
表2 两组实验室检查结果比较Tab.2 Comparison of laboratory results between the two groups
2.3 AECOPD合并DVT的Logistic多因素回归分析
以是否合并DVT作为因变量,以单因素分析结果中有意义的因素:平均动脉压、下肢水肿、肺动脉高压、D-二聚体作为自变量进行多因素Logistic回归分析,结果显示,下肢水肿、肺动脉高压是AECOPD合并DVT的独立危险因素(P<0.05,OR=5.215, 3.741),而平均动脉压和D-二聚体不是AECOPD合并DVT的独立危险因素(P>0.05)。详见表3。
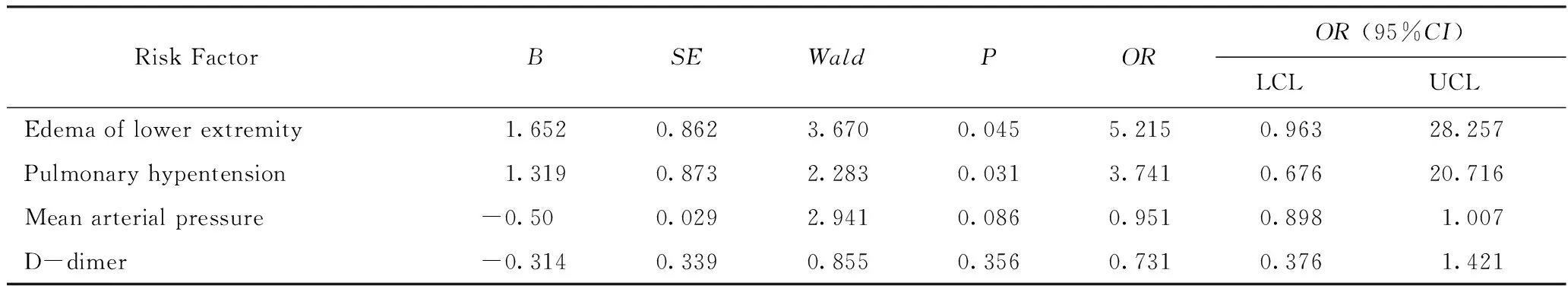
表3 AECOPD合并DVT的危险因素分析Tab.3 The risk factors of AECOPD combined with DVT
3 讨论
COPD每年的发病率及病死率均较高,位居全球疾病死亡原因的第4位[2,9],我国COPD总患病人数已达1亿之多,发病率等同于高血压、糖尿病等慢性疾病,已成为我国最常见的慢性疾病之一,造成巨大的社会及经济负担[10]。文献[11]报道约90%以上的PE来源于DVT栓子脱落, COPD合并PE的发生率达15.03%[12], 文献[13]显示,AECOPD继发PE的发生率较非AECOPD患者高23.6%,AECOPD合并DVT的发生率为19%~29%。DVT已成为AECOPD的常见并发症,本研究中AECOPD合并DVT的发生率为19.61%,与文献[3]报道相符。
本研究中两组患者的性别、年龄、住院时间、吸烟饮酒史、抗血小板治疗、生活能力评分、心率及心律失常等差异均无统计学意义(P>0.05),两组患者的下肢水肿和平均动脉压差异具有统计学意义(P<0.05),但对本研究中单因素分析的阳性结果行多因素Logistic回归分析显示,对于AECOPD患者下肢水肿是下肢血栓形成的独立危险因素(OR=5.215),而平均动脉压不是下肢血栓形成的独立危险因素,由此可见下肢水肿促进了下肢血栓的形成[11]。
AECOPD患者因感染、右心室衰竭、静脉血瘀滞等因素,使得患下肢静脉血栓的风险及病死率均明显升高。研究[14-15]证明血栓形成是一个炎性反应过程,炎性反应与血栓形成之间存在着密切的联系,AECOPD时炎性介质大量释放及血管内皮损伤,致血小板黏附、聚集。如CRP诱导的补体活化产物作用于活化的内皮细胞,使血管内皮细胞产生凝血酶原,促进炎性反应并激活凝血系统[16]。IL-6和TNF不仅使血小板数量增加,也可以增强血小板的反应活性,IL-6通过诱导产生抗原刺激T细胞增殖及B细胞成熟,上调免疫反应,诱导释放全身性炎症因子,从而增强血小板对凝血酶的反应活性,TNF还可下调天然抗凝通路,使补体激活、凋亡和坏死从而进一步启动外源性凝血系统[13]。IL-8能够趋化中性粒细胞、T淋巴细胞以及碱性粒细胞至病灶部位,加重缺氧及血管内皮损伤,使血管收缩及重塑,血管壁内膜增厚及中膜无肌小动脉肌化甚至形成结缔组织,最终导致肺动脉压升高[17-18]。虽然较多研究[13-18]显示,炎性反应因子是DVT的危险因素,但本研究对患者的血白细胞、CRP、IL-6、IL-8、TNF等统计分析发现两组差异无统计学意义(P>0.05),考虑与本研究中病例数量较少有关。统计显示,两组患者肺动脉高压差异有统计学意义(P<0.05),且肺动脉高压是AECOPD合并DVT的独立危险因素(OR=3.741),在临床工作中可以根据AECOPD肺动脉高压情况预测DVT风险,及时进行DVT的排查和治疗。
D-二聚体是纤溶酶水解交联纤维蛋白的产物,有研究[19]显示,AECOPD合并DVT的患者较未合并DVT的患者,D-二聚体水平显著增高。FIB在凝血酶的作用下还可以转化为纤维蛋白并交织成网,同时促进红细胞和血小板的聚集,使得血浆及全血黏度增加,加速血栓的形成[20]。本研究中两组患者D-二聚体差异有统计学意义(P<0.05),而FIB差异无统计学意义(P>0.05),但在行Logistic回归中,D-二聚体不能作为DVT的独立危险因素,考虑可能由于感染、创伤的多种因素亦会导致其升高,使D-二聚体阴性预测值高达100%,阳性预测值只有31.6%所致[3]。
多项研究[2,12,21]均报道卧床或制动≥3 d是AECOPD患者发生VTE的独立危险因素,可明显增加DVT发生率。本研究显示,AECOPD患者入院前卧床时间均<3 d,此为本研究的缺陷,需扩大研究数据量消除偏倚进一步分析。
综上所述,对于AECOPD患者可通过现有的危险因素推断患者发生DVT的可能性,进而针对性地完善检查,达到早期诊断、早期治疗的效果。但目前仍缺乏类似的大样本量的前瞻性研究,期待更多的研究帮助临床分析。
