B7-H3基因敲降ES-2细胞系构建及其对细胞增生的影响
2021-02-03邓梦琪张艳芹常翔宇徐春玉苗劲蔚
邓梦琪 张艳芹 常翔宇 吴 迪 徐春玉 苗劲蔚
(首都医科大学附属北京妇产医院妇瘤科,北京 100006)
卵巢癌(ovarian cancer,OC)是病死率最高的妇科生殖系统恶性肿瘤[1],其生物学行为特性是起病隐匿、进展迅速、复发及病死率高。由于缺乏早期诊断手段,发病后多在短时间内盆腹腔广泛种植和转移,因此60%的OC在首次就诊已为晚期[2]。
B7同系物3(B7 homolog 3,B7-H3)是2001年发现的协同刺激分子B7家族成员之一,也是重要的免疫检查点[3]。研究[4]显示,与PD-1/PD-L1、CTLA-4主要作用T细胞不同,B7-H3能在降低CD8+T细胞活化的同时抑制自然杀伤细胞的活性,并在细胞增生分化等方面起调控作用。B7-H3在众多恶性肿瘤的细胞增生中发挥重要作用[5-6],本实验通过慢病毒介导的shRNA干扰技术建立B7-H3敲降的ES-2细胞株,检测B7-H3表达情况并观察敲降组与对照组细胞增生活性改变,为研究以B7-H3为靶点的ES-2细胞株增生机制研究提供基础。
1 材料与方法
1.1 细胞及主要试剂
CO2细胞培养箱 (美国 Thermo Fisher Scientific公司)、超净细胞工作台 (美国 Thermo Fisher Scientific公司)、微量可调移液枪(法国Glison公司)、eclipse TS100-F倒置光学显微镜(日本NiKon公司)、MULTIFUGE X3R 台式离心机(美国Thermo Fisher Scientific公司)和precision GP 10型水浴锅(美国Thermo Fisher Scientific公司)、免疫荧光显微镜(日本NiKon公司)、Applied BiosystemsTM7500 实时定量 PCR 仪(美国 Thermo Fisher Scientific公司)、LSR FORTESSA流式细胞仪(美国BD公司)、酶标仪(美国Thermo公司)。
1.2 主要仪器
人卵巢透明细胞癌细胞株(ES-2)购自武汉普诺赛公司。McCoy-s-5-A培养基(北京索莱宝公司),标准胎牛血清(美国Life公司)、1XPBS溶液(北京 索莱宝公司)、0.25%(质量分数)胰蛋白酶-EDTA溶液(北京索莱宝公司)、Trizol(美国Invitrogen公司)、TIAN Script RT试剂盒(北京天根生化科技有限公司)、 SYBR FAST qPCR试剂盒(美国KAPA Biosystems公司)、 氯仿(北京化学试剂厂)、异丙醇(北京化学试剂厂)、兔抗人B7-H3抗体(美国Abcam公司ab134161)、山羊F(ab′)2抗人Fc-PE抗体(美国Abcam公司,Ab98596)、青链霉素(北京索莱宝公司)、细胞计数试剂盒(cell counting kit-8,CCK-8)(北京索莱宝公司)。
1.3 细胞培养及慢病毒载体检测B7-H3的转染
将ES-2人卵巢癌细胞培养在含有10%(体积分数)胎牛血清(fetal bovine serum, FBS)的McCoy-s-5-A培养物中,5%(体积分数)CO2培养箱中,37 ℃,75%±5%湿度条件下培养。以国家生物技术信息中心(National Coalition Building Institute,NCBI)基因库中记录的B7-H3的基因序列为基础,分别设计3条shRNA,将3条shRNA分别进行引物合成,并插入慢病毒表达骨架质粒中,完成慢病毒基因沉默质粒构建。比较测序和筛选正确的克隆结果后,进行质粒提取。使用限制酶消化获得线性化载体。通过线性化载体和退火产物制备反应体系,线性载体与设计的底漆连接,产物直接转化。适当扩大克隆培养并提取以用于下游病毒包装。293 T细胞与携带靶序列的工具载体质粒GV115,Helper 1.0和Helper 2.0共转染,转染完成后48~72 h收集未纯化的细胞上清液。然后,将上清液相对浓缩并纯化以获得高滴度的慢病毒溶液,并测定慢病毒的滴度。实验分为两组,一组为感染编号为429病毒的对照组(对照病毒429),另一组为分别感染编号为526、527及528病毒的B7-H3敲降组(沉默病毒526、527及528),其序列信息如表1。将ES-2细胞珠与慢病毒载体孵育72 h以进行转染。
1.4 RT-qPCR检测B7-H3 mRNA的表达
在6孔板中培养细胞,在细胞生长至80%融合条件下收集细胞。提取总RNA。首先将细胞以2 000 r/min 离心5 min。然后除去上清液,加入1 mL Trizol。在室温下静置5 min后,将其转移到新的1.5 mL Eppendorf管中。加入200 μL氯仿后,将混合物在室温放置10 min。将混合物在4 ℃以12 800 r/min离心15 min。收集上部上清液,并加入等体积的预冷异丙醇。在4 ℃下静置10 min后,再次在4 ℃下以12 800 r/min离心12 min,弃去上清液。用1 mL新鲜的DEPC水制备的75%(体积分数)乙醇洗涤残余物。将悬浮液在4 ℃以11 800 r/min离心5 min两次并弃去上清液。在获得总RNA之后,反转录成cDNA,以GAPDH为内标通过RT-qPCR检测B7-H3的相对表达改变B7-H3和GAPDH的序列如下:B7-H3,正向引物:5′-AGC ACT GTG GTT CTG CCTCAC A-3′,反向引物:5′-CAC CAG CTG TTT GGT ATC TGT CAG-3′;GAPDH,正向引物:5′-TGA CTT CAA CAG CGA CAC CCA-3′,反向引物:5′-CAC CCT GTT GCT GTA GCC AAA-3′。循环参数如下:第一步,预变性95 ℃ 30 s。第二步,95 ℃ 5 s,然后60 ℃ 30 s,40循环。第三步,95 ℃ 15 s,60 ℃持续30 s和95 ℃持续15 s。
1.5 通过流式细胞术检测B7-H3的蛋白表达
将上述各组实验样本用PBS洗涤2次,消化,1 000 r/min 条件下离心5 min收集细胞,加入100 μL PBS悬浮细胞后,加入5 μLB7-H3抗体混匀后,于4 ℃ 在避光条件下反应30 min。收集细胞用PBS洗3遍后,加入5 μL二抗混匀后,于4 ℃在避光条件下反应30 min。待反应完全后,离心,去除抗体,用300 μL PBS重悬细胞,上机检测。
1.6 CCK-8测定检测转染后ES-2细胞的增生活性
将shB7-H3和shNC组中的细胞分别接种在96孔板中进行孵育。从接种后第2天到孵育结束前,进行CCK-8处理4 h,并使用酶标仪(美国Thermo Scientific公司)在490 nm波长光下测量吸光度值,检测活细胞的数量。
1.7 统计学方法
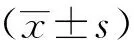
2 结果
2.1 shRNA序列
根据目的基因序列,分别设计3条shRNA,其序列信息如表1所示。

表1 shRNA序列Tab.1 shRNA sequence
2.2 B7-H3 shRNA慢病毒在ES-2细胞中的感染情况
B7-H3 shRNA沉默病毒(526、527及528)和对照组(429)均有绿色荧光蛋白标签。选取高表达B7-H3蛋白的卵巢透明细胞癌细胞株ES-2,用526、527、528、429分别感染72 h后,在荧光显微镜下观察细胞。感染72 h后,均可观察到均匀明亮的绿色荧光且细胞状态正常,各组病毒均可成功感染ES-2细胞(图1)。

图1 荧光显微镜下绿色荧光蛋白在ES-2细胞中的表达情况Fig.1 Green fluorescent protein expression in ES-2 cells under a fluorescence microscope(10×)A:silent virus 526; B: silent virus 527; C: silent virus 528; D:control virus 429.
2.3 敲降效果
连续筛选并传代5次后,qRT-PCR检测B7-H3 mRNA的表达量(图2),流式细胞术检测B7-H3蛋白表达(图3)。与对照病毒429组(1.03±0.25)相比,沉默病毒526组(0.22±0.01)及沉默病毒528组(0.12±0.03)B7-H3 mRNA水平明显降低,差异有统计学意义(F=31.05,P<0.001);蛋白水平检测可见沉默病毒526及528组中B7-H3蛋白的表达明显低于对照组(shNC-429),差异有统计学意义(F=3 222.68,P<0.001),详见表2。

图2 qRT-PCR检测B7-H3 mRNA的表达量Fig.2 qRT-PCR detection of B7-H3 mRNA expression***P<0.001.

图3 流式细胞术检测B7-H3 蛋白表达Fig.3 Flow cytometry to detect B7-H3 protein expression
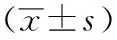
表2 流式细胞术检测B7-H3 蛋白表达Tab.2 Flow cytometry detection of B7-H3 protein expression
2.4 B7-H3基因敲低前后ES-2细胞增生活性改变
使用酶标仪进行吸光值检测,并对第0、24、48、72小时的数值进行统计分析。组间ES-2细胞增生活性在B7-H3基因敲低后48 h(F=20.595,P<0.001)及72 h时(F=61.882,P<0.001),差异有统计学意义;与对照病毒429组细胞相比,沉默病毒526组及528组细胞增生速度明显降低,差异有统计学意义(P<0.05,图4)。
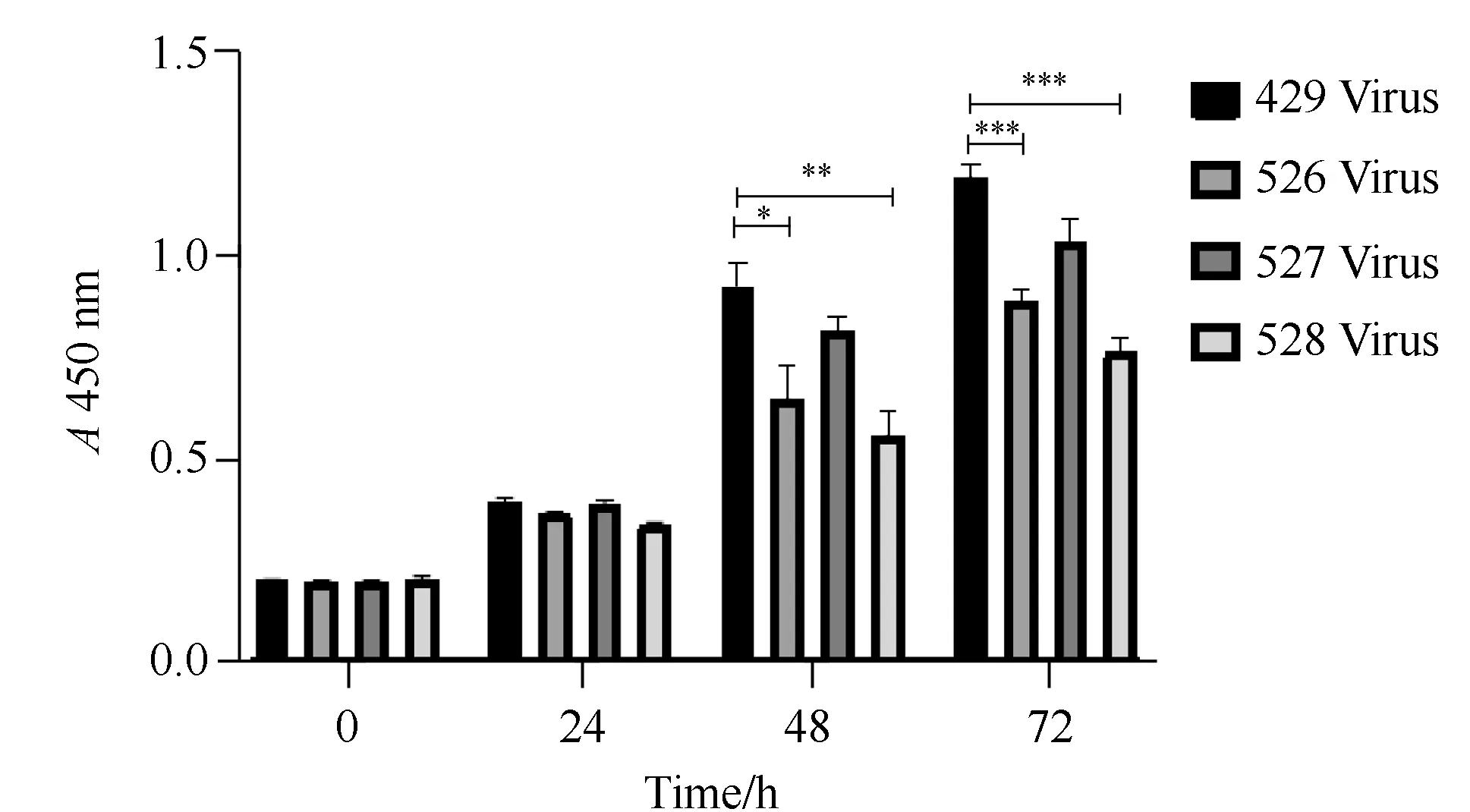
图4 CCK-8检测细胞增生Fig.4 CCK-8 detects cell proliferationCCK-8:cell counting kit-8; *P<0.05, **P<0.01, ***P<0.001.
3 讨论
OC是恶性程度极高的妇科生殖系统,晚期患者5年生存率低于40%[7]。OC预后差的一个至关重要的原因是癌细胞早期出现化学药物治疗耐药,虽然近年来妇科肿瘤领域开展了一些研究[8-9],并发现了一些可能的耐药机制,如DNA损伤修复功能加强、凋亡通路阻滞等[8-9],但尚无突破性进展,OC耐药仍然是OC治疗难以攻克的瓶颈问题。但随着人们对肿瘤发生学的研究深入,发现OC是典型的免疫抑制性肿瘤,免疫逃逸是其发生、发展过程中的重要机制。在过去的40年里,免疫靶向治疗策略在肿瘤的临床治疗中一直没有受到重视,但是最近免疫检查点PDL1(B7-H1)抑制剂的发现引发了免疫肿瘤学的新纪元[10-11]。B7-H3属于B7家族,是重要的免疫检查点[12]。B7-H3除了调节肿瘤免疫外,还具有调节肿瘤侵袭性的非免疫功能。研究[13-14]表明,B7-H3可通过Janus激酶2(Janus kinase 2,Jak2)/信号传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)/基质金属蛋白酶(matrix metalloprotein,MMP)-9信号通路[13]调节各种癌细胞[14]的迁移、侵袭和黏附。此外,B7-H3在结直肠癌和乳腺癌细胞中的过度表达通过激活Jak2/STAT3/凋亡抑制蛋白survivin信号通路增强对凋亡的抵抗,进而削弱了肿瘤细胞对化疗药物紫杉醇的敏感性[15-16]。B7-H3更是被证明可以调节黑色素瘤细胞中转移相关蛋白金属蛋白酶组织抑制因子1(tissue inhibitor of metalloproteinases,TIMP-1),MMP-2,TIMP-2,STAT3和白细胞介素-8(interleukin-8,IL-8),影响疾病的预后[17]。总之,B7-H3能在不同肿瘤中通过不同机制促进肿瘤的侵袭和侵袭。通过此次实验,成功构建了B7-H3基因敲低及敲除ES-2细胞系,同时检测B7-H3基因敲降程度对ES-2细胞增生率的影响,提出B7-H3基因敲降可以抑制ES-2细胞增生,为后续B7-H3在卵巢癌细胞增生方面的机制研究奠定基础。
