青稞及其制品的体内外淀粉消化特性研究
2021-02-02谢仲寅
方 圆,任 欣,彭 洁,谢仲寅,张 敏
(北京工商大学 北京食品营养与人类健康高精尖创新中心/北京市食品添加剂工程技术研究中心,北京 100048)
青稞是中国高寒地区主要农作物,高寒缺氧的环境孕育了青稞“三高两低”,即高蛋白、高维生素、高纤维和低脂肪、低糖的特性[1]。研究表明:长期食用青稞,可降低慢性代谢疾病的风险,如高血压[2]、肥胖[3]、高血脂等[4-5]。此外,青稞β-葡聚糖在水溶液中具有辅助降血糖功能,对葡萄糖稳态有良好的影响[6]。目前,青稞的营养价值及潜在健康效益日益受到关注,而淀粉作为青稞的主要成分,决定着青稞的营养价值及其生理特性。
近年来临床研究发现,淀粉的消化性与许多慢性疾病密切相关。餐后血糖应答很大程度上取决于碳水化合物的消化程度及消化速率,而具有缓慢消化性质的淀粉有利于维持餐后血糖的稳定,降低餐后胰岛素的分泌,适合糖尿病病人食用[7-9]。研究表明:淀粉来源、自身结构特征[10]、食品中其他组分以及食品加工过程等均可影响淀粉的消化特性[11]。
然而,关于从体内及体外综合探究青稞淀粉消化性的研究较少。因此,本研究主要从以下3个方面展开:1)以小麦粉为阳性对照,研究生青稞全粉的体外消化特性,以及加热和挤压处理对青稞全粉体外消化率的影响;2)探讨不同青稞制品体外消化特性及预估血糖生成指数(estimated glycemic index,eGI)的差异;3)探讨不同青稞制品体内血糖生成指数(glycemic index,GI)的差异。通过体外及体内对青稞消化特性进行综合探究,以了解青稞及其制品的消化特性。
1 材料与方法
1.1 材料与试剂
北青3号青稞(总淀粉质量分数60.7%、蛋白质质量分数9.6%、脂肪质量分数2.2%、膳食纤维质量分数13.5%、水分质量分数12.2%),山西东方亮生命科技有限公司;金沙河小麦粉(总淀粉质量分数67.6%、蛋白质质量分数12.2%、脂肪质量分数2.0%、膳食纤维质量分数5.5%、水分质量分数13.1%)、食盐,河北金沙河面业集团有限公司;转化酶(I4504)、淀粉葡萄糖苷酶(10113)、胃蛋白酶(P7000)、胰酶(P7545),美国Sigma公司;葡萄糖氧化酶法测定试剂盒(E1010),北京普利莱基因技术有限公司;氢氧化钾、无水乙酸钠、盐酸、乙酸、无水乙醇、氢氧化钾等,均为分析纯,北京半夏科技发展有限公司。
1.2 仪器与设备
WF-20B型高效粉碎机,江阴市智健机械制造有限公司;SLG30型双螺杆挤压机,济南赛百诺科技开发有限公司;JHMZ200型和面机、JMTD168/140型试验面条机,北京东孚久恒仪器技术有限公司;4-16KS型冷冻离心机,德国Sigma冻干机有限公司;THZ-82A型水浴恒温振荡器,上海江星仪器有限公司;F200-PRO型酶标仪,帝肯Tecan(上海)贸易有限公司;Aucc-Chek Performa型(卓越)血糖仪,上海罗氏制药有限公司。
1.3 实验方法
1.3.1青稞粉的制备
青稞生粉:青稞经80目粉碎机粉碎后,再进行120目粉碎得到青稞生粉。
青稞挤压粉:青稞经80目粉碎机粉碎后,进行挤压处理(螺杆转速为260 r/min,1~4区温度分别为40、70、100、150 ℃,模口3.9 mm),再将挤压处理后的青稞粉进行120目粉碎,得到青稞挤压粉。
青稞熟粉:青稞生粉加入水中(料液比1∶1 g/mL),沸水浴加热15 min得到青稞熟粉。
1.3.2青稞制品的制备
青稞鲜湿面:称料(青稞生粉、青稞挤压粉、小麦粉质量比1∶1∶3),混合均匀后进行和面、醒发,将醒发好的面团轧片、切条,得到厚度为1 mm,宽度为1.5 mm的青稞鲜湿面。
青稞挂面:称料(青稞生粉、青稞挤压粉、小麦粉质量比1∶1∶3),混合均匀后进行和面、醒发,将醒发好的面团轧片、切条,最后放入烘箱进行干燥处理(预干燥阶段为温度25 ℃,时间40 min;主干燥阶段为温度45 ℃,时间140 min;末干燥阶段为温度30 ℃,时间60 min),得到青稞挂面。
青稞馒头:称料(青稞生粉、青稞挤压粉、小麦粉质量比1∶1∶3),混合均匀后进行和面、发酵,将发酵好的面团分割搓圆,然后放入蒸锅中蒸15 min,冷却后得青稞馒头。
青稞炒面:称料(青稞生粉、青稞挤压粉、小麦粉质量比1∶1∶3),混合均匀后放入锅中,电磁炉120 W翻炒20 min,冷却后得到青稞炒面。
1.3.3体外淀粉消化率测定
1.3.3.1 样品前处理
对青稞粉及不同青稞制品的体外淀粉消化速率测定,参照文献[12-13]进行适当修改。
游离葡萄糖(free glucose,FG)含量测定的前处理:称取约含0.3 g淀粉的待测样品于50 mL离心管中,加入3颗小玻璃珠以模拟消化过程中肠道环境;向离心管中准确加入25 mL 0.1 mmol/L的醋酸盐缓冲溶液(pH值 5.2),充分涡旋后置于沸水浴中糊化30 min。取出冷却至37 ℃,加入0.3 mL 3 000 U/mL的转化酶溶液,涡旋混匀后37 ℃水浴加热30 min。取0.2 mL消化液于4 mL无水乙醇中进行灭酶。然后在3 000 r/min离心5 min后取上清液,用于测定FG含量。
20、120、180 min时葡萄糖释放量(G20、G120、G180)测定的前处理:称取一份约含0.3 g淀粉的待测样品置于50 mL离心管中,加入10 mL新鲜配制的质量分数为0.5%的胃蛋白酶溶液和5颗小玻璃珠,涡旋混匀后放入37 ℃水浴中,30 min后向离心管中加入10 mL 0.1 mmol/L的醋酸盐缓冲溶液(pH值 5.5),然后加入5 mL混合酶溶液(胰酶、淀粉葡萄糖苷酶与转化酶组成)以启动消化。整个消化过程均在37 ℃、210 r/min水浴震荡中加热进行,共持续180 min。分别于消化开始后的20、120、180 min时取0.2 mL消化液于4 mL的无水乙醇中进行灭酶。然后在3 000 r/min速率下离心5 min后取上清液,用于测定20、120、180 min时的葡萄糖释放量。
总葡萄糖(total glucose, TG)释放量测定的前处理:将消化180 min后的消化液充分涡旋震荡,沸水浴加热30 min后冰水浴15 min,接着加入10 mL 7 mol/L的氢氧化钾溶液,冰水浴30 min。然后分别取0.2 mL样本溶液加入1 mL 1 mol/L的醋酸溶液(含40 μL 100 U/mL淀粉葡萄糖苷酶)中,70 ℃水浴加热30 min后,沸水浴10 min灭酶,冷却至室温后再加入20 mL去离子水,在3 000 r/min离心5 min后取上清液,用于测定TG含量。
1.3.3.2 葡萄糖含量测定
根据Trinder反应原理[14-15],葡萄糖在葡萄糖氧化酶作用下生成葡萄糖酸和过氧化氢;然后过氧化物酶催化过氧化氢,使色原物质(4-氨基安替比林)生成醌亚胺,颜色的深浅与葡萄糖浓度成正比。分别配制浓度为0.125、0.250、0.500、1.000、1.500、2.000、2.500 mmol/L的葡萄糖标准溶液,按照试剂盒说明操作,在37 ℃孵育20 min,用酶标仪在530 nm处测吸光度,绘制标准曲线,y=6.496 88x+0.024 83(R2=0.999 41)。根据体外消化的数据,淀粉可被分为不同消化组分[12],快消化淀粉(rapidly digestible starch,RDS)、慢消化淀粉(slowly digestible starch,SDS)及抗性淀粉(resistant starch,RS),各组分质量分数(%)的计算方法见式(1)~式(4):
(1)
(2)
(3)
m(TS)=[m(TG)-m(FG)]×0.9 。
(4)
式(1)~式(4)中,m(G20)为体外水解20 min时释放的葡萄糖,mg;m(G180)为体外水解180 min时释放的葡萄糖,mg;m(FG)为游离葡萄糖,mg;m(TG)为总葡萄糖释放量,mg;m(TS)为总淀粉干质量,mg;0.9为转换系数。
1.3.4预估血糖生成指数测定
体外模拟淀粉消化过程,分别于20、40、60、90、120、180 min时取样,计算水解液中葡萄糖的质量(mg)、体外淀粉消化动力学参数以及eGI值,并利用式(5)对消化过程进行拟合[16]。水解度(hydrolysis index,HI)通过待测样品水解曲线下面积与参照物(新鲜白面包)水解曲线下面积的比值计算得出。将白面包的eGI定义为100,通过式(6)计算得出其他待测样品的eGI。以白面包为参照物的eGI值乘以0.7即可得出以葡萄糖标准溶液为参照物(葡萄糖eGI=100)的eGI值[17]。
C=C∞(1-e-kt) ;
(5)
eGI=39.71+0.549HI。
(6)
式(5)、式(6)中,C∞为最终水解平衡时的葡萄糖水解率,%;k为动力学常数,min-1;t为水解时间,min。
1.3.5体内血糖反应测定
选取12名志愿者(男女各6人),年龄介于20~24岁,平均BMI为(20.03±1.66)kg/m2。受试者均无消化系统、呼吸系统、内分泌系统疾病和碳水化合物不耐受症,血糖、血脂等生化指标全部正常,1个月内没有节食减肥及服用任何药物。在实验期间避免剧烈运动、暴饮暴食、饮酒、熬夜等不良生活行为,避免食用刺激性食物,每次测试前需正常饮食,按时休息。本研究经北京大学生物医学伦理委员会许可,并与受试者签订知情同意书。
志愿者从实验前1天晚20:00开始禁食,可少量饮水。实验当天上午8:00—9:00测定空腹血糖,然后向每位志愿者提供1份受试样品(见表1),要求志愿者在15 min内进食完毕。从第1口进食时间开始计时,分别于进食开始后的15、30、45、60、90、120 min采集指尖血,测定血糖浓度。参比物葡萄糖标准溶液进行2~3次实验,待测样品至少进行1次实验,每次实验间隔至少72 h[18]。以葡萄糖作为参考食物(GI=100),以时间为横坐标,各个时点的血糖值为纵坐标,制作血糖应答曲线。用梯形法计算2 h餐后曲线下增量面积(IAUC),然后根据式(7)计算待测物血糖生成指数[19]。
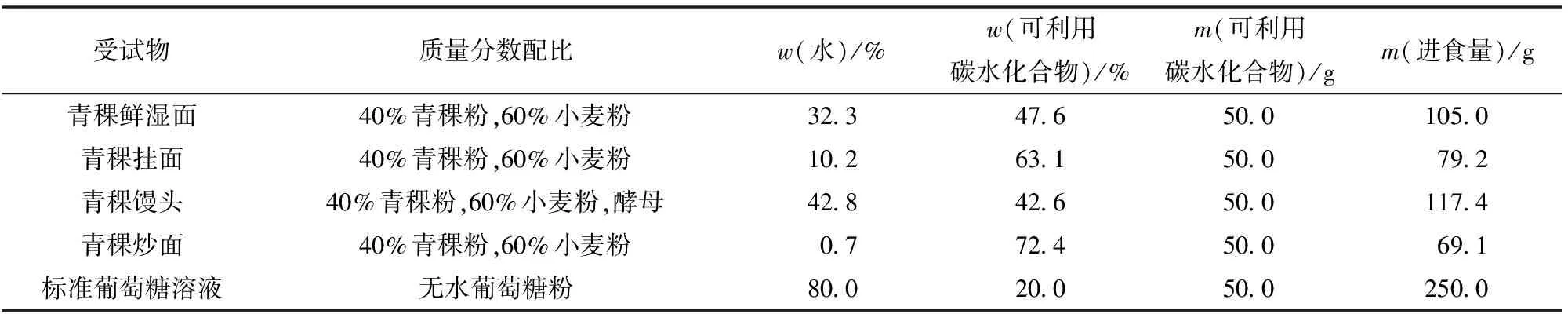
表1 青稞制品和标准葡萄糖溶液的进食量
(7)
1.4 数据处理
所有体外实验均至少进行3次重复。采用SPSS对获得的所有数据进行分析,数据以平均值±标准差表示,使用Origin 9.0软件绘图。
2 结果与分析
2.1 青稞全粉体外淀粉消化率及eGI分析
以小麦粉为阳性对照,分别测定青稞生粉、青稞熟粉及青稞挤压粉的体外淀粉消化率,见图1。由图1(a)可知,青稞和小麦体外淀粉水解速率均在前20 min增长最快;在20~120 min增速减慢;当水解进行到120 min后,水解速率基本趋于稳定。整体而言,青稞生粉与小麦生粉的体外淀粉水解率没有显著性的差异;但蒸煮过后,青稞熟粉的体外淀粉消化速率显著低于小麦熟粉。如图1(b),蒸煮过后,青稞和小麦粉中RDS质量分数显著升高(P<0.05),SDS和RS质量分数显著降低(P<0.05),其中以小麦粉RDS质量分数从30.52%±0.41%增加到46.41%±0.67%最为明显。这主要是因为蒸煮过后部分淀粉发生糊化。糊化后的淀粉更容易消化吸收,对血糖和胰岛素的刺激可能会更大。本研究结果也进一步说明:淀粉糊化是SDS和RS转化为RDS的过程[13]。与小麦熟粉相比,青稞熟粉RDS质量分数显著低于小麦熟粉(P<0.05),而SDS和RS质量分数显著高于小麦熟粉(P<0.05)。据此推测,日常膳食中以青稞熟粉代替小麦熟粉将更有利于血糖控制。
挤压是一种常见的淀粉改性及食品预处理方式,具有高效、连续、能耗低、污染小等优点,已广泛应用于谷物生产加工中[20-21]。对青稞粉进行挤压处理后,青稞粉的体外淀粉消化率显著提高(P<0.05),RDS质量分数显著增加,RS质量分数显著降低,与以往的研究结果一致[22-23]。究其原因,在挤压过程中,高温、高压及高剪切力破坏淀粉颗粒结构,淀粉的结晶区遭到破坏,无定型区域增加,内部结构松散,淀粉酶因挤压后淀粉表面多孔疏松而更易与淀粉内部的酶作用位点结合,从而提高消化速率。
小麦粉和青稞粉的淀粉体外模拟水解动力学方程的特征参数见表2。由表2可知,各样品的eGI值由高到低依次为小麦熟粉、青稞挤压粉、青稞熟粉、青稞生粉、小麦生粉。蒸煮和挤压处理使青稞的eGI值增加,但经过同样处理的青稞熟粉的体外淀粉消化各动力学参数及eGI值显著低于小麦熟粉(P<0.05),这可能与原料基本组分有一定的相关性。研究表明:eGI值与蛋白质及膳食纤维含量呈显著负相关[24]。这主要是因为蛋白质与淀粉结合较紧密,限制淀粉酶与淀粉的接触[25]。而膳食纤维能够增加消化液体系黏度,并与淀粉分子相互缠绕,延缓了酶对淀粉的水解作用,从而降低淀粉消化率[26]。本研究中青稞粉的蛋白质含量低于小麦粉,但膳食纤维含量远高于小麦粉,使得青稞粉的酶敏感性相对较低,在一定程度上抵抗了淀粉酶的水解[27]。
2.2 不同青稞制品的体外淀粉消化率及eGI分析
淀粉的消化率受多种因素影响,如淀粉来源、淀粉结构、直链淀粉含量、食品中其他组分、不同加工方式等[11]。其中,不同加工方式是影响淀粉消化率的主要因素,并最终影响餐后血糖反应。食品经加工后,质构、营养特性、消化特性均会发生变化[26]。研究表明:马铃薯的淀粉消化率及预估血糖生成指数因加工烹调方式的不同而产生显著性的差异[28]。为了明确常见加工方式对青稞体外淀粉消化速率的影响,本研究评价了同种青稞原料粉经不同加工方式制成的青稞鲜湿面、青稞挂面、青稞馒头及青稞炒面的淀粉消化特性,见图2。如图2(a),青稞馒头的体外淀粉消化速率最快,青稞炒面的体外淀粉消化速率最慢。经过180 min水解后,青稞馒头中90.86%±6.97%的淀粉被水解,青稞挂面中有83.09%±2.39%的淀粉被水解,青稞鲜湿面和青稞炒面中分别有79.16%±4.03%和79.05%±5.34%的淀粉被水解。由图2(b)可知,虽然青稞炒面的RS质量分数与青稞挂面及鲜湿面没有显著性的差异(P>0.05);但青稞炒面的RDS质量分数显著低于其他3种制品,这也是青稞炒面消化速率低于其他3种制品的原因之一。4种青稞制品由不同的加工方式制得,其中,在馒头的制作过程中,需要加入酵母进行发酵,因而形成疏松多孔的结构,使淀粉酶易于与淀粉内部的酶作用位点结合,从而促进酶解消化。与此同时,较高的水分含量和蒸制加热过程使淀粉的颗粒与结晶结构丧失,淀粉糊化,对酶解反应的敏感性增加[29]。青稞鲜湿面及挂面的生产过程中都经过了压延处理,使内部组织结构紧密[30],阻碍了淀粉与淀粉酶的接触,使其淀粉消化率低于青稞馒头。青稞炒面经过炒制工艺制成,水分含量低,淀粉糊化程度低。另外,在低水分含量炒制过程中,部分支链淀粉侧链降解为直链淀粉,生成直链淀粉-脂质复合物,提高了结晶度,降低了淀粉消化率[31]。
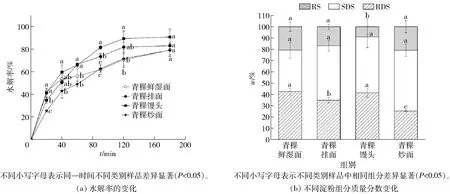
图2 青稞制品体外淀粉消化特性分析
青稞制品的体外淀粉消化率及预估血糖生成指数如表3,各样品的最终水解平衡时的葡萄糖水解率相差较大,其中青稞馒头具有最高的C∞、HI及eGI值。与图2(b)比较发现,淀粉样品中RS质量分数越高,其C∞、GI值越低。动力学常数k也随着淀粉样品不同而存在差异,k值越大说明淀粉的体外消化达到C∞的速度越快[32],但C∞与k变化趋势并不完全一致。青稞鲜湿面的k值显著高于青稞馒头(P<0.05),但其C∞比青稞馒头低得多。也就是说,青稞鲜湿面早期水解速率较快,但其最终水解平衡时葡萄糖水解率较低,因此,青稞鲜湿面最终的eGI值低于青稞馒头。eGI值以白面包或葡萄糖为参考食物,各样品的eGI值由大到小依次为青稞馒头、青稞挂面、青稞鲜湿面、青稞炒面,这一趋势与RS质量分数降低趋势一致。
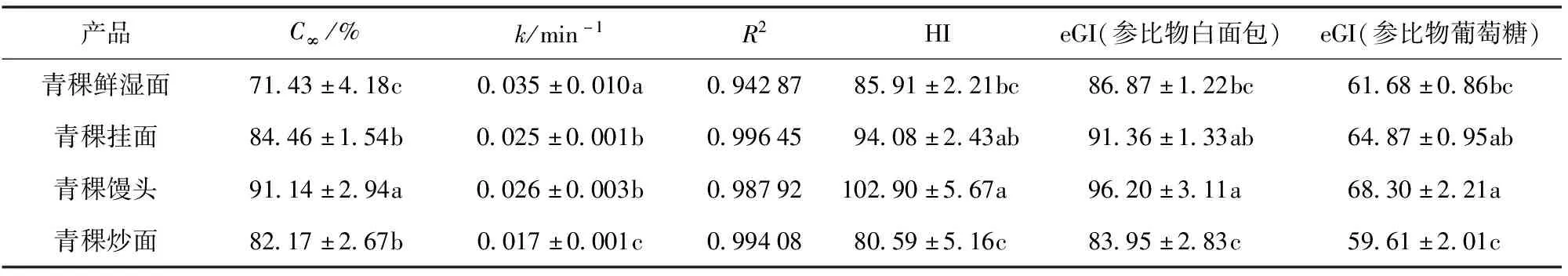
表3 青稞制品淀粉体外模拟水解动力学方程的特征参数
2.3 不同青稞制品GI值分析
GI是Jenkins等[33]于1981年首次提出的,它是反映食物引起人体血糖升高程度的指标,是人体进食后机体血糖生成的应答状况,对饮食控制餐后血糖有指导意义;然而淀粉体外消化特性是否能准确地反映出体内餐后血糖变化仍然存在争议[34]。为了综合评价不同加工方式制成的青稞制品间消化率的差异,研究进一步对青稞制品的体内淀粉消化率进行探究,如图3。峰值时间和浓度是影响血糖曲线的2个主要因素,葡萄糖标准溶液在进食30 min时达到峰值,接着血糖浓度又快速下降,而4种青稞制品的峰值浓度都显著低于葡萄糖标准溶液(P<0.05),同时,青稞挂面及青稞鲜湿面的峰值出现在45 min,即青稞制品使餐后血糖峰值降低和延迟。而4种制品中,青稞馒头餐后血糖应答曲线波动最大,青稞炒面餐后血糖应答曲线波动最小,最为平稳,这与淀粉体外消化率趋势一致。
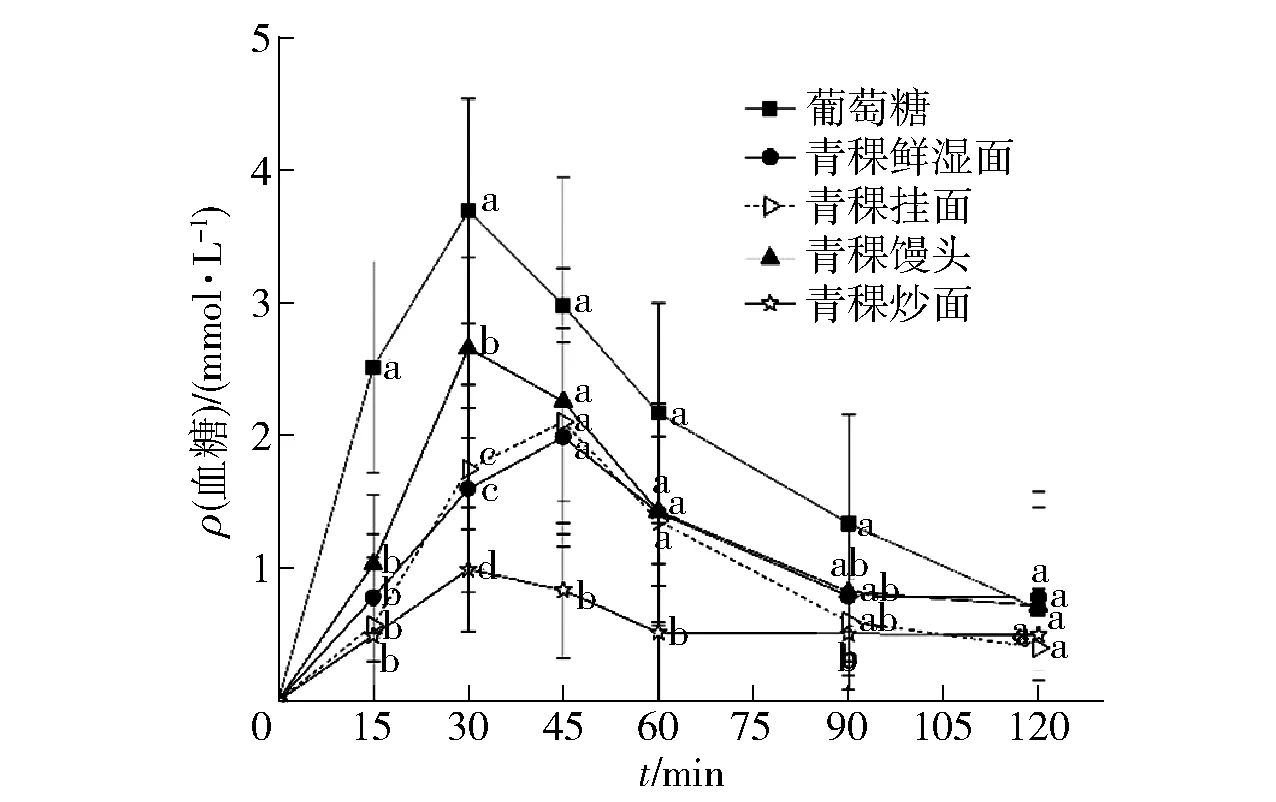
不同小写字母表示同一时间不同类别样品差异显著(P<0.05)。
表4对各样品的餐后血糖反应特征进行了分析。4种青稞制品的0~60 min血糖应答曲线下增量面积(IAUC0~60)显著低于葡萄糖标准溶液,说明青稞产品使餐后血糖在前期较为平稳,不容易造成前期血糖浓度过高。从GI值来看,以葡萄糖为参考,青稞馒头GI为70±11,属于高GI食物;青稞鲜湿面GI为60±13,处于55 表4 青稞制品的餐后血糖反应特征分析 此外,青稞产品的GI值与RDS(R=0.733,P=0.007)呈极显著正相关。研究发现:对青稞来说,体外淀粉消化在一定程度上是一个可靠的指标,可预测青稞食物的体内餐后血糖反应。但是,由于食物特性不同及肠胃系统的复杂性,是否所有的食物体外淀粉消化率都能准确预测出其体内血糖反应还不确定,需要开展更广泛、更具体的工作,才能将特定食品的体外结果应用于临床应用或流行病学研究。 通过对青稞原料粉及4种青稞制品的体内外淀粉消化特性进行探究,发现蒸煮和挤压处理均可显著增加青稞及小麦中RDS质量分数,降低RS质量分数,经过蒸煮处理的青稞熟粉的淀粉消化速率显著低于小麦熟粉。因此与日常生活中常见的主食小麦相比,青稞更适合于血糖控制人群或糖尿病病人食用。与此同时,不同的加工方式制得的青稞制品的淀粉消化率和餐后血糖反应有很大的差异,其中青稞馒头GI值最高,青稞炒面GI值最低,说明炒制更适合青稞功能保健食品的加工。在日常生活中,消费者需要根据自身的健康状况选择合适的产品。此外,为了进一步明确青稞改善血糖代谢的作用,有必要针对青稞对糖尿病的干预作用及其青稞降糖机理进行研究,以期促进青稞产业的发展和青稞食品的推广。
3 结 论
