外界因素和食品内部环境变化对Brevilaterin抗菌特性的影响
2021-02-02王美姿刘杨柳韩盼盼王露露王星星贾英民
王美姿,刘杨柳,韩盼盼,秦 明,王露露,王星星,陈 洲,贾英民
(北京工商大学 食品与健康学院,北京 100048)
食品防腐是保障食品免受微生物污染、延迟保质期的重要举措,除采用低温、腌制(高糖或高盐等)、真空保藏等传统的防腐方法以外,通常还会添加各类防腐剂以达到协同抗菌的功效[1]。随着人们对食品安全问题的日益重视,以往常用的化学类防腐剂由于易残留、过量食用后易导致人体出现健康问题等缺陷已逐步被限制使用[2],一些新型的生物类防腐剂应运而生。抗菌肽(antimicrobial peptides,AMPs)被认为是当下研究最热、应用前景最好的生物防腐剂之一[3]。AMPs是由宿主产生的能抵御外界微生物侵害、消除体内突变细胞的一类小分子多肽[4],具有抑菌谱广、抑菌机制独特且不易残留等优势;而且,诸如Nisin等一系列的AMPs物质都已被正式批准并应用在食品防腐当中[5]。
食品是一个复杂多变的混合体系,受组分构成、加工方式以及存储条件等众多因素的影响,并由此影响食品添加剂,如防腐剂等的使用[6]:Nisin在酸性食品中能发挥出非常好的抗菌效果,但在中性或碱性条件下却几乎无抗菌作用,高温处理或在含卵磷脂(≥1%)的食品中也同样会完全失去抗菌活力[7];食品中存在的金属离子也可能对AMPs的抗菌活性造成影响,如张炜等[8]发现,Fe2+能使抗菌肽BSN-37的活性消失;此外,食品的酸碱性以及表面活性剂等的存在均可能对AMPs的抗菌活性产生影响,如酸处理能显著降低辣椒籽AMPs[9]的抗菌活性,而吐温-20和吐温-80却能使其抗菌能力提高[10]。可见,AMPs能否适应外界因素和食品内部环境的变化直接制约其在食品防腐领域中的应用。为此,挖掘出适应不同食品的AMPs新资源成为该领域研究者期待解决的关键问题之一。
侧孢短芽孢杆菌(Brevibacilluslaterosporus)是近年来新发现的生物抗性细菌,能分泌多组分AMPs物质,这些AMPs具有抗细菌、抗真菌、抗癌细胞和抗病毒等生物特性,而且能抵抗温度、pH值及化学试剂等外界因素对其抗菌活性的影响。本课题组前期已获得了一株优良的B.laterosporus[11],并发现温度、pH值、化学试剂以及紫外线处理等外界因素均不会影响该菌分泌的AMPs(Brevilaterin)的抗菌活性,表现出了Brevilaterin良好的应用潜能[12-13]。然而,Brevilaterin是否能抵抗食品中更多外界因素对其抗菌活性的影响还不得而知,这也一定程度上限制了其应用,此外,Brevilaterin在食品发生变化的过程中所表现出的抗菌作用规律也不清楚。本研究将以Brevilaterin为对象,系统研究不同外界因素对其抗菌活性的影响,并考察Brevilaterin在食品内部环境变化过程中的抗菌作用规律,旨在为其在食品防腐中的应用提供充足的理论支撑。
1 材料与方法
1.1 材料与试剂
抗菌肽Brevilaterin,由本实验室筛选的侧孢短芽孢杆菌B.laterosporusS62-9[14]分泌所得,其终效价为861.0 AU/mL。
指示菌:金黄色葡萄球菌(Staphylococcusaureus,CICC No.10001)、单增李斯特氏菌(Listeriamonocytogenes,CICC No.21635)、藤黄微球菌(Micrococcusluteus,CICC No.10269)、铜绿假单胞菌(Pseudomonasaeruginosa,CICC No.10351)、乳酸乳球菌(Lactococcuslactis,CICC No.20711)、嗜碱芽孢杆菌(Halomonasalkalicola,CICC No.11012s)、梭状芽孢杆菌(Bacillusfusiformis,CICC No.20463),均购自中国工业微生物菌种保藏管理中心。
发酵培养基:葡萄糖15.0 g,鱼蛋白胨12 g,CaCl21.38 g,ZnCl20.008 16 g、Tween-20 1 g,蒸馏水1.0 L,pH值7.0。
胰蛋白胨大豆琼脂(TSA)培养基:胰蛋白胨15.0 g,大豆胨5.0 g,NaCl 5.0 g,琼脂13.0 g,蒸馏水1.0 L,pH值7.3±0.2。
乳酸菌培养基I(LBMI):酵母膏7.5 g,葡萄糖10.0 g,番茄汁100 mL,蛋白胨7.5 g,KH2PO42.0 g,Tween-80 0.5 g,蒸馏水900 mL,pH值7.0。
MRS肉汤培养基:蛋白胨10 g, 牛肉粉5 g,葡萄糖20 g,酵母粉4 g,乙酸钠5 g,KH2PO45 g,MgSO40.2 g,柠檬酸三铵2 g,MnSO40.05 g,Tween-80 1 g,蒸馏水 1.0 L,pH 值6.2±0.2。
营养琼脂(NA)培养基:蛋白胨10 g,牛肉浸粉3 g,NaCl 5 g,琼脂15 g,蒸馏水1.0 L,pH值7.3±0.1。
1.2 仪器与设备
PREP中压层析系统,瑞士BUCHI公司;Scan 4000型全自动菌落计数仪,法国Interscience;INFINITE Spark 10M型酶标仪,瑞士Tecan公司;Omega series微生物生长曲线测定仪,德国BMG Labtech公司。
1.3 实验方法
1.3.1Brevilaterin抗菌活性测定
采用琼脂扩散法,以S.aureus为指示菌[9]。以经2代活化的菌为种子液发酵制备菌悬液,稀释菌浓度至OD600为0.7~0.8,按体积分数为3%的量添加到预冷至50 ℃左右的NA培养基中,迅速混匀后倒平板,备用。
取无菌牛津杯摆放在倒好的平板上,加入50 μL Brevilaterin溶液,将平板移至4 ℃冰箱并静置预扩散1 h,再移至37 ℃恒温培养箱内静置培养16 h,待平板上长出致密的菌层,并出现清晰的抑菌圈后取出,用全自动菌落计数仪测量抑菌圈直径。
1.3.2最小抑菌浓度的测定
最小抑菌浓度(minimum inhibitory concentration,MIC)的测定,采用微量液体稀释法,参照Kondejewski等[15]的方法并作适当修改。
1)调节菌体浓度。以无菌培养基为空白,测定菌悬液的OD600,调节菌浓度至与0.5麦氏比浊管(McFarland)相同的OD600(约为1×108CFU/mL),再用0.85%无菌生理盐水稀释菌浓度至1.0×106CFU/mL,备用。
2)MIC测定。以96板的每行为一个测试组,各设3个平行,1~10列分别为不同浓度的处理组,11列为阳性对照组,12列为空白对照组。向1~11列微孔中分别注入100 μL无菌培养基,第12列加入200 μL无菌培养基。向第1列中加入100 μL质量浓度为0.5 mg/mL的AMPs溶液,再逐级向后进行2倍稀释至第10列,混匀后舍弃第10列板孔中的100 μL溶液。再分别向1~11列微孔中接入100 μL预调好浓度的菌悬液,使其终浓度为5×105CFU/mL,置于菌株最适生长温度下培养16~20 h。使用酶标仪检测600 nm波长处的吸光值(A值),根据A值计算AMPs对菌株的生长抑制率。结合抑制率大于等于90%所对应的浓度,以及肉眼观察无可见菌生长的最低浓度最终确定MIC。
1.3.3最小杀菌浓度的测定
最小杀菌浓度(minimum bactericidal concentration,MBC)的测定,以MIC测定结果为基础,分别吸取MIC实验中无菌生长浓度下的菌悬液100 μL并涂布于固体培养基上,置于该菌最适生长条件下培养24 h,以平皿上菌落数小于5个的最低浓度为MBC值,实验重复3次。
1.3.4不同外界因素及处理对Brevilaterin抗菌活性影响实验
1.3.4.1 金属离子、乳化剂、增稠剂、酶类和蔗糖对Brevilaterin抗菌活性影响的处理方法
考察了不同外界因素对Brevilaterin抗菌活性的影响,包括金属离子、乳化剂、增稠剂、酶类和高浓度蔗糖。处理方法:分别将金属离子(Na+、K+、Ca2+、Mg2+、Co2+、Zn2+、Mn2+、Ni2+、Al3+和Fe3+,终浓度为12.5~300.0 mmol/L、乳化剂(甘油、十二烷基苯磺酸钠、单硬脂酸甘油酯和大豆磷脂,终质量分数为1%)、增稠剂(明胶、羧甲基纤维素钠、黄原胶和卡拉胶,终质量分数为0.5%)、酶类(脂肪酶、蛋白酶K、胰蛋白酶、胃蛋白酶、复合蛋白酶、溶菌酶、酸性蛋白酶和碱性蛋白酶,终质量浓度为30.0 mg/mL)和蔗糖(终质量分数10%~50%)与Brevilaterin(终质量浓度为0.6 mg/mL)混匀,再按1.3.1的方法测定其抗菌活性。以只添加不同因素的样品组作为阴性对照组,以只添加Brevilaterin的样品组作为阳性对照组。
1.3.4.2 反复冻融对Brevilaterin抗菌活性影响的处理方法
将终质量浓度为0.6 mg/mL的Brevilaterin反复冻融(-20 ℃冻结,常温解冻;0~12次)处理,再按1.3.1的方法测定Brevilaterin的抗菌活性,以不经冻融处理的Brevilaterin为空白对照。
1.3.5食品内部环境变化对Brevilaterin抗菌作用影响实验
分别考察了食品内部温度、pH值、渗透压变化以及氧含量变化对Brevilaterin抗菌作用规律的影响,以MIC和MBC为最终考察指标。
1.3.5.1 温度变化实验
以S.aureus、L.monocytogenes、M.luteus、P.aeruginosa为指示菌,按照1.3.2和1.3.3的方法分别测定Brevilaterin在温度变化条件下(4、10、25、37 ℃)对指示菌的MIC和MBC。
1.3.5.2 pH值变化实验
以L.lactis、S.aureus和H.alkalicola为指示菌,按照1.3.2和1.3.3的方法分别测定Brevilaterin在pH值变化条件下(pH值 2.0~11.0)对指示菌的MIC和MBC。
1.3.5.3 渗透压变化实验
以S.aureus为指示菌,按照1.3.2和1.3.3的方法分别测定Brevilaterin在渗透压变化条件下(蔗糖质量分数为3%~50%;NaCl质量分数为1%~15%)对S.aureus的MIC和MBC。
1.3.5.4 氧含量变化实验
以B.fusiformis、S.aureus为指示菌,按照1.3.2和1.3.3的方法分别测定Brevilaterin在氧气含量变化条件下(5%~21%)对B.fusiformis、S.aureus的MIC和MBC。
2 结果与分析
2.1 不同外界因素及处理条件对Brevilaterin抗菌活性的影响
2.1.1不同外界因素对Brevilaterin抗菌活性的影响
本课题组前期探索发现,温度、pH值、常见的化学试剂以及紫外线等并不直接影响Brevilaterin的抗菌活性[12-13]。在此基础上,本研究进一步系统考察了更多外界因素对Brevilaterin抗菌活性的影响,包括金属离子、乳化剂、增稠剂、酶类和高浓度蔗糖。结果表明,Brevilaterin能够抵抗除大豆磷脂以外的所有测试因素对其抗菌活性的影响。可见,Brevilaterin具有很好的环境适应性,这也为其在更多类别食品中的抗菌应用提供了良好的理论支撑。
2.1.1.1 金属离子的影响
某些食品(如皮蛋、油条、卤水豆腐等)因加工的需要通常会添加较高浓度的金属离子,如Pb2+、Al3+、Mg2+、Ca2+等。这些金属离子(添加量在10~300 mmol/L)很可能会对蛋白或肽类物质的稳定性产生影响并造成其活性的变化[1,10,16],如金属离子会抑制鱼精蛋白的抑菌活力,并随着电荷数和浓度的增加而增强[1]。李军等[16]发现,90.0 mmol/L Ag+使萝卜籽蛋白提取物的抗菌活性降低70%,而300.0 mmol/L的Ca2+可以使花椒籽蛋白AMPs的活性提高[10]。还有部分肽类抗生素要发挥抗菌作用还需依赖金属离子的存在,这也为其应用带来一定的麻烦,如杆菌肽和博来霉素就是典型的金属依赖类抗菌肽[17]。金属离子对Brevilaterin抗菌活性研究的实验结果见表1。

表1 金属离子对Brevilaterin抗菌活性的影响
2.1.1.2 乳化剂的影响
乳化剂是在面包、蛋糕和饼干等食品中起乳化、分散、润滑和稳定作用的常用添加剂(添加量在0.5%~5.0%)[18-19]。乳化剂在疏水和静电作用下,很可能会与蛋白或肽类结合,进而影响它们的活性[20],如Gänzle等[7]曾研究发现,1%的卵磷脂会使Nisin完全失去抗菌活性。乳化剂对Brevilaterin抗菌活性研究的实验结果见图1。由图1可见,Brevilaterin的抗菌活性除了受到大豆磷脂一定程度的抑制以外,均不受其他乳化剂的影响。

图1 乳化剂对Brevilaterin抗菌活性的影响
2.1.1.3 增稠剂的影响
增稠剂主要用于改善和增加食品的黏稠度,保持流态食品、胶冻食品的色、香、味和稳定性,改善食品物理性状,并能使食品有润滑适口的感觉。增稠剂常添加在果冻、调味糖浆、软糖等食品中[21],常用添加量为0.5%~5.0%[22]。如李鹏等[23]发现,用质量分数为1.05%卡拉胶和0.45%海藻酸钠组成的复合胶制备南瓜果冻,能更好地保持果冻的柔软性和弹性。增稠剂对Brevilaterin抗菌活性研究的实验结果见图2。由图2可见,Brevilaterin的抗菌活性基本不受增稠剂的影响,因此,Brevilaterin适合果冻、软糖等食品的防腐应用。

图2 增稠剂对Brevilaterin抗菌活性的影响
2.1.1.4 酶制剂的影响
焙烤食品、酿造食品、肉类食品等,在加工过程中通常会添加某种酶制剂来有效提高其加工程度、改进加工工艺以及改善其风味和品质[24-25];然而,酶的添加(质量浓度一般达10 mg/mL以上时),尤其是蛋白酶,通常会对蛋白或肽类物质的结构造成破坏,致使其生物活性丧失[12,23]。研究发现,不同来源的AMPs对蛋白酶具有不同的敏感性,如萝卜籽蛋白提取物基本不受9 mg/mL蛋白酶影响[16],而格氏乳球菌分泌的garviecin LG 34极易被蛋白酶(木瓜蛋白酶、中性蛋白酶、胃蛋白酶和胰蛋白酶,5 mg/mL)水解[26]。基于抗菌肽Brevilaterin是由13个氨基酸、N末端有一个C6脂肪酸组合而成的结构特点,本研究重点考察蛋白酶与脂肪酶对其抗菌活性的影响,实验结果见图3。图3表明,Brevilaterin对多种蛋白酶均表现出很强的抗性;此外,Brevilaterin的抗菌活性同样不受脂肪酶影响。
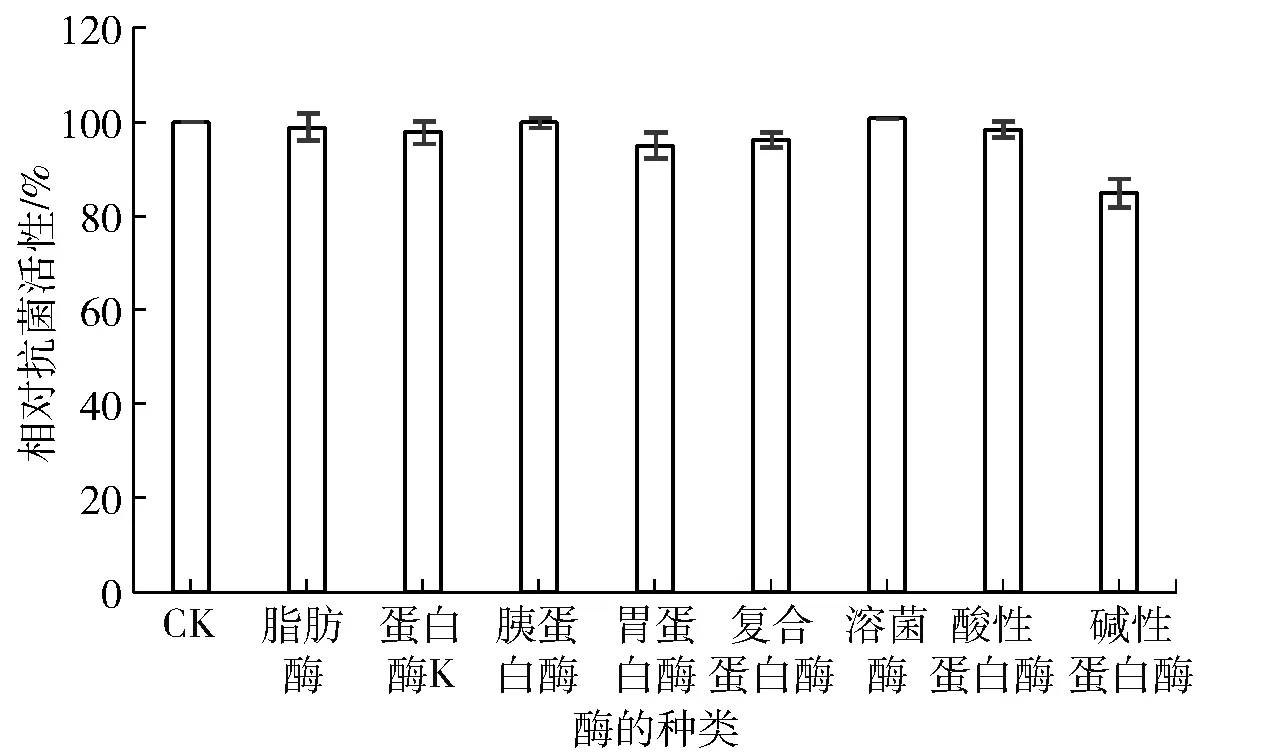
图3 蛋白酶对Brevilaterin抗菌活性的影响
2.1.1.5 高浓度蔗糖的影响
果脯、蜜饯以及罐头类食品通常采用过量加糖的方式来拟造高渗的保藏环境,以此来防止微生物的侵染,如此极端的食品属性就对生物防腐剂提出更高的要求。本研究发现(实验结果见图4),Brevilaterin在含有50%蔗糖的环境中依然能够保持原有的抗菌活力,这表明其非常适用于高渗的保藏环境下的防腐保鲜。
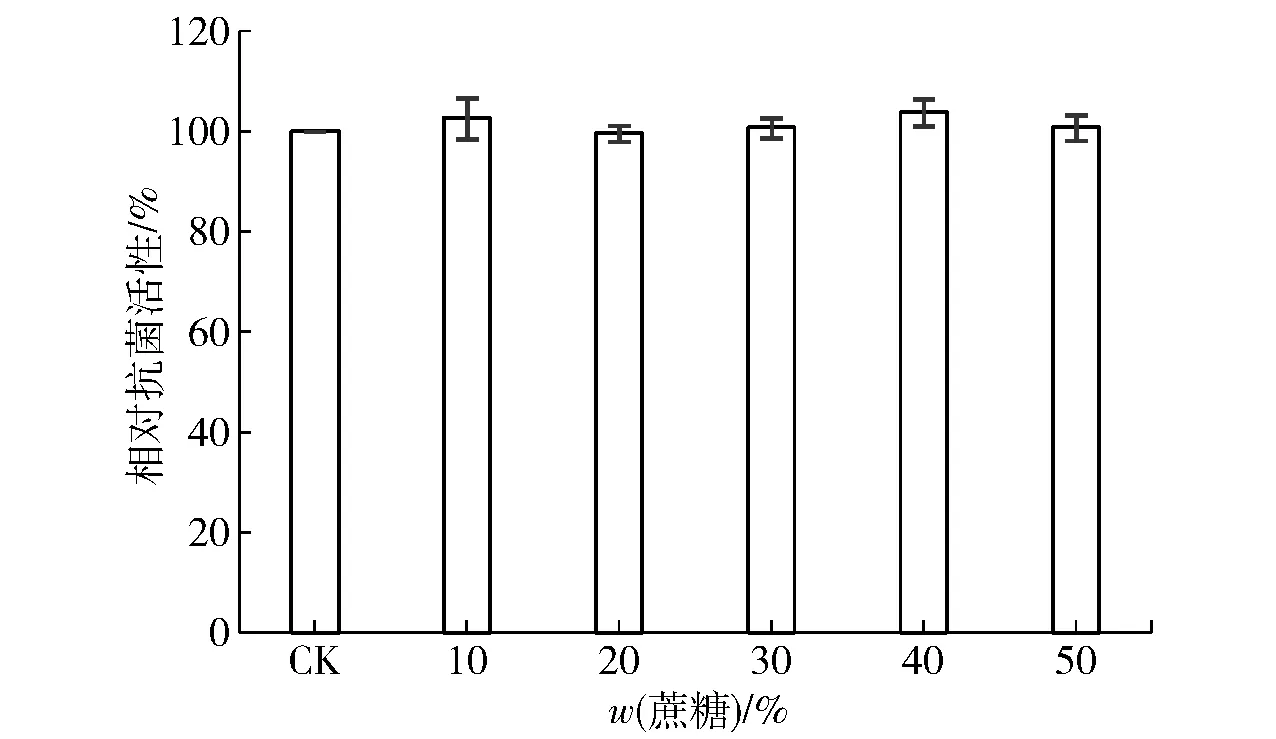
图4 蔗糖对Brevilaterin抗菌活性的影响
2.1.2反复冻融处理对Brevilaterin抗菌活性的影响
本研究还考察了反复冻融处理对Brevilaterin抗菌活性的影响,实验结果见图5。图5表明,Brevilaterin能够完全耐受反复冻融处理对其抗菌活性的影响,表现出优异的稳定性。
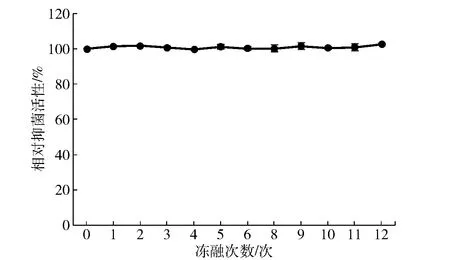
图5 冻融次数对Brevilaterin抗菌活性的影响
低温及冷冻环境可以保持水果、蔬菜、奶制品、鲜肉等食品品质(嫩度、持水性、脂肪氧化)和商品品质(色泽、质构),但反复解冻过程又很容易引入食品腐败菌的侵染;同时,蛋白和肽类物质的生物活性很可能会受冻融处理的影响而改变,给其应用带来一定的隐患[27]。图5显示,Brevilaterin在经过12次反复冻融之后依然能够保持原有的抗菌活力,表明其能够适应于较大的温度反复变化。其他来源的AMPs如BSN-37、F1的粗提物,经10~12次、5次反复冻融后[28],抗菌活性也能保持不变。
2.2 食品内部环境变化对Brevilaterin抗菌作用的影响
食品的属性及其加工工艺不尽相同,为了实现有效抑制食品腐败菌的生长、延长货架期,存储时通常都会选用差异性很大的食品保藏环境。降低保藏温度、调整酸碱度、创造高渗环境和应用真空包装或脱氧剂是最常用于控制食品腐败菌生长的重要方式,但为了延长食品保存的货架期,目前大部分食品保藏时除了选用上述特殊食品保藏环境外,还需加入一定量的防腐剂来强化抑制食品腐败菌的生长。
随着食品贮藏时内部环境的变化,食品腐败菌的生长状态和生长量可能会受到不同程度的影响。特别是当生长条件偏离菌株最适生长条件时,菌株的生长会出现缓慢,甚至休眠的状态,菌体生长量也会随之出现一定程度的下降[29]。为此,本研究以OD600为指标,考察了受试菌在生长环境发生变化时的生长量变化。结果表明,受试菌在最适生长环境下,菌体生长良好,但逐渐偏离受试菌最适生长条件时,菌体生长缓慢,菌体量出现一定程度的减少(具体结果未列出)。
此外,虽然前期研究已证实Brevilaterin在不同因素的影响以及不同条件的处理下均能保持良好的抗菌效果[12-13],但是,Brevilaterin在食品内部环境发生变化时是否会对食品腐败菌表现出不同的抗菌作用规律呢?本研究通过模拟不同食品内部环境的变化(温度、pH值、渗透压以及氧含量),考察抗菌肽Brevilaterin对食品腐败菌的抗菌作用规律,旨在明确Brevilaterin能够抑制或者杀死受试菌所需要添加的参考量。
2.2.1温度变化对Brevilaterin抗菌作用的影响
选取S.aureus、L.monocytogenes、M.luteus和P.aeruginosa为指示菌,分别测定4 ℃(冷藏)、10 ℃(低温)、25 ℃(室温)和37 ℃(菌体最适生长温度)下Brevilaterin对各指示菌的MIC和MBC,实验结果见表2。表2表明,Brevilaterin对所有测试温度下的菌株均有很好的抑制效果,但随着温度的改变,Brevilaterin对各指示菌的MIC和MBC也产生了不同程度的变化。在4 ℃下,Brevilaterin对M.luteus的MIC和MBC均为37 ℃下的1/8;在10 ℃下,Brevilaterin对P.aeruginosa的MIC和MBC均为37 ℃下的1/4,对L.monocytogenes的MIC和MBC分别为37 ℃下的1/4和1/2,对S.aureus的MIC和MBC均为37 ℃下的1/2。
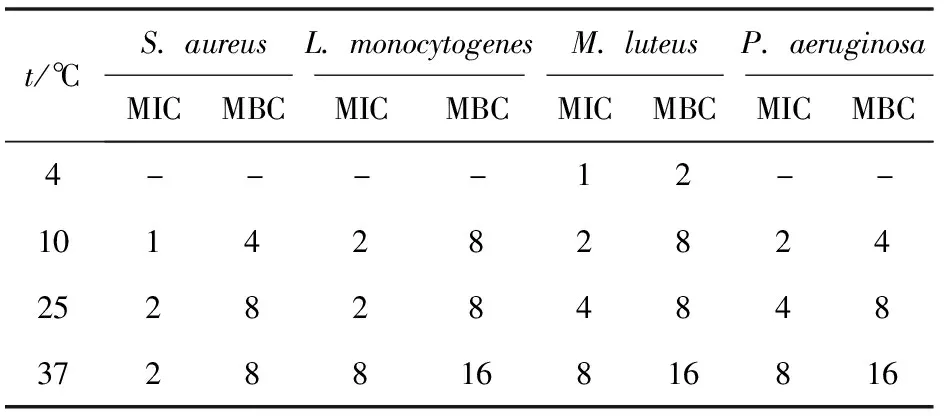
表2 温度变化对Brevilaterin抗菌作用的影响
温度是调控微生物生长性状的主要因素之一,而降低保藏温度也是食品防腐的重要措施[30]。所以,阐明温度变化时Brevilaterin对食源性致病菌的抗菌作用规律对于科学地指导AMPs的防腐应用有着重要的意义。本研究发现,随着温度的降低,Brevilaterin对各指示菌的MIC和MBC逐渐减小,这也反映出Brevilaterin对食源性致病菌的抗菌作用逐渐增强。可能原因是,低温条件下微生物逐步进入休眠状态,生长繁殖趋缓,代谢和免疫等功能逐渐弱化,在此环境下Brevilaterin便能发挥出更好的抗菌效果[31];同时,这也表明了在达到相同的抗菌效果时,Brevilaterin在较低温度下所需添加的量便能大大减少,降低了其应用成本[32]。
2.2.2pH值变化对Brevilaterin抗菌作用的影响
以L.lactis、S.aureus、H.alkalicola为指示菌,分别测定pH值变化时Brevilaterin对各指示菌的MIC和MBC,实验结果见表3。表3表明,Brevilaterin对所有测试pH值下的菌株均有很好的抑制效果,但随着pH值的改变,Brevilaterin对各指示菌的MIC和MBC也产生了不同程度的变化。pH值为2时,Brevilaterin对L.lactis的MIC和MBC降低为pH为6值时的1/2;pH值为8~9时,Brevilaterin对S.aureus的MIC和MBC减小到pH值为7时的1/2;而Brevilaterin在pH值为7.0值时会对H.alka-licola表现出最强的抗菌活性。
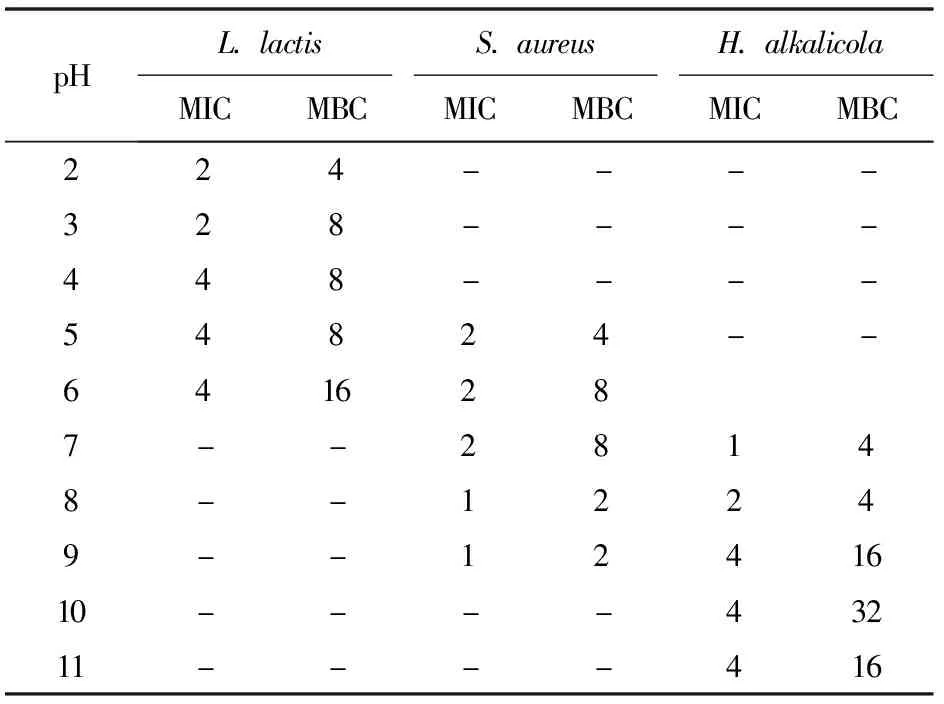
表3 pH值变化对Brevilaterin的抗菌作用的影响
酸碱环境是影响微生物生长的重要因素之一,而调整食品保存的pH值也是有效防止食品腐败变质的重要方法。本课题组前期研究结果证实,pH值的变化对Brevilaterin抗菌活性并不产生影响[14]。本研究发现,在偏离菌株最适的生长pH值时,Brevilaterin对指示菌的MIC和MBC显著减小,说明其对食源性致病菌的抗菌作用增强。产生该结果的原因:一方面是因为菌株生长趋缓;另一方面可能是,pH值改变会引起膜电势的改变[1],从而导致指示菌对Brevilaterin敏感性改变,进而使Brevilaterin的添加量减少,同样达到防止腐败的效果。
2.2.3渗透压变化对Brevilaterin抗菌作用的影响
以S.aureus为指示菌,分别测定不同浓度的蔗糖和NaCl存在环境下,Brevilaterin对S.aureus的MIC和MBC,实验结果见表4。表4结果表明,随着蔗糖或者NaCl浓度的改变,Brevilaterin对S.aureus的MIC和MBC也发生了变化。在蔗糖质量分数达12.5%及以上时,Brevilaterin对S.aureus的MBC为初始条件下的1/2;类似的,在8%NaCl存在时,Brevilaterin对S.aureus的MBC为对照的1/2。

表4 渗透压变化对Brevilaterin抗菌作用的影响
拟造高渗环境是最常用于控制微生物生长的食品存储方法之一[33]。本研究发现,当食品的渗透压较高时,Brevilaterin对S.aureus的MBC会显著减小,可见其对食源性致病菌的抗菌作用增强,Brevilaterin与渗透压的协同能对食源性致病菌产生更强的抗菌作用。产生该结果的可能原因是,微生物离开其生长最适的水分活度后[34],菌株逐渐出现缓慢、休眠等状态,菌体量也随之降低,进而使得Brevilaterin抑制指示菌所需用量减少。
2.2.4氧含量对Brevilaterin抗菌作用的影响
以B.fusiformis和S.aureus为指示菌,分别测定氧气体积分数为5%、10%、15%、21%时,Brevilaterin对各指示菌的MIC和MBC,实验结果见表5。表5表明,氧含量的变化仅能一定程度上调控菌株的生长状态,但并不影响Brevilaterin对指示菌的抗菌效果。

表5 氧含量变化对Brevilaterin抗菌作用的影响
氧气是影响微生物生长不可缺少的因素之一,使用真空包装或应用脱氧剂都是食品防腐的重要手段[35],但常见的食源性致病菌多属于兼性厌氧型菌株,它们在有氧和无氧环境中均能生长,如大肠杆菌、沙门氏菌。本研究发现,氧含量的变化并不影响Brevilaterin对厌氧菌B.fusiformis和对照菌S.aureus的抗菌作用,因此Brevilaterin在厌氧环境也能达到防腐抗菌的效果。
3 结 论
本研究考察了不同外界因素对Brevilaterin抗菌活性的影响,结果表明,Brevilaterin能抵抗除大豆磷脂以外的所有因素以及反复冻融处理对其抗菌活性的影响。本研究还深入探讨了食品内部环境变化对Brevilaterin抗菌作用规律的影响,结果表明,随着温度、pH值和渗透压的改变,Brevilaterin的抗菌作用规律均会发生显著变化。随着温度的降低,Brevilaterin对S.aureus、L.monocytogenes、M.luteus和P.aeruginosa的抗菌作用逐渐增强,MIC和MBC减少至菌株生长最适温度下的1/8~1/2;当pH值偏离L.lactis、S.aureus和H.alkalicola生长最适pH值时,Brevilaterin对这些菌株的MIC和MBC均减小为初始的1/4~1/2;渗透压升高后,Brevilaterin对S.aureus的MBC也降低为常压下的1/2。总体上,当食源性致病菌的生长条件偏离其最适条件时,Brevilaterin能表现出更强的抗菌作用,而此时的MIC和MBC均降低至最适条件下的1/8~1/2。Brevilaterin良好的稳定性,以及能随着食品内部环境变化而表现出不同的抗菌作用的特点,可为Brevilaterin在食品防腐中的科学应用提供理论依据。
