氢气对噪声性聋的有效防护时间及机制研究
2021-02-01石磊于宁秦含黛蒋晴晴朱玉华孙勍郭维维杨仕明
石磊 于宁 秦含黛 蒋晴晴 朱玉华 孙勍 郭维维 杨仕明
中国人民解放军总医院耳鼻喉头颈外科学部(北京 100853)
噪声性聋(Noise induced hearing loss,NIHL)是指由于长期暴露于损伤性噪声环境中引起的以毛细胞损伤为主要病理机制的进行性感音神经性聋。据美军国防部披露,截至2009年美军共认定120.99万名军人及退伍军人患有不同程度噪声性聋,是同期美军总人数的84.7%[1],另据公开资料显示我军服役2年以上的高炮兵的听力损失达48.3%,炮兵为37.5%,装甲兵为30.6%,舰艇部队(0.5-12年)为23.5%[2],我军面临的情况同样严峻。此外,NIHL还可引起除听力下降外一系列的生理、心理疾病[3]。因此,高效NIHL防治药物研究迫在眉睫,目前NIHL药物防治拥有诸多靶点,但以针对抗氧化应激药物的研究最为广泛且防治效果显著。近来研究已经证实氢气干预可有效防治NIHL[4,5],但其预防作用持续时间尚不清楚,本研究旨在探索氢气预防作用持续时间及机制。
1 材料和方法
1.1 实验动物及分组
SPF级雄性豚鼠35只,体重300g,购自北京维通利华有限公司。实验动物合格证编号:SCXK(京)2016-0011。随机取5只正常豚鼠作为正常组在饲养14天后处死进行病理组织染色。余30只随机等分为两组:噪声组和氢气组,每组15只。所有动物在噪声暴露后第14天听性脑干反应(ABR)测试结束后处死取耳蜗。实验前均通过解放军总医院动物实验伦理委员会审批。
1.2 预防性吸入氢气
选用Healthgen牌氢气发生器生产氢气,通过特制管路将气体输入临时饲养箱中,预充气15min确保饲养箱内氢气浓度稳定在1000ppm,随后将豚鼠置于饲养箱内1小时,吸入结束后1h行脉冲声暴露。
1.3 脉冲噪声暴露
将清醒状态的豚鼠置于特制笼具内并固定头部,确保双耳接受同等剂量的脉冲声刺激。在专用消声室中,将脉冲管置于豚鼠头部正前方、距耳屏5cm处,给予峰值为163 dB SPL,脉宽0.25ms,时间间隔为10s的脉冲声(B&K 2209型声级计校准),每次噪声暴露施加一组8个脉冲声;每隔2h重复一组,直至听阈≥90dB终止。
1.4 ABR听力测试
氢气组(15只豚鼠)及噪声组(15只豚鼠)在首组脉冲声暴露前、每组暴露后即刻及其后第1天、3天、7天、14天行ABR测听(美国TDT系统)。使用异氟烷进行呼吸麻醉诱导及维持,隔声屏蔽室内连接针式电极(记录电极置于颅顶正中皮下,参考电极置于测试耳耳廓皮下,接地电极置于对侧耳廓皮下),调整给声喇叭使之贴近外耳道,采用Click、4kHz、8kHz、16kHz刺激声,每次叠加1024次,以可重复的ABR波Ⅲ的最低刺激强度为阈值。
1.5 免疫荧光染色
免疫荧光标记Myosin-7a观察肌球蛋白表达、鬼笔环肽(Phalloidin)标记毛细胞骨架用于外毛细胞计数、突触前蛋白CtBP2和突触后蛋白Glu-A2用于带状突触计数。
噪声暴露后14天ABR测听结束后,处死噪声组和氢气组豚鼠(每组3只6耳),快速取出耳蜗,蜗顶钻孔、开放圆窗和卵圆窗,4%多聚甲醛溶液自蜗顶灌流、4℃过夜固定。将标本置于10%乙二胺四乙酸(EDTA)溶液中脱钙4天,分离基底膜,将其置于Triton X100+10%山羊血清中封闭1h,加入Myosin-7a一抗(1:100稀释,兔源,Abcam)4℃过夜,PBS冲洗3次,加入二抗(ALEXA 488,1:400,山羊抗兔,Abcam)和phalloidin(1:1000稀释,Abcam),室温避光染色1h,PBS冲洗3次,DAPI甘油封片,激光共聚焦显微镜拍照。使用ImageJ软件对Moysin-7a染色行荧光半定量分析。另取噪声组和氢气组每组3耳基底膜底回,同法加入CtBP2(1:200,鼠源,Abcam)和Glu-A2(1:200,兔源,Abcam)一抗及二抗(ALEXA 555,山羊抗鼠,1:400,Abcam;ALEXA 647,山羊抗兔,1:400,Abcam),扫描层距设定为0.35μm拍照。
1.6 琥珀酸脱氢酶染色观察
噪声暴露后14天ABR测听结束后,处死噪声组和氢气组豚鼠(每组1只2耳)豚鼠断头取耳蜗,打开卵圆窗、圆窗及蜗顶,自蜗顶缓慢灌注新鲜配置琥珀酸脱氢酶(Succinic dehydrogenase,SDH)染液(0.2 mol/L磷酸缓冲液,0.2 mol/L琥珀酸钠,0.1%氯化硝基四氮唑蓝,染液配置比例为1:1:2),39°C孵育1h,同法固定、脱钙、取基底膜铺片,光学显微镜(Olympus BX51)下观察,高灵敏度相机(Olympus DP-72)拍照。
1.7 透射电镜观察
噪声暴露后14天ABR测听结束后,处死噪声组和氢气组豚鼠(每组1只2耳),取耳蜗,蜗顶开孔、开放圆窗和卵圆窗,2.5%戊二醛灌流并浸泡,4℃过夜固定,10%EDTA溶液脱钙1周。显微镜下分离基底膜,0.1M磷酸缓冲液冲洗,1%锇酸后固定1h,磷酸缓冲液漂洗,梯度酒精脱水,环氧树脂包埋,半薄切片定位,超薄切片铅铀染色,FEI120kV透射电镜拍照。
1.8 统计方法
所有实验数据采用SPSS 20(美国SPSS)软件行两个独立样本t检验,所有实验计数资料采用均值±标准差()表示,P<0.05为差异有统计学意义。
2 结果
2.1 ABR测听结果
噪声暴露前氢气组和噪声组ABR阈值差异无统计学意义(P=0.68),第一组脉冲噪声暴露后(即0h),氢气组与噪声组相比,氢气组可降低16KHz的ABR阈值,差异有统计学意义,在两组豚鼠听阈≥90dB前,噪声组豚鼠听阈始终高于氢气组,且随频率增高,差异具有统计学意义时间点逐渐增多;噪声暴露结束后(6h至14D)听力恢复过程中,两组豚鼠ABR听阈均明显下降,氢气组ABR听阈明显低于噪声组,在Click、4KHz、16KHz处均出现差异具有统计学意义时间点(图1)。
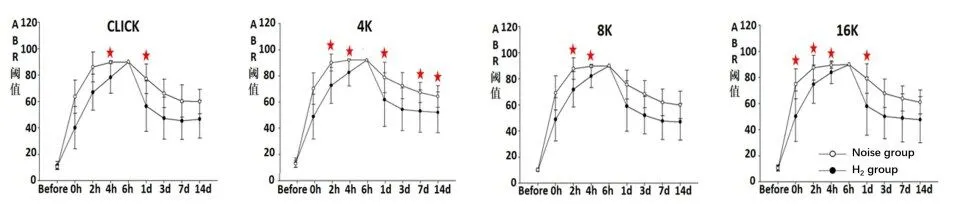
图1 不同时间点ABR阈值,n=30耳。星号代表噪声组和氢气组ABR阈值差异在该时间点具有统计学意义(P<0.05),两实验组间ABR click声差异在4h和1天时具有统计学意义,P值分别为0.001、0.032;两实验组4k频率差异在2h、4h、1天、7天、14天时具有统计学意义,P值分别为0.005、0.001、0.034、0.02、0.041;8k频率差异在2h、4h具有统计学意义,P值分别为0.004、0.001;16k频率差异在0h、2h、4h、1天时具有统计学意义,P值分别为0.043、0.022、0.001、0.015。Fig.1 ABR threshold at each time point(n=30 Ears).The asterisk represents that the difference of ABR threshold between noise group and hydrogen group at the time point has statistical significance(P<0.05),The difference of click was statistically significant at 4h and 1d,P=0.001,0.032;The difference of 4K was statistically significant at 2h,4h,1d,7d and 14d,P=0.005,0.001,0.034,0.02,0.041;When compared at 8k,the difference was statistically significant at 2h and 4h,P=0.004,0.001;The difference of 16K was statistically significant at 0h,2h,4h and 1d,P=0.043,0.022,0.001,0.015.
对噪声暴露期间ABR数据进行曲线拟合及直线回归,各频率的直线回归方程氢气组斜率均>噪声组,氢气组拟合曲线各频率在4h时斜率开始变陡(图2)。
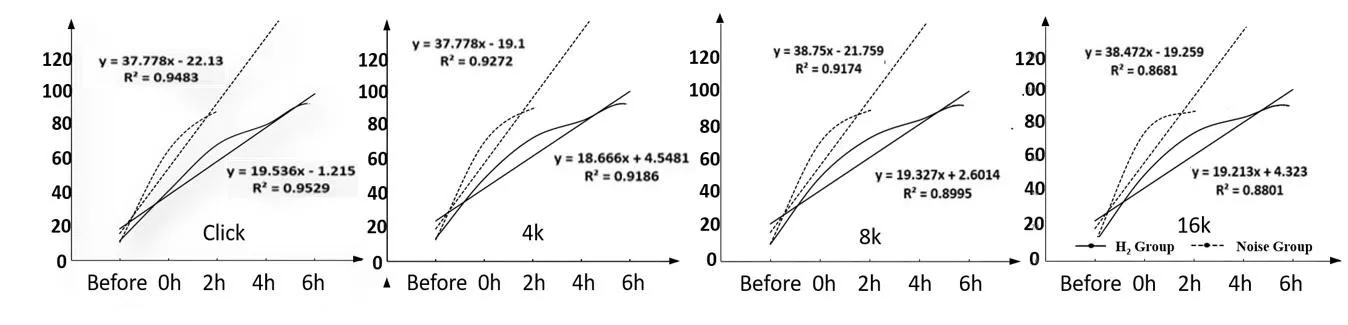
图2 噪声暴露期间折线图曲线拟合及直线回归结果,n=30Fig.2 Curve fitting and linear regression results of line graph during noise exposure,n=30
2.2 各时间点噪声组ABR阈值≥90dB及氢气组ABR阈值<90dB耳数统计
整理统计噪声组各频率在不同时间点ABR阈值≥90dB耳数。噪声暴露后2h各频率ABR阈值≥90dB耳数已超过50%(图3)。

图3 噪声组各频率不同时间点ABR阈值≥90dB耳数统计,噪声组耳数n=30Fig.3 Statistics of ears with ABR threshold≥90dB at each frequency and time point in noise group,Noise group n=30
整理统计氢气组各频率不同时间点ABR阈值<90dB耳数,在噪声暴露2h后各频率ABR阈值<90dB耳数均超过50%;4h时间时只有Click频率ABR阈值<90dB耳数超过50%,其余三个频率均少于50%;6h时间点,全部频率ABR听阈<90dB耳数均未超过50%(图4)。
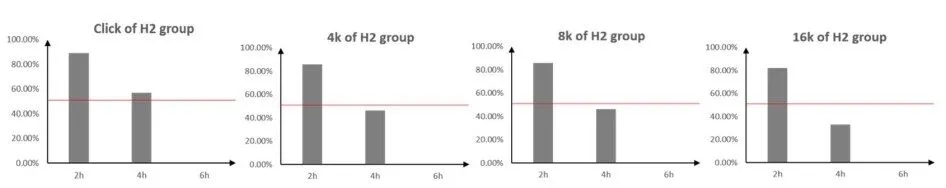
图4 氢气组各频率各时间点ABR阈值<90dB耳数统计,氢气组耳数n=30Fig.4 Statistics of animals with ABR threshold<90dB at each frequency and time point in the hydrogen group,H2 group n=30
2.3 免疫荧光染色及相关计数
相较于正常豚鼠耳蜗基底膜Myosin-7a染色,噪声组与氢气组Myosin-7a染色荧光强度均出现下降,但氢气组荧光强度仍高于噪声组(图5)。

图5 Myosin-7a免疫荧光染色及荧光半定量分析Fig.5 Myosin-7a immunofluorescence staining and fluorescence semi quantitative analysis
Phalloidin标记毛细胞,正常豚鼠耳蜗基底膜铺片可见3排外毛细胞排列整齐、无缺失,噪声组与氢气组毛细胞均出现丢失,但氢气组外毛细胞丢失数量明显少于噪声组,对氢气组和噪声组外毛细胞丢失数量差值进行t检验,差异具有统计学意义(P=0.03<0.05)(图6)。
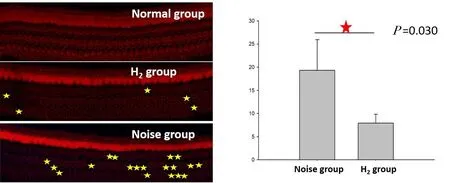
图6 鬼笔环肽免疫荧光染色及丢失外毛细胞计数,黄色星号代表丢失的外毛细胞,红色星号代表具有统计学意义(P<0.05),行毛细胞计数的耳数n=6。Fig.6 Immunofluorescence staining of phalloidin and count of missing outer hair cells,The yellow asterisk represents the missing outer hair cells,The red asterisk represents statistical significance(P<0.05),n=6
CtBP2/Glu-A2标记带状突触,正常豚鼠内毛细胞带状突触数量为15.4±2.54,氢气组为10.5±2.32,噪声组为8.1±2.02,对氢气组与噪声组间突触数量差异进行统计学分析,两组间差异无统计学意义(P=0.65)(图7)。
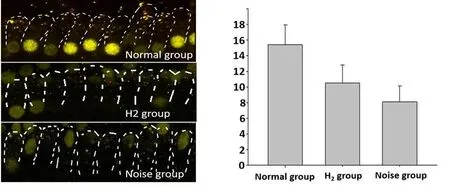
图7 Ctbp-2/Glu-A2免疫荧光染色及突触计数,进行突触计数耳数n=3Fig.7 Ctbp-2/Glu-A2 immunofluorescence staining and Synaptic count,n=3
2.4 琥珀酸脱氢酶染色
正常豚鼠毛细胞SDH染色均匀深染,噪声组基底膜染色可见着色变浅,片状无染色区并毛细胞肿胀,氢气组同样上述改变但明显轻于噪声组(图8)。
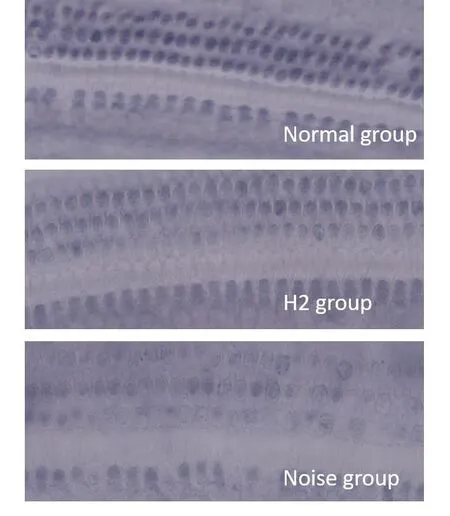
图8 琥珀酸脱氢酶染色Fig.8 Succinate dehydrogenase staining
2.5 透射电镜
本实验发现噪声组动物半结髓鞘层状结构显示不清,较正常组髓鞘内髓板结构欠规则,髓板间距不均匀、松散,且髓板出现囊泡状异常物质,而氢气组半结损伤明显轻于噪声组(图9)。
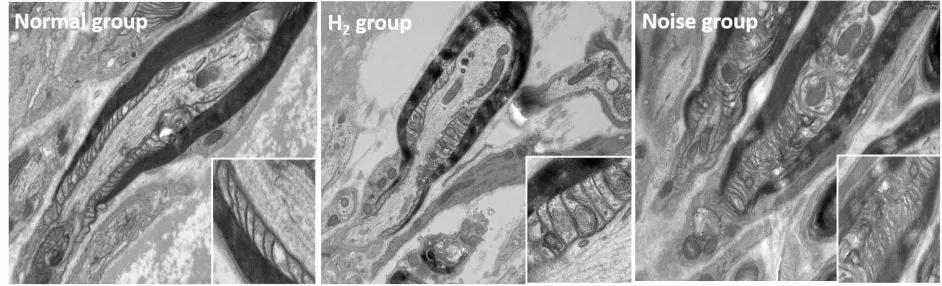
图9 半结透射电镜图Fig.9 Transmission electron micrograph of heminode
3 讨论
已有学者证实,氢气在动物模型中对NIHL具有极佳的防治意义[6],但氢气对脉冲噪声引起的NIHL是否同样具有优秀的防治效果及其防治持续时间尚不明确。相较于稳态噪声,脉冲噪声具有更高的机械能,可对内耳造成更严重的机械损伤与代谢损伤。
由于氢气特殊理化性质及内耳较少的组织量,尚无准确检测氢气治疗后内耳氢气含量方法,故无法有效测试其半衰期,为探索氢气预防NIHL有效时间,本实验通过对豚鼠施加步进式脉冲声并利用ABR测听建立动物模型,利用ABR测听对氢气有效防治时间进行评估,并为规定NIHL动物模型噪声损伤强度和氢气药效时间分别提出两个参数:1、半数致聋时间:本实验噪声条件下使得总耳数的半数ABR阈值≥90dB的时间;2、半数有效时间:本实验噪声条件下使得氢气组总耳数的半数听力阈值<90dB的时间。结果发现,噪声组在噪声暴露后2h,各频率ABR阈值≥90dB动物数量已超过50%,故认为该噪声模型半数致聋时间为2h;氢气组在噪声暴露4h时,只有Click频率ABR阈值<90dB动物数量超过50%,其余三个频率均少于50%,故认定该噪声模型下氢气的半数有效时间2-4h,在对噪声暴露期间ABR听阈数据进行曲线拟合及直线回归发现,各频率氢气组斜率均>噪声组,再次证实氢气干预可有效减缓噪声致聋进程,氢气预防组ABR阈值拟合曲线各频率在4h时斜率开始增加,提示氢气预防作用在4h后效果变差,与氢气预防半数有效时间结果一致。氢气作为小分子气体依浓度梯度由高浓度向低浓度扩散,易于透过内耳迷路屏障[7],利于氢气直接进入Corti器发挥防治作用,同时也造成了有效防治时间较短,连续吸入1000ppm浓度氢气的半数有效时间仅为2-4小,意味着氢气防治NIHL对氢气的持续吸入具有较高的依赖性,给药间隔时间可能较短,但其具体给药间隔时间尚需进一步设计实验进行验证。
Myosin-7a参与毛细胞纤毛形态发生和机械传导,在典型亚型特异性缺失的小鼠中,引发与人类1型Usher综合征相似的听力下降[8,9],Phalloidin常用于标记毛细胞纤毛进行细胞计数,Ctbp-2/Glu-A2分别位于带状突触前、后膜上,是确保听觉信号准确传递的重要结构,既往研究证实耳蜗神经元比毛细胞更容易受到损伤,低强度脉冲声即可在不引起毛细胞损伤情况下损伤带状突触[10,11],基于以上观点,本实验通过免疫荧光染色发现:脉冲噪声暴露后,Myosin-7a染色荧光强度下降,表明脉冲噪声可能对毛细胞骨架产生严重机械损伤,氢气组Myosin-7a染色荧光强度虽也有下降,但仍强于噪声组,提示氢气吸入可有效降低脉冲声引起的机械损伤,但仍需要后续进一步定量研究明确。通过对Ctbp-2/Glu-A2染色行突触计数发现,预防性应用氢气一定程度对脉冲噪声引起的带状突触损伤起到保护作用,但受限于实验方法及技术限制,氢气组、噪声组带状突触计数与正常对照间差异并未出现统计意义,后续仍需进一步验证;琥珀酸脱氢酶是存在于细胞线粒体内膜的一种氧化还原酶,杨卫平等发现噪声暴露后外毛细胞肿胀畸形、着色变浅,即脉冲声可导致外毛细胞线粒体功能受损,并认为这是由于脉冲噪声强大的机械性损伤和继发氧自由基堆积引起的代谢性损伤导致[12]。本实验通过SDH染色,证实氢气干预可有效保护噪声暴露后线粒体功能,进而可能减少线粒体氧自由基产生;文献证实,噪声暴露后半结结构持续不恢复是隐性听力损失重要机制[13],本实验发现噪声组动物半结髓鞘层状结构显示不清,较正常组髓鞘内髓板结构欠规则,且髓板出现囊泡状异常物质,氢气组半结损伤轻于噪声组,提示氢气干预可能对半结具有保护作用。
本实验通过建立动物模型及相关病理形态学学分析,证实氢气对脉冲声所致NIHL具有显著的预防作用,半数有效时间<4h,并可有效降低噪声对内耳毛细胞、半节的损伤作用,提示氢气对隐性听力损失同样具有预防意义。
