基于网络药理学的大黄治疗阿尔茨海默病作用机制研究
2021-02-01张运辉周小青伍大华杨梦琳郑彩杏童天昊
张运辉,周小青,伍大华,杨梦琳,郑彩杏,童天昊
1湖南中医药大学;22011数字中医药协同创新,长沙 410208;3重庆三峡医药高等专科学校中医学院,重庆 404120;4湖南省中医药研究院附属医院,长沙 410006
阿尔茨海默病(Alzheimer’s disease,AD)多发生于老年和老年前期,是一种以进行性记忆力丧失、认知功能下降、精神行为功能障碍为主要表现的神经系统退行性病变[1],是当今全球医学界研究的重点之一[2]。随着全球老龄化进程加快,AD患病数逐年增加,今后将以每20年递增1倍的速度增加,预计到2050年全世界AD患者将达1.315亿,严重威胁着老年人的健康与生命安全,同时给社会和家庭带来沉重的经济负担[3,4]。目前美国食品药品监督管理局(FDA)批准上市的抗AD药物主要是N-甲基-D-天门冬氨酸(NMDA)受体阻滞剂和乙酰胆碱酯酶(ACHE)抑制剂,但由于上述两类药物作用靶点广泛,虽可适度改善患者的症状,但仍不能根治、逆转AD的发展,且长期服用会引起严重的副作用[5]。目前,越来越多的学者关注中药及其活性成分抗AD效应,中医药具有整体性和多样性的特点,可发挥多成分、多层次、多环节、多靶点、双向调节的综合作用,且毒性明显小于化学药,与AD发病机制的复杂性和综合性的特征非常契合。
大黄始载于《神农本草经》,是蓼科植物药用大黄、唐古特大黄、掌叶大黄的干燥根和根茎,性寒,味苦,归脾、胃、大肠、肝、心经。具有泻下攻积、清热泻火、解毒、活血祛瘀之效。中医对AD的病机认识,认为“脑消髓减”为疾病基础,“痰瘀阻络”为标,近年更发展AD的“毒损脑络”的病机。Wang等[6]实验研究发现,(1)AD大鼠伴有肠源性内毒素,其脑组织及血浆中TNF-α、IL-lβ、IL-10含量明显高于对照组(P<0.05),说明可能肠源性内毒素参与了AD的病理反应过程,促成慢性炎症及氧化应激反应;(2)AD模型大鼠血脑屏障下降,通透性增高,使得正常情况下不能通过血脑屏障的内毒素进入脑内,引发局部炎症;研究结果提示肠源性内毒素在AD形成中有重要作用。大黄具有“以通为补”的作用,并能通腑降浊、活血祛瘀、清热解毒,有“荡涤肠胃”、“推陈致新”的作用,减少体内肠源性内毒素的集聚,能针对AD“脑消髓减、痰瘀阻络、毒损脑络”的病机,可以很好的运用于认知功能的改善。因此,深入探讨大黄的作用靶点,分析其可能抗AD的作用机制,对于阐述大黄的科学内涵具有重要作用。
网络药理学可研究药物、靶标和疾病之间的关系,可通过整合中药化学成分、疾病靶标构建“化学成分-作用靶标-疾病靶标-蛋白质相互作用网络[7]”,将相互作用关系可视化为网络模型,并从分子层面和整体的角度研究药物对生物网络的影响。本研究借助网络药理学方法,构建有效成分-靶标作用网络,结合体外细胞实验深入探讨大黄治疗AD的作用机制,为今后治疗AD中药研究提供方向和思路。
1 材料与方法
1.1 大黄有效成分及其靶点的筛选
以“Radix et Rhizoma Rhei”为关键词,从TCMSP数据库(中药系统药理学分析平台,http://lsp.nwu.edu.cn/tcmsp.php)查询大黄的有效成分,本研究基于ADME(药物吸收、分布、代谢、排泄)模型,运用OBioavail 1.1来预测有效成分的口服利用度(oral bioavailability,OB),对大黄的化学成分进行OB和类药性(drug likeness,DL)筛选,并设置OB≥30%及DL≥18%作为筛选条件[8]。最后,使用Uniprot数据库并借助Perl语言,将靶点的“蛋白名(protein name)”统一转换为“基因名(genename)”,得到的信息用于后续的网络药理学数据分析。
1.2 AD疾病相关基因检索
在Drugbank数据库(https//www.drugbank.ca/)、Dis Ge NET数据库(http//www.disgenet.org/)和TTD数据库(https//bidd.nus.edu.sg/group/cjttd/)中筛选治疗阿尔茨海默病的相关靶点,以“Alzheimer”为检索关键词,并对检索到的靶点进行处理,之后将三个数据库重复项去除从而获得最终的疾病靶点。
1.3 大黄有效成分与AD共同靶点筛选及PPI网络构建
将大黄有效成分的相关靶点和AD的靶点导入OmicShare平台(https://www.omicshare.com/)找出大黄有效成分与AD的交集靶点,再将这些交集靶点导入到STRING数据库,选择物种为“Homo sapiens”(人源)进行操作,最小相互作用阀值设为“medium confidence=0.4”,得到蛋白互作PPI网络,即“大黄-靶点-阿尔茨海默病”网络。
1.4 关键靶基因的筛选
应用Cytoscape 3.7.1软件对PPI网络进行拓扑属性分析,计算PPI网络整体的点度中心性(degree centrality,DC)、接近中心性(closeness centrality,CC)和中介中心性(betweenness centrality,BC)”,以betweenness、closeness和degree的均数为“阈值”,选取betweenness、closeness和degree同时在阈值之上的靶点为“关键靶基因”,明确PPI网络中的关键靶基因。
1.5 关键靶基因的代谢通路与生物过程分析
为进一步研究大黄抗AD的作用情况,采用Metascape平台对大黄的AD靶点群进行KEGG代谢通路富集分析,研究大黄靶点的主要抗AD代谢通路;再进行GO生物过程富集分析,诠释大黄靶点的抗AD生物过程,Metascape的平台列表与背景均选择“Homo Sapiens”(人源)进行操作。筛选出AD与大黄有效成分相关性前20的分子功能和前10的信号通路。
1.6 网络构建
将大黄有效成分、对应靶点导入Cytoscape 3.7.1构建大黄有效成分-基因靶点网络。
1.7 体外验证实验
1.7.1 细胞与试剂
大鼠肾上腺髓质嗜络细胞瘤细胞株PC12细胞(长沙赢润生物技术有限公司);Aβ25-35(美国Sigma公司);谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)和超氧化物歧化酶(SOD)试剂盒(均购自南京建成生物研究所);ELISA测定试剂盒、生化试剂(南京建成生物研究所);Annexin-V/PI凋亡检测试剂盒(晶美公司);PI3K、Akt、Nrf2、HO-1、NF-κBp65引物合成(由上海生工生物工程有限公司提供);TB Green Premix Ex Taq PCR试剂盒(TAKARA公司);总RNA抽提试剂(Trizol)(宝生物工程(大连)有限公司);DMEM细胞培养液(默飞世尔生物化学制品(北京)有限公司);10%新生小牛血清(Hyclone Lab);PBS(北京索莱宝科技有限公司);FBS(吉泰远成生物科技有限公司)。大黄,购自湖南中医药大学第一附属医院,经鉴定为蓼科植物大黄的干燥块根,取100 g经水提、蒸发、浓缩至不流动的清膏,使用时称取适量,溶解,过滤膜除菌后于-20 ℃保存。
1.7.2 细胞培养及分组干预
PC12细胞培养于DMEM培养基(含10% FBS、1% P/S),37 ℃、5% CO2培养箱培养,细胞贴壁后取对数生长期细胞,分为5组。对照组:加入不含 FBS、P/S的DMEM中孵育24 h;模型组:予Aβ25-35(20 μmol/L)孵育24 h[9];大黄低剂量组(1 mg/mL)、大黄中剂量组(2 mg/mL)、大黄高剂量组(4 mg/mL)孵育24 h。
1.7.3 MTT比色法检测细胞存活率
将5×MTT用稀释液稀释成1×MTT溶液;每孔加50 μL 1×MTT溶液,37 ℃孵育4 h;弃上清液,每个孔加入200 μLDMSO,在平板摇床上摇2~3分钟使其均匀。酶标仪在570 nm波长处检测每个孔PC12细胞的吸光度值。
根据公式计算PC12细胞的存活率:

100%
1.7.4 ELISA检测PC12细胞上清液IL-1β、IL-6和TNF-α含量
PC12细胞以1×107接种于96孔板中,100 μL/孔,当80%融合时,分别给予各组处理因素,每组3个复孔。按实验要求处理完成后,收集上清液留作待测标本。采用酶联免疫吸附测定进行检测,按照 ELISA测定试剂盒的说明进行操作。
1.7.5 比色法检测PC12细胞培养上清SOD、GSH-Px和MDA
冰上裂解细胞,离心,取上清,制成样品溶液,按谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)和超氧化物歧化酶(SOD)试剂盒说明书操作,检测各项指标。
1.7.6 流式细胞仪检测PC12细胞凋亡率
按凋亡检测试剂盒说明操作,培养的PC12细胞经不含乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰酶消化处理,冰上裂解、离心收集细胞,沉淀加入结合缓冲液后加入FITC-AnnexinV和PI,室内避光孵15 min后流式细胞仪检测10 000个细胞,用凋亡分析软件计算PC12细胞凋亡率,每一时相点重复检测5次。
1.7.7 荧光定量法检测PC12细胞上清PI3K、Akt、Nrf2、HO-1、NF-κB p65 mRNA表达
采用Trizol抽提各组总RNA,超微量核酸检测仪测定总RNA浓度,利用Ta Ka Ra试剂盒根据说明书逆转为cDNA,SYBR Premix Ex Taq II 10 μL、上下游引物各1μL、DNA模板2 μL、双蒸水6 μL,共20 μL,混合均匀,进行逆转录,将得到的c DNA产物根据试剂盒说明书配制如下反应体系:预变性95 ℃、30 s;PCR反应95 ℃、5 s,60 ℃、30 s,72 ℃、15 s,反应重复35个循环。以β-actin为内参,采用2-ΔΔCt法分析基因表达量。引物序列见表1。
1.7.8 统计学处理
实验数据以均数±标准差表示,采用SPSS 24.0软件做统计分析,组间差异比较用单因素方差分析统计,方差齐者用LSD检验(方差不齐者先将数据转换后使之方差齐),P<0.05有统计学意义。

表1 引物序列
2 结果
2.1 大黄有效成分的筛选
如表2所示,本研究共筛选出大黄中含有的17个有效成分(M1~M17)。

表2 大黄有效成分
2.2 有效成分-基因靶点网络的构建
将筛选后的17个有效成分及276个相关靶点导入 Cytoscape 3.7.1构建“大黄有效成分-基因靶点网络”(图1)。17个红色菱形表示大黄的活性成分,276个绿色三角形为活性成分作用靶点,共有1 211条边代表靶点和化学成分之间的相互作用, 体现了大黄多成分、多靶点的特点。

图1 大黄有效成分-基因靶点网络Fig.1 The gene target network of the effective components of Radix et Rhizoma Rhei注:红色菱形:大黄活性成分;绿色三角形:靶基因。Note:Red diamond:Active components of Radix et Rhizoma Rhei;Green triangle:Target gene.
2.3 阿尔茨海默病相关基因
在Drugbank、Dis Ge NET和TTD数据库检索AD的靶基因,共得到2 245个基因。
2.4 蛋白互作网络构建图
在Drugbank、Dis Ge NET和TTD数据库检索AD的靶基因与大黄作用的靶基因有107个重复,这107个靶基因可能为大黄抗阿尔茨海默病的靶点。为研究各靶点在体内的相互作用关系,寻找核靶点,将潜在靶点蛋白群进行PPI网络分析(见图2),结果共发现107个靶蛋白发生相互作用,产生786条代表蛋白之间相互作用的边。
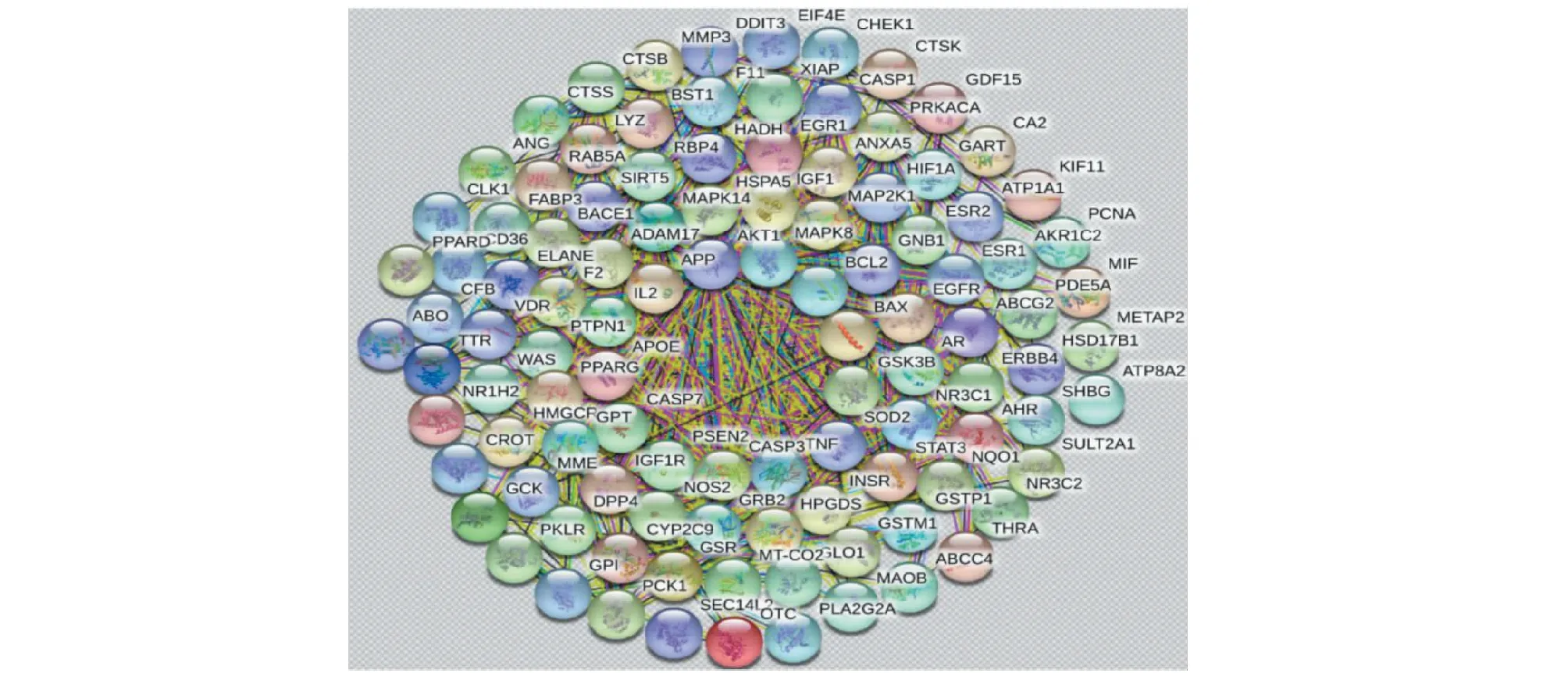
图2 靶蛋白 PPI 网络图Fig.2 PPI network diagram of target protein
2.5 核心靶点分析结果
Cytoscape 3.7.1计算得到,PPI网络平均度值为14.32,平均介数为3.72×10-2,平均紧密度为0.67,度值、介数和紧密度均超过平均值的靶蛋白共8个,依次为APP、TNF、SOD2、CASP3、CASP7、BAX、Bcl-2、IL2,说明以上8个靶点在PPI网络中处于关键位置,很可能是大黄抗AD的关键靶点。
2.6 Metascape分析的KEGG和GO结果
通过GO数据库分析,大黄有效成分靶标与AD疾病靶标基因功能有炎症反应、氧化应激反应、炎症反应的负调节、MAPK活性的正调控、老化、记忆、调亡过程、神经元凋亡过程的正调控、信号转导、cAMP生物合成过程、调节活性氧代谢过程、细胞内受体信号通路、缺氧反应等条目(见图3),说明大黄治疗AD的机制可能与炎症反应、细胞凋亡、氧化应激反应、细胞内受体信号通路、cAMP生物合成过程等密切相关。

图3 有效组分-基因靶点-分子功能的GO富集气泡图Fig.3 Bubble chart of GO enrichment of effective components-gene targets-molecular functions
通过KEGG数据库富集大黄治疗AD关键靶标所参与的通路主要涉及PI3K-Akt信号通路、Nrf2/HO-1信号通路、NF-κB信号通路、MAPK信号通路、IL-17信号通路、TNF信号通路、mTOR信号通路、TLR4信号通路、Wnt信号通路、阿尔茨海默病等(见图4),说明大黄可能主要通过调控炎症反应、细胞凋亡、氧化应激反应来防治AD。

图4 前10个代表性的通路Fig.4 Top 10 representative pathways
2.7 MTT法检测各组PC12细胞的细胞存活率比较
采用MTT法检测各组细胞存活率,统计分析结果如表3所示:与对照组比较,模型组的PC12细胞的存活率明显减低,有显著性差异(P<0.01);与模型组相比,随着大黄浓度增加,PC12细胞存活率显著上升(P<0.05,P<0.01),表明大黄对PC12细胞具有明显保护作用。

表3 各组细胞存活率的比较
2.8 ELISA检测PC12细胞上清液IL-1β、IL-6和TNF-α含量
结果见表4,大黄作用PC12细胞24 h后,与对照组比较模型组PC12细胞IL-6、IL-1β和TNF-α含量均显著升高(P<0.01);与模型组比较,大黄中、高剂量组的PC12细胞IL-6、IL-1β和TNF-α含量均显著降低(P<0.05,P<0.01),表明大黄对PC12细胞的炎症反应具有明显的抑制作用。

表4 各组PC12细胞上清液中IL-1β、 IL-6和TNF-ɑ 含量比较
2.9 各组PC12细胞培养上清SOD、GSH-Px和MDA比较
结果见表5,与对照组比较,模型组SOD、GSH-Px活力下降,MDA含量增高(P<0.01)。与模型组比较,大黄各组SOD、GSH-Px活力均明显升高,MDA含量减少(P< 0.05,P< 0.01),表明大黄对PC12细胞的氧化应激反应具有明显的抑制作用。

表5 各组PC12细胞上清液中SOD、GSH-Px和MDA比较
2.10 流式细胞仪检测各组PC12细胞的凋亡率比较
结果见表6,正常PC12细胞也有一定比例的凋亡率,与对照组比较,模型组PC12细胞凋亡率明显升高(P<0.01);与模型组比较,随着大黄浓度增加,PC12细胞凋亡率显著降低(P<0.05,P<0.01),表明大黄对PC12细胞的凋亡具有明显的抑制作用。

表6 各组PC12细胞凋亡率的比较
2.11 各组PC12细胞上清液PI3K、Akt、Nrf2、HO-1、NF-κB p65 mRNA的表达
结果见表7,与对照组比较,模型组细胞NF-κB p65 mRNA表达水平显著升高(P<0.01),PI3K、Akt、Nrf2、HO-1mRNA表达水平显著降低(P<0.05)。与模型组比较,大黄各组能够显著降低NF-κB p65 mRNA表达水平(P<0.05,P<0.01),显著提高PI3K、Akt、Nrf2、HO-1 mRNA表达水平(P<0.05,P<0.01)。说明大黄能够明显抑制NF-κB p65基因的表达,促进PI3K、Akt、Nrf2、HO-1基因的表达。

表7 各组PC12细胞PI3K、Akt、Nrf2、HO-1、NF-κB p65 mRNA表达比较
3 讨论与结论
AD是老年痴呆中最常见的一种类型,是神经系统至今仍未解决的重大难题,目前仍缺乏有效的治疗方法。随着全球人口老龄化进程加快,发病率呈逐年上升趋势,对老年人健康和生活质量造成巨大威胁,并给全世界带来沉重的经济负担。Su等[10]研究发现,“毒损脑络”己经成为AD发生发展的关键,贯穿于整个AD的病理演变过程。大黄始载于《神农本草经》,归脾、胃、大肠、肝、心经。具有泻下攻积、清热泻火、解毒、活血祛瘀之功。Tian[11]认为大黄有以通为补的功效,促进胃肠系统降浊受纳,并认为“浊”是肠道内毒素,可能损伤机体,大黄能够促进补益药物的补益作用,更好的发挥“补肾填精”的作用,而且大黄具有活血化瘀的功效,能消痰浊瘀血通络,能通腑降浊,解火热毒邪,对应中医“脑消髓减、痰瘀阻络、毒损脑络”的AD病机。
本研究通过TCMSP平台的OB和DL筛选,共筛选出大黄17个有效成分,涉及107个AD 靶点及相关信号通路162个。网络分析结果表明大黄可能通过作用于APP、TNF、SOD2、CASP3、CASP7、BAX、Bcl-2等关键靶点。
在本研究筛选出的信号通路中,与大黄有效靶点的关联度最高的是PI3K-Akt信号通路,其次是Nrf2/HO-1信号通路和NF-κB信号通路。PI3K/Akt通路是一条经典且重要的信号途径,参与了包括细胞增殖、细胞调亡、炎症反应等重要的细胞活动。许多研究发现,神经元的氧化损伤是AD发病极早期的重要病理事件,AD患者脑内PI3K/Akt 通路抑制,并且促进细胞凋亡[12,13],而激活PI3K/Akt信号通路可抑制细胞凋亡和氧化应激反应[14,15]。Qi等[16]研究发现,激活PI3K/Akt 信号途径可降低AD模型小鼠tau蛋白磷酸化水平,提高其学习记忆能力。Nrf2/HO-1信号通路是调控AD过程中炎症反应和氧化应激的重要信号通路,Nrf2/HO-1信号通路的激活可以显著增加大脑皮质和海马组织的抗炎和抗氧化应激反应能力,抑制神经元凋亡,发挥神经保护作用[17-20]。近年来关于PI3K/Akt信号通路的多项研究发现其信号通路途径与HO-1的表达存在密切关系,PI3K/Akt信号通路的激活能明显促进Nrf2、HO-1基因表达上调,激活Nrf2/HO-1信号通路,从而发挥抑制细胞凋亡、氧化应激反应和炎症反应的作用[21-24]。NF-κB信号通路不仅参与学习记忆、机体免疫、神经元可塑性调节,还参与神经系统中多种基因的调控、细胞凋亡的信号传导过程[25,26],在一定程度上影响AD的发生和发展。近年来研究发现Nrf2/HO-1与NF-κB介导的炎症反应关系密切,Nrf2和NF-κB在保持细胞氧化还原平衡及对抗氧化应激和炎症反应中是两条关键的信号通路,两条信号通路借由一序列复杂的分子间作用互相影响[27]。NF-κB与Nrf2负性相关,Nrf2的增多会致使NF-κB表达下调,从而拮抗炎症反应。
为了验证网络药理学的分析结果,本研究选择了大黄对Aβ25-35诱导的PC12细胞的细胞存活率、凋亡率、炎症反应、氧化应激反应、PI3K/Akt/Nrf2/HO-1信号通路及NF-κB信号通路的调控作用进行了实验验证。验证结果表明大黄能有效抑制Aβ25-35诱导的PC12细胞的炎症反应、氧化应激反应、细胞凋亡和提高其细胞存活率,上调PI3K、Akt、Nrf2、HO-1基因,下调NF-κB基因。
综上,大黄具有多成分、多靶点协同治疗阿尔茨海默病的作用。本文基于系统药理学研究大黄对阿尔茨海默病的具体作用靶点及机制,对今后临床运用大黄治疗阿尔茨海默病具有重要指导意义。
