产电细胞的合成生物学设计构建
2021-01-30赵贞尧张保财李锋宋浩
赵贞尧,张保财,李锋,宋浩
(1 天津大学化工学院,天津300072; 2 天津大学合成生物学前沿科学中心和系统生物工程教育部重点实验室,天津300072)
引 言
随着国民经济的飞速发展,能源短缺和环境污染已成为我国工业现代化进程中的两大难题,开发绿色环保可再生新能源的需求迫在眉睫。以电活性微生物为核心的生物电催化系统,特别是产电微生物构成的微生物燃料电池(microbial fuel cell,MFC)是潜在解决方案。MFC 借助产电微生物抽提、转化蕴藏在有机物中的电子,并与外界环境中的电子受体(电极、金属氧化物等)进行电子交换,实现化学能与电能间的能量转化,在能源环境等诸多领域有着广泛的应用[1-4]。
产电微生物在生态系统中分布广泛,目前已经发现包括细菌、真菌和古菌在内的产电微生物有上百种,并且随着筛菌技术的发展,越来越多的产电微生物被发现[5-6]。当前,希瓦氏菌(Shewanella)和地杆菌(Geobacter)作为模式产电菌,研究最为广泛[7]。而自然环境中野生型产电微生物存在可利用底物谱窄、底物摄取代谢强度弱,胞内电子池容量小、胞内还原力再生效率差,胞外电子传递速率慢、电子通量小,且其所构成的微生物电催化系统稳定性差,难以适应复杂的环境等问题,这已成为限制其工业化应用的主要瓶颈[8]。
近年来,随着研究的不断深入,从基因分子水平理解产电微生物的代谢生理、电生理机制已成为现实。同时伴随着合成生物学、基因编辑技术的迅猛发展,以及从头设计合成、多模块组合适配等工程化策略的引入,产电微生物的能量转化效率得到大幅提升。本文基于产电微生物介导化学能到电能的能量转化路径,以模式产电菌Shewanella 和Geobacter 为主体,总结阐明了产电微生物的电子胞内生成过程与胞外传递机制。系统综述了近五年国内外利用合成生物学增强产电微生物底物摄取利用、强化胞内电子生成、加速胞外电子传递方面的研究进展(图1),并对未来设计构建高效产电细胞的研究进行了展望。
1 产电微生物的胞内电子生成与胞外电子传递机制
1.1 产电微生物的胞内电子生成
产电微生物作为微生物燃料电池系统的催化核心,通常以环境中的有机物(如甲酸、乙酸、乳酸、葡萄糖等)作为电子供体。有机底物经过产电微生物的中心碳代谢,将电子传递给胞内NAD+、FAD 形成胞内还原力NADH、FADH2,或存储在丙酮酸、甲酸等中间代谢物中,这些胞内还原力和富含电子的中间代谢物共同构成了产电微生物的胞内可释放电子池。随后,在NADH 脱氢酶、丙酮酸脱氢酶、甲酸脱氢酶等酶催化下,胞内电子载体携带的电子汇入位于细胞内膜的醌池中,位于醌池中的电子经过甲基萘醌脱氢酶释放,实现电子的胞内生成,并最终通过胞外电子传递系统传递到胞外电子受体[9-11]。
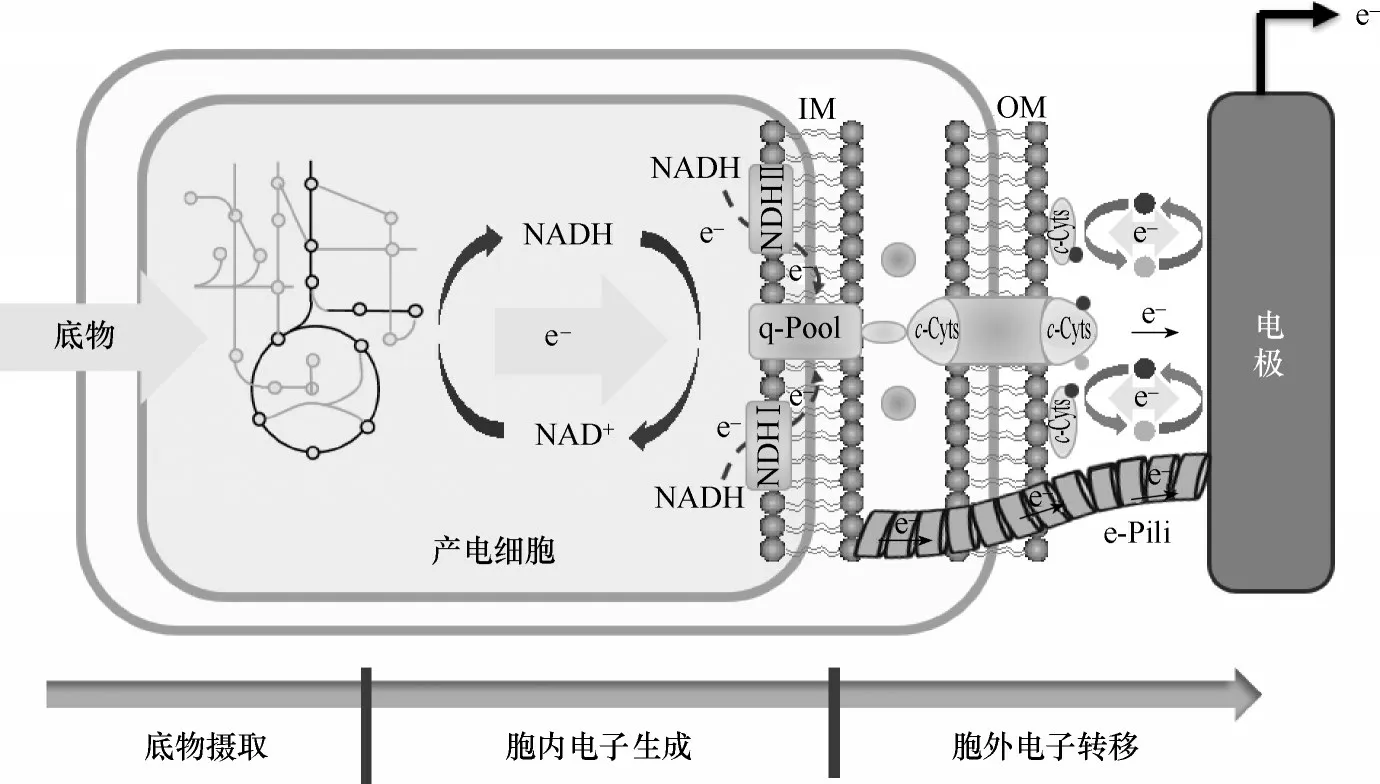
图1 产电细胞电子生成和传递Fig.1 Electron generation and transfer of exoelectrogens
NADH 是产电微生物胞内主要的电子存在形式,负载了绝大部分来自底物的电子,在NADH 脱氢酶的催化下,电子实现从NADH 到内膜醌池的汇集转化。因此,产电微生物NADH 脱氢酶催化的效率直接影响了产电微生物胞内电子的生成效率。目前共发现三类NADH 脱氢酶[9,12]:①Na+跨膜移位的 NADH 脱 氢 酶(Na+-translocating NADH dehydrogenase,NQR),在NQR 催化的NADH 氧化过程中,伴随Na+的跨膜运输,产生膜两侧的离子梯度势,从而对酶催化反应产生反馈抑制作用[13]。②H+跨膜移位的Ⅰ型NADH 脱氢酶(H+-pumping type ⅠNADH dehydrogenase, NDH Ⅰ),NDH Ⅰ催化的NADH 氧化,伴随着H+的跨膜运输,从而产生膜两侧的质子动力势。一方面,膜两侧的质子动力势驱动了ATP合酶加速合成ATP;另一方面,较大的质子动力势又反馈抑制了NDH Ⅰ催化的NADH 氧化反应,不利于电子从NADH 到内膜醌池的传递。③无质子跨膜的Ⅱ型NADH 脱氢酶(non-protonpumping type ⅡNADH dehydrogenase, NDH Ⅱ),由于NDH Ⅱ催化过程中不存在H+的跨膜转运,这使得NADH 的氧化反应不受高离子梯度势或质子动力势的反馈抑制,另外NDH Ⅱ仅由一条肽链组成,蛋白分子大小仅为上两类脱氢酶的1/10,极大降低了细胞的生理、代谢负荷。在大多数产电微生物中,三类NADH 脱氢酶均有分布,共同催化电子从NADH到内膜醌池的转化。
1.2 产电微生物的胞外电子传递
通常认为电子从细胞(内)膜到胞外电子受体(电极、金属氧化物等)的传递过程为产电细胞的胞外电子传递(extracellular electron transfer, EET)[5]。来自醌池的电子通过细胞表面导电元件,跨越绝缘的细胞外结构(细胞膜、细胞壁),通过直接或间接的方式传递到胞外电子受体。目前,两种胞外电子传递机制得到广泛认可。
(1)基于细胞色素蛋白或导电纳米线介导的直接电子传递:c 型细胞色素蛋白是产电微生物表面的主要导电元件,在绝大部分产电微生物中均有分布。这些色素蛋白中含有多个血红素,利用铁原子氧化态与还原态之间的可逆反应介导电子传递。目前已发现数百种色素蛋白,但对其分子机制的研究主要集中在模式产电菌奥达奈希瓦氏菌(Shewanella oneidensis)的金属还原途径(MtrCAB)和硫还原地杆菌(Geobacter sulfurreducens)的Pcc 途径[14]。在MtrCAB 途径中,位于细胞内膜的甲萘酚脱氢酶CymA 将汇入醌池的电子传递到周质色素蛋白FccA、STC 等,随后通过外膜MtrCAB 色素蛋白多聚体传递到胞外[15]。最新研究显示,外膜MtrCAB 色素蛋白多聚体由周质色素蛋白MtrA、跨膜孔蛋白MtrB和外膜色素蛋白MtrC组成。MtrA、MtrC是含有多个血红素的c 型色素蛋白,MtrB 是细胞外膜上由26 股反向平行的β 链组成的疏水性桶状孔蛋白,连接了外膜两侧的色素蛋白,将嵌入内侧的含有血红素的MtrA 与外环境隔离,形成自然绝缘的“分子电线”可有效防止氧气等外源分子掠夺膜内电子[16]。G.sulfurreducens 的Pcc 路径与MtrCAB 相似,包含了内膜色素ImcH 和CbcL、周质空间色素PpcA-E 以及外膜色素蛋白OmaB、OmaC、OmcB 及OmcC 等[17-21]。不同的是,Geobacter的色素蛋白更丰富,并含有多个同源物,这使其具有多条“膜电子通道”,因此,G.sulfurreducens相比S.oneidensis具有更大的跨膜电子通量。
除了细胞色素蛋白,产电微生物还可以利用细胞表面长达数十微米的菌毛,即“导电纳米线(e-Pili)”介导电子的远距离传导[22-25]。当前,对产电微生物“导电纳米线”介导胞外电子传递的研究主要集中在G.sulfurreducens 的IV 导电菌毛Pili 上,e-Pili由菌毛蛋白PilA 单体组装而成,富含芳香氨基酸[26-29]。目前关于电子在e-Pili 中的传递机制仍有争论。Malvankar 等[30]认为e-Pili 芳香氨基酸残基的π-π 键轨道相互重叠,电子在电子云中自由穿梭,以离域的形式沿着菌毛传递;而另一种观点认为电子并非以自由穿梭的形式沿e-Pili 传递,而是借助e-Pili 中的芳香氨基酸或色素蛋白(OmcS 等),以电子跳跃的形式传递[31]。
(2)基于可溶性氧化还原活性分子介导的间接电子传递:除上述基于细胞色素蛋白或导电纳米线介导的直接电子传递外,产电微生物还可利用自身分泌的或环境中存在的可溶性氧化还原活性分子(黄素类[32-33]、吩嗪类[34]、醌类[35-36])以及细胞代谢中间物(甲酸、氢气)间接介导电子传递。目前,针对可溶性氧化还原活性分子介导产电微生物间接电子传递机制的研究,主要集中在黄素类化合物介导S. oneidensis 间接电子传递上。最初认为这些氧化还原活性分子,以游离形式穿梭于产电菌和电子受体之间,通过“双电子氧化还原反应”介导产电微生物的电子传递[33]。但近期研究发现,一些小分子化合物(如黄素类物质)还可以作为外膜色素蛋白的辅因子,与外膜导电色素蛋白结合在一起形成半醌等物质,以“单电子氧化还原反应”方式加快基于导电色素蛋白的单电子传递过程,其电子传递速率是色素蛋白直接接触导电速 率 的103~105倍[37-40]。Breuer 等[41-42]进 一 步 研 究了Shewanella 外膜色素蛋白与黄素类化合物的作用关系,发现色素蛋白与黄素的结合是一个可逆过程,色素蛋白中高保守CX8C 模体中的半胱氨酸巯基氧化形成的二硫键是调控黄素分子与色素蛋白绑定结合的核心部位,这一核心区域受到外界环境的直接影响。在厌氧环境中,二硫键处于还原状态,加速黄素分子与色素蛋白的结合,进而形成单电子介导机制;而在有氧条件下,氧化态的二硫键不利于黄素分子与色素蛋白结合,导致黄素分子-色素蛋白复合物分离,黄素类分子以双电子机制介导电子传递。此外,部分产电微生物还可通过分泌c-型色素蛋白,并以其作为电子传递载体介导间接电子传递[41-42],如Geobacter 可通过分泌色素蛋白pgcA,在缺少导电纳米线情况下还原不溶性铁氧化物,但这些分泌型色素蛋白类电子传递载体往往具有电子受体特异性,只能将电子传递到金属氧化物等特定电子受体中[43]。
2 产电微生物能量转化效率的合成生物学强化
2.1 产电微生物底物摄取范围与摄取速率的合成生物学强化
自然环境中野生型产电微生物受限于底物转运蛋白和胞内相关代谢酶缺乏,致使底物摄取范围窄、代谢速率缓慢,严重限制了产电微生物的电子生成和传递效率[44-45]。近年来,研究人员分别采用自适应性进化策略和合成生物学理性设计方法,拓宽了产电微生物的底物摄取范围,提高了底物摄取速率,同时按照“劳力分工”原则构建了混合产电微生物菌群,进一步提高了以产电微生物为核心的微生物燃料电池的能量转化效率。
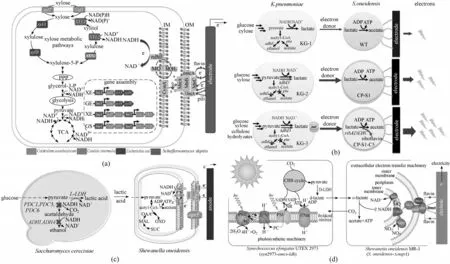
图2 产电菌的底物摄取范围拓宽(a)构建代谢木糖产电的工程希瓦氏菌[47];(b)构建希瓦氏菌-肺炎克雷伯氏菌合成菌群产电[55];(c)构建酿酒酵母菌-希瓦氏菌合成菌群产电[56];(d)构建蓝藻-希瓦氏菌合成菌群产电[57]Fig.2 Extension of substrate scope of electrogenic bacteria(a)construction of S.oneidensis for metabolizing xylose[47];(b)synthetic Klebsiella pneumoniae-Shewanella oneidensis consortium for power generation[55];(c)synthetic S.cerevisiae-S.oneidensis consortium for power generation[56];(d)synthetic S.cyanobacteria-S.oneidensis consortium for power generation[57]
2.1.1 拓宽底物摄取范围 以模式产电菌Shewanella 为代表的产电微生物可利用底物谱窄,仅可以利用甲酸、乳酸等有机酸作为电子供体产电。为增强产电微生物对葡萄糖、木糖、甘油等廉价、易得、分布广泛底物的利用效率,Sekar 等[46]采用适应性进化和定向筛选策略,激活了Shewanella MR-1 的木糖代谢途径,使之能够代谢木糖生长。相比于适应性进化,合成生物学理性设计在拓宽底物谱的同时提高了底物的摄取速率。Li等[47]将假丝酵母(Candida intermedia)和丙酮丁醇梭杆菌(Clostridium acetobutylicum)的木糖转运蛋白,大肠杆菌(Escherichia coli)的异构酶途径以及裂殖酵母(Schefersomyces stipites)的氧化还原酶途径在S.oneidensis MR-1 中异源表达,构建了木糖摄取代谢路径,使其可以将木糖作为电子供体放电,进一步提高了产电微生物的底物利用效率[图2(a)]。
葡萄糖作为最常见的工业发酵底物,单摩尔电子含量要远高于乳酸。通过对Shewanella 的基因序列比对分析发现,其自身具有代谢葡萄糖的Entner-Doudoroff 途径,这表明Shewanella 具有利用葡萄糖产电的潜力。针对这一现象,Howard 等[48]在仅含有葡萄糖的最小培养基中筛选了具备代谢葡萄糖能力的Shewanella,这证明Shewanella 的确具有利用葡萄糖为单一碳源的能力。此外,Choi 等[49]将运动发酵单胞菌(Zymomonas mobilis)的葡萄糖转运基因(glf)和葡萄糖激酶基因(glk)在S. oneidensis MR-1中进行异源表达,经过改造后的S. oneidensis MR-1能够利用葡萄糖作为单一碳源生长,同时也可以葡萄糖作为电子供体。因此,通过适应性进化策略与合成生物学理性设计方法可不断拓宽产电微生物可用底物谱,对扩展产电微生物的应用范围具有重要意义。
2.1.2 强化底物转化速率 在拓宽产电微生物的底物利用谱范围的同时,提高产电细胞的底物摄取速率可进一步强化产电微生物的代谢速率与代谢通量,从而增强产电微生物电子的胞内生成。为此,Johnson 等[50]在S.oneidensis MR-1 中表达了光驱动质子泵视紫红质,光照条件下,质子泵视紫红质将质子逆浓度梯度跨膜转运,从而在细胞膜两侧产生更大的质子动力势,提高了底物乳酸的摄取速率,最终增强了S.oneidensi 的电子传递速率。除了通过合成生物学理性改造产电微生物外,通过人工干预改变产电微生物的电化学环境或外源添加化学物质改变细胞膜通透性也可以提高底物转化速率,Matsuda 等[51]证明Shewanella 中TCA 循环活性受到电化学的精确门控,这使得改变阳极电位以提速Shewanella 的物质代谢速率成为可能。Wang 等[52]发现向微生物燃料电池中添加乙二胺四乙酸(EDTA),可显著提高微生物燃料电池的功率密度,进一步研究发现,EDTA 不仅能够改善S. oneidensis MR-1 的外膜通道环境,还能上调S.oneidensi 的TCA 循环相关基因的表达水平,进一步增强了其TCA 循环的代谢强度,从而拉动、提升了底物摄取与转化速率。此外,Wen 等[53]用表面活性剂鼠李糖脂处理细胞,发现鼠李糖脂能够显著加强产电菌自身酶活从而促进菌体生长,同时降低细胞膜的电子传递阻力,提升了电子传递速率。通过增强细胞边界膜结构的通透性,可显著提高底物的摄取、代谢速率,降低电子传递的阻力。
2.1.3 构建混菌生态系统 针对单种产电微生物的底物改造往往会增加产电菌的代谢负荷,难以大幅提高产电菌的电子传递速率与能量转化效率。通过构建人工混菌系统,调配多菌间相互作用,实现菌株间代谢耦合适配,增强混菌产电体系利用廉价工业发酵底物和复杂混合物系统的产电能力,从而彻底解除Shewanella、Geobacter 等模式产电菌的底物限制。Li 等[54-55]构建了肺炎克雷伯氏菌(Klebsiella pneumoniae)和S. oneidensis MR-1 的两菌混菌产电体系,K.pneumoniae以葡萄糖、木糖或甘油作为底物高产乳酸供给S.oneidensis 产电,该系统可通过降解玉米秸秆水解液高效产电,实现农牧废物向清洁电能的转化[图2(b)];Lin 等[56]以葡萄糖作为底物,将酿酒酵母(Saccharomyces cerevisiae)和S.oneidensis MR-1 混合培养,通过合成生物学改造强化了S. cerevisiae 的乳酸生产能力,并增强S.oneidensis MR-1细胞膜通透性、导电性,使得混菌产电系统的功率密度大幅提升[图2(c)];Zhu 等[57]构建了新型的微生物光伏系统,光合蓝细菌(Synechococcus elongatus)在光照下将二氧化碳转化为乳酸供给S.oneidensis MR-1 产电,通过培养过程优化使得产电系统可以持续工作超过40 d[图2(d)]。因此,建立代谢耦合的人工菌群产电系统能够显著强化MFC 的底物摄取范围以及摄取能力,实现复杂底物向电能的转化。
2.2 产电微生物胞内电子生成的合成生物学强化
野生型产电微生物往往面临胞内电子池容量小,胞内还原力再生速率差以及胞内还原力-电子转化效率低等问题,这严重限制了产电细胞的电子输出通量和胞外电子传递速率。为此,研究人员利用合成生物学理性设计方法和多模块组合工程策略,强化胞内还原力再生,提高了胞内NADH/NAD+比例和总量。使得胞内可释放电子池得到拓宽,加快胞内还原力到可释放电子的转化,强化了产电微生物的胞内电子生成。
2.2.1 强化胞内还原力再生 胞内还原力再生水平与可释放电子池容量(NADH/NAD+比例及总量)直接决定了产电细胞的可释放电子水平。通过加快中心碳代谢、抑制胞内还原力消耗路径(如乳酸合成代谢)、过表达NAD+合成酶基因等手段可显著提高产电微生物的胞内电子池容量。在厌氧条件下,微生物通过合成富含电子的中间产物(如丙酮酸等)以维持自身胞内氧化还原平衡。然而,这使得胞内电子发生流失,为此,Yong 等[58]在E.coli中通过敲除乳酸脱氢酶基因ldhA,在厌氧条件下抑制了丙酮酸向乳酸的转化,从而提升胞内NADH/NAD+的比例和总量,提高了细胞与电极之间的电子传递速率[图3(a)]。在厌氧条件下,微生物中心碳代谢受到多重调控系统的严密调控,导致TCA 循环强度下降,源自电子供体的电子大多储存在乙醇、甲酸、乙酸等中间代谢物中,难以释放到胞外。针对这一问题,Liu等[59]通过敲除E.coli双组分调控系统Arc中的arcA 基因,提高了TCA 循环的代谢强度,增强了厌氧条件下E.coli 呼吸能力,最终提升其电催化效率和电流输出能力[图3(b)]。
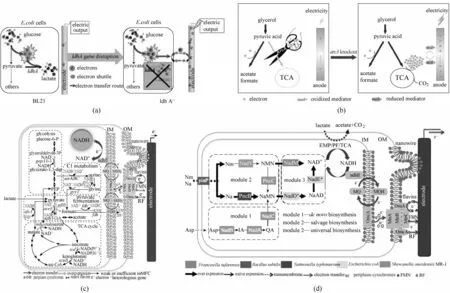
图3 产电菌胞内电子生成和传递的强化(a)敲除ldhA以扩充大肠杆菌可释放电子池[58];(b)敲除arcA以扩充大肠杆菌可释放电子池[59];(c)模块化强化NADH再生路径以强化希瓦氏菌胞内还原力再生[60];(d)改造希瓦氏菌从头合成NAD+以强化希瓦氏菌胞内还原力再生[61]Fig.3 Generation and transform of intracellular electronics in electrogenic bacteria(a)knockdown ldhA in E.coli for augmenting intracellular electron pool[58];(b)knockdown arcA in E.coli for augmenting intracellular electron pool[59];(c)modular engineering regeneration pathway of NADH in S.oneidensis for intracellular reducing power regeneration[60];(d)engineering de novo biosynthesis of NAD(H/+)in S.oneidensis for intracellular reducing power regeneration[61]
相比于E.coli,Shewanella 作为模式产电微生物更具备电子池扩容潜力。近年来,通过从头设计合成、多模块组合工程策略强化,研究人员拓宽Shewanella 的胞内还原力再生与可释放电子池,显著提高了微生物燃料电池的输出功率。Li等[60]利用合成生物学模块化策略和代谢工程方法,对S.oneidensis MR-1中心碳代谢中所有氧化还原路径进行了系统分析。从糖酵解路径、C1 代谢路径、丙酮酸发酵代谢路径和TCA 循环四个模块中挖掘到4个显著增强NADH 再生的基因并进行模块化组合表达,将NADH/NAD+比例提高4.3倍,使得代谢流更多地流向NADH 再生方向,强化了胞内还原力再生[图3(c)]。此外,Li 等[61]重构了S. oneidensis MR-1 内的NAD+的生物合成路径,通过合成生物学模块化手段解耦、组合NAD+从头合成途径、补救合成途径和通用合成路径,成功将胞内NAD(H/+)总量提高2.1倍,并将其胞外电子传递速率提升4.4 倍,揭示了产电微生物的胞内还原力NAD(H/+)总量是限制其胞外电子传递速率的核心瓶颈之一[图3(d)]。
2.2.2 提高胞内还原力-电子转化效率 储存在胞内NADH 中的电子在NADH 脱氢酶的作用下,汇入醌池,实现胞内还原力到电子的转化。针对野生型产电微生物NADH 脱氢酶催化效率低限制胞内还原力-电子转化效率这一瓶颈问题,通过设计优化NADH 脱氢酶,可以显著增强NADH 的电子释放,增强产电微生物胞内还原力-电子的转化效率。Vamshi 等[62]在E.coli 中异源表达来自枯草芽孢杆菌(Bacillus subtilis)的NAD Ⅱ,工程改造后的E.coli 电流输出能力提升了9 倍,同时促进了电极表面生物膜的形成,极大降低了其电荷转移阻力。另外,Shewanella loihica PV-4 中的NAD II 具有较强的催化活性,在模式产电菌S.oneidensis MR-1 中异源表达源自Shewanella loihica PV-4 的NAD Ⅱ,极大地强化了S.oneidensis MR-1 的还原力-电子的转化速率[63]。因此,通过优化改造NADH 脱氢酶,促进胞内还原力到电子的转化,可以加快胞内电子汇入内膜醌池,从而扩充内膜电子通量。
2.3 产电微生物的胞外电子传递的合成生物学强化
产电微生物胞外电子传递速率低是限制微生物电催化系统工业化广泛应用的重要瓶颈[64],针对这一关键科学问题,近年来,研究人员基于产电微生物直接电子传递和间接电子传递机制,将合成生物学理性设计与多模块组合适配工程策略融入设计中。通过优化产电微生物色素蛋白系统、强化导电纳米线介导的远距离电子传递、构建电活性生物膜以及强化电子传递载体的合成传递,显著提高了产电微生物的胞外电子传递速率。
2.3.1 优化细胞色素蛋白系统 细胞色素蛋白是电子跨越绝缘细胞膜的高速通道,连接了胞内电子生成系统与胞外电子传递系统,同时也是直接电子传递和间接电子传递两种电子传递机制的交汇点[14]。设计、优化产电微生物的细胞色素蛋白系统对提高其胞外电子传递速率具有重要意义。Ajo-Franklin等[65-68]在非电活性微生物E.coli中从头设计构建了导电色素蛋白系统,他们将S.oneidensis MR-1 的CymA、MtrCAB 关键导电色素蛋白引入E. coli,在E.coli 建立了一套新的电子传递通道,最终显著提高了E.coli对金属离子和金属氧化物的还原速率[图4(a)];此外,Sekar等[69]将Geobacter 的外膜色素蛋白OmcS 引入蓝藻(Synechococcus elongatus PCC 7942),外膜色素蛋白的引入显著地提升了S.elongatus 的胞外电子传递速率,使得生物光电池的光电子生成能力提升了9倍。
相较于非电活性微生物,电活性微生物本源的色素蛋白系统需要进一步理性设计和工程改造。通过完善周质电子传递链、消除周质空间耗电子反应、提升外膜导电蛋白数量等策略改善基于色素蛋白系统的电子传递速率。位于S.oneidensis MR-1细胞内膜的CymA 是连接醌池和外膜氧化还原蛋白(MtrA、OmcA 和OmcB)之间的重要电子传递通道,Vellingiri 等[70]通过过表达S. oneidensis MR-1 中的cymA 基因强化了微生物燃料电池的产电性能[图4(b)];Delgado 等[71]认为S.oneidensis 周质空间杂乱的电子传递环境可能导致部分电子无法传递到MtrABC复合物,从而不能最大化胞内电子输出。随后,他们为了消除部分周质空间电子竞争并提升电子向外传递速率,将部分起到电子争夺作用的基因替换为血红素合成基因cctA,将S. oneidensis 的cctA表达强度上调3.7 倍,最终使得柠檬酸铁的还原率提升了1.7 倍,所输出电流密度提升了23%。Min等[72]将黄素生物合成基因簇ribD-ribC-ribBA-ribE和胞外氧化还原蛋白mtrC-mtrA-mtrB 在S.oneidensis MR-1 中共同表达,最大电流密度分别增加了约110%和87%,显著地增强基于两种电子传递机制的电子传递速率[图4(c)]。以上研究结果证明,采用合成生物学方法优化介导电子传递过程的细胞色素蛋白将显著提高产电微生物的胞外电子传递能力。
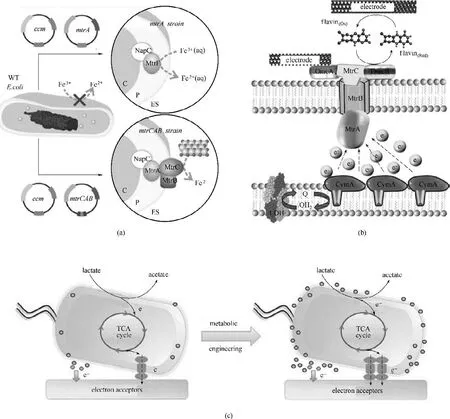
图4 强化导电元件提升电活性微生物产电能力(a)异源表达mtrCAB的大肠杆菌用于还原可溶性金属氧化物[68];(b)过表达cymA加强希瓦氏菌的胞外电子传递[70];(c)共表达mtrC-mtrA-mtrB和ribD-ribC-ribBA-ribE 增强希瓦氏菌的胞外电子传递[72]Fig.4 Strengthen the conductive components for enhanceing the electricity generation capacity of electroactive microorganisms(a)overexpressing mtrCAB in E.coli for reducing soluble metal oxide[68];(b)overexpressing cymA in S.oneidensis for enhancing extracellular electron transfer[70];(c)coexpression of mtrC-mtrA-mtrB and ribD-ribC-ribBA-ribE in S.oneidensis for enhanceing extracellular electron transfer[72]
2.3.2 强化导电纳米线介导的远距离电子传递 产电微生物细胞表面长达数十微米的导电纳米线由于其超高的电导率,在电子的长距离传递中展现出独特的优势。然而,目前仅有G.sulfurreducens 等少数产电菌具有导电纳米线,通过对不具备导电性的菌毛单体蛋白结构进行编码重构,可显著提高产电细胞菌毛的电导率。Liu等[73]在敲除P.aeruginosa的菌毛单体蛋白pilA*的同时,异源表达来自G.sulfurreducens的菌毛蛋白基因pilA,成功组装出电导率与G. sulfurreducens 相当的e-Pili。通过比对多株产电菌菌毛单体蛋白PilA 的氨基酸序列,发现菌毛单体蛋白PilA 的N 端序列呈现高度保守的α-螺旋。相比于其他菌株,G. sulfurreducens 的菌毛蛋白PilA仅有N 端保守区的61 个氨基酸。随后,他们将P.aeruginosa 的PilA*截断,表达仅含N 端61 个氨基酸的PilA*1~61,发现敲除pilA*的P.aeruginosa 能够形成e-Pili,电子传递速率显著提高,由此推测菌毛蛋白PilA 的N 端保守α-螺旋可能是导电Pili 的核心结构。此外,在G. sulfurreducens 的菌毛单体蛋白PilA的C 末端融合功能短肽(组氨标签等),在保持产电细胞Pili 高电导率的同时使其具有特异性吸附、识别功能,可进一步拓宽产电微生物在生物传感器、环境修复等领域的应用。
进一步研究发现,导电纳米导线的电导率与菌毛单体蛋白PilA 中的芳香氨基酸密切相关。通过将G.sulfurreducens中PilA 蛋白C 端的苯丙氨酸和酪氨酸替换为电子云密度更高的色氨酸,G.sulfurreducens 的pili 直径缩减至1.5 nm,仅为原来的一半,而所形成的e-Pili 电导率增加了2000 倍[29]。Tan 等[27]在G.sulfurreducens 中异源表达金属还原地杆菌(G.metallireducens)的菌毛蛋白,发现产生了更多的e-Pili,并且电导率提高5000 倍。相比于G.sulfurreducens,G. metallireducens 的菌毛单体蛋白C端的芳香氨基酸密度更高。因此其导电纳米线具有更高的电导率,电子传递阻力更小,这为产电微生物设计合成高电导率的纳米导线提供了理论依据。
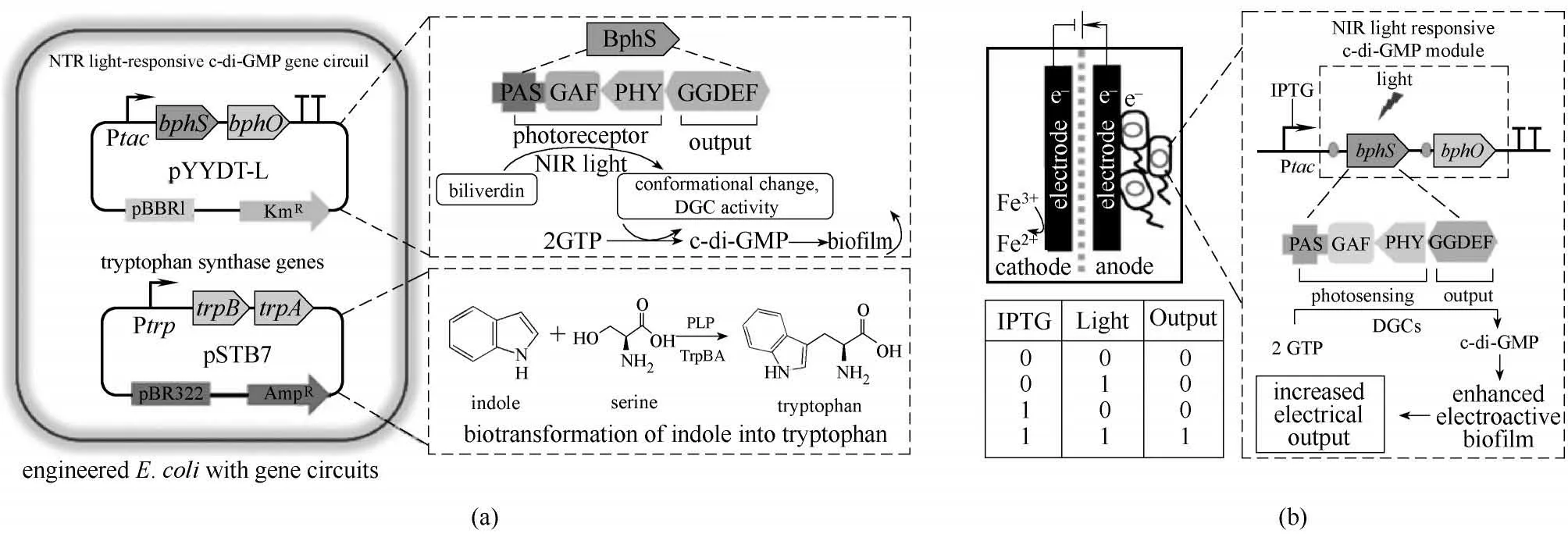
图5 强化导电生物膜提升微生物电活性(a)构建近红外光响应性大肠杆菌生物膜系统催化吲哚转化为色氨酸[80];(b)在MFC中构建基于近红外光响应的c-di-GMP逻辑门[81]Fig.5 Strengthen the conductive biofilm to improve the electrical activity of microorganisms(a)construction of NIR-light-responsive E.coli biofilm system for catalyzing indole into tryptophan[80];(b)construction of NIR light responsive c-di-GMP logic gate in MFC[81]
2.3.3 构建电活性生物膜 产电微生物常以多细胞形式与电极直接接触导电,微生物及其分泌的蛋白质、多糖、脂质、DNA 等胞外聚合物共同构成导电生物膜。电极生物被膜通过导电纳米线、色素蛋白及其复合物介导胞外电子传递,速率远高于浮游细胞利用氧化还原活性分子介导的电子传递。其中,Geobacter 的阳极生物膜厚度可以达到50 μm,同时电子传递速率随其生物膜增厚而提高[74-76]。然而,野生型产电微生物的生物被膜厚度薄、细胞数量少、内部传质效率低、导电性差、难以适应复杂的应用环境。因此,通过合成生物学手段提升生物膜机械强度、导电性能,构建成熟、稳定的导电生物膜将进一步提高电活性微生物的胞外电子传递速率。
环二鸟苷酸(cyclic diguanylate,c-di-GMP)是胞内第二信使信号分子,通过调节胞外多糖产生、表面黏附素表达、生物膜消散等细胞行为控制细菌的生物膜的形成[77]。在G.sulfurreducens 中存在一类受c-di-GMP 调控的PilZ 蛋白域,Leang 等[78]敲除含有PilZ 蛋白域的基因GSU1240,发现工程菌的生物膜厚度比野生型提升了6 倍,电极表面形成更加致密的导电生物膜,并成功将功率密度提升70%。Liu等[79]分别构建了IPTG 诱导型启动子和组成型启动子开启表达c-di-GMP 生物合成基因ydeH 的S.oneidensis MR-1,经过工程改造的S. oneidensis MR-1 最大功率密度可以达到野生型的2.8 倍,强化cdi-GMP 合成的工程菌几乎完全覆盖电极表面,极大地强化了S. oneidensis MR-1 的直接电子传递过程;Hu 等[80-81]利用光敏色素c-di-GMP 合成基因bphS 和发光色团合成基因bphO 构建了光控合成生物膜的微生物,体系中存在IPTG 时,近红外光开启c-di-GMP生产进而强化生物膜形成,促进胞外电子传递,强化电流输出能力和目标产物的合成(图5)。以上研究结果表明,c-di-GMP参与产电微生物的电极生物膜形成过程,通过调控c-di-GMP 的合成将强化产电微生物的电极附着量以及附着面积,显著提升基于生物膜直接电子传递机制介导的胞外电子传递速率。
细 胞 外 聚 合 物(extracellular polymeric substances,EPS)是位于细胞外周,由多糖、蛋白质和核酸等物质构成的,具有较强的结构内聚力和黏附性的复合物[82],可以促使产电微生物在电极表面更好地形成生物膜。加快EPS 的合成、减缓EPS 的降解有助于生物膜更好地定植在电极表面,Ding 等[83]认为腐胺可能与EPS 的分解直接相关,通过构建转座子文库,筛选到腐胺合成缺陷型菌株。进一步研究发现,该突变株生物膜中EPS 的含量得到大幅提升,并强化了对铬的还原能力。通过调控电活性微生物EPS成分构成,使生物膜获得更强的附着能力,提高电极表面的生物附着量。Kouzuma 等[84]发现通过敲除S.oneidensis MR-1中与多糖荚膜合成相关的基因SO3177可以增强其细胞表面的疏水性,强化在石墨电极表面的定植效果,最终使得MFC 的产电提高了50%;Godeke 等[85]认为胞外核酸(extracellular DNA,e-DNA)与生物膜的形成直接相关,通过敲除细胞外核酶编码的基因exeM 从而降低e-DNA 的降解能力,显著提升了生物膜的厚度。上述研究结果表明,工程改造产电细胞的EPS,对提高生物膜黏附性、增加产电微生物的电极表面生物量、提高微生物与电极表面电子传递速率具有重要意义。
群体感应(quorum sensing,QS)系统通过调控参与黏附的膜外蛋白、引导群体迁徙行为、刺激EPS分泌、促进菌落形态变化等方式控制生物被膜的形成。在厌氧条件下,P. aeruginosa 中吩嗪类化合物的合成量受到2-庚基-3,4-二羟基喹啉(2-heptyl-3,4-dihydroxyquinoline,PQS)信号分子的抑制,Wang等[86]通过合成生物学手段降低厌氧条件下P.aeruginosa 中PQS 浓度,使其吩嗪合成能力显著增强,最终将微生物燃料电池的最大电流密度提升了5 倍。分析伏安特性曲线发现绿脓菌素参与了电极生物膜的氧化还原反应,这表明QS系统通过控制吩嗪等小分子化合物的分泌,从而强化了电极生物膜导电能力。Chen 等[87]研究了群体感应信号分子酰基高丝氨酸内酯(acyl homoserine lactones,AHLs)对产电菌电活性的影响。借助混菌体系分析内、外源的AHLs 分子对菌群产电影响,发现AHLs 使混菌MFC 系统中微生物的电化学活性、电极生物量、生物膜致密性、活/死细胞比、EPS 成分多样性以及氧化还原性都得到提升,同时发现外源添加的AHLs会使Geobacter 的丰度从56%提升至71%~78%;随后,他们[88]进一步研究了AHLs 对Geobacter soli GSS01的影响,发现Geobacter soli GSS01本身分泌的内源性AHLs 可以促进生物膜的形成并强化电活性,而外源性的AHLs 则会进一步增强这些过程。因此,利用QS系统强化电活性微生物的电极生物膜附着、提高生物膜中的电子传递载体浓度对提高微生物燃料电池的产电性能具有积极意义。
2.3.4 强化电子传递载体生成 可溶性氧化还原活性分子(黄素类、吩嗪类、醌类等)介导的产电微生物间接电子传递是大部分产电微生物主要的胞外电子传递方式。然而,野生型产电微生物电子传递载体的合成、传递能力有限。为此,研究人员通过合成生物学方法强化电子传递载体的合成传递,同时按照劳力分工原则,利用人工混菌系统强化微生物电催化体系的电子传递载体供给,将产电微生物胞外电子传递速率提高数十倍。针对模式产电菌S. oneidensis 因黄素合成能力不足而限制其胞外电子传递速率的问题,Yang 等[89]将B.subtilis 中编码核黄素合成相关酶的核心基因簇ribADEHC 在S.oneidensis MR-1 中异源表达,将核黄素产量提高到26.15 μmol/L,S.oneidensis MR-1 双向电子传递速率分别提高13.2 倍(放电)和15.5 倍(噬电)[图6(a)];在此基础上,Lin 等[90]进一步将ribADEHC 基因簇和P. aeruginosa PAO1 孔蛋白基因oprF 在S. oneidensis MR-1 中组合表达,同时强化了核黄素合成和传递能力,使核黄素的产量提高至39.7 μmol/L,电子传递效率提高12倍[图6(b)]。这进一步证明强化黄素生产对S.oneidensis MR-1胞外电子传递效率的提升具有重大意义。
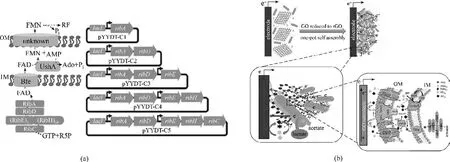
图6 强化电子传递载体提升电活性微生物产电能力(a)构建黄素生物合成途径以强化希瓦氏菌胞外电子传递[89];(b)构建核黄素-自组装三维rGO杂化生物膜以强化MFC的电流输出能力[90]Fig.6 Strengthen the electron shuttle for enhancing the electrical activity of microorganisms(a)construction of a synthetic flavin biosynthesis pathway in S.oneidensis for enhancing extracellular electron transfer[89];(b)construction of flavins-selfassembled three-dimensional(3D)rGO biohybrid biofilm for enhancing power generation of MFC[90]
除了强化S.oneidensis 单菌黄素产量外,理性设计、构建高产黄素的人工混菌系统也能显著强化MFC 的产电效率。Liu 等[91]设计了高产核黄素的B.subtilis 以及S. oneidensis MR-1 混合培养体系,将微生物燃料电池中的核黄素浓度从0.55 μmol/L 提高至5.32 μmol/L,显著提升了电池体系内的电子传递速率。Yang 等[92]利用合成生物学策略改造E. coil,以木糖为底物将核黄素产量从3.3 μmol/L 提升至115.2 μmol/L,并与高度疏水的工程S. oneidensis MR-1 共同培养,成功将产电系统的功率密度提升了6.8倍;Liu等[93]构建了以葡萄糖为底物的“E.coil-B. subtilis-S. oneidensis”三菌互作产电系统。其中,E. coil 和B. subtilis 以葡萄糖为底物,分别为S.oneidensis MR-1提供电子供体乳酸和电子传递载体核黄素,而S.oneidensis MR-1 代谢生成的乙酸作为底物回补给E. coil 和B. subtilis,这使得放电过程的电子释放率得到大幅提升,最终该系统的库仑效率达到了55.7%。
吩嗪及其衍生物是一种以二氮杂蒽为碳骨架的化合物,当前已从自然界分离出包括吩嗪-1-羧酸(phenazine-1-carboxylic acid,PCA)、吩嗪-1-酰胺(phenazine-1-carboxamide,PCN)、绿 脓 菌 素(pyocyanin,PYO)在内的近百种吩嗪化合物。吩嗪类化合物作为电子载体参与细胞生理代谢已被广泛研究[34,94-96]。Newman 等[97]研究发现,添加吩嗪类物质可以加快包括Geobacter 和Shewanella 在内的大多数电活性微生物的呼吸强度和胞外电子传递能力,Pham 等[34]通过添加实验证实PCA、PCN 等吩嗪类物质可将微生物燃料电池的产电能力提升1.5倍。针对产电污泥的菌落分析证实,产气肠杆菌(Enterobacter aerogenes)可 以 利 用P. aeruginosa 产 出的吩嗪与电极形成新的呼吸链[98]。因此,提高MFC中吩嗪的浓度将显著增强微生物的电化学活性从而提升MFC 的功率输出能力。在模式产电菌P.aeruginosa PAO1中,磷酸烯醇丙酮酸经过phzA-G 等7 个基因合成PCA,之后经过phzS 和phzM 转化为PYO,Schmitz 等[99]将来自P.aeruginosa PAO1 的吩嗪合成核心基因簇phzA-G 以及phzM 和phzS 在恶臭假单胞菌(Pseudomonas putida)中异源表达,使恶臭假单胞菌的PYO 产量达到45 mg/L,同时发现不具备产电能力的恶臭假单胞菌能够检测到电流输出,实现了非电活性微生物向电活性微生物的转化;Yong等[100]通过在P.aeruginosa 中过表达PYO 合成路径中的phzM基因,将PYO的产量提高了1.6倍,显著增强电池的产电能力。
除了针对吩嗪合成基因簇进行直接改造外,调节与吩嗪合成和分泌相关的调控因子也影响着吩嗪的产量。常见的吩嗪调控方式有群体感应系统、双组分调节系统以及后转录调节,通过设计改造微生物吩嗪的调控方式对其产量进行人工干预是提升MFC 功率密度的重要手段。Venkataraman 等[101]对P. aeruginosa 中与GacS/GacA 双组分调节系统相关的retS 突变型进行研究发现,突变菌株的吩嗪产量提升了39 倍,这使得电流水平提升了48 倍;Yong等[102]在P. aeruginosa 中过表达群体感应系统rhl 相关基因,使得MFC 的最大电流输出提高了1.6 倍,分析发现相比野生型,工程菌合成了更多的吩嗪类化合物(0.4 g/ml PYO 和4 g/ml PCA),这说明QS 系统可以通过调节吩嗪的产量从而控制电流的输出。
3 应用展望
电活性微生物驱动的微生物燃料电池在废水处理、海洋能源开发、环境智能监测与修复、生物冶金以及生物计算等多方面展现出广阔的应用前景。随着电子传递机制研究的不断深入,产电微生物的胞外电子传递速率和能量转化效率有望逐渐实现量级突破,这将大大加快以产电微生物为核心的生物智能合成和生物电催化领域工业化进展,为绿色可持续性生产新能源或大宗精细化学品的生产提供新思路。
有机物被产电微生物摄取直至传递到电极,仅有约10%的电子能来到电极表面。在胞内反应过程中电子除了以电流的形式流出细胞,胞内反应还会消耗大量电子以参与还原态物质的合成、胞内能量代谢调控等过程;在周质电子传递过程中,复杂的周质氧化还原环境会分流胞内的部分电子,形成周质空间“电子逃逸”过程;随着电子传递到细胞外周环境,电子在不稳态环境中极容易被环境中存在的氧气等氧化态物质消耗造成电子流失。
为此,未来微生物产电系统设计还可以聚焦于以下方面:(1)依靠代谢工程分析产电细胞的胞内氧化还原反应,系统地测绘产电细胞胞内氧化还原过程,设计化学级联效应更强的反应路径以提高目标产物产量;(2)对周质空间氧化还原酶进行系统分析,按照对微生物生长的影响和化学反应亲和势判断周质酶对电子的掠夺程度并通过合成生物学手段对周质空间进行清理,使得电子流更多流向与电极相关联的色素蛋白;(3)寻找化工产品代替或修饰电极材料,通过改善产电微生物外周的电化学性能改变电子在外部环境的传递速率,同时扩充细胞与电极之间的电子通量,大大提升微生物燃料电池的功率输出;(4)根据微生物电化学系统的动量、质量传递过程设计电化学反应器,通过反应器优化缩减反应过程中产生的热力学、动力学损失,通过反应器结构优化加强微生物发酵过程与产电过程的耦合,保证能量的高密度输出。
