一株鲫鱼致病性镰刀菌的分离鉴定及其生物学特性∗
2021-01-30张艳珍付龙威王咏星刘云国
张艳珍,付龙威,王咏星,刘云国
(1. 临沂大学 生命科学学院,山东 临沂276000;2. 新疆大学 生命科学与技术学院,新疆 乌鲁木齐830046)
0 引言
鲫鱼(Carassius auratus)俗名鲫瓜子、河鲫等,其肉质细嫩、味道鲜美、营养丰富,具有较高的药用价值及滋补食疗作用,是重要的经济食用鱼类之一[1−3],在我国淡水养殖业中占据十分重要的地位[4,5].随着鲫鱼养殖规模扩大、种质退化、集约化程度提高以及抗生素等药品滥用,致使养殖环境恶化,其病害问题日益突出,并具有传染迅速、发病死亡率高和治愈困难的特点,给渔民造成巨大的经济损失,阻碍了养殖业的持续健康发展[6,7].
在对鲫鱼疾病调查中,研究人员关注较多的是细菌病原菌[8−11],以引起鲫鱼细胞性败血病的嗜水气单胞菌(Aeramonas hydrophila)为主[10],而真菌病原的研究却没有被重视,相关报道仅有水霉菌(Saprolegnia)[12,13].事实上,水霉菌也是我国水产养殖鱼类最常见的真菌病原菌,但致使鱼类患病的真菌病原并不仅仅是水霉菌,水产养殖环境的变化也促使越来越多致病菌的出现.
目前,对真菌性病原菌的研究较多的还有镰刀菌(Fusarium),其隶属菌物界,半知菌亚门,是一类重要的世界性分布真菌类群,其种类繁多,适应性强;营寄生兼腐生生活,可导致多种植物、动物甚至人类发病[14,15].养殖鱼类在免疫力低下时可感染镰刀菌进而引起爆发性死亡,其感染症状为鱼体附有棉花状菌丝和溃疡性病灶.近30年来,报道的鱼类镰刀病原菌主要有腐皮镰刀菌(Fusarium solani)[16−18]、镰状镰刀菌(F.fusarioides)[19]、棉腐镰刀菌(F.buharicum)[20]、弯角镰刀菌(F.comtoceras)[21]、串珠镰刀菌(F.moniliforme)[22]和尖孢镰刀霉(F.oxysporum)[23−25].目前,尚未在鲫鱼中发现存在镰刀病原菌的相关报道.
病原菌的分类鉴定对鱼类疾病具有重要意义,也是研究发病机理和科学防治的基础.ITS (Internal Transcribed Spacer) 是核糖体内部转录间隔区,进化过程中受自然选择的压力小,可容忍更多的变异;该区域比18S rDNA更保守,体现在种内相对一致,种间差异较明显,适合于真菌物种的分子鉴定和系统发育分析[26].目前,基于ITS r DNA序列分析的鉴定技术结合传统形态学分类法已被广泛应用于病原真菌的分类鉴定[27].
新疆地区气候寒冷,鱼类在越冬期免疫力低下,增加了镰刀菌病爆发的可能.鉴于此,本研究从新疆昌吉地区患病的鲫鱼鱼体分离得到一株高致病性菌株JC01,结合菌株的形态特征和ITS rDNA序列分析进行鉴定,并探究其生物学特性,以期为鲫鱼养殖中可能的镰刀菌病害的有效防治提供理论参考.
1 材料与方法
1.1 材料来源
患病鲫鱼及健康鲫鱼卵采于新疆昌吉某渔场,随后运送到新疆大学生命科学与技术学院鱼类疾病实验室进行研究.
试验所用病原菌分离培养基是PDA培养基,购于青岛海博生物技术公司;抗生素、青霉素和链霉素购于北京索莱宝科技有限公司.
1.2 菌株的分离与纯化
用酒精棉擦拭患病鲫鱼体表,挑取病灶处的菌丝体,75%酒精浸洗2~3 s后,再用无菌水冲洗干净,接种于含100 mg/L青霉素-链霉素的PDA平板上,25 ℃恒温培养至贴壁生长,挑取最边缘菌丝转接到新的PDA平板上,重复多次直至获得纯培养物,将布满菌丝的平板置于4 ℃备用.
1.3 菌株的人工感染实验
向长满菌丝的PDA平板中注入10 mL无菌过滤河水,25 ℃摇床震荡培养20 h,使产生的孢子充分混匀到无菌河水中,3 000 rmp/min离心5 min,除去菌丝体,光学显微镜下用血球计数板进行孢子计数,最后稀释为浓度5×103个/mL的孢子悬液.取50粒健康的鲫鱼卵放入含有孢子悬液的培养皿中,多次吹打移液枪充氧,同时,将放入灭菌过滤河水(不含孢子)的鲫鱼卵设置为对照.用无菌水反复冲洗鲫鱼卵,镜检确保没有菌丝或孢子附着后才用于试验.显微镜下连续观察记录卵的感染情况,并计算感染率(%).镜检卵膜出现明显菌丝即可确定为感染.
1.4 形态特征观察
挑取长势良好的JC01纯培养物点接到新的PDA平板上,25 ℃恒温培养3 d,肉眼观察菌落特征;打孔器打出直径为5 mm的PDA培养基到载玻片上,接种JC01的纯培养物到培养基上,盖上盖玻片[28],放到铺有浸湿滤纸的培养皿中,25 ℃培养3 d后在显微镜下观察菌丝的形态特征.
1.5 生理特性试验
挑取长势良好的JC01 参照Hussein 等[29]用打孔器无菌制备直径为5 mm的菌饼,接种到含有双抗的新无菌PDA平板上培养,分别置于4 ℃、10 ℃、15 ℃、20 ℃、25 ℃、28 ℃、30 ℃下恒温培养3 d记录生长情况;用1 mol/L的HCl和NaOH溶液调节pH,分别配置pH为4、5、6、7、8、9、10的PDA培养基,参照Hussein 等[29]用打孔器无菌制备直径为5 mm的菌饼,接种后于25 ℃培养3 d观察生长情况;参照Hussein 等[29]用打孔器无菌制备直径为5 mm的菌饼,接种到用NaCl配制0~6%梯度为1.0%不同浓度NaCl的PDA培养基,25 ℃培养3 d观察生长情况.均用十字交叉法测量菌落直径(mm),每组进行3次平行实验.
1.6 病原菌株的ITS序列鉴定
1.6.1 DNA提取与PCR扩增
参考可小丽等[30]的方法对菌株JC01进行DNA提取,采用通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’TCCTCCGCTTATTGATATGC-3’)扩增整个ITS序列[31],PCR反应体系为25 μL∶1.5 μL Mg2+(25 mM),2.5 μL,10×PCR Buffer,0.5 μL dNTP (2.5 mM),1.0 μL ITS1,1.0 μL ITS4,0.5 μL Taq酶(5U/μL ),1.0 μL 模板(10 ng/μL )以及17 μL ddH2O.在Power Cycler(Biometra GmbH)中进行PCR反应,95 ℃预变性5 min后,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,共35个循环,最后72 ℃延伸5 min.PCR产物经纯化后送往上海生工生物工程有限公司进行测序.
1.6.2 序列分析
将测得的ITS rDNA序列用DNAMAN软件编辑后,在NCBI的GenBank数据库中进行在线BLAST比对,下载同源性较高的菌株ITS序列,使用软件MEGA 7.0进行多重比较,通过邻接法(Neighbour-joining,NJ)构建系统发育树,从而确定菌株JC01的亲缘关系及分类地位.
2 结果
2.1 菌株的分离
患病鲫鱼的病灶处集中在头部、背鳍两侧和尾部,表面附着的白色丝状物与水霉菌很相似[19].挑取病灶处菌丝接种于含双抗的PDA培养基中,转接3次后,获得纯培养物JC01.
2.2 菌株的人工感染实验
由表1可知,分离株JC01对健康鲫鱼卵具有较强的致病性.培养第2 d时,鱼卵出现感染现象;培养5 d后,约92%的鱼卵被感染.

表1 分离株JC01对健康鲫鱼卵的人工感染试验Tab 1 Artificial infection test of isolated JC01 on healthy Carassius auratus eggs
2.3 菌株的形态特征
菌株JC01接种于PDA培养基上,25 ℃恒温培养,菌株一开始生长缓慢,培养24 h后大量生长,菌落大、边缘整齐、结构干燥蓬松,正面雪白背面呈黄色(图1),显微镜下观察:菌丝呈透明管状,中间有横隔,分支较多(图1(c));具有镰刀形分生孢子(箭头下方)以及球状厚垣孢子(图1(d)),可初步鉴定为镰刀菌.
2.4 菌株的生理特性
2.4.1 温度对菌株JC01生长的影响
由图2可知,菌株JC01在10~30 ℃范围内均可生长,10~20 ℃生长缓慢,25 ℃生长良好,28 ℃生长最快,30℃生长开始变慢,4 ℃几乎不生长.菌落的直径随着温度升高而增大,在28 ℃达到最大,最适生长温度为28 ℃.

图1 分离株JC01的形态图Fig 1 Morphological characterization of strain JC01
2.4.2 pH对菌株JC01生长的影响
菌株JC01在pH 5~9 范围内均可生长(图3),但pH 7~9间其菌落直径随pH的增大而缓慢降低,最适生长pH为7.

图2 温度对菌株JC01生长的影响Fig 2 Effect of temperature on the growth ofstrain JC01

图3 pH对菌株JC01生长的影响Fig 3 Effect of pH on the growth of strain JC01
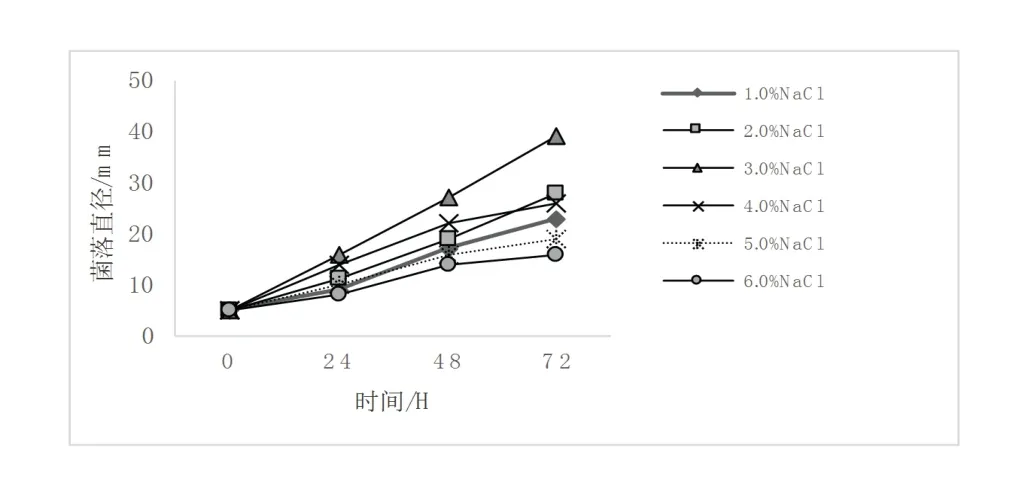
图4 NaCl对菌株JC01生长的影响Fig 4 Effect of NaCl on the growth of strain JC01

图5 基于分离株JC01 ITS rDNA 序列所构建的系统发育树Fig 5 The constructed phylogenetic tree based on ITS rDNA sequence of strain JC01
2.4.3 NaCl浓度对菌株JC01生长的影响
如图4所示,氯化钠浓度对菌株生长具有抑制作用,恒温培养72 h后菌落均未达到40 mm.氯化钠浓度为0%~3.0%时菌株生长状况良好,氯化钠浓度从3.0%逐渐升高到6.0%时,菌株生长变得缓慢,最适氯化钠质量分数为3.0%.
2.5 菌株JC01的序列分析
用通用引物ITS1和ITS4扩增出的JC01序列为542 bp的特异性片段,使用BLAST对菌株JC01的ITS序列和Gen Bank数据库中已知同源序列进行比较,结果显示菌株JC01与数据库中的镰刀菌自然聚类,同源性高达99%.邻接法构建的系统发育树(图5)进一步表明,菌株JC01与Fusarium langsethiae(NO:MG274309.1)的亲缘关系最近,因此可判定分离株JC01为镰刀菌属中的Fusarium langsethiae.
3 讨论
随豆粕、各种谷类等植物源性饲料在水产养殖中的应用日益增加,鱼类受镰刀菌感染的潜在风险比以往更加敏感[32],人们逐渐认识到镰刀菌对鱼类的危害性,但有关鱼类镰刀病原菌的鉴定和致病性研究仍较少.本研究从新疆昌吉患病鲫鱼中分离了一株高致病性镰刀菌JC01,并对其形态、生物学特性进行研究,为鲫鱼镰刀菌病的防治提供理论依据.
真菌的传统分类方法,主要是依据菌株的形态特征、生长特性和生理生化指标来进行的.由于真菌的形态特征复杂,且部分形态特征和生理生化指标因环境变化而不稳定,依靠形态学进行鉴定,不仅费时费力、误差大、准确性比较低,同时也难以在种的层次上判断真菌的分类[33].比如尖孢镰刀菌(F.oxysporum)和串珠镰刀菌(F.moniliforme)的分生孢子都是镰刀状,两端渐尖,菌落及显微形态特征极相似,尤其是有时候培养物不典型或不产孢,仅用传统方法鉴定是很困难的[34].近年来,随分子生物学的快速发展,基于ITS r DNA序列分析的鉴定技术逐渐被应用到真菌的分类鉴定中,弥补了传统分类鉴定的不足.本研究采用形态学将菌株JC01初步鉴定为镰刀菌,菌株JC01的ITS序列与镰刀菌同源性最高,系统发育树上和Fusarium langsethiae(No: MG274309.1)聚到一起.因此,菌株JC01被鉴定为Fusarium langsethiae.
人工感染实验结果显示分离株JC01对健康鱼卵具有较高的致病率,而黄文芳[18]和可小丽[25]等采用鱼苗个体进行人工感染,其结果显示体表无损伤的鱼无发病症状,而本研究出现这种情况的原因可能是鱼卵的自身保护机制没有个体鱼强,在孢子液浸泡过程中易受到感染.分离株JC01的温度和pH的适应范围很大,但低温以及高pH条件下JC01的生长状况不好.JC01的最适NaCl浓度为3%,这与黄文芳等[18]探究的分离自大黑鲈的镰刀菌病原菌的最适NaCl浓度不一样,且NaCl浓度范围也不一样,说明了镰刀菌菌株的种类或生长条件不同,其对NaCl的敏感程度也不同,但总体上都是随NaCl浓度升高,菌株的生长被抑制.因此,在鲫鱼养殖过程中,要防治养殖密度过大,根据镰刀菌菌株对NaCl的敏感程度选择合适用量.
4 结论
镰刀菌感染鲫鱼致使鲫鱼患病,给鲫鱼养殖业带来经济损失,在一定程度上,也对食品安全甚至人体健康构成威胁.本研究首次从患病鲫鱼鱼体分离出一株高致病性镰刀菌Fusarium langsethiae,其最适生长温度、pH、盐度分别为28 ℃、7、3%,这为后续鲫鱼镰刀病的防治研究提供了一定的理论依据.
