高砷酸性浸出液中回收铜的试验研究∗
2021-01-30韩光辉黄玉代王省超魏炎斌
韩光辉,黄玉代,王省超,魏炎斌
(新疆大学 化学学院;应用化学研究所;能源材料化学教育部重点实验室;先进功能材料自治区重点实验室;新疆 乌鲁木齐830046)
0 引言
在中国有色金属材料的消费中铜的消费量仅次于铝[1].金属铜广泛应用于电气、轻工、机械制造、建筑工业、国防工业等领域,是极其重要的有色金属.铜是不可再生的自然资源,在人类不断的开采使用下,存量铜资源日趋减少,但是经济发展又使得铜的需求日益增长[2],这一矛盾使得从各种废弃物中回收铜而实现铜的二次利用成为了研究的热点.在来自于含砷冶金烟灰的酸性浸出液中含有大量的铜,从中回收铜就是本文主要研究目的.
回收高砷含铜废水中铜的方法有很多,主要有铁氧化还原法[3]、离子交换法[4]、液膜法[5]、硫化沉淀法[6]和萃取分离法等.至今只有萃取分离法得到了较好的工业应用,适合大规模处理含铜废液或浸出液.萃取法就是利用有机物与铜离子螯合形成不稳定的配合物,配合物将铜从水相中富集出来进入油相,然后在强酸条件下,配位键被破坏,最后铜离子进入酸性反萃液中,以达到选择性分离的目的.萃取分离铜的过程如下式所示[7]:

式中:HR为萃取剂,CuR2为铜与萃取剂形成的配合物,O表示油相,A表示水相.
铜的萃取剂有很多种,按其结构可以分为肟类、复配类、β-二酮类、季铵盐类和其他类[8].其中应用最广、品种最多的是羟肟类萃取剂.目前市场上所占份额最大的就是以5-壬基水杨醛肟为活性物质的铜萃取剂,不同厂家推出的萃取剂因为其改质剂不同,萃取性能也不相同[9,10].5-壬基水杨醛肟的结构式[11]为:

由于其拥有不能转动的碳氮双键(-C=N-),故有顺式和反式之分,其结构式为:

5-壬基水杨醛肟萃取铜是一种螯合萃取,肟基中的氮原子和酚羟基中的氧原子提供孤对电子给铜离子,形成配位键,这样肟基和酚羟基氮、氧、氢原子就和铜原子形成了五元或者六元环,能够形成相对稳定的螯合物[12].其萃取作用机理为:

由于顺式5-壬基水杨醛肟的给电子基团的构型与铜离子配位的优势空间取向不一致,决定了起主要萃取作用的活性物质主要为反式结构;除了铜以外,大部分金属与5-壬基水杨醛肟的给体原子的软硬不太适配,造成铜与这些基团生成的螯合物相对稳定,从而对铜具有很高的选择性;萃取时有H+产生,使得铜萃余液的pH下降,但是由于铜原子同时是两个五元环和两个六元环的组成原子,螯合萃取物稳定性很高,因此产生的H+对萃取影响很小,也使得5-壬基水杨醛肟在一定的酸性溶液中能够萃取分离铜[13].
本文根据需要选取了市场上比较有代表性的三种萃取剂,分别是北京意特格公司代理的国外产品Acorga M5640、中国科学院上海有机化学研究所研发的N902和重庆康普化学工业有限公司研发的Mextral5640H(注:本文中AcorgaM5640简写为AM5640;Mextral5640H简写为M5640H).通过研究不同的萃取条件,选出所需的最佳萃取剂,并通过系统试验对比各种因素对萃取分离铜的影响,确定最佳的萃取工艺条件.
1 试验仪器与方法
1.1 试验废水、试验仪器和试剂
试验废水来自含砷烟灰的氧化酸性浸出液,测定废水中的各种离子的含量,结果见表1.

表1 高砷酸性浸出液的分析结果Tab 1 The analysis results of high acid leach liquor
主要用的试验仪器:美国Thermo公司iCAP6300型等离子体发射光谱仪(ICP-AES)、梅特勒-托利多FE20型实验室pH计、昆山超声KQ-500DE型数控超声波清洗器、上海司乐84-1A型磁力搅拌器、长城科工贸SHB-IIIG型循环水式多用真空泵.
主要用的试验试剂:氢氧化钠(分析纯)、浓硫酸(分析纯)、磺化煤油(工业级)、AM5640(工业级)、N902(工业级)、M5640H(工业级)等.
1.2 试验方法
萃取:一定温度下,调节水相pH值,磺化煤油稀释萃取剂到一定浓度,按一定相比进行混合,磁力搅拌一段时间,静置分相,测萃余液中金属离子的浓度.
反萃:一定温度下,将负载金属离子的有机相跟一定浓度的硫酸在一定的相比下混合,磁力搅拌一段时间,静置分相,测萃余液和反萃液中金属离子的浓度.
2 结果与讨论
2.1 铜萃取实验
2.1.1 萃取时间对萃取率的影响
室温下,调水相初始pH=2.01,取浓度为30%的三种萃取剂,分别按相比O/A=3∶5将两相混合,磁力搅拌,一段萃取,改变磁力搅拌的时间,考察不同萃取时间对三种萃取剂萃取率的影响,结果如图1所示.
由图1可见,在40 s以内,随时间的延长,三种萃取剂的萃取率迅速升高,40 s之后,萃取率几乎没有变化,可以确定最佳的萃取时间是40~50s.从整体趋势来看,M5640H 的萃取率大于N902和AM5640的,N902和AM5640的萃取率相差不大.通过最佳萃取点数据分析,得出N902和AM5640的铜一段萃取率约为79%,M5640H的铜一段萃取率是83.71%,要使铜的萃取率达到95%以上,需要对酸性浸出液进行两段萃取.

图1 萃取时间对铜萃取率的影响Fig 1 Effect of extraction time on extraction rate of Cu
2.1.2 初始pH对萃取率的影响
室温下,改变水相初始pH值,取浓度为30%的三种萃取剂,按相比O/A=3∶5将两相混合,二段萃取,磁力搅拌45 s,考察不同水相初始pH值对萃取率的影响.同时也考察萃取剂对锌离子的萃取情况,即萃取剂对铜锌分离的选择性问题,结果如图2所示.
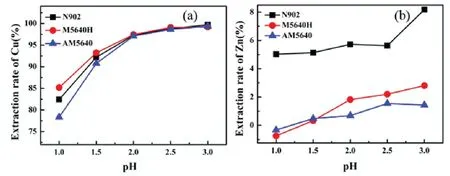
图2 水相初始pH值对铜(a)和锌(b)萃取率的影响Fig 2 Effect of initial pH value of the water phase on extraction rate of Cu (a) and Zn (b)
由图2(a)可见,水相初始pH值对三种萃取剂的萃取率影响都比较大,在pH<2时,萃取率随着pH值的升高迅速上升,萃取率M5640H>N902>AM5640;在pH>2时,萃取率趋于平缓,三种萃取剂的萃取率几乎相等;在pH=2处,M5640H对铜的萃取率为97.44%,高于其它两种萃取剂.
由图2可见,三种萃取剂对铜锌分离都有非常高的选择性,在铜的萃取率达到97%时锌的萃取率几乎都维持在6%以下.由图2(b)可见,在pH<2.5时,N902对锌的萃取率在5%左右; 在pH=3时,N902对锌的萃取率最高在8%左右.而在pH测试范围内,M5640H和AM5640对锌的萃取率均在3%以下,N902对铜锌的分离选择性明显要低于M5640H和AM5640的.由于三种萃取剂对铜锌的分离选择性都能达到分离需要,在下面的试验中将不再考察萃取剂对铜锌分离选择性的问题.
关于测试时萃取体系是否达到平衡的讨论:设萃取反应平衡时的萃取平衡常数为Kex,则有:

通过两边取对数并变形得到:
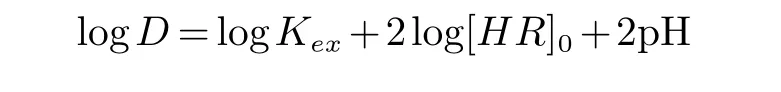
由上式可知,当萃取剂浓度HR不变时,平衡时的pH值应与logD呈直线关系,其斜率是铜离子的价态数2,通过调节初始水相的pH值可以改变萃取后的溶液的平衡水相pH值,同时可以根据萃取前后水相中的铜离子计算出分离比D,以平衡水相pH值对logD作图,如图3所示.由图3可见,三条直线的斜率都在2左右,可以认为萃取已经达到了平衡状态,测得的数据是有效的.

图3 分配比与平衡水相pH的关系Fig 3 The relation between distribution ratio and balance pH of water phase
调节酸性浸出液pH会导致一部分铜损失,结果如图4所示.在pH<2范围内,铜的损失率在10%左右;当pH>2时,铜的损失率迅速上升;当pH=3时铜的损失量达到了75.29%.
同时,在调pH值过程中发现当pH=2.35~2.40时,溶液开始出现明显的浑浊,调节pH值后溶液的颜色对比图如图5所示.

图4 水相pH值对铜损失率的影响Fig 4 The effect of pH value on loss rate of Cu

图5 调节到不同pH值后溶液的颜色Fig 5 The color of the solution after adjust pH to different value

图6 萃取相比O/A对萃取率的影响Fig 6 Effect of extraction phase ratio on extraction rate of Cu
由图5可见,随着pH值的增大,溶液颜色逐渐变淡,当pH=4时溶液几乎完全褪色.综合考虑铜的萃取率和损失率,在pH=2.00~2.30时萃取分离铜的效果最佳.
2.1.3 萃取相比O/A对萃取率的影响
室温下,调水相pH=2.30,取浓度为30%的三种萃取剂,改变萃取相比O/A,两段萃取,磁力搅拌45 s,考察不同萃取相比对三种萃取剂萃取率的影响,结果如图6所示.
由图6可见,当O/A<0.6时,萃取率随着相比的增大而升高;当O/A≥0.6时,随着相比的增加萃取率变化不大,每个萃取剂的萃取率变化都在0.5%以内,继续增加相比会增大萃取时混合液的体积,对萃取单元要求更大的萃取空间,增加生产成本.综上所述,决定选择相比O/A=0.6(即3∶5).
2.1.4 萃取剂浓度对萃取率的影响
室温下,调节水相的初始pH=2.30,改变萃取剂浓度,按相比O/A=3∶5混合两相,磁力搅拌45 s,两段萃取.考察不同萃取剂浓度对三种萃取剂萃取率的影响,并记下分相时间.结果如图7所示.

图7 萃取剂浓度对铜萃取率的影响(a),萃取剂浓度与油水分相时间的关系(b)Fig 7 Effect of concentration of extractant on extraction rate of Cu(a),Effect of concentration of extractant on the separated phase time of oil and water(b)
由图7(a)可见,随着萃取剂浓度的增加,萃取率逐渐升高,当萃取剂浓度达到20%时,三种萃取剂的萃取率都达到99%以上,之后随着萃取剂浓度的增加,萃取率几乎不再变化.由此可见,当萃取剂浓度为20%时,萃取剂通过两段萃取几乎完全将铜离子从水相中萃取出来,继续增加萃取剂浓度会增加油水分相时间,如图7(b)所示.综合考虑,萃取剂浓度为20%较合适.
2.1.5 萃取温度对萃取率的影响
在控制其他变量不变的情况下,根据公式∆rGm=−RTlnK,同时根据公式G=H−TS,设温度变化不大,得到:

即

假设焓变和熵变不随温度变化而变化,则

由2.1.2中推导出来的公式:logD=logKex+2log[HR]O+2pH ,可以推出:

令I=∆rSm/2.303R+2log[HR]0+2pH.由于萃取剂浓度的对数和萃取过程pH变化较小,也可以认为是不变的,则I为常数,所以可以近似的得到:
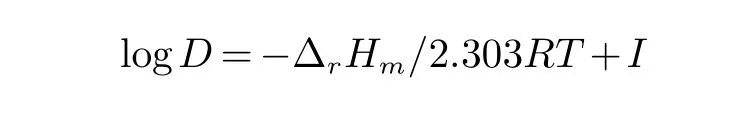
改变萃取温度,调节水相初始pH=2.30,取浓度为20%的三种萃取剂,按相比O/A=3∶5将两相混合,磁力搅拌45 s,静置分相,一段萃取,考察温度对三种萃取剂萃取率的影响,结果如图8所示.
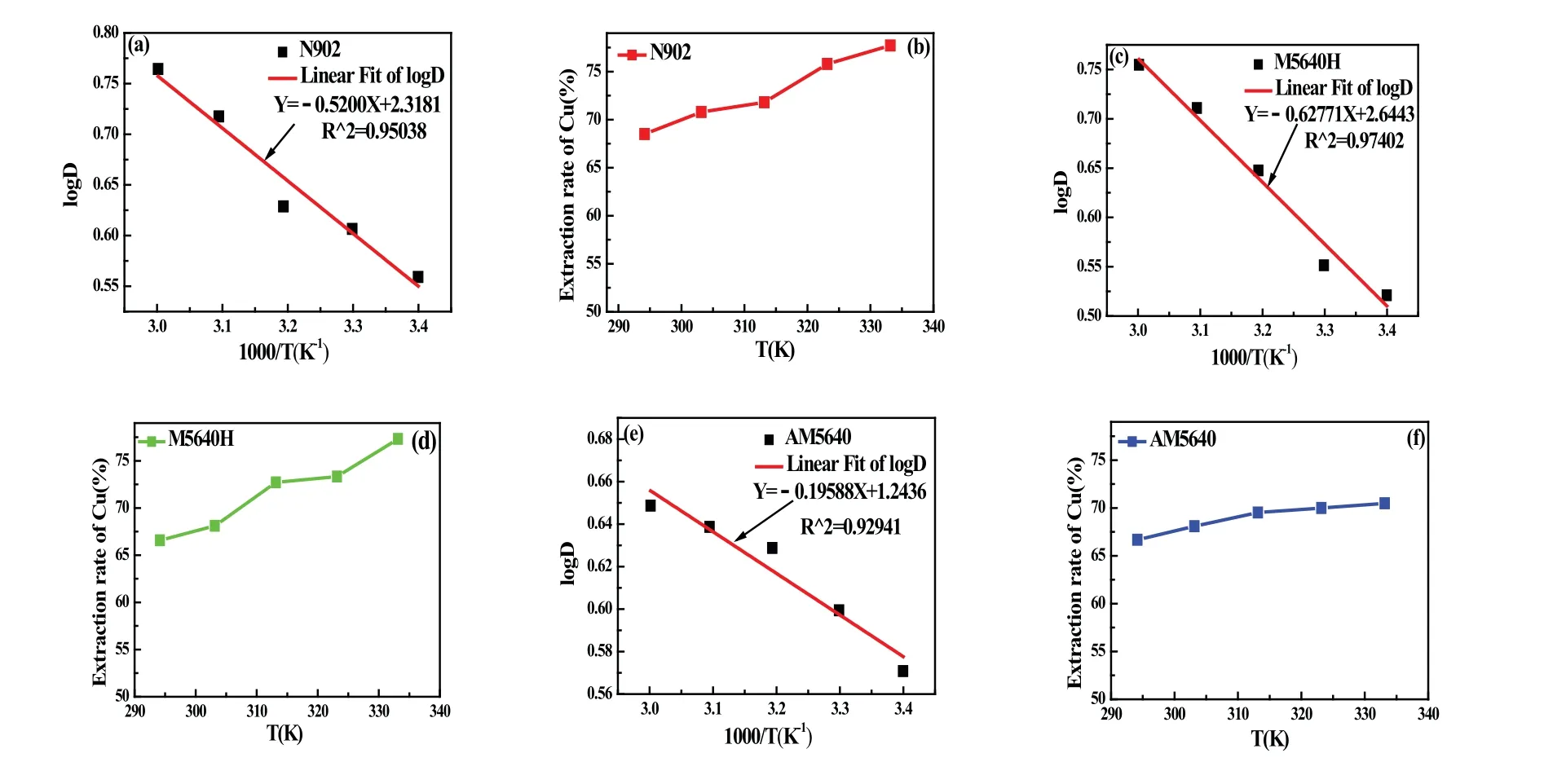
图8 分配比与温度的关系(a),(c),(e);萃取率与温度的关系(b),(d),(f)Fig 8 The relation between distribution ratio and temperature(a),(c),(e); The relation between extraction rate of Cu and temperature(b),(d),(f)
由图8(a),(c),(e)可见,直线的斜率可以算出在温度为294 K(21 ℃)到333 K(60 ℃)区间内的平均热效应,N902的∆rHm=9.957 kJ/mol,M5640H的∆rHm=12.019 kJ/mol,AM5640的∆rHm=3.751 kJ/mol,均为正值,可见铜萃取过程是一个吸热过程,这与很多文献的报道是相符的.
由图8(b),(d),(f)可见,从整体的曲线看,受温度影响程度的大小为M5640H>N902>AM5640,这与其相应的∆rHm相一致的.在294 K(21 ℃)到313 K(40 ℃)这个区间内,随着温度的升高,三种萃取剂的单级萃取率变化不大,都能维持在65%以上,最高不超过73%.萃取温度较高时,萃取率和萃取速度虽然有一定的提高,但是对能量的需求增大了企业的生产成本,同时温度高时,萃取剂挥发性增加,造成大量的萃取剂浪费;温度低时,萃取率和萃取速度都相对较低,降低了生产效率.综合考虑,选择萃取温度在294 K(21 ℃)到303 K(30 ℃)这个区间内,即室温萃取.
通过上述的几组控制单变量法实验可知,M5640H在相同的萃取时间或相同的水相初始pH下具有较高的萃取效率.其分相时间和对锌铜的萃取选择性与AM5640相似,均优于N902.而在相同相比和萃取剂浓度下,三种萃取剂萃取率均为99%左右,差别不大.在温度对萃取剂影响程度方面,M5640H表现相对较差,受温度影响较严重,AM5640最为优异,几乎不受温度影响,在20~30 ℃的室温下,M5640H萃取率变化不大.市场上的萃取剂价格AM5640>N902>M5640H,其中AM5640与M5640H每吨相差15 000元左右.综合考虑三种萃取剂的性能与售价,优先选择M5640H作为铜的萃取剂.
2.2 铜反萃实验
2.2.1 反萃时间对铜反萃率的影响
室温下,按2.1中的最佳工艺条件,用M5640H萃取,得到一段萃取的负载有机相,按相比O/A=1∶1与4 mol/L的硫酸溶液混合,改变反萃时间,一段反萃,考察反萃时间对反萃率的影响,结果如图9所示.

图9 反萃时间对铜反萃率的影响Fig 9 The effect of time on reextraction rate of Cu

图10 硫酸浓度和相比对铜反萃率的影响Fig 10 The effect of sulfuric acid concentration and phase ratio on reextraction rate of Cu
由图9可见,反萃60 s后,有机相与水相已经达到了反萃的动态平衡,之后变化不大,说明硫酸对于M5640H的反萃速度很快,达到平衡后的反萃率为99%左右,符合萃取分离铜的要求,故对铜使用一段反萃,反萃时间为60 s.
2.2.2 硫酸浓度与相比O/A对铜反萃率的影响
室温下,按2.1中的最佳工艺条件,用M5640H萃取,得到一段萃取的负载有机相,按相比O/A=1∶1、1.5∶1、2∶1、2.5∶1分别与1 mol/L、2 mol/L、3 mol/L、4 mol/L的硫酸溶液混合,磁力搅拌60 s,一段反萃,考察不同硫酸浓度和不同相比对铜反萃率的影响,结果如图10和表2所示.

表2 反萃液中的铜离子浓度(mg/L)Tab 2 The concentration of copper ion of strip liquor (mg/L)
由图10和表2可见,当硫酸浓度不变时,随着相比O/A的增大,反萃液中铜离子的浓度随之增大,反萃率随之减小.当相比O/A不变时,随着硫酸浓度的增大,反萃液中的铜离子浓度随之增大,反萃率也随之增大.1 mol/L和2 mol/L硫酸的反萃率最高分别为58%和82%,3 mol/L与4 mol/L的萃取率最高达到99%以上,故硫酸浓度在3 mol/L与4 mol/L中选取,3 mol/L硫酸只有在相比O/A=1∶1时反萃率才能达到99%,而此时反萃液铜离子浓度仅仅只有13.1 g/L,萃取剂的富集作用不明显,其他相比下的反萃率都低于90%,因此,选取4 mol/L的硫酸作为反萃剂.4 mol/L硫酸以相比O/A=2.5∶1反萃时反萃液中的铜离子浓度高达30.9 g/L,而在4 mol/L硫酸中铜离子的质量浓度达到26.5 g/L时会有硫酸铜晶体析出,其次相比为2.5∶1时,反萃率只有90%.综上所述,决定选择用4 mol/L硫酸在相比为2∶1条件下反萃.
3 结论
(1)通过考察三种萃取剂在萃取时间、水相初始pH、对铜锌的选择性、萃取剂浓度、萃取相比和萃取温度等单变量变化条件下的萃取率,结合三种萃取剂的市场价格,综合考虑选择出最佳的萃取剂是Mextral5640H.
(2)萃取铜的最佳的条件为:室温下,萃取剂Mextral5640H的浓度为20%,水相pH=2.00~2.30,有机相与水相的相比O/A=3∶5,萃取时间40~50 s,两段萃取.萃取率最高达到97%~99%.反萃铜的最佳条件为:室温下,有机相与4 mol/L硫酸以相比O/A=2∶1反萃,萃取时间60 s ,一段反萃,反萃液中的铜离子浓度24.8~25.4 g/L,反萃率达到96%~99%.
(3)使用醛肟类萃取剂Mextral5640H萃取浸出液中的铜,萃取效果好,萃余液中残留铜的浓度较低,工艺简单,能耗低,适合湿法冶金中回收铜.
