番红花多柱头突变体Cs5的转录组分析
2021-01-29李军,吴霁蓂,高广春,朱志明,李白,蒋琦,周鸿宇
李军,吴霁蓂,高广春,朱志明,李白,蒋琦,周鸿宇
关键词:番红花;柱头;突变体;转录组
中图分类号:S567.23+9文献标识码:A文章编号:1000-4440(2021)06-1630-03
Transcriptome analysis of saffron mutant Cs5 with multiple stigmas
LI Jun1,WU Ji-ming2,GAO Guang-chun2,ZHU Zhi-ming3,LI Bai4,JIANG Qi2,ZHOU Hong-yu2
(1. School of Modern Agriculture, Jiaxing Vocational & Technical College, Jiaxing 314036, China;2.School of Medicine Science, Jiaxing University, Jiaxing 314001, China;3.Jiaxing Xiuzhou Tianhe Saffron Professional Cooperative, Jiaxing 314000, China;4.Jiaxing Academy of Agricultural Sciences, Jiaxing 314016, China)
Key words: saffron;stigma;mutant;transcriptome
番红花(Crocus sativus L.)为鸢尾科番红花属球茎类药用植物,以其干燥柱头入药,具有活血化瘀、解郁安神、凉血解毒等功效,同时也应用于食品、化妆品行业染料及香料的制作[1-2]。番红花在浙江、江苏、上海、四川等地广泛栽培,但全国种植面积不到667 hm2,占市场需求量的20%左右,大部分还是依赖进口,因此番红花的需求量非常大。然而,由于番红花为三倍体雄性不育植物,仅靠球茎进行营养繁殖,而且每一朵花只有3个柱头,所以产量极低[3-4]。因此,培育高产优质的番红花品种将有效缓解国内外番红花市场的供求矛盾,具有重要的基础理论研究价值和产业应用前景。
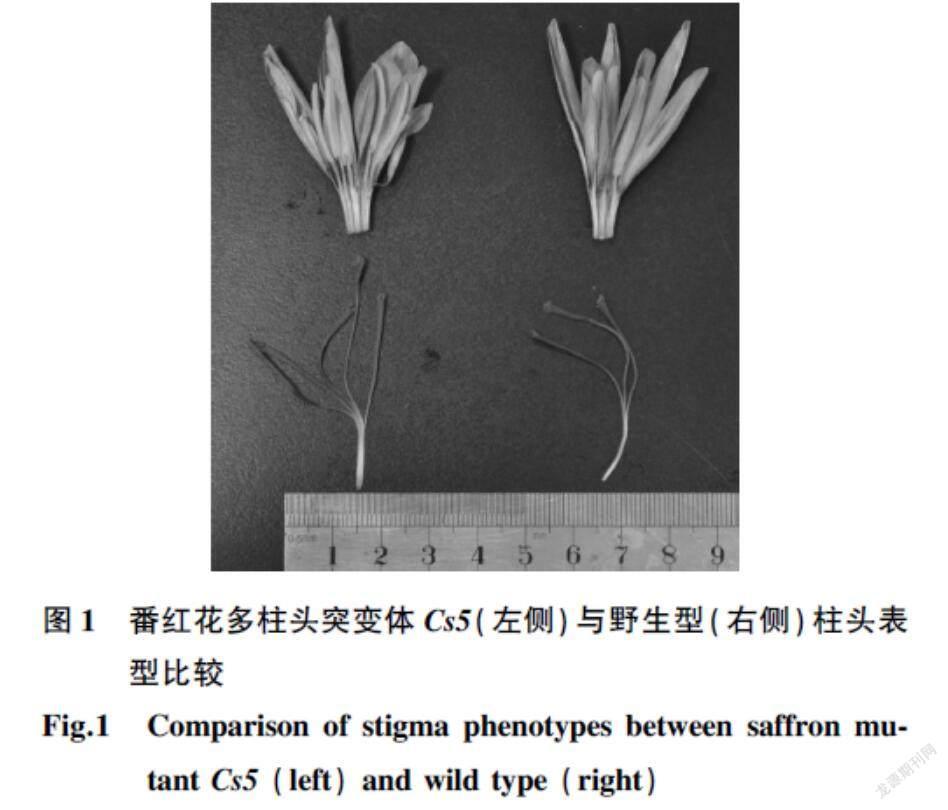
野生型番红花的花为顶生;花被片6个,淡紫色,长4~6 cm;雄蕊3个,雌蕊三心皮合生,子房下位,花柱细长,黄色柱头3个,伸出花被筒外后下垂,深红色,顶端略膨大。本研究在番红花生产过程中发现了多柱头突变体Cs5,其雌蕊上端花柱和柱头数量均为5个,形态与野生型无异,花柱聚合后比野生型粗壮(图1)。柱头数量的增多有助于提高番红花花丝的产量及花农收入,是番红花新品种培育的主要方向。通过转录组学和代谢组学,结合共表达网络分析番红花柱头发育的调控基因AGL6,发现其可能通过影响花器官的发育进而影响柱头的生物量,最终影响次生代谢物的产量[2,5-6]。番红花柱头数量是影响产量的一个重要指标,调控其生长发育的结构基因的挖掘和调控机制的研究有助于解决番红花资源短缺问题,然而目前相关研究报道较少。
目前,RNA-Seq分析测试技术在植物特异突变、特定发育时期以及不同组织器官基因差异表达等方面的研究中广泛应用[7-9]。本研究拟对番红花多柱头突变体Cs5柱头及其野生型柱头进行转录组测序和生物信息学比较分析,筛选差异表达基因,分析基因功能以及相关的代谢通路,以期为研究影响番红花柱头数量的相关调控基因及相关信号通路提供理论依据。
1材料与方法
1.1试验材料
番红花多柱头突变体Cs5样本为浙江省嘉兴市农业科学研究院番红花种植基地里的自然突变体,其雄蕊、花柱和柱头的数量均为5个,均比野生型多2个。于盛花期分别采集番红花多柱头突变体Cs5和野生型番红花的柱头,每10个1组,设3次重复,于-80 ℃超低温冰箱中冻存,用于后续试验。
取各处理组的样品各0.1 g,液氮研磨,采用PureLink Plant RNAReagent Kit试剂盒(Invitrogen公司产品)提取柱头的总RNA,在Illumina HiSeq2500仪器(上海美吉生物医药科技有限公司产品)上进行RNA-Seq测序。
1.2差异表达基因分析和功能注释
采用Trinity软件将各处理组的有效数据组装成对应的转录本序列,用Blast软件将各样品测序得到的所测读段与Unigene库进行比对,利用DESeq软件以错误发现率(FDR)≤0.05且log2 Fold Change≥1为条件筛选差异表达基因(DEGs)。使用Blast软件将DEGs与NR、SWISS、GO、COG、KEGG数据库信息进行比对,获得相应的注释信息。
1.3差異表达基因的验证及表达模式分析
分别选取10个差异表达基因,利用实时荧光定量PCR验证测序数据的可靠性,以及差异表达基因在花瓣、叶片、球茎、雄蕊、柱头等不同组织中的表达模式。实时荧光定量PCR:总反应体积20 μl,反应条件为95 ℃预变性2 min;95 ℃ 10 s,58 ℃ 20 s,72 ℃ 30 s,循环数为40个,72 ℃延伸30 s。用2-△△Ct计算基因表达差异。
差异表达基因实时荧光定量PCR验证和表达模式分析的数据用GraphPad Prism5.0软件进行统计处理,采用One-way ANOVA进行差异显著性分析。
2结果与分析
2.1基因组装分析
利用Illumina HiSeq2500仪器进行无参转录组测序,番红花多柱头突变体Cs5产生了60 063 054条序列数,野生型产生了54 706 306条序列数,各处理组的G、C基本随机分布,无明显偏差。质量控制分析后,突变体保留54 984 766条序列,野生型保留49 715 722条序列。采用Trinity软件对数据进行组装,对得到的52 317条Unigenes分别进行功能注释,其中NR数据库29 392条,GO数据库20 510条,COG数据库21 126条,KEGG数据库12 875条,SWISS数据库20 510条,其中NR数据库注释比最高,达56.18%。
2.2差异表达基因分析
对番红花多柱头突变体Cs5和野生型番红花的转录组数据进行差异分析,共筛选出917个差异表达基因,其中番红花多柱头突变体Cs5中有412个(约占44.93%)基因表达上调,505个(约占55.07%)基因表达下调。显著差异表达基因中包括MADS家族转录因子基因15个(包含9个已鉴定的番红花MADS类转录因子基因),MYB家族转录因子基因19个,BHLH家族转录因子基因7个,WRKY家族转录因子基因5个,SEUSS家族转录因子基因6个,TF1转录因子基因1个,与植物激素相关的转录因子基因23个,这些转录因子基因大多与植物花发育相关。
2.3實时荧光定量PCR验证差异表达基因
为了进一步验证测序结果的可靠性,从917个差异表达基因中随机选择10个差异表达基因(包含3个上调表达基因,7个下调表达基因)进行实时荧光定量PCR验证,与转录组数据比较后发现,这10个基因的表达情况与测序结果一致,说明本次转录组测序结果真实可信。
2.4DEGs的GO功能注释分析
对番红花多柱头突变体DEGs进行GO功能注释分析,有316个基因被注释到41个分类条目上,包括145个上调基因和171个下调基因。这些基因功能分为生物过程、细胞组分和分子功能3大类,分别包含141、103、72个条目。对这3类条目的二级分类结果进行统计分析,发现DEGs在生物过程条目中主要分布在细胞过程和代谢过程,在细胞组分条目中主要包括共质体和细胞膜等,在分子功能条目中主要包括结合活性和催化活性。
2.5DEGs的KEGG功能注释分析
通过与KEGG数据库比对,对所有DEGs进行功能注释和富集分析。结果显示,917个差异表达基因被富集在179个代谢通路中,以校正P值<0.05为条件筛选出20个显著富集的代谢通路,包括次生代谢产物生物合成、植物激素信号转导、RNA转运、淀粉和蔗糖代谢等。植物激素信号转导中富集了5个差异表达基因,涉及生长素、赤霉素、脱落酸的代谢通路,植物激素在植物生长发育的不同时期和不同组织器官中均发挥重要的作用,番红花多柱头突变体Cs5的性状很有可能与激素表达、信号转导密切相关。
2.6DEGs表达模式分析
从917个差异表达基因中随机选取10个差异表达基因,通过实时荧光定量PCR技术分析其在番红花不同组织器官里的表达情况。本研究结果表明,DN34196、DN30594、DN41391、DN24459和DN39219共5个差异表达基因在番红花柱头中的表达量与其在雄蕊、花瓣、叶片和球茎中的表达量有极显著差异(P<0.01);DN26020在番红花柱头中的表达量与其在雄蕊和花瓣中的表达量无显著差异,与其在叶片和球茎中的表达量存在极显著差异(P<0.01);DN17686和DN31280在柱头中的表达量与其在叶片中的表达量无显著差异,与其在雄蕊、花瓣和球茎中的表达量存在极显著差异(P<0.01)。
3讨论
番红花作为经济价值极高的药用植物,药用部位的产量一直是科研人员关注的焦点[10-11]。本研究通过转录组测序技术对番红花多柱头突变体Cs5柱头和野生型番红花柱头进行转录组分析,从中发现可能与柱头发育相关的转录因子包括MADS家族、MYB家族、BHLH家族、WRKY家族、SEUSS家族以及与植物激素相关的转录因子。另外,番红花突变体中MADS-box基因包含A Class (AP1)、B Class (PI/AP3)、C Class(AG)、D Class(AGL)和E Class(SEP),说明番红花花发育过程也涉及到5类基因在不同时间和空间的精确表达[6]。
植物自身激素水平在雌蕊发育过程中扮演着重要角色,本研究发现一批与生长素、赤霉素、细胞分裂素和脱落酸的合成、失活及信号转导途径调控相关的转录因子,通过这些转录因子的调控可以维持植物包括雌蕊在内的花器官的正常发育[12-13]。番红花柱头的发育质量和数量直接影响其经济价值,多柱头突变体的发现一方面可以为通过组培快繁技术快速扩繁突变体数量,提高番红花产量的研究提供试验材料,另一方面本研究获得的转录组分析数据使得解析多柱头突变体形成机制,以及通过生物技术调控、创制更多突变体成为了可能。随着基因组﹑转录组和蛋白质组学技术的发展以及分子生物学技术的不断提高,相信将来在番红花柱头生长发育调控网络上的一些蛋白质生物学功能和基因间互作关系的研究会有更大突破。
参考文献:
[1]SHAHI T, ASSADPOUR E, JAFARI S M. Main chemical compounds and pharmacological activities of stigmas and tepals of ‘red gold’; saffron[J]. Trends in Food Science & Technology, 2016, 58: 69-78.
[2]陈祥慧,谭何新,张磊.西红花中类胡萝卜素生物合成途径研究进展[J].中草药,2018,49(19):4702-4709.
[3]朱娇,张永春,周琳,等. 不同光周期对西红花开花和花丝品质的效应比较[J]. 西北植物学报,2021, 41(3):431-438.
[4]DOUGLAS M H, SMALLFIELD B M, WALLACE A R, et al. Saffron (Crocus sativus L.): The effect of mother corm size on progeny multiplication, flower and stigma production [J]. Scientia Horticulturae, 2014, 166:50-58.
[5]NING K, HAN Y Y, CHEN Z J, et al. Genome-wide analysis of MADS-box family genes during flower development in lettuce[J]. Plant Cell and Environment, 2019, 42(6): 1868-1881.
[6]SHEN X, ZHAO Z, WANG J, et al. Genome wide analysis of MADS-box gene family in Brassica oleracea reveals conservation and variation in flower development[J]. BMC Plant Biology, 2019, 19: 106.
[7]LI J, YE C, CHANG C. Comparative transcriptomics analysis revealing flower trichome development during flower development in two Lonicera japonica Thunb. cultivars using RNA-seq [J]. BMC Plant Biology, 2020, 20:341.
[8]DENG M H, ZHAO K, LV J H, et al. Flower transcriptome dynamics during nectary development in pepper(Capsicum annuum L.) [J]. Gnentics and Molecular Biology, 2020, 43(2):e20180267.
[9]HUANG S, LIU Z, LI C, et al. Transcriptome analysis of a female-sterile mutant (fsm) in Chinese cabbage (Brassica campestris ssp. pekinensis)[J]. Frontiers in Plant Science, 2017, 8:546.
[10]王楨,张永春,杨柳燕,等. 西红花组织培养研究进展[J].中国农学通报,2019, 35(12):100-106.
[11]陈莹,张怡婷,开国银,等. 西红花等级标准与抗肿瘤药效的研究进展[J]. 植物生理学报,2021,57(7):1385-1392.
[12]CUCINOTTA M, CAVALLERI A, WILLIAM C J, et al. Auxin and Flower development: a blossoming field [J]. Cold Spring Harbor Perspectives in Biology, 2020, 13:a039974.
[13]ARROM L, MUNN-BOSHCH S. Hormonal changes during flower development in floral tissues of Lilium [J]. Planta, 2012, 236(2):343-354.
(责任编辑:王妮)
收稿日期:2021-04-12
基金项目:国家自然科学基金项目(81703667);嘉兴市公益性研究计划项目(2020AY10023);浙江省大学生科技创新计划项目(2020R417016);嘉兴市科技特派员专项项目(2021K117);嘉兴学院大学生创新创业能力个性化培养项目
作者简介:李军(1981-),男,山东泰安人,博士,副研究员,主要从事植物分子生物学研究。(E-mail)lijunjx1@163.com
通讯作者:高广春,(E-mail)gaogcjx@163.com
